Второе начало термодинамики. Принцип работы тепловой машины. Цикл Карно. КПД теплового двигателя. Второе начало (закон) термодинамики. Энтропия. Цикл Карно Коэффициент полезного действия тепловой машины
 Равновесное состояние термодинамической системы определяется постоянством значений макроскопических величин, характеризующих это состояние. Обратимым называют такой термодинамический процесс А→B, который, будучи проведен в обратном направлении, возвращает систему в исходное состояние, проходя через те же промежуточные состояния в обратной последовательности, а состояние тел вне термодинамической системы остались неизменными. P А Обратимый В V А В Квазистатический – процесс, в ходе которого система все время остается в состоянии равновесия. Круговой D C
Равновесное состояние термодинамической системы определяется постоянством значений макроскопических величин, характеризующих это состояние. Обратимым называют такой термодинамический процесс А→B, который, будучи проведен в обратном направлении, возвращает систему в исходное состояние, проходя через те же промежуточные состояния в обратной последовательности, а состояние тел вне термодинамической системы остались неизменными. P А Обратимый В V А В Квазистатический – процесс, в ходе которого система все время остается в состоянии равновесия. Круговой D C
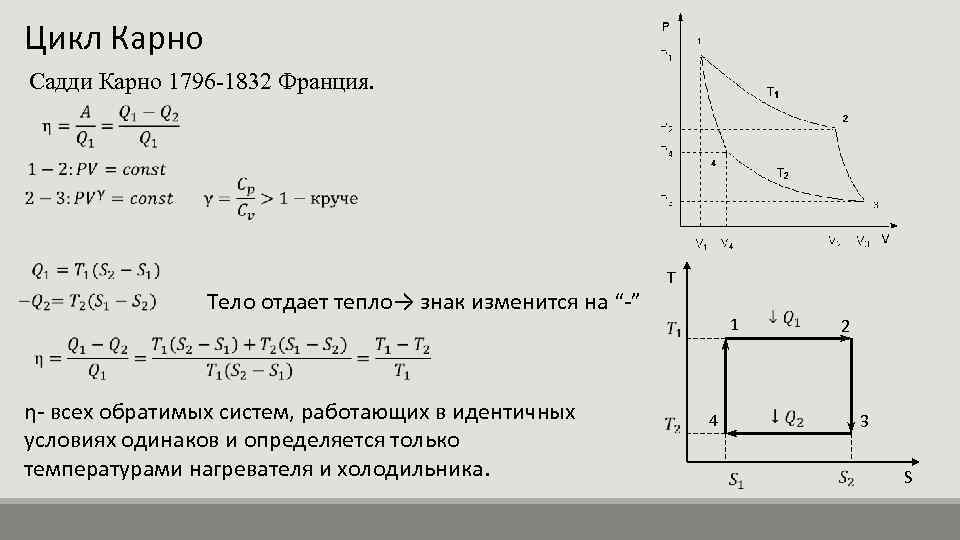 Цикл Карно Садди Карно 1796 -1832 Франция. Тело отдает тепло→ знак изменится на “-” η- всех обратимых систем, работающих в идентичных условиях одинаков и определяется только температурами нагревателя и холодильника. T 1 4 2 3 S
Цикл Карно Садди Карно 1796 -1832 Франция. Тело отдает тепло→ знак изменится на “-” η- всех обратимых систем, работающих в идентичных условиях одинаков и определяется только температурами нагревателя и холодильника. T 1 4 2 3 S
 При необратимом адиабатическом процессе энтропия возрастает η-любой необратимой машины всегда меньше, чем η обратимой, работающей в тех же условиях. Тепловая машина. 1 2 4 3
При необратимом адиабатическом процессе энтропия возрастает η-любой необратимой машины всегда меньше, чем η обратимой, работающей в тех же условиях. Тепловая машина. 1 2 4 3
 Предвестники 2 -ого начала термодинамики. Нельзя ли построить периодически действующую тепловую машину без холодильника? . Q 2=0 => такая машина превращала бы в работу всю теплоту, заимствованную от нагревателя. Закон сохранения энергии здесь не нарушается. Тогда представляется возможность создания вечного двигателя 2 -го рода (перпетуум мобиле 2 -го рода) => Заимствуем тепло из «неограниченного» (из океана, атмосферы, недров Земли) источника и превращаем его в работу. … тепло и вечный двигатель => Вильгельм Оствальд (1853 -1932 гг.)
Предвестники 2 -ого начала термодинамики. Нельзя ли построить периодически действующую тепловую машину без холодильника? . Q 2=0 => такая машина превращала бы в работу всю теплоту, заимствованную от нагревателя. Закон сохранения энергии здесь не нарушается. Тогда представляется возможность создания вечного двигателя 2 -го рода (перпетуум мобиле 2 -го рода) => Заимствуем тепло из «неограниченного» (из океана, атмосферы, недров Земли) источника и превращаем его в работу. … тепло и вечный двигатель => Вильгельм Оствальд (1853 -1932 гг.)
 Возможность совершения работы тепловыми двигателями обусловлена переходом тепла от тела более нагретому к телу менее нагретому.
Возможность совершения работы тепловыми двигателями обусловлена переходом тепла от тела более нагретому к телу менее нагретому.




 Энтропия, а для -приведенная теплота, является Но отношение функцией состояния системы - энтропия, где S- параметр состояния(как и P, V, T) В замкнутой или изолированной системе при протекании любого обратимого процесса энтропия остается неизменной
Энтропия, а для -приведенная теплота, является Но отношение функцией состояния системы - энтропия, где S- параметр состояния(как и P, V, T) В замкнутой или изолированной системе при протекании любого обратимого процесса энтропия остается неизменной
 При протекании в замкнутой термодинамической системе необратимого процесса, энтропия системы возрастает, достигая своего максимума в состоянии равновесия системы. Если, то какие либо изменения в системе без внешнего воздействия невозможны. - для обратимого процесса - для необратимого процесса Энтропия-мера отклонения реального процесса от идеального.
При протекании в замкнутой термодинамической системе необратимого процесса, энтропия системы возрастает, достигая своего максимума в состоянии равновесия системы. Если, то какие либо изменения в системе без внешнего воздействия невозможны. - для обратимого процесса - для необратимого процесса Энтропия-мера отклонения реального процесса от идеального.
 I-начало: II-начало: В замкнутой или изолированной системе при протекании необратим процесса энтропия системы возрастает, достигая своего максимума в состоянии равновесия системы. Если система находится в состоянии равновесия то какие либо изменения в системе без внешнего воздействия невозможны. Энтропия замкнутой системы может только возрастать. 1. Устанавливает наличие в природе фундаментальной асимметрии – однонаправленность всех самопроизвольно происходящих в природе процессов. 2. Количество энергии в замкнутых системах сохраняется, но распределение энергии меняется необратимым образом. III-начало: Если Т→ 0, то S→ 0, т. е. невозможно охладить вещество до температуры абсолютного нуля.
I-начало: II-начало: В замкнутой или изолированной системе при протекании необратим процесса энтропия системы возрастает, достигая своего максимума в состоянии равновесия системы. Если система находится в состоянии равновесия то какие либо изменения в системе без внешнего воздействия невозможны. Энтропия замкнутой системы может только возрастать. 1. Устанавливает наличие в природе фундаментальной асимметрии – однонаправленность всех самопроизвольно происходящих в природе процессов. 2. Количество энергии в замкнутых системах сохраняется, но распределение энергии меняется необратимым образом. III-начало: Если Т→ 0, то S→ 0, т. е. невозможно охладить вещество до температуры абсолютного нуля.

 - МАЛО! У реальных
- МАЛО! У реальных
 2. Клаузиус (1822 – 1888) в 1850 “ Теплота не может самопроизвольно переходить от тела менее нагретого к телу более нагретому. ” Вообще “она” возможна. Но она невозможна при условии, что во всех остальных телах не произошло никаких изменений. Холодильник, но процесс не самопроизвольный, а сопровождается работой электрического мотора. 3. т. Нернста: энтропия любого тела стремится к нулю при Т → 0 Обратимый процесс - процесс, при котором система переходит из состояния А в В и возможно вернуть ее хотя бы одним способом в исходное состояние А и при том так, чтобы во всех остальных телах не произошло никаких изменений.
2. Клаузиус (1822 – 1888) в 1850 “ Теплота не может самопроизвольно переходить от тела менее нагретого к телу более нагретому. ” Вообще “она” возможна. Но она невозможна при условии, что во всех остальных телах не произошло никаких изменений. Холодильник, но процесс не самопроизвольный, а сопровождается работой электрического мотора. 3. т. Нернста: энтропия любого тела стремится к нулю при Т → 0 Обратимый процесс - процесс, при котором система переходит из состояния А в В и возможно вернуть ее хотя бы одним способом в исходное состояние А и при том так, чтобы во всех остальных телах не произошло никаких изменений.
 Второе начало термодинамики. Направление термодинамических процессов в изолированной системе → к состояниям, вероятность которых максимальна: --Теплопередача => выравнивание температур. --Диффузия => однородный газ не может собраться в одной половинке сосуда. Энтропия. Статистический вес - число различных микросостояний, посредством которых осуществляется данное макросостояние w; Все макросостояния равновесны => вероятность макросостояния пропорциональна его статистическому весу. – энтропия – характеризует вероятность состояния термодинамической системы.
Второе начало термодинамики. Направление термодинамических процессов в изолированной системе → к состояниям, вероятность которых максимальна: --Теплопередача => выравнивание температур. --Диффузия => однородный газ не может собраться в одной половинке сосуда. Энтропия. Статистический вес - число различных микросостояний, посредством которых осуществляется данное макросостояние w; Все макросостояния равновесны => вероятность макросостояния пропорциональна его статистическому весу. – энтропия – характеризует вероятность состояния термодинамической системы.
 Невозможность вечного двигателя 2 -ого рода. Молекулы сами собрались в ½ части сосуда и, затем, за счет подводимого тепла изотермически расширяясь совершают работу: Вроде бы все хорошо, если бы молекулы действительно циклически собирались самопроизвольно в ½ части объема сосуда. А вот у тепловой машины энтропия возрастает! но т. к. , то
Невозможность вечного двигателя 2 -ого рода. Молекулы сами собрались в ½ части сосуда и, затем, за счет подводимого тепла изотермически расширяясь совершают работу: Вроде бы все хорошо, если бы молекулы действительно циклически собирались самопроизвольно в ½ части объема сосуда. А вот у тепловой машины энтропия возрастает! но т. к. , то
 Связь энтропии с вероятностью. Всякий процесс в природе протекает так, что система переходит в состояние, вероятность которого больше. Если система находится в состоянии с данной энтропией, то с подавляющей вероятностью следует ожидать, что она перейдет в состояние с большей энтропией, т. е. что наиболее вероятным изменением энтропии является ее возрастание. Но возможны и процессы с уменьшением энтропии – флуктуации ω в среднем росте.
Связь энтропии с вероятностью. Всякий процесс в природе протекает так, что система переходит в состояние, вероятность которого больше. Если система находится в состоянии с данной энтропией, то с подавляющей вероятностью следует ожидать, что она перейдет в состояние с большей энтропией, т. е. что наиболее вероятным изменением энтропии является ее возрастание. Но возможны и процессы с уменьшением энтропии – флуктуации ω в среднем росте.
Первое начало термодинамики, выражая закон сохранения и превращения энергии, не позволяет установить направление протекания термодинамических процессов. Кроме того, можно представить множество процессов, не противоречащих первому началу, в которых энергия сохраняется, а в природе они не осуществляются. Появление второго начала термодинамики - необходимость дать ответ на вопрос, какие процессы в природе возможны, а какие нет - определяет направление развития процессов.
Используя понятие энтропии и неравенство Клаузиуса, второе начало термодинамики можно сформулировать как закон возрастания энтропии замкнутой системы при необратимых процессах: любой необратимый процесс в замкнутой системе происходит так, что энтропия системы при этом возрастает.
Можно дать наиболее краткую формулировку второго начала термодинамики: в процессах, происходящих в замкнутой системе, энтропия не убывает. Здесь существенно, что речь идет о замкнутых системах, так как в незамкнутых системах энтропия может вести себя любым образом (убывать, возрастать, оставаться постоянной). Кроме того, отметим еще раз, что энтропия остается постоянной в замкнутой системе при обратимых процессах. При необратимых процессах в замкнутой системе энтропия всегда возрастает.
2.10 Тепловые двигатели и холодильные машины.
Цикл Карно и его коэффициент полезного действия
для идеального газа.
Изформулировки второго начала термодинамики по Кельвину следует, что вечныи двигатель второго рода – периодически действующий двигатель, совершающий работу за счет охлаждения одного источника теплоты, - невозможен. Для иллюстрации этого положения рассмотрим работу теплового двигателя.
Принцип действия теплового двигателя приведен на рис.63. От термостата с более высокой температурой T 1 , называемого нагревателем за цикл отнимается количество теплоты Q 1 , а термостату с более низкой температурой Т 2 , называемому холодильником , за цикл передается количество теплоты Q 2 , при этом совершается работа A=Q 1 –Q 2 .
Чтобы термический коэффициент полезного действия теплового двигателя был h =1, должно быть выполнено условие Q 2 =0, т.е. тепловой двигатель должен иметь один источник теплоты, а это невозможно. Так, французский физик и инженер Н. Л. С. Карно показал, что для работы теплового двигателя необходимо не менее двух источников теплоты с различными температурами, иначе это противоречило бы второму началу термодинамики.
Рис. 2.10.1 Рис. 2.10.2
Процесс, обратный происходящему в тепловом двигателе, используется в холодильной машине, принцип действия которой представлен на
рис. 2.10.2.
Системой за цикл от термостата с более низкой температурой Т 2 отнимается количество теплоты Q 2 и отдается термостату с более высокой температурой T 1 количество теплоты Q 1 . Для кругового процесса Q=A, но, по условию, Q=Q 2 –Q 1 <0, поэтому А<0 и Q 2 –Q 1 = -А, или Q 1 =Q 2 +А, т.е. количество теплоты Q 1 , отданное системой источнику теплоты при более высокой температуре T 1 , больше количества теплоты Q 2 , полученного от источника теплоты при более низкой температуре Т 2 , на величину работы, совершенной над системой. Следовательно, без совершения работы нельзя отбирать теплоту от менее нагретого тела и отдавать ее более нагретому. Это утверждение есть не что
иное, как второе начало термодинамики в формулировке Клаузиуса.
Однако второе начало термодинамики не следует представлять так, что оно совсем запрещает переход теплоты от менее нагретого тела к более нагретому. Ведь именно такой переход осуществляется в холодильной машине. Но при этом надо помнить, что внешние силы совершают работу над системой, т.е. этот переход не является единственным результатом процесса.
Основываясь на втором начале термодинамики, К а р н о вывел теорему носящую теперь его имя: из всех периодически действующих тепловых машин, имеющих одинаковые температуры нагревателей (Т 1) и холодильников (Т 2 ), наибольшим кпд обладают обратимые машины; при этом кпд обратимых машин, работающих при одинаковых температурах нагревателей (Т 1) и холодильников (Т 2), равны друг другу и не зависят от природы рабочего тела.
Карно теоретически проанализировал обратимый наиболее экономичный цикл, состоящий из двух изотерм и двух адиабат, и называемый
циклом Карно. Рассмотрим прямой цикл Карно, в котором в качестве рабочего тела используется идеальный газ, заключенный в сосуд с подвижным поршнем.
При изотермическом процессе U=const, поэтому количество теплоты Q 1 , полученное газом от нагревателя, равно работе расширения А 12 , совершаемой газом при переходе из состояния 1 в состояние 2:
 . (2.10.1)
. (2.10.1)
При адиабатическом расширении 2-3 теплообмен с окружающей средой отсутствует, и работа расширения А 23 совершается за счет изменения внутренней энергии:
![]() .
.
Второе начало (закон) термодинамики. Энтропия. Цикл Карно.
Круговые процессы (циклы)
Первый закон термодинамики утверждает, что теплота может превращаться в работу, а работа в теплоту и не устанавливает условий, при которых возможны эти превращения.
Превращение работы в теплоту происходит всегда полностью и безусловно. Обратный процесс превращения теплоты в работу при непрерывном её переходе возможен только при определенных условиях и не полностью. Теплота сам собой может переходить только от более нагретых тел к холодным. Переход теплоты от холодных тел к нагретым сам собой не происходит. Для этого нужно затратить дополнительную энергию.
Таким образом, для полного анализа явления и процессов необходимо иметь кроме первого закона термодинамики еще дополнительную закономерность. Этим законом является второй закон термодинамики. Он устанавливает, возможен или невозможен тот или иной процесс, в каком направлении протекает процесс, когда достигается термодинамическое равновесие и при каких условиях можно получить максимальную работу.
Формулировки второго закона термодинамики.
Для существования теплового двигателя необходимы два источника - горячий источник и холодный источник (окружающая среда). Если тепловой двигатель работает только от одного источника, то он называется вечным двигателем 2-го рода.
Первая формулировка (Оствальда):
"вечный двигатель 2-го рода невозможен".
Вечный двигатель первого рода это тепловой двигатель, у которого L>Q1, где Q1 - подведенная теплота. Первый закон термодинамики "позволяет" возможность создать тепловой двигатель, полностью превращающий подведенную теплоту Q1в работу L, т.е. L = Q1. Второй закон накладывает более жесткие ограничения и утверждает, что работа должна быть меньше подведенной теплоты (L Вечный двигатель 2-го рода можно осуществить, если теплоту Q2 передать от холодного источника к горячему. Но для этого теплота самопроизвольно должна перейти от холодного тела к горячему, что невозможно. Отсюда следует вторая формулировка (Клаузиуса): "теплота не может самопроизвольно переходит от более холодного тела к более нагретому". Для работы теплового двигателя необходимы два источника - горячий и холодный. Третья формулировка (Карно): "там где есть разница температур, возможно совершение работы". Все эти формулировки взаимосвязаны, из одной формулировки можно получить другую. Одной из функций состояния термодинамической системы является энтропия. Энтропией называется величина, определяемая выражением: dS = ?Q / T. [Дж/К] (7) или для удельной энтропии: ds = ?q /T [Дж/(кг·К)] (8) Энтропия есть однозначная функция состояния тела, принимающая для каждого состояния вполне определенное значение. Она является экстенсивным (зависит от массы вещества) параметром состояния и в любом термодинамическом процессе полностью определяется начальным и конечным состоянием тела и не зависит от пути протекания процесса. Энтропию можно определить как функцию основных параметров состояния: S = f1(P,V); S = f2(P,T); S = f3(V,T); (9) или для удельной энтропии: s = f1(P,v); s = f2(P,T); S = f3(v,T); (10) Так как энтропия не зависит от вида процесса и определяется начальными и конечными состояниями рабочего тела, то находят только её изменение в данном процессе, по следующим уравнениям: S = cv·ln(T2/T1) + R?·ln(v2/v1); (11) S = cp·ln(T2/T1) - R?·ln(P2/P1); (12) S = cv·ln(Р2/Р1) + cр·ln(v 2/v 1). (13) Если энтропия системы возрастает (?s > 0), то к системе подводится тепло. Если энтропия системы уменьшается (?s < 0), то от системы отводится тепло. Если энтропия системы не изменяется (?s = 0, s = сonst), то к системе не подводится и от неё не отводится тепло (адиабатный процесс или изоэнтропный процесс). Термодинамическим процессом называют переход системы из одного равновесного состояния в другое. Если система в результате совершения нескольких процессов приходит в первоначальное состояние, то говорят, что она совершила замкнутый процесс или цикл. Циклом Карно называется круговой цикл, состоящий из 2-х изотермических (протекающих при постоянной температуре) и из 2-х адиабатных процессов (протекающих без теплообмена с окружающей средой). Обратимый цикл Карно в p-v- и T-s- диаграммах показан на рис.1: 1-2 - обратимое адиабатное расширение при s1=сonst. Температура уменьшается от Т1 до Т2. 2-3 - изотермическое сжатие, отвод теплоты q2 к холодному источнику от рабочего тела. 3-4 - обратимое адиабатное сжатие при s2=сonst. Температура повышается от Т3 до Т4. 4-1 - изотермическое расширение, подвод теплоты q1 к горячего источника к рабочему телу. Основной характеристикой любого цикла является термический коэффициент полезного действия (т.к.п.д.). T = Lц / Qц, (14) или?t = (Q1 - Q2) / Q1. Рис.1.
Для обратимого цикла Карно термический к.п.д. определяется по формуле: Tк = (Т1 - Т2) / Т1. (15) Отсюда следует первая теорема Карно: "термический к.п.д. обратимого цикла Карно не зависит от свойств рабочего тела и определяется только температурами источников". Из сравнения произвольного обратимого цикла и цикла Карно вытекает 2-я теорема Карно: "обратимый цикл Карно является наивыгоднейшим циклом в заданном интервале температур" Следовательно, термический к.п.д. цикла Карно всегда больше термического к.п.д. произвольного цикла: Tк > ?t. (16) Дальнейшие работы по термодинамике показали, что энтропия имеет глубокий физический смысл. В необратимых процессах она возрастает и достигает максимума, когда система приходит в состояние теплового равновесия. Например, в Солнечной системе, согласно второму закону термодинамики, идут процессы, приводящие к возрастанию энтропии. Происходит рассеяние энергии Солнца, что в конечном итоге приведёт Солнечную систему в состояние теплового равновесия с очень низкой температурой. Клаузиус назвал это явление тепловой смертью Солнечной системы. Он же распространил этот вывод и на всю Вселенную и предсказал тепловую смерть Вселенной. Однако данные астрофизики последних десятилетий показывают, что во Вселенной идут процессы, противоречащие второму закону термодинамики. В отдельных её частях вспыхивают сверхновые звёзды, т.е. идут процессы с уменьшением энтропии, что противоречит второму началу. Следовательно, второй закон термодинамики нельзя распространять на всю Вселенную, как это сделал Клаузиус. Лекции по физике.
Молекулярная физика и
основы термодинамики
Второе начало термодинамики.
Тепловые двигатели. Энтропия. Цикл
Карно
Обратимые и необратимые процессы
Обратимым называют процесс,
допускающий возможность возвращения
системы в первоначальное состояние без
того, чтобы в окружающей среде остались
какие-либо изменения
Обратимым может быть лишь
равновесный процесс, но не всякий
равновесный процесс обратим
2
Обратимые и необратимые процессы
Пример. Рассмотрим
систему из газа,
находящегося в цилиндре
под поршнем, на котором
установлен груз
Уберём груз. Газ
расширится.
Чтобы вернуть газ в
исходное положение надо
поднять груз на высоту h,
совершив работу A=Mgh,
и положить его на
поршень
Процесс не обратимый
М
М
М
М
h
3
Обратимые и необратимые процессы
Разобьём груз на две
равных части
Теперь, чтобы расширить
и сжать газ в исходное
состояние, надо затратить
работу A=Mgh/2
Если мы будем
производить
перемещение поршня на
бесконечно малые
расстояния, то получим
обратимый процесс
М/2
h
М/2
М/2
М/2
М/2
М/2
М/2
4
Обратимые и необратимые процессы
Пример равновесного необратимого
процесса – теплообмен
Компенсацией за осуществление
необратимых круговых процессов
является перевод энергии из одной формы
в другую. В этом проявляется
неэквивалентность различных форм
энергии
Тепловая энергия оказывается менее
ценным видом энергии, чем другие
5
Второе начало термодинамики
Второе начало термодинамики
констатирует неэквивалентность
различных видов энергии. Оно
постулирует направление протекания
тепловых процессов
Формулировка Клаузиуса: Теплота не
может самопроизвольно переходить от
тела менее нагретого к более нагретому
6
Второе начало термодинамики
Формулировка Томсона. Невозможен
круговой процесс, единственным
результатом которого было бы
совершение работы за счёт охлаждения
теплового резервуара
Устройство, которое позволяло бы
осуществлять этот процесс, называется
вечным двигателем второго рода
7
Второе начало термодинамики
Второе начало Т.Д. накладывает запрет на
вечный двигатель второго рода
Из второго начала Т.Д. можно получить
множество конкретных результатов с
помощью метода циклов и метода
термодинамических функций
8
Тепловые двигатели
Тепловой двигатель – это устройство, в
котором совершается циклический Т.Д. процесс
В любом тепловом двигателе тепло передаётся
от нагревателя к рабочему телу, а затем к
холодильнику. При этом совершается полезная
работа
Нагреватель
Q1
Рабочее
тело
Q2
Холодильник
A
9
Тепловые двигатели
10
Метод циклов
В циклическом процессе
U=0 Q=A=Q1-Q2
При переходе 12 работа
совершается системой, а
при переходе 21 над
системой
При переходе 1"2‘ тепло
передаётся системе, а при
переходе 2"1" от
системы
КПД теплового двигателя
=A/Q1=(Q1-Q2)/Q1
P
Адиабаты
Q1
2"
1
1" Q2
2
V
11
Цикл Карно
Цикл Карно состоит из
двух изотерм и двух
адиабат
Теплоёмкости в
адиабатическом и
изотермическом
процессах не зависят от
рабочего тела, поэтому их
рассмотрение позволяет
выявить ряд общих
закономерностей
P
Адиабаты
Изотермы
Q1
Т1
Q2
Т2
V
12
Цикл Карно
Первая теорема Карно: Коэффициент
полезного действия тепловой машины,
работающей по циклу Карно, зависит
только от температур нагревателя и
холодильника и не зависит от устройства
машины и типа рабочего тела
13
Цикл Карно
Для идеального газа:
Q1=RT1ln(V2/V1)
Q2=RT2ln(V4/V3)
A=Q1-Q2=RT1ln(V2/V1)RT2ln(V3/V4)
=A/Q1=/RT1ln(V2/V1)
Из уравнения адиабаты:
TV-1=const
P
V1
Q1
Т1
V2
Q2
V4
Т2
V3
V
14
Цикл Карно
T1V1-1= T2V4-1 и T1V2-1= T2V3-1 V2/V1=V3/V4 =(T1-T2)/T1=1-T2/T1
Для повышения КПД надо повышать
температуру нагревателя и понижать
температуру холодильника
=(Q1-Q2)Q1=(T1-T2)/T1 Q1/T1=Q2/T2
Величина Q/T называется приведённой
теплотой
15
Цикл Карно
Вторая теорема
Карно: КПД любого
цикла не может быть
больше, чем КПД
цикла Карно - =1Т2/Т1, где под Т1
понимается
максимальная, а под
Т2 минимальная
температура
P
V
16
Энтропия
Рассмотрим произвольный
равновесный цикл.
Аппроксимируем его малыми
циклами Карно
Для каждого цикла К можно
записать:
Q1i/T1i-Q2i/T2i=0
Просуммировав по всем
циклам получим:
Qk/Tk=0
Т.о. получаем, что dQ/T –
дифференциал некоторой
Т.Д. функции
Назовём эту функцию
энтропией
P
V
17
Энтропия
Энтропия – это такая функция состояния,
дифференциал которой связан с элементарным
тепловым эффектом в обратимом процессе
соотношением:
dQ=TdS
()
Энтропия S имеет размерность теплоёмкости
С учётом () первое начало Т.Д. можно выразить
как:
TdS=dU+PdV
Отсюда, зная термическое и калорическое
уравнения, состояния можно найти зависимость
энтропии от Т.Д. параметров
18
Энтропия
Найдём энтропию идеального газа
Из dU=cVdT и P/T=R/V следует что:
dS=cVdT/T+RdV/V S(T,V)=cVlnT+RlnV
при cV=const
Можно S выразить через T и P:
S(T,P)=cPlnT-RlnP
19
Энтропия
Определение энтропии через теплоту
встречает одну трудность. В точке Т=0
интеграл dQ/T может расходиться
Эта неопределённость устраняется
постулатом Нернста, называемым иногда
третьим началом термодинамики
20
Постулат Нернста
Постулат Нернста сводится к двум
утверждениям:
1.
2.
При приближении к абсолютному нулю
энтропия стремится к определённому
конечному пределу. Можно положить
S(Т=0)=0
Все равновесные процессы при Т=0
происходят без изменения энтропии. В
частности, при Т=0 S не зависит от объёма
21
Статистическая интерпретация
энтропии
Вероятность состояния пропорциональна его
статистическому весу Ω, т.е. числу
микроскопических способов, которым может быть
осуществлено данное макросостояние
Разобьём некоторую Т.Д. систему на две
подсистемы, которые находятся в состояниях со
стат. весами Ω1 и Ω2
Число способов, которыми может реализоваться
данное состояние системы:
Ω=Ω1Ω2
22
Статистическая интерпретация
энтропии
Т.о. логарифм стат. веса является
аддитивной функцией состояния системы:
lnΩ=lnΩ1+lnΩ2
Энтропия системы:
S=klnΩ
()
где k – постоянная Больцмана
Формула () называется формулой
Больцмана
23
Статистическая интерпретация
энтропии
Т.к. равновесным состоянием является
состояние с наибольшим стат. весом (и
наибольшей энтропией), то можно
заключить, что при протекании
необратимых процессов энтропия
изолированной системы возрастает
Энтропия системы, находящейся в
равновесном состоянии, максимальна
24
Статистическая интерпретация
энтропии
При протекании обратимых процессов энтропия
изолированной системы остаётся постоянной
Энтропия равновесной системы не остаётся
строго постоянной она претерпевает флуктуации
Второй закон термодинамики, иногда
называемый законом возрастания энтропии,
утверждает, что энтропия изолированной
системы может только возрастать либо
оставаться неизменной:
S≥0
25
26 Лекция
13
. Тепловые и
холодильные машины. Второе начало
термодинамики. Цикл Карно. Теорема
Карно. Термодинамическая шкала температур.
Неравенство Клаузиуса. Термодинамическая
энтропия. Закон возрастания энтропии.
Третье начало термодинамики.
Тепловые машины
или тепловые двигатели
,
предназначены для получения полезной
работы за счет теплоты, выделяемой
вследствие химических реакций (сгорания
топлива), ядерных превращений или по
другим причинам. Для функционирования
тепловой машины обязательно необходимы
следующие составляющие: нагреватель,
холодильник и рабочее тело
. Х
олодильником
может являться, например, окружающая
среда. В дальнейшем будет применяться понятие
термостата
, под
которым подразумевается тело, находящееся
при постоянной температуре и обладающее
бесконечной теплоёмкостью – любые
процессы получения или отдачи теплоты
не меняют температуру этого тела. Р Замечание
. Наличие штриха означает.
что берётся абсолютное значение указанной
величины, т.е. Q
Х
=
Q
Х
. Такой круговой процесс называется
прямым
. В прямом
процессе теплота забирается у более
нагретого тела и после совершения
системой работы над внешними телами
остаток теплоты отдаётся менее нагретому
телу. Тепловые машины
работают по прямому циклу.
Процесс, в котором теплота забирается
у менее нагретого тела и отдаётся более
нагретому телу в результате совершения
работы над системой внешними телами,
называется обратным.
По
обратному циклу работают холодильные
машины
.
Теплота, полученная системой, считается
положительной Q
Н
> 0
, а
отданная – отрицательной Q
Х
< 0
. Если Q
Х
> 0
– теплота, полученная
холодильником
, то можно записать: Q Х
= Q Х
= Q Х . Внутренняя энергия – это функция
состояния, поэтому при круговом
(циклическом) процессе, когда система
возвращается в исходное состояние,
внутренняя энергия не изменяется. Из
первого начала термодинамики следует: Но так как
так как
определяется для циклических (повторяемых)
процессов. (Для нециклического
процесса
подобное отношение
называется полезным выходом
.) Замечание
. Передача теплоты
холодильнику является обязательной
для циклического процесса. Иначе рабочее
тело придёт в тепловое равновесие с
нагревателем, и передача теплоты от
нагревателя будет невозможной. Поэтому
КПД любой тепловой машины всегда меньше
единицы:
В холодильной машине внешние тела
совершают работу А
внеш
по отводу теплоты Q
2
от охлаждаемого тела и передаче
теплоты Q
1
тепловому резервуару (обычно – это
окружающая среда). КПД
холодильной машины или холодильный
коэффициент – это отношение отведённого
количества теплоты к затраченной работе:
Вообще говоря, этот коэффициент может
быть как меньше единицы, так и больше
единицы – всё зависит от работы внешних
тел. Тепловой насос
- устройство, «перекачивающее» теплоту
от холодных тел к нагретым и предназначенное,
например, для обогрева помещения. При
этом теплота
Так как теплота, отводимая от окружающей
среды больше нуля, то КПД теплового
насоса больше единицы. Но для КПД этого
же прямого цикла
т.е. КПД теплового
насоса равен обратной величине КПД
прямого цикла
.Циклический (круговой) термодинамический процесс.
 ассмотрим
циклический процесс, в котором нагреватель
передает рабочему телу теплоту Q
Н
.
Рабочее тело совершает работу и затем
отдаёт тепло холодильнику Q
Х
.
ассмотрим
циклический процесс, в котором нагреватель
передает рабочему телу теплоту Q
Н
.
Рабочее тело совершает работу и затем
отдаёт тепло холодильнику Q
Х
.
 ,
то
,
то ,
,
 .
.Коэффициент полезного действия (термический кпд) прямого цикла:
 .
. .
. отбирается у окружающей среды, имеющей
меньшую температуру, и воздуху в помещении
отдаётся теплота
отбирается у окружающей среды, имеющей
меньшую температуру, и воздуху в помещении
отдаётся теплота
 .
Тепловой насос работает по обратному
тепловому циклу. (Этот принцип обогрева
называется динамическим отоплением).
КПД теплового насоса
равен отношению теплоты, переданной
помещению, к затраченной работе:
.
Тепловой насос работает по обратному
тепловому циклу. (Этот принцип обогрева
называется динамическим отоплением).
КПД теплового насоса
равен отношению теплоты, переданной
помещению, к затраченной работе:
 .
. ,
,
 ,
поэтому
,
поэтому ,
,
