Трипсин расщепляет жиры. Большая энциклопедия нефти и газа
Слюна содержит фермент птиалин, чрезвычайно энергично катализирующий гидролиз крахмала. В отличие от кислотного гидролиза, гидролиз крахмала птиалином идет лишь до образования дисахарида мальтозы.
Слюна содержит фермент птиалин (амилазу), чрезвычайно энергично катализирующий гидролиз крахмала.
Под гйствием фермента птиалина (амилазы) происходит частичное ревращение крахмала сначала в декстрины, а затем в дисаха-ид мальтозу. Второй фермент слюны мальтаза расщепляет альтозу на две молекулы глюкозы.
Важнейшим ферментом слюны является птиалин - амилаза слюны, которая катализирует гидролиз крахмала до декстринов и частично даже до мальтозы. Окончательный гидролиз этих продуктов расщепления до глюкозы осуществляется в тонком кишечнике.
В 1831 г. Лейке открыл, что птиалин обладает диастатической активностью и, наконец, в 1833 г. А.
В организме человека крахмал гидролизуется под влиянием фермента птиалина, или амилазы, содержащейся в слюне. Таким образом, слюна служит не только для увлажнения пищи, чтобы облегчить прохождение ее по пищеводу, но и является важным пищеварительным соком.
Строго говоря, при действии фермента слюны - птиалина - крахмал гидролизуется не до глюкозы, а до мальтозы, являющейся дисахаридом. Однако нет необходимости фиксировать внимание учащихся на этой детали, тем более что мальтоза подобно глюкозе восстанавливает гидрат окиси меди.
Объясните следующие термины: двенадцатиперстная кишка, секретин, птиалин, энтерокиназа, зимоген, липаза, реннин, стеапсин, химус, желчные соли, трипсиноген, холецистоки-нин.
Крахмал первоначально подвергается воздействию находящегося в слюне фермента, птиалина, но в основном гидролиз крахмала происходит в тонком кишечнике, где под действием ферментов поджелудочной железы и других высокоактивных ферментов крахмал превращается в глюкозу. Часть простых Сахаров, к числу которых относится глюкоза, переносится кровью в печень, где происходит их отложение в составе гликогена. Другая часть Сахаров поступает непосредственно в общий кровоток, где они сгорают с выделением энергии, превращаются в жиры либо накапливаются в мышцах в виде гликогена. Гликоген может высвобождаться при первой же необходимости и служит источником энергии. Метаболизм углеводов регулируется таким гормоном, как инсулин. Механизмы превращения углеводов в СО2 и Н2О очень сложны и не будут рассматриваться в данной книге.
Слюна обладает нейтральной реакцией, и это соот-тствует оптимальному действию птиалина и мальтозы. Содер - аЩий соляную кислоту желудочный, сок прекращает действие рментов слюны в желудке, так как в кислой среде они теряют ю активность. Тем не менее ферменты птиалин и мальтоза гут некоторое время продолжать свое действие в желудке, скольку пищевой комок лишь постепенно пропитывается желу - чным соком.
Мальтоза образуется при действии на крахмал диастаза солода, а также птиалина слюны. Она является промежуточным продуктом винокуренной и пивоваренной промышленности.
Ферментативный гидролиз проходит под действием ферментов, содержащихся в растениях и в животных организмах (диастаз солода, птиалин слюны и др.), которые называются амилазами. Эти ферменты расщепляют 1 - 4 связи, но не гидролизуют 1 - 6 связи. Остальная его часть образует ряд промежуточных олигоса-харидов.
Гидролитическое расщепление крахмала (амилолиз) при затирании катализируют амилозы солода. Кроме них солод содержит несколько ферментов из групп амилоглюкозидаз и трансфераз, которые атакуют некоторые продукты расщепления крахмала; однако по количественному соотношению они имеют при затирании только второстепенное значение.
При затирании природным субстратом является крахмал, содержащийся в солоде. Так же как любой природный крахмал, он не является единым химическим веществом, а смесью, содержащей в зависимости от происхождения от 20 до 25% амилозы и 75-80% амилопектина.
Молекула амилозы образует длинные, неразветвленные, спиральносвернутые цепочки, состоящие из молекул α-глюкозы, взаимно связанных глюкозидными связями в положении α-1,4. Количество глюкозных молекул различно и колеблется от 60 до 600. Амилоза растворима в воде и окрашивается йодным раствором в синий цвет. По Мейеру , амилоза под действием β-амилазы солода полностью гидролизуется до мальтозы.
Молекула амилопектина состоит из коротких разветвленных цепочек. Наряду со связями в положении α-1,4, в разветвленных местах встречаются также связи α-1,6. Глюкозных единиц в молекуле насчитывается около 3000. Ячменный амилопектин содержит их, по Мак Леоду , от 24 до 26, в то время как солодовый только 17-18. Амилопектин без нагрева нерастворим в воде, при нагреве образует клейстер.
Солод содержит две амилазы, расщепляющие крахмал до мальтозы и декстринов. Одна из них катализирует реакцию, при которой быстро исчезает синяя окраска с йодным раствором, однако мальтозы образуется относительно мало; эта амилаза называется декстринирующей или α-амилазой (α-1,4-глюкан-4-глюканогидролаза, ЕК 3.2.1 Л.). Под действием второй амилазы синяя окраска с йодным раствором исчезает только тогда, когда образуется большое количество мальтозы; это амилаза осахаривающая или β-амилаза (β-1,4-глюканмальтогидролаза, ЕК 3.2.1.2) * .
* (Обозначения α и β относятся к оптической форме образующегося сахара (α-мальтоза или β-мальтоза). )
Декстринирующая α-амилаза. Она является типичным компонентом солода. α-Амилаза активизируется при солодоращении, однако в ячмене Кнеен обнаружил ее только в 1944 г. . Она катализирует расщепление α-1,4 глюкозидных связей. Молекулы обоих компонентов крахмала, т. е. амилозы и амилопектина, при этом неравномерно разрываются внутри; только конечные связи, не гидролизуются. Происходит разжижение и декстринизация проявляющаяся в быстром снижении вязкости раствора (разжижение затора). Разжижение крахмального клейстера является одной из функций солодовой α-амилазы. Представление об участии другого разжижающего фермента (амилофосфатазы) в настоящее время не считается обоснованным. Характерно, что α-амилаза вызывает исключительно быстрое снижение вязкости крахмального клейстера, восстанавливающая способность которого при этом возрастает очень медленно. Синяя йодная реакция крахмального клейстера (т. е. раствора амилопектина) под действием α-амилазы быстро изменяется через красную, бурую да ахроической точки, а именно при низкой восстанавливающей способности.
В естественных средах, т. е. в солодовых экстрактах и заторах, аα-амилаза имеет температурный оптимум 70°С; инактивируется при 80°С. Оптимальная зона pH равна от 5 до 6 с четким максимумом на рН-кривой. Она стабильна в диапазоне pH от S до 9. аα-Амилаза очень чувствительна к повышенной кислотности (является кислотонеустойчивой); инактивируется окислением да pH 3 при 0°С или до pH 4,2-4,3 при 20°С.
Осахаривающая β-амилаза. Она содержится в ячмене и ее объем при соложении (проращивании) сильно возрастает. β-Амилаза обладает высокой способностью катализировать расщепление крахмала до мальтозы. Она не разжижает нерастворимый нативный крахмал и даже крахмальный клейстер.
Из неразветвленных цепочек амилазы β-амилаза отщепляет вторичные α-1,4 глюкозидные связи, а именно от невосстанавливающихся (неальдегидных) концов цепей. Мальтоза постепенно отщепляет от отдельных цепочек по одной молекуле. Расщепление амилопектина происходит также, однако фермент атакует разветвленную молекулу амилопектина одновременно в нескольких пространственных цепочках, а именно в местах разветвления, где находятся связи α-1,6, перед которыми расщепление прекращается.
Вязкость крахмального клейстера под действием α-амилазы снижается медленно, в то время как восстанавливающая способность возрастает равномерно. Йодная окраска переходит из синей очень медленно в фиолетовую, а потом в красную, однако ахроической точки вообще не достигает.
Температурный оптимум β-амилазы в солодовых экстрактах и заторах находится при 60-65°С; она инактивируется при 75°С. Оптимальная зона pH равна 4,5-5, по другим данным - 4,65 при 40-50°С с нерезким максимумом на рН-кривой.
Общее действие α- и β-амилазы. Амилаза (диастаза), содержащаяся в солоде обычных типов и в специальном диастатическом солоде, является природной смесью α- и β-амилазы, в которой β-амилаза количественно преобладает над α-амилазой.
При одновременном действии обеих амилаз гидролиз крахмала намного глубже, чем при самостоятельном действии одного из названных ферментов, и мальтозы при этом получается 75-80%.
Осахаривание амилозы и конечных групп амилопектина β-амилаза начинает с конца цепочек, в то время как α-амилаза атакует молекулы субстрата внутри цепочек.
Низшие и высшие декстрины образуются наряду с мальтозой под действием α-амилазы на амилозу и амилопектин. Высшие декстрины образуются также под действием β-амилазы на амилопектин. Декстрины являются разновидностью эритрогранулозы и α-амилаза разрывает их вплоть до α-1,6 связей, так что образуются новые центры для действия β-амилазы. Тем самым α-амилаза повышает активность β-амилазы. Кроме того, α-амилаза атакует декстрины типа гексозы, образующиеся под действием β-амилазы на амилозу.
Декстрины с нормальными прямыми цепочками осахариваются обеими амилазами. При этом β-амилаза дает мальтозу и немного мальтотриозы, а α-амилаза - мальтозу, глюкозу и мальтотриозу, которая дальше расщепляется до мальтозы и глюкозы. Декстрины с разветвленными цепочками рвутся до мест разветвления. При этом образуются низшие декстрины, иногда олигосахариды, главным образом трисахариды и изомальтоза. Таких разветвленных остаточных продуктов, которые ферменты дальше не гидролизуют, насчитывается около 25-30% и они называются конечными декстринами.
Разницу температурного оптимума α- и β-амилазы на практике используют для регулировки взаимодействия обоих ферментов тем, что подбором правильной температуры поддерживают деятельность одного фермента в ущерб другому.
Амилоглюкозидазы солода, например α- и β-глюкозидаза, β-h-фруктозидаза, - это гидролизующие ферменты, реагирующие точно так же, как амилазы, которые, однако, гидролизуют не крахмал, а только некоторые продукты расщепления.
Трансглюкозидазы, скорее негидролизующиеся ферменты, однако механизм катализированных ими реакций подобен механизму гидролаз. В солоде содержатся трансглюкозидазы, фосфорилирующие или фосфорилазы, и нефосфорилирующие, например циклодекстриназа, амиломальтаза и др. Все эти ферменты катализируют перенос сахарных радикалов. Их технологическое значение второстепенное.
Ферменты, расщепляющие белковые вещества
Расщепление белков (протеолиз) катализируют при затира-нии ферменты из группы пептидаз или протеаз (пептид гидролаз, ЕК 34), гидролизующие пептидные связи = СО = NH =. Они делятся на эндопептидазы, или протеиназы (пептид пептидогидролазы, ЕК 3.44) и экзопептидазы или пептидазы (дипептид гидролазы, ЕК 3.4.3).
В заторах субстратами являются остатки белкового вещества ячменя, т. е. лейкозина, эдестина, гордеина и глютелина, частично измененного при соложении (например, коагулированного при сушке) и продукты их расщепления, т. е. альбумозы, пептоны и полипептиды.
Некоторые белковые вещества образуют открытые цепи связанных пептидными связями аминокислот со свободными концевыми аминными группами = NH 2 И карбоксильными группами = СООН. Кроме них в молекуле белков могут находиться аминогруппы диаминокарбоновых кислот и карбоксильные группы дикарбоновых кислот. До тех пор пока некоторые белки имеют пептидные цепи, замкнутые в кольца, они не имеют конечных аминных и карбоксильных групп.
Ячмень и солод содержат один фермент из группы эндопептидаз (протеиназ) и не менее двух эксопептидаз (пептидаз). Их гидролизующее действие взаимно дополняется.
Эндопептидаза (протеиназа). Как настоящая протеиназа, ячменная и солодовая эндопептидаза гидролизует внутренние пептидные связи протеинов. Макромолекулы белков при этом расщепляются на меньшие частицы, т. е. полипептиды с меньшей молекулярной массой. Точно так же, как остальные протеиназы, ячменная и солодовая протеиназа действуют активнее на измененные белки, например денатурированные, чем на белки нативные.
По своим свойствам ячменная и солодовая протеиназы относятся к ферментам типа папаина, очень распространенным в растениях. Их оптимальная температура находится между 50-60°С, оптимум pH колеблется от 4,6 до 4,9 в зависимости от субстрата. Протеиназа относительно стабильна при высоких температурах и тем самым отличается от пептидаз. Наиболее стабильна она в изоэлектрической области, т. е. при pH от 4,4 до 4,6. По Кольбаху, активность фермента в водной среде снижается уже спустя 1 ч при 30°С; при 70°С через 1 ч он полностью разрушается.
Гидролиз, катализированный солодовой протеиназой, протекает постепенно. Между белками и полипептидами было выделено несколько промежуточных продуктов, из которых важнейшими являются пептоны, называемые также протеозы, альбумозы и т. д. Это высшие продукты расщепления коллоидного характера, которые имеют типичные свойства белков. Они осаждаются в кислой среде танином, однако при биуретовой реакции (т. е. реакции с сернокислой медью в щелочном растворе белка) окрашиваются в розовый цвет вместо фиолетового. При кипячении пептоны не коагулируют. Растворы имеют активную поверхность, они вязки и при встряхивании легко образуют пену.
Последнюю степень расщепления белков, катализированных солодовой протеиназой, представляют полипептиды. Они только отчасти являются высокомолекулярными веществами с коллоидными свойствами. Нормально полипептиды образуют молекулярные растворы, легко диффундирующие. Как правило, они не реагируют как белки и не осаждаются танином. Полипептиды являются субстратом пептидаз, которые дополняют действие протеиназы.
Экзопептидазы (пептидазы). Комплекс пептидаз представлен в солоде двумя ферментами, однако допускается наличие и других.
Пептидазы катализируют отщепление терминальных остатков аминокислот от пептидов, причем сначала образуются дипептиды и, наконец, аминокислоты. Пептидазы характеризуются субстратной специфичностью. Среди них имеются и дипептидазы, гидролизующие только дипептиды, и полипептидазы, гидролизующие высшие пептиды, содержащие в молекуле не менее трех аминокислот. В группе пептидаз различаются аминополипептидазы, активность которых обусловливает присутствие свободной аминогруппы, и карбоксипептидазы, требующие присутствия свободной карбоксильной группы.
Все солодовые пептидазы имеют оптимальный pH в слабощелочной области между pH 7 и 8 и оптимальную температуру около 40°С. При pH 6, при котором протекает протеолиз в прорастающем ячмене, активность пептидаз ярко выражена, в то время как при pH 4,5-5,0 (оптимум протеиназ) пептидазы инактивируются. В водных растворах активность пептидаз снижается уже при 50°С, при 60°С пептидазы быстро инактивируются.
Ферменты, расщепляющие сложные эфиры фосфорной кислоты
При затирании большое значение придается ферментам катализирующим гидролиз сложных эфиров фосфорной кислоты.
Отщепление фосфорной кислоты технически очень важно из-за ее непосредственного влияния на кислотность и буферную систему пивоваренных полупродуктов и пива.
Природным субстратом солодовых фосфоэстераз являются сложные эфиры фосфорной кислоты, из которых в солоде преобладает фитин. Это смесь кзльцисвых и магниевых солей фитиновой кислоты, которая является гексафосфорным сложным эфиром инозита. В фосфатидах фосфор связан как сложный эфир с глицерином, в то время как нуклеотиды содержат фосфорный эфир рибозы, связанный с пиримидиновым или пуриновым основанием.
Важнейшей солодовой фосфоэстеразой является фитаза (мезоинозитгексафосфатфосфогидролаза, ЕК 3.1.3.8). Она очень активна. От фитина фитаза постепенно отщепляет фосфорную кислоту. При этом образуются различные фосфорные сложные эфиры инозита, которые в конце концов дают инозит и неорганический фосфат. Наряду с фитазой были описаны также сахарофосфорилаза, нуклеотидпирофосфатаза, глицерофосфатаза и пи- рофосфатаза.
Оптимальный pH солодовых фосфатаз находится в относительно узком диапазоне - от 5 до 5,5. К высоким температурам они чувствительны по-разному. Оптимальный температурный интервал 40-50°С очень близок к температурному интервалу пептидаз (протеаз).
Расщепление белков в желудочно-кишечном тракте - это часть метаболизма белков, совокупность управляемых процессов, осуществляемых в системе пищеварения, которые представляют собой химическую переработку белков поступающих в организм с пищей, для последующего их всасывания в кровь и в лимфу.
Расщепление белковых молекул начинается в желудке. Благодаря наличию соляной кислоты белки набухают и денатурируют. На них действует пепсин желудочного сока, который выделяется вне активном виде пепсиногена и активируется соляной кислотой.
Под действием пепсина белок расщепляется на альбумозы и пептоны.
Дальнейший гидролиз альбумозы и пептона происходит в 12-перстной кишке.
Из поджелудочной железы в 12-перстную поступают неактивные формы: трипсиноген, химотрипсиноген, полипептидазы.
В полости 12-перстной кишке трипсиноген превращается в активный трипсин под действием энтерокеназы, образовывается активный трипсин расщепляет альбумозы и пептоны,а часть его затрачивается на превращение химотрипсиногенов в химотрипсин.
Он дополняет действие тринсина, образуются небольшие пептиды их гтдролиз катализируют аминополипептидазы и карбоксиполипептидазы.
При этом дипептиды,на них действуют дипептидазы и выделяются стенками тонкого кишечника. Аминокислоты попадают в кровь, с кровью проходят через печень, затем циркулируют по организму и используются в клетках для синтеза новых белковых молекул.
Невсосавшиеся перемещаются в толстый кишечник,где под действием ферментов микроорганизмов образуются ядовитые вещества.
Переваривание вначале идет в желудке, затем в просвете тонкого кишечника (полостное пищеварение) и затем пристеночное пищеварение - в пристеночном слое кишечного эпителия.
В ротовой полости происходит механическое измельчение пищи. Пищевой комок в желудке подвергается действию соляной кислоты, при этом он набухает и увеличивается поверхность для действия пептидгидролаз желудка – пепсина и гастриксина.
(В основном белки перевариваются в кишечнике под действием пептидгидролаз поджелудочной железы (трипсин, химотрипсин, эластаза, карбоксипептидаза) и кишечника (аминопептидаза, дипептидаза, трипептидаза). Под действием эндопептидаз (пептидазы желудка, трипсин, химотрипсин, эластаза) белки распадаются до полипептидов, под действием экзопептидаз (карбоксипептидаза, аминопептидаза, ди- и трипептидазы) полипептиды распадаются до аминокислот.
Разрушение аминокислот при гниении может идти 2 путями: 1) декарбоксилирование; 2) окисление боковой цепи.
При декарбоксилировании аминокислот образуются соответствующие амины. В толстом кишечнике обычно декарбоксилируются диаминомонокарбоновые аминокислоты, например, при декарбоксилировании орнитина образуется путресцин, при декарбоксилировании лизина образуется кадаверин – реакции знать.
Путресцин и кадаверин образуются также при разложении трупов, поэтому первоначально их называли трупными ядами. Впоследствии оказалось, что эти вещества не ядовиты и могут выводиться без предварительного обезвреживания. В кишечнике эти амины образуются в небольшом количестве, выводятся с мочой.
Второй путь гниения – окисление боковой цепи аминокислот. По этому пути гниют в основном циклические аминокислоты – тирозин и триптофан. Так, при окислении боковой цепи тир образуются крезол и фенол, при окислении боковой цепи три образуются индол и скатол. Эти соединения называют кишечными ядами.)
ПЕРЕВАРИВАНИЕ БЕЛКОВ В ПИЩЕВАРИТЕЛЬНОМ ТРАКТЕ. Переваривание питательных веществ (белков, углеводов, липидов) - это процесс гидролиза соответствен-ных соединений, входящих в состав продуктов питания, происходит в травно-м канале и приводит к образованию простых биомолекул, которые за счет действия специальных механизмов мембранного транспорта всасываются в кровь или лимфу.
Переваривание белков начинается в желудке под действием желудочного сока. В его состав входит хлоридная кислота, вырабатываемая обкладовими клетками слизистой оболочки желудка. Она денатурирует белок, что облегчает его последующее расщепление. В состав желудочного сока входят кислые фосфаты и некоторые органические кислоты. Хлоридная кислота способствует превращению проферменту пепсиногена, который секретируется главными клетками слизистой оболочки желудка, в активный протеолитический фермент пепсин.
Оптимальная концентрация водородных ионов для пепсина составляет 1,5...2,5, что соответствует кислотности желудочного сока в процессе пищеварения. При увеличении рН среды до 6,0 (в кишечнике) пепсин теряет свою активность. Пепсин относится к однокомпонентных ферментов, то есть до ферментов-протеинов. За сутки в желудке вырабатывается около 2 г пепсина. Каталитическая активность пепсина желудка очень высока. Он катализирует расщепление пептидных связей в молекуле белка, образованных аминогруппами ароматических и дикарбоновых аминокислот. В результате действия пепсина образуются полипептиды различной величины и отдельные свободные аминокислоты.
Кроме пепсина в желудочном соке содержится протеолитический фермент гастріксин, оптимальные значения рН которого находятся в пределах 3,5...4,5. Гастріксин вступает в действие на последних этапах переваривания пищи в желудке.
В желудке грудных детей обнаружен сычужный фермент - химозин. Оптимум действия этого фермента рН 3,5...4,0. Под влиянием хімозину в присутствии солей кальция казеїноген молока в ходе гидролиза превращается в казеин и молоко сворачивается.
Легче других в желудке перевариваются альбумины и глобулины животного и растительного происхождения; плохо расщепляются белки соединительной ткани (коллаген и эластин) и совсем не расщепляются кератин и протаміни.
Частично переваренная полужидкая масса питательных соединений, образующийся в желудке (химус) периодически поступает через пилорический клапан в двенадцатиперстную кишку. В эту часть пищеварительного канала поступают из поджелудочной железы протеолитические ферменты и пептидазы, которые действуют на пептиды, поступающие из желудка. Каталитическая действие этих ферментов происходит в слабощелочной среде (рН 7,5...8,0), которое образуется имеющимися в кишечном соке бикарбонатами. Большинство ферментов протеолитического действия, которые функционируют в тонкой кишке, синтезируются в экзокринных клетках поджелудочной железы в виде проферментів, которые активируются после их поступления в двенадцатиперстную кишку (трипсиноген, хімотрипсиноген, проеластаза, прокарбоксипептидази А и Б). Гидролиз белков и пептидов, поступающей из желудка, происходит как в полости тонкой кишки, так и на поверхности энтероцитов - пристеночное или мембранное пищеварение.
Сок поджелудочной железы поступает в двенадцатиперстную кишку и смешивается с кишечным соком. Эта смесь содержит протеолитические ферменты, расщепляющие белки, альбумози и пептоны до небольших пептидов, а затем до аминокислот. К протеолитических ферментов относятся трипсин, химотрипсин, карбоксипептидазы, амінопептидази и большая группа три - и дипептидаз.
Трипсин находится в соке поджелудочной железы в неактивной форме, в виде проферменту трипсиногену. Его активация происходит под действием фермента кишечного сока - энтерокиназы. Для процесса активирования необходимы ионы Са2+. Процесс преобразования трипсиногену в трипсин осуществляется путем отщепления небольшого пептида с N-конца пептидной цепи фермента.
Трипсин гидролизует как нерасщепленный в желудке белки, так и высокомолекулярные пептиды, действуя главным образом на пептидные связи между аргинином и лизином. Оптимум рН для трипсина составляет 7,0...8,0. Трипсин делает сравнительно неглубокий гидролиз белка, образует полипептиды и небольшое количество свободных аминокислот.
Активность трипсина может снижаться под влиянием ряда ингибиторов. К ним относятся основные пептиды с молекулярной массой 9000 Да. Они обнаружены в поджелудочной железе, крови, легких, в бобах сои. Снижает активность трипсина и мукопротеїн, что содержится в сырых яйцах - авідин.
Химотрипсин - второй протеолитический фермент поджелудочной железы. Он также секретируется в неактивной форме, в виде хімотрипсиногену. Под действием трипсина хімотрипсиноген переходит в активный фермент - химотрипсин. Действие химотрипсина подобная действия трипсина. Оптимум рН для обоих ферментов примерно одинаковый, химотрипсин действует на белки и полипептиды, содержащие ароматические аминокислоты (тирозин, фенилаланин, триптофан), а также на пептидные связи, которые не поддаются воздействию трипсина (метионин, лейцин).
Пептиды, образовавшиеся в результате действия на белки пепсина, трипсина и химотрипсина в нижних отделах тонкой кишки, подвергаются дальнейшему расщеплению. Этот процесс осуществляют карбоксипептидазы, амінопептидази. Эти ферменты относятся к металлоферментов. Они активируются двовалентними ионами: Mg2+, Mn2+, Со2+, которые играют важную роль в формировании фермент-субстратного комплекса.
Механизм действия амино - и карбоксипептидаз заключается в відщіпленні от концевых пептидов аминокислот, имеющих свободную аминную или карбоксильну группу. Небольшие пептиды, остались нерозщепленими и состоят из трех-четырех аминокислотных остатков, подвергаются гидролизу специфическими ди - и триамінопептидазами. В соке поджелудочной железы является фермент эластаза.
Эластаза - ендопептидаза, что также имеет широкую субстратну специфичность, расщепляя пептидные связи, образуемые остатками аминокислот малого размера - глицина, аланина, серина.
Таким образом, в результате последовательного действия на белки протеолитических ферментов в кишечнике образуются свободные аминокислоты, которые всасываются в кровь через стенку кишечника
Образование ядовитых продуктов в толстом кишечнике, их обезвреживание в печени при помощи серной и глюкуроновой кислот.
Аминокислоты, не всосавшаяся в кровь через слизистую оболочку тонкой кишки, подвергаются воздействию микроорганизмов в толстом кишечнике. При этом ферменты микроорганизмов расщепляют аминокислоты и превращают их в амины, жирные кислоты, спирты, фенолы и другие вещества, нередко ядовитые для организма. Этот процесс иногда называют гниением белков в кишечнике. В его основе лежит декарбоксилирования аминокислот, при этом из аминокислот появляются биологические амины. Так, из аминокислоты орнитина образуется путресцин:
Из лизина образуется кадаверин:
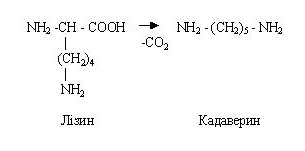
Путресцин и кадаверин выводятся из организма с фекальными массами. В тех случаях, когда эти соединения попадают в кровь, они выводятся с мочой в неизмененном виде.
Из тирозина образуется крезол, а если процесс идет дальше, то и фенол:

Из триптофана образуются скатол и индол:

При глубоком разрушении кишечными микроорганизмами серосодержащих аминокислот - цистіну, цистеина и метионина - образуется сероводород (H2S), меркаптан (CH3SH) и другие серосодержащие соединения.
Продукты гниения белков всасываются в венозную кровь, затем попадают в печень, где и обезвреживаются с помощью серной или глюкуроновой кислоты.
Этот процесс осуществляется по следующей схеме:


Индол и скатол также обезвреживаются в печени при участии серной и глюкуроновой кислот. Однако они предварительно окисляются: скатол в скатоксил, индол в индоксил и в виде парных кислот выводятся из организма с мочой.

Некоторые ядовитые вещества, например, бензойная кислота, образовавшаяся из фенилаланина, обезвреживаются в печени с помощью глицина. При этом образуется гіпурова кислота - безвредное соединение, которое выделяется с мочой.

Возможности печени в обезвреживании образующихся в толстой кишке ядовитых веществ, что всосались в кровь, не безграничны. При снижении ее функциональной способности (например, в связи с перенесенными ранее заболеваниями) поступления значительного количества ядовитых веществ может оказаться чрезмерной нагрузкой, тогда часть необезвреженных ядовитых веществ разносится (большим кругом кровообращения) по всему организму, вызывая его отравление. Происходит преждевременное старение клеток и их гибель. При этом отмечается ухудшение самочувствия человека, его мучают головные боли.
Для предупреждения негативного воздействия ядовитых веществ на организм необходимо рационально планировать пищевой рацион. В него должны быть включены продукты, содержащие не только белки, но и жиры и углеводы, полезные кисломолочные продукты, потому что молочнокислые бактерии способствуют ускорению гибели гнилостных микроорганизмов толстой кишки. В рационе необходима пища является источником пектиновых веществ и клетчатки, что, повышая двигательную активность кишечника, способствуют выведению шлаков (в том числе и ядовитых веществ) из организма.
Внутриклеточный обмен белков: дезаминирование, декарбоксилирование, переаминирование.
Основная часть аминокислот, образуется в кишечнике из белков, поступает в кровь (95 %) и небольшая часть - в лимфу. По воротной вене аминокислоты попадают в печень, где тратятся для биосинтеза различных специфических белков (альбуминов, глобулинов, фибриногена), другие аминокислоты током крови разносятся ко всем органам и тканям, транспортируются внутрь клеток, где они используются для биосинтеза белков. Неиспользованные аминокислоты окисляющиеся до конечных продуктов обмена.
Процесс расщепления тканевых белков катализируется тканевыми ферментами - протеиназами-катепсинами.
Соотношение между аминокислотами в белках, распадаются и синтезируются, разное, поэтому часть свободных аминокислот должна быть преобразована в другие аминокислоты или окисленное до простых соединений и выведена из организма. Итак, в организме существует внутриклеточный запас аминокислот, в значительной степени пополняется за счет процессов взаимопревращения аминокислот, гидролиза белков, синтеза аминокислот и поступления их из внеклеточной жидкости. В то же время благодаря синтезові белков и других реакций (образование мочевины, пуринов и т.п.) постоянно происходит удаление свободных аминокислот из внеклеточной жидкости.
Дезаминирование аминокислот. Суть дезаминирование заключается в расщеплении аминокислот под действием ферментов на аммиак и безазотистий остаток (жирные кислоты, оксикислоты, кетокислоты). Дезаминирование может идти в виде восстановительного, гидролитического, окислительного и внутрімолекулярного процессов. Последние два типа преобладают у человека и животных.
Окислительное дезаминирование подразделяется на две стадии. Первая стадия является ферментативной, она заканчивается образованием неустойчивого промежуточного продукта - імінокислоти, что во второй стадии спонтанно в присутствии воды распадается на аммиак и -кетокислоту. Ферменты, которые катализируют этот процесс, содержащих в качестве простетическая группы НАД или ФАД.
В организме человека наиболее активно протекает дезаминирование глутаминовой кислоты под действием фермента глутаматдегідрогенази, что нахо-дится в митохондриях клеток всех тканей. В результате этого процесса образует -кетоглутаровая кислота участвует во многих процессах обмена веществ.
Трансаминирование (переаминирование) аминокислот. Обязательным условием трансаминирования является участие дикарбоновых аминокислот (глутаминовой и аспарагиновой), в виде соответствующих им кетокислот - -кетоглутарової и щавелевооцтової могут взаимодействовать со всеми аминокислотами, за исключением лизина, треоніну и аргинина.
При переамінуванні происходит непосредственный перенос аминогруппы с аминокислоты на кетокислоту, а кетогрупи - кетокислоты с аминокислотой без увольнения при этом аммиака.
Этот процесс протекает в несколько этапов. В общем виде реакция выглядит так:

Реакцию катализируют ферменты, относящиеся к классу трансфераз, их простетической группой является фосфорпіридоксаль - фосфорный эфир витамина В6.
Процесс переаминирования широко распространен в живой природе. Его особенность - легкая обратимость.
Реакции переаминирования играют большую роль в обмене веществ. От них зависят такие важнейшие процессы, как биосинтез многих заменимых аминокислот из соответствующих им кетокислот, распад аминокислот, объединение путей углеводного и аминокислотного обмена, когда из продуктов распада глюкозы, например, пировиноградной кислоты, может образоваться аминокислота аланин и наоборот.
Відбудовне аминирование. Этот процесс противоположный дезамінуванню. Он обеспечивает связывание аммиака кетокислотами с образованием соответствующих аминокислот.
Відбудовне аминирование катализируется хорошо функционирующей ферментной системой, что обеспечивает аминирование -кетоглутарової или щавелевооцтової кислоты с образованием глутаминовой или аспарагиновой кислоты.

При обезвреживании аммиака неорганическими и органическими кислотами происходит образование аммонийных солей. Этот процесс осуществляется в почках. Аммонийные соли, образовавшиеся выводятся из организма с мочой и потом.
Декарбоксилирование аминокислот. Процесс декарбоксилирования каталі-теризуется декарбоксилазами, специфическими для каждой аминокислоты, простетической группой которых служит пиридоксальфосфат. Эти ферменты относятся к классу лиаз. Процесс декарбоксилирования, заключается в відщіпленні от аминокислот СО2 с образованием аминов, можно показать на следующей схеме:

Механизм реакции декарбоксилирования аминокислот согласно общей теории піридоксалевого катализа сводится к образованию пиридоксальфосфат-субстратного комплекса в активном центре фермента.
Таким путем из триптофана образуется триптамин, с гідрокситриптофана - серотонин. Из аминокислоты гистидина образуется гистамин. Из глутаминовой кислоты при декарбоксилировании образуется -аминомасляная кислота (ГАМК).
Амины, образующиеся из аминокислот, называют биогенными аминами, потому что они оказывают на организм мощный биологический эффект.
Биогенные амины проявляют физиологическое действие в очень малых концентрациях. Так, введение в организм гістамину приводит к расширению капилляров и повышение их проницаемости, сужение крупных сосудов, сокращение гладких мышц различных органов и тканей, повышение секреции соляной кислоты в желудке. Кроме того, гистамин участвует в передаче нервного возбуждения.
Серотонин способствует повышению кровяного давления и сужению бронхов; его малые дозы угнетают активность центральной нервной системы, в больших дозах это вещество оказывает стимулирующее действие. В различных тканях организма большие количества гистамина и серотонина находятся в связанной, неактивной форме. Биологическое действие они проявляют только в свободной форме.
-аминомасляная кислота (ГАМК) накапливается в мозговой ткани и представляет собой нейрогуморальный ингибитор-медиатор торможения центральной нервной системы.
Большие концентрации этих соединений могут представлять угрозу для нормального функционирования организма. Однако в животных тканях имеется аміноксидаза, что расщепляет амины до соответствующих альдегидов, которые затем превращаются в жирные кислоты и распадаются до конечных продуктов.
Обезвреживание аммиака.

В процессе превращения аминокислот в тканях образуются их конечные продукты обмена - оксид углерода, вода и аммиак. Вода используется организмом для обеспечения биохимических процессов. Оксид углерода частично выводится из организма с выдыхаемым воздухом, другая его часть утилизируется в процессах синтеза (например, при синтезе жирных кислот, пуриновых оснований и т.д.). Аммиак, который образуется в результате дезаминирования аминокислот, является токсичным веществом, увеличение его концентрации в крови и других тканях оказывает неблагоприятное действие, особенно на нервную систему. Токсичность аммиака обусловлена тем, что он способствует відбудовному амінуванню -кетоглутарової кислоты в митохондриях. Это приводит к удалению ее из цикла Кребса и, как следствие, к падению тканевого дыхания и избыточного образования кетоновых тел из ацетил-КоА.
В процессе эволюции живые организмы выработали различные эффективные механизмы со обезвреживания токсического действия аммиака, основными из которых являются: образование аминов глутамина или аспарагина, відбудовне аминирование, нейтрализация кислот, синтез мочевины.
Синтез глютамина или аспарагина имеет большое значение для организма. Он протекает в местах непосредственного образования аммиака (например, в печени, мозга), там же находится и фермент, каталізуючий этот процесс, глутамінсинтетаза, что относится к классу лігаз. Синтез амидов требует доставки энергии в виде АТФ, присутствии глутаминовой или аспарагиновой кислот, свободного аммиака и соответствующих специфических ферментов. Реакция синтеза амида связана с распадом АТФ.

Таким образом, в цитрулини зафиксирована одна молекула аммиака.

Второй этап. Происходит связывание еще одной молекулы аммиака в глутаминовую кислоту путем восстановительного аминирование с -кетоглутаровою кислотой. Глутаминовая кислота передает зафиксированную молекулу аммиака в виде NH2-группы на щавелевооцтову кислоту, которая превращается в аспарагиновую кислоту (процесс переаминирования):

Третий этап. На этом этапе осуществляется синтез мочевины. Цитруллин, взаимодействуя с аминогруппой аспарагиновой кислоты, образует аргінінобурштинову кислоту (аргінінсукцинат).
В этом процессе используется энергия еще одной молекулы АТФ.

Аргінінобурштинова кислота расщепляется на аргинин и фумарову кислоту. Фумаровая кислота включается в углеводный обмен, превращаясь в яблочную, которая путем дегидрирования переходит в щавелевоцтову.

Щавелевооцтова кислота может присоединять к себе аммиак и снова превращаться в аспарагиновую кислоту или, подвергаясь декарбоксилированию, в пировиноградную, а потом в коэнзим А, который используется в различных реакциях биосинтеза или окисляется до СО2 и Н2О.
Аргинин, образовавшийся под действием аргінази, гидролитически расщепляется на орнитин и мочевину. Орнитин высвободившийся может снова вступить в реакцию с новой молекулой карбомоїлфосфату и процесс повторится.
Подсчитано, что в состоянии азотистого равновесия организм взрослого человека потребляет и соответственно выделяет 15 г азота; с екскретованого с мочой азота на долю мочевины приходится около 85 %, креатініну - 5, аммонийных солей - 3, мочевой кислоты - 1, других его форм - 6.

