Молочная кислота рн водных растворов. Молочная кислота (2-гидроксипропионовая кислота)
МОЛОЧНАЯ КИСЛОТА
(2-гидроксипропионовая
кислота) СН 3 СН(ОН)СООН, молекулярная масса 90,1; бесцветные кристаллы. Известны Д(+)-молочная
кислота, D(-)-молочная (мясо-молочная) кислота и рацемич. МОЛОЧНАЯ КИСЛОТАк.-молочная кислота брожения.
Для D,L- и D-М.к. температура плавления соответственно 18 °С и 53 °С; температура кипения соответственно 85°С/1
мм рт.ст. и 103°С/2мм рт.ст.; для D-М.к. [a] D 20
-2,26 (концентрация 1,24% в воде). Для D,L-M. к. DH 0 обр
- 682,45 кДж/моль; DH 0 пл 11,35 кДж/моль;
DH исп 110,95 кДж/моль
(25°С), 65,73 кДж/моль (150°С). Для L-М.к. DH 0 сгор
- 1344,8 кДж/моль; DH 0 обp -694,54 кДж/моль; DH 0 пл
16,87 кДж/моль.
Из-за высокой гигроскопичности
МОЛОЧНАЯ КИСЛОТАк. обычно используют ее концентрир. водные растворы-сиропообразные бесцв. жидкости
без запаха. Для водных растворов МОЛОЧНАЯ КИСЛОТАк. d 20 4 1,0959 (40%),
1,1883 (80%), 1,2246 (100%); n D 25 1,3718 (37,3%),
1,4244 (88,6%); h 3,09 и 28,5 мПа. с (25 0 С) соответственно для
45,48 и 85,32%-ных растворов; g 46,0 . 10 -3 Н/м(25°С)для
1 М раствора; е 22 (17°С). МОЛОЧНАЯ КИСЛОТАк. растворим в воде, этаноле, плохо-в бензоле, хлороформе
и др. галогенуглеводородах; рK а 3,862 (25 °С); рН водных
растворов 1,23 (37,3%), 0,2 (84,0%).
Окисление МОЛОЧНАЯ КИСЛОТАк. обычно сопровождается
разложением. При действии HNO 3 или О 2 воздуха в присутствии
Сu или Fe образуются НСООН, СН 3 СООН, (СООН) 2 , СН 3 СНО,
СО 2 и пировиноградная кислота. Восстановление МОЛОЧНАЯ КИСЛОТАк. HI приводит к пропионовой
кислоте, а восстановление в присутствии Re-черни - к пропиленгликолю.
М. к. дегидратируется до
акриловой кислоты, при нагревании с НВr образует 2-бромпропионовую кислоту, при взаимодействии
Са-соли с РСl 5 или SОСl 2 -2-хлорпропионилхлорид. В присут.
минеральных кислот происходит самоэтерификация МОЛОЧНАЯ КИСЛОТАк. с образованием лактона формулы I, а
также линейных полиэфиров. При взаимодействие МОЛОЧНАЯ КИСЛОТАк. со спиртами образуются гидроксикисло ты
RCH 2 CH(OH)COOH, a при взаимодействии солей МОЛОЧНАЯ КИСЛОТАк. со спиртамиэфиры.
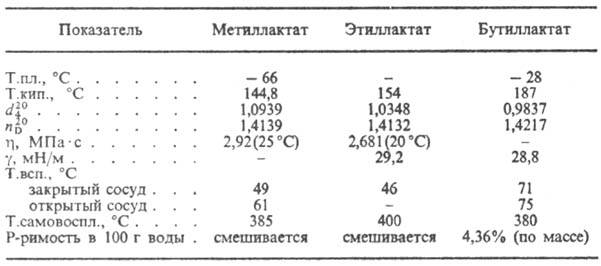
Соли и эфиры МОЛОЧНАЯ КИСЛОТА к. называют лактатами (см. табл.).
М.к. образуется в результате
молочнокислого брожения
(при скисании молока, квашении капусты, солении овощей, созревании
сыра, силосовании кормов); D-М.к. обнаружена в
тканях животных, растений, а также в микроорганизмах.
В промышлености МОЛОЧНАЯ КИСЛОТА к. получают
гидролизом 2-хлорпропионовой кислоты и ее солей (100 °С) или лактонитрила CH 3 CH(OH)CN
(100 °С, H 2 SO 4) с последующей образованием эфиров, выделение
и гидролиз которых приводит к продукту высокого качества. Известны др. способы
получения МОЛОЧНАЯ КИСЛОТАк.: окисление пропилена оксидами азота (15-20°С) с последующей обработкой
H 2 SO 4 , взаимодействие СН 3 СНО с СО (200 °С, 20
МПа).
СВОЙСТВА НЕКОТОРЫХ ЛАКТАТОВ
М.к. применяют в пищевая промышлености,
в протравном крашении, в кожевенном производстве, в бродильных цехах в качестве
бактерицидного средства, для получения лек. ср-в, пластификаторов. Этил- и бутиллактаты
применяют в качестве растворителей эфиров целлюлозы, олиф, растит. масел; бутил-лактат-также
как растворитель некоторых синтетич. полимеров.
Мировое производство МОЛОЧНАЯ КИСЛОТАк. 40
тысяч т (1983).
Химическая энциклопедия. Том 3 >>
Рациональная номенклатура ферментов составляется путем прибавления к латинскому корню названия субстрата, на который действует фермент, или к названию процесса, катализируемого ферментом, окончания "аза".
Например, фермент, воздействующий на крахмал (amylum), называется амилаза; мочевину (urea) – уреаза; фенолы – фенолаза и т.д.
Кроме рационального названия сохранились ранее появившиеся термины: пепсин, трипсин.
В 1961 г. принята новая международная классификация, в основу которой принят тип катализируемой реакции.
В настоящее время известно около 3000 различных ферментов. Классификацию их проводят по типу их действия. Различают 6 классов ферментов:
1 .Оксидоредуктазы – окислительно-восстановительные
ферменты; катализируют биологическое окисление.
2.Трансферазы – катализируют реакции переноса различных химических групп от одной молекулы (донора) к другой молекуле (акцептору).
3. Гидролазы – осуществляют химические превращения веществ с участием молекулы воды.
4. Лиазы – отщепляют от субстратов ту или иную группу негидролитическим путем.
5. Изомеразы – осуществляют изомерные превращения соединений.
6. Лигазы (синтетазы) – катализируют реакции синтеза, сопровождающиеся отщеплением фосфорной кислоты от АТФ или другого трифосфата.
I класс . Оксидоредуктазы – это ферменты окислительно-восстановительных реакций, лежащих в основе биологического окисления. Название ферментов составляется по следующей форме: название субстрата (донора), от которого отщепляются атомы водорода (электроны), название акцептора, на который переносятся атомы водорода и оканчивается названием "оксидоредуктаза": например, лактат: НАД-оксидоредуктаза.
Различают следующие подклассы:
1) аэробные дегидрогеназы, которые переносят электроны и протоныводорода с окисляемого субстрата на кислород:
H 2 S + O 2 S окисленная + H 2 O 2
сероводород
к ним относятся ферменты оксидазы;
2) анаэробные дегидрогеназы переносят электроны и протоны водорода с окисляемого на другой субстрат. К ним относятся пиридинзависимые и флавинзависимые дегидрогеназы. Например, окисление молочной кислоты происходит под действием лактатдегидрогеназы, при этом НАД восстанавливается в НАДН 2:

молочная кислота пировиноградная кислота
Окисление янтарной кислоты происходит поддействием сукцинатдегидоогеназы, при этом ФАД восстанавливается в ФАДН 2 .

янтарная кислота фумаровая кислота
3) электронтранспортазы – переносчики электронов. К ним относятся цитохромные ферменты, цитохромоксидазы дыхательной цепи митохондрий
4) пероксидаза и каталаза. Пероксидаза катализирует окисление субстрата перекисью водорода. Например, под действием пероксидазы сероводород окисляется с участием перекиси водорода:
H 2 S + H 2 O 2 S окисленная + 2H 2 O
Каталаза в организме животных разрушает перекись водорода на воду и молекулярный кислород:
2H 2 O 2 2H 2 O + O 2
Каталаза обезвреживает действие перекиси и является источником молекулярного кислорода в тканях.
II класс . Трансферазы – катализируют реакции переноса атомов и групп атомов, включают следующие подклассы:
1) Аминоферазы – ферменты, переносящие аминогруппы с одного вещества на другое. Коферментом является производное витамина B 6 (пиридоксин): например, глутаминовая кислота отдает аминную группу на пируват, в результате синтезируется аланин и образуется а-кетоглутаровая кислота.

глутаминовая пируват α - кетоглутаровая аланин
кислота кислота
Пиридоксин – фермент, осуществляющий эту реакцию, называется 1-глутамил:пируватаминотрансфераза или по старой номенклатуре – аминофераза.
2) Ацилтрансферазы – ускоряют перенос ацилов (остатков карбоновых кислот) на аминокислоты, спирты и другие соединения. Например, синтез ацетилхолина осуществляется с участием фермента холинацетилтрансферазы:

3) Фосфотрансферазы – ферменты, ускоряющие реакцию переноса остатка фосфорной кислоты. Донором фосфатных остатков чаще всего является АТФ. Например, гексокиназа ускоряет перенос остатка фосфорной кислоты на глюкозу:

α-D -глюкоза глюкозо-6-фосфат
4) Метилферазы - ферменты, переносящие метильную группу с одного соединения на другое: например, при синтезе креатина донором метильной группы является метионин.
5) Глюкозилтрансферазы - переносчики глюкозидных
остатков:
11(C 6 H 12 O 6) + УДФ - глюкоза (n+1) (C 6 H 12 O 6) + УДФ
к ним относятся гликогенсинтазы, глюкозилтрансферазы, фосфорибозилтрансферазы и т.д.
6) Алкилтрансферазы – переносчики спиртовых остатков. К ним относятся холинтрансфераза, фосфатилдиэтаноламин-трансфераза и др.
III класс. Гидролазы - разрывают внутримолекулярные связи путем присоединения элементов воды:
R - R 1 + HOH R - H + R 1 - ОН
К ним относятся следующие подклассы:
1) Эстеразы - ферменты, гидролизирующие эфирные связи по схеме:
R 1 -0-R 2 + HOH R 1 -H+ R 2 -OH
Например, фосфодиэстеразы - гидролизуют фосфорные эфиры:
Диацилглицерин 3-фосфорная кислота + HOH диацилглицерин + H 3 PO 4 .
К этому подклассу относятся: фосфатазы (кислая, щелочная), глюкозо-6-глюкозо-1-фосфатаза, РНК-аза и др.
Карбоксиэстеразы – гидролизуют сложные эфирные связи:

тристеарин глицерин стеариновая
К этим ферментам относятся липазы, лецитиназы, простые эстеразы и т.д.
Сульфоэстеразы – гидролизуют сернокислые эфиры по следующей схеме:
фенолсерная кислота фенол серная кислота
2) Гликозидазы – гидролизуют гликозидные связи, к ним относятся α- и β-амилазы, мальтаза, лактаза, сахараза.
3) Пептидазы. Различают эндопептидазы – пепсин, трипсин, хемотрипсин; экзопептидазы – аминопептидаза, карбоксипептидаза, дипептидазы, трипептидазы.
Пептидазы гидролизуют пептидные связи по следующей реакции:
![]()
аланилаланин аланин
В результате гидролиза образуется две молекулы аланина.
4) Амидазы – ферменты, гидролизующие амидные связи пуриновых и пиримидиновых оснований, амидов аминокислот и
аргинина. Примеры:
А) Аденин + H 2 O гипоксантин + NH 3
пуриндезаминаза

глутаминовая глутамин

аргинин мочевина орнитин
5) Полифосфатазы - гидролизуют фосфорноангидридные связи:
АТФ + H 2 O АДФ + H 3 PO 4
К этой группе относятся Na + , K + , Mg 2+ -ATФaзa, и др.
IV класс. Лиазы – ферменты, расщепляющие связи без Участия воды, разрывая при этом C-C связи, C-N связи, C-O связи. К ним относятся ферменты альдолаза, декарбоксилаза и другие. Например, альдолаза разрывает C-C связи гексозы (1,6 -дифосфофруктозы) с образованием двух триоз, фосфодиоксиацетона и фосфоглицеринового альдегида:

V класс . Изомеразы: катализируют изомеризацию, изомерные превращения молекул, например, молекулы глюкозы во фруктозу. Мутазы изменяют местоположение различных групп или атомов в молекуле. К ним относятся: фосфоглицеромутаза, фосфоглюкомутаза, фосфофруктомутаза и т.д. Например, фосфодиоксиацетон под действием изомеразы превращается в фосфоглицериновый альдегид:

фосфодиоксиацетон фосфоглицериновый альдегид
VI класс. Лигазы (синтетазы) – ферменты, катализирующие присоединение молекул друг к другу. Например:
Аминокислота + тРНК аминоацил-тРНК
Сюда относятся ферменты: ДНК-полимеразы, РНК-полимеразы, ферменты, катализирующие синтез белков и т.д.
Реактивы:
Фталевая кислота
Ход работы:
В сухую пробирку помещают ~0,1-0,2 г ортофталевой кислоты и нагревают ее на пламени спиртовки, держа пробирку горизонтально. Образуется фталевый ангидрид, который сублимируется и вновь конденсируется на холодных стенках пробирки. Пробирку охлаждают, затем осторожно нагревают осадок фталевого ангидрида, он легко плавится и стекает на дно пробирки.
Опыт №56. Получение фенолфталеина
Реактивы:
Фталевый ангидрид
Ход работы:
В сухую пробирку помещают ~0,2 г фенола, ~0,1 г фталевого ангидрида, ~5 капель концентрированной серной кислоты и осторожно нагревают на пламени спиртовки. Смесь плавится, происходит конденсация фенола с фталевым ангидридом:

Затем, пробирку охлаждают на воздухе. К охлажденной смеси приливают полпробирки воды и энергично встряхивают. Полученный раствор переносят в другую пробирку и добавляют несколько капель раствора щелочи. В щелочной среде появляется малиново-красное окрашивание, что указывает на присутствие фенолфталеина в растворе.
В щелочной среде происходит изомеризация одного из бензольных ядер, образуется хиноидная группировка, которая и обуславливает появление окраски. При подкислении раствора окраска исчезает, при внесении щелочи она вновь появляется. Указанное свойство фенолфталеина используют в аналитической химии как показатель (индикатор) реакции среды.
Если вместо фенола взять резорцин (двухатомный фенол) и проводить опыт аналогично вышеописанному, то образуется флуоресцеин. Раствор флуоресцеина в щелочной среде имеет красивую окраску, в проходящем свете красную, в отраженном зеленую (флуоресценция).
VIII. ГИДРОКСИКИСЛОТЫ
Опыт №57. Обнаружение молочной кислоты
Реактивы:
Раствор 1%-ный фенола
Раствор 1%-ный хлорида железа
Молочная кислота
Ход работы:
К ~3 мл 1%-ного раствора фенола прибавляют несколько капель 1%-ного раствора хлорида железа (III). Жидкость окрашивается в ярко-фиолетовый цвет вследствие образования комплексных фенолятов трехвалентного железа. К полученной жидкости добавляют несколько капель молочной кислоты и наблюдают изменение цвета раствора в зелено-желтый благодаря образованию лактата железа (CH 3 CH(OH)COO) 3 Fe.
Опыт №58. Разложение молочной кислоты при нагревании с концентрированной серной кислотой
Реактивы:
Молочная кислота
Концентрированная серная кислота
Ход работы:
Смесь равных объемов (по ~0.5 мл) молочной и серной кислот осторожно нагревают в пробирке с газоотводной трубкой. Выделяющийся оксид углерода (II) зажигают у отверстия газоотводной трубки, он горит голубоватым пламенем.
- α-оксипропионовая (2-гидроксипропановая) кислота, CH 3 CH(OH)COOH. Одноосновная оксикарбоновая кислота; важный промежуточный продукт обмена веществ у животных, растений и микроорганизмов; предельная монокарбоновая кислота ациклического ряда

Была открыта шведским химиком Карлом Шееле в 1780 году.
В 1807 году Йенс Якоб Берцелиус выделил из мышц цинковую соль молочной кислоты.
Описание и свойства
Бесцветные кристаллы, легко растворяются в воде, этаноле, плохо – в бензоле, хлороформе. Существует в двух оптически активных (-)- и (+)-формах (t
пл 25-26 °С) и в виде неактивной рацемической (±)-формы (t пл 18 °С).
Реакции

Молочная кислота в организме человека и животных
Молочная кислота формируется при распаде глюкозы. Иногда называемая «кровяным сахаром», глюкоза является главным источником углеводов в нашем организме. Это основное топливо для мозга и нервной системы, так же как и для мышц во время физической нагрузки. Когда расщепляется глюкоза, клетки производят АТФ (аденозина трифосфат), который обеспечивает энергией большинство химических реакций в организме. Уровень АТФ определяет, как быстро и как долго наши мышцы смогут сокращаться при физической нагрузке. Производство молочной кислоты не требует присутствия кислорода, поэтому этот процесс часто называют «анаэробным метаболизмом». Многие считают, что мышцы производят молочную кислоту, когда недополучают кислород из крови. Другими словами, вы находитесь в анаэробном состоянии. Однако, учёные утверждают, что молочная кислота образуется и в мышцах, получающих достаточно кислорода. Увеличение количества молочной кислоты в кровотоке свидетельствует лишь о том, что уровень её поступления превышает уровень удаления. Кислород не играет здесь существенной роли. Зависимое от лактата производство АТФ очень незначительно, но имеет большую скорость. Это обстоятельство делает идеальным его использование в качестве топлива, когда нагрузка превышает 50 % от максимальной. При отдыхе и субмаксимальной (скорее умеренной, под субмаксимальной обычно понимают 90 % от максимума) нагрузке организм предпочитает расщеплять жиры для получения энергии. При нагрузках в 50 % от максимума (порог интенсивности для большинства тренировочных программ) организм перестраивается на преимущественное потребление углеводов. Чем больше углеводов вы используете в качестве топлива, тем больше производство молочной кислоты.
Чтобы глюкоза могла проходить через клеточные мембраны, ей необходим инсулин. Молекула же молочной кислоты в два раза меньше молекулы глюкозы, и гормональная поддержка ей не нужна - она с лёгкостью сама проходит через клеточные мембраны.
Применение.
Молочную кислоту применяют в пищевой промышленности, в протравном крашении, в кожевенном производстве, в бродильных цехах в качестве бактерицидного средства, для получения лекарственных средств, пластификаторов. Этил- и бутиллактаты применяют в качестве растворителей эфиров целлюлозы, олиф, растительных масел; бутил-лактат — также как растворитель некоторых синтетических полимеров.
Мировое производство молочной кислоты — 40 тыс. т (1983 год).
 Генрих Отто Виланд
Генрих Отто Виланд
 Адольф Иоганн Фридрих Вильгельм фон Байер
Адольф Иоганн Фридрих Вильгельм фон Байер
 Фридрих Бергиус
Фридрих Бергиус
 Общая характеристика металлов. Нахождение в природе и распространенность. Способы получения и очистки
Общая характеристика металлов. Нахождение в природе и распространенность. Способы получения и очистки
 Хром как химический элемент
Хром как химический элемент
Cтраница 1
Окисление молочной кислоты двуокисью свинца приводит к получению уксусного альдегида.
При окислении молочной кислоты бихроматом калия в присутствии серной кислоты образуется уксусный альдегид, который улавливается при перегонке реактивом Несслера. Окраска последнего указывает лишь на возможное присутствие в пробе молочной кислоты.
Задание 10.7. Окисление молочной кислоты в пнровнноградную (2-ок-сопропановую) кислоту происходит в живых организмах как один из этапов биологического растепления углеводов.
Пировиноградную кислоту можно синтезировать окислением молочной кислоты (см. разд.
Энергия, выделяющаяся при окислении молочной кислоты, используется в мышце для ресинтеза гликогена.
Примером этой реакции может служить окисление молочной кислоты в пировиноградную кислоту.
Нами подробно изучалось влияние кислотности среды и избытка окислителя при окислении молочной кислоты бихрома-том калия.
Если отравленную продуктом собственной жизнедеятельности мышцу перенести в атмосферу кислорода, то картина меняется. Начинаются два процесса: окисление молочной кислоты, результатом которого являются дополнительное и очень существенное по масштабам выделение энергии, и синтез гликогена. Оказывается, что процессы постепенного превращения гликогена в глюкозу и затем в молочную кислоту во всех своих важнейших стадиях обратимы. Биохимическая машина может работать навыворот и из конечных продуктов опять создавать сырье. Некоторая часть молочной кислоты - конечного продукта гликогенолиза (разложение гликогена) вновь переходит Б сырье - гликоген.
Метод основан на измерении интенсивности окраски соединения, образующегося в процессе реакции а цетальдегида, который возник за счет окисления молочной кислоты с параок-сидифенилом.
Хотя цитохром Ь2 катализирует разложение и других субстратов (а-окси-н-бутиратов, а-окси-м-капроатов, ос-оксиизокапроатов), их концентрация в биогологических средах на несколько порядков ниже, чем концентрация молочной кислоты, поэтому мешающее влияние пренебрежимо мало. Большое число метаболитов с восстановительными свойствами, например мочевая кислота, глутатион, цистеин, адреналин, аскорбиновая кислота, р-аланин, окисляются или [ Fe (CN) 6 ] 3, или на платиновом электроде, и их ток окисления складывается с током, соответствующим окислению молочной кислоты. Поэтому в присутствии этих метаболитов проводить определение молочной кислоты нежелательно.
Такой прибор описан для микроопределения треонина при помощи тг-оксидифенила (см. гл. Окисление молочной кислоты в ацетальдегид заканчивается при 50 водяной бани за 30 мин. За это же время ацетальдегид выдувают в 15 мл крепкой HtaSCh, содержащей избыток л-оксидифенила. Всю операцию проводят так, как описано в гл.
Пробирки с фильтратом помещают в воду со льдом и медленно, по каплям, добавляют по 1 мл концентрированной серной кислоты. Пробирки следует все время осторожно встряхивать и следить, чтобы их содержимое не нагревалось. Для ускорения процесса окисления молочной кислоты обе пробирки переносят в кипящую баню на 4 мин, а затем быстро охлаждают в ледяной воде. После охлаждения в каждую пробирку добавляют по 1 - 2 капли 0 1 % - ного раствора вератрола, осторожно встряхивают несколько минут. В опытной пробе развивается ярко-розовое окрашивание, так как произошел гликолиз под влиянием ферментов мышечной ткани. В контрольной пробе окраска слабо-розовая за счет молочной кислоты, которая присутствовала в мышечной кашице до начала опыта.
Группой Лурия было показано, что присоединение белковых молекул колицина К и Е1 к клеткам бактерии E-coli сопровождается прекращением синтеза макромолекул: белков, ДНК, РНК и гликогена. Прекращается также активный транспорт молочного сахара (лактозы), глютамина, различных аминокислот и ионов калия и магния. В то же время клетка продолжает аккумулировать глюкозу, активный транспорт которой обеспечивается непосредственно энергией окисления молочной кислоты.
Она является также одним из промежуточных продуктов при молочнокислом и спиртовом брожении углеводов. Может быть получена при взаимодействии ацетил-хлорида с цианидом калия с последующим гидролизом образующегося кетононитрила или путем окисления молочной кислоты.
С фильтратами проделывают реакцию а присутствие молочной ислоты. Для этого в 2 чистые пронумерованные пробирки отбирают: в первую - 10 капель фильтрата контрольной пробы, во вторую - 10 капель фильтрата опытной пробы. Нельзя забывать, что сильное перегревание может привести к обугливанию молочной кислоты. Для ускорения процесса окисления молочной кислоты обе пробирки переносят в кипящую водяную баню на 4 - 5 минут и затем быстро охлаждают в ледяной воде. В каждую пробирку к охлажденным жидкостям добавляют по 3 капли 0 2 % спиртового раствора вера-трола или гваякола.
