Hangi hastalık için ne tür bir ilaç betaferondur. Betaferon - kullanım talimatları. Uluslararası tescilli olmayan isim
Enjeksiyonluk çözelti için liyofilize toz - 1 şişe. interferon beta-1b - 0,3 mg (9,6 milyon IU'ya karşılık gelir) eksipiyanlar: insan albümini; mannitol 1 ml hazırlanan çözelti, 0.25 mg (8 milyon IU) rekombinant interferon beta-1b içerir Enjeksiyon için bir çözeltinin hazırlanması için 1 ml sulu bir çözücü, şırıngalarda bir çözücü ile tamamlanan flakonlarda 5.4 mg sodyum klorür içerir veya alkollü mendilli veya dipsiz şişeler; 5 veya 15 setlik bir kutuda.
Dozaj formunun açıklaması
Liyofilizat: liyofilize beyaz kütle. Çözücü: Berrak, partikül içermeyen çözelti. Sulandırılmış çözelti: hafif opalesan ila opalesan çözelti, renksiz veya açık sarı.
farmakokinetik
0.25 mg'lık önerilen dozda s/c uygulamasından sonra, kandaki interferon beta-1b konsantrasyonu düşüktür veya hiç saptanmaz. 0,5 mg Betaferon®'un sağlıklı gönüllülere s / c uygulamasından sonra, plazmadaki Cmax, enjeksiyondan 1-8 saat sonra yaklaşık 40 IU / ml'dir. Bu çalışmada, s / c uygulandığında Betaferon®'un mutlak biyoyararlanımı yaklaşık %50'dir. İntravenöz uygulamada, ilacın serumdan klerensi ve T 1/2'si sırasıyla ortalama 30 ml / dak / kg ve 5 saattir. Betaferon'un her geçen gün uygulanması, ilacın kan plazmasındaki seviyesinde bir artışa yol açmaz, farmakokinetik parametreleri de tedavi süresince değişmez. Sağlıklı gönüllülerde gün aşırı 0.25 mg dozda Betaferon® s/c uygulaması ile biyolojik yanıt belirteçlerinin (neopterin, beta2-mikroglobulin ve immünosupresif sitokin IL-10) seviyeleri başlangıç değerlerine göre önemli ölçüde arttı 6 -12 saat ilk ilaç dozlarının uygulanmasından sonra. Cmax'a 40-124 saat sonra ulaşıldı ve 7 günlük (168 saat) çalışma süresi boyunca yüksek kaldı.
farmakodinamik
Betaferon®'un (interferon beta-1b) aktif maddesi, antiviral ve immün düzenleyici aktiviteye sahiptir. Multipl sklerozda interferon beta-1b'nin etki mekanizmaları tam olarak belirlenmemiştir. Bununla birlikte, interferon beta-1b'nin biyolojik etkisine, insan hücrelerinin yüzeyinde bulunan spesifik reseptörlerle etkileşiminin aracılık ettiği bilinmektedir. İnterferon beta-1b'nin bu reseptörlere bağlanması, interferon beta-1b'nin biyolojik etkilerinin aracıları olarak kabul edilen bir dizi maddenin ekspresyonunu indükler. Bu maddelerin bazılarının içeriği, interferon beta-1b ile tedavi edilen hastaların serum ve kan hücresi fraksiyonlarında belirlendi. İnterferon beta-1b, gama-interferon için reseptörlerin bağlanma kapasitesini ve ekspresyonunu azaltır, bozulmalarını arttırır. Ek olarak interferon beta-1b, periferik kan mononükleer hücrelerinin baskılayıcı aktivitesini arttırır.
klinik farmakoloji
Hem relapsing-remitting hem de sekonder progresif multipl sklerozda Betaferon® ile tedavi, hastalığın klinik alevlenmelerinin sıklığını (%30) ve şiddetini, hastaneye yatış sayısını ve steroid tedavisi ihtiyacını azaltır ve ayrıca remisyon süresini uzatır. . Sekonder progresif multipl sklerozlu hastalarda Betaferon® ile tedavi, hastalığın daha da ilerlemesini ve sakatlık başlangıcını geciktirmeyi mümkün kılar. 12 aya kadar şiddetli (yani hastalar sürekli tekerlekli sandalye kullanmaya zorlandıklarında). Bu etki, hastalığın alevlenmesi olan ve olmayan hastalarda ve ayrıca herhangi bir özürlülük indeksi olan hastalarda gözlenmektedir (genişletilmiş özürlülük ölçeği EDSS'ye göre 3,0 ila 6,5 puan arası olan hastalar çalışmaya katılmıştır). Betaferon® ile tedavi sırasında nükseden ve sekonder ilerleyici multipl sklerozlu hastaların beyin MRG'sinin sonuçları, ilacın patolojik sürecin ciddiyeti üzerinde önemli bir olumlu etkisinin yanı sıra yeni aktif odakların oluşumunda önemli bir azalma olduğunu doğrulamaktadır. .
Kullanım endikasyonları Betaferon
hastalarda klinik olarak anlamlı multipl skleroza (CRMS) geçişi yavaşlatmak için intravenöz kortikosteroidler gerektirecek kadar inflamatuar bir süreçle birlikte klinik olarak izole sendrom (CIS) (alternatif tanıların dışlanması koşuluyla multipl sklerozu düşündüren tek klinik demiyelinizasyon epizodu) gelişme riski yüksektir. Yüksek riskin genel kabul görmüş bir tanımı yoktur. Çalışmaya göre, monofokal CIS (CNS'de 1 lezyonun klinik belirtileri) ve MRG'de >=9 T2 odakları ve/veya odakları biriken kontrast ajanı olan hastalarda CRMS gelişme riski yüksektir. Multifokal CIS'li hastalar (CNS'de >1 lezyonun klinik belirtileri), MRG'deki odak sayısından bağımsız olarak CRMS geliştirme riski yüksektir; Relapsing-remitting multipl skleroz (RRMS) - ayakta tedavi gören hastalarda (yani yardımsız yürüyebilen hastalarda) alevlenmelerin sıklığını ve şiddetini azaltmak için, son 2 yılda en az 2 alevlenme öyküsü olan ve ardından nörolojik tam veya eksik iyileşme eksiklik; alevlenmeler veya son iki yıl içinde nörolojik fonksiyonlarda belirgin bir bozulma ile karakterize, hastalığın aktif seyri ile ikincil ilerleyici multipl skleroz - hastalığın klinik alevlenmelerinin sıklığını ve şiddetini azaltmak ve aynı zamanda hızını yavaşlatmak için hastalığın ilerlemesi.
Betaferon kullanımına kontrendikasyonlar
tarihte doğal veya rekombinant interferon beta veya insan albüminine aşırı duyarlılık; gebelik; emzirme. DİKKATLİ Aşağıdaki hastalıklarda: kalp hastalığı, özellikle evre III-IV kalp yetmezliği (NYHA sınıflandırmasına göre), kardiyomiyopati; depresyon ve/veya intihar düşünceleri (geçmiş dahil), tarihte epileptik nöbetler; monoklonal gamopati; anemi, trombositopeni, lökopeni; karaciğer fonksiyon bozukluğu; 18 yaşına kadar (yeterli uygulama deneyimi olmaması nedeniyle).
Hamilelikte ve çocuklarda Betaferon Kullanımı
Hamilelikte kontrendikedir. Bununla birlikte, Betaferon®'un hamile kadınlarda tedavi edildiğinde fetal zarara neden olup olmayacağı veya insan üreme fonksiyonunu etkileyip etkilemeyeceği bilinmemektedir. Multipl sklerozlu hastalarda yapılan kontrollü klinik çalışmalarda, spontan düşük vakaları olmuştur. Rhesus maymunlarında yapılan çalışmalarda, insan interferon beta-1b embriyotoksik olmuştur ve daha yüksek dozlarda düşük oranlarında artışa neden olmuştur. Çocuk doğurma çağındaki kadınlar bu ilaçla tedavi sırasında yeterli doğum kontrol yöntemleri kullanmalıdır. Betaferon® ile tedavi sırasında hamilelik olması veya hamileliğin planlanması durumunda, tedavinin kesilmesi önerilmelidir. İnterferon beta-1b'nin anne sütüne geçip geçmediği bilinmemektedir. Emzirilen bebeklerde ciddi advers reaksiyon potansiyeli göz önüne alındığında, emzirme durdurulmalı veya ilaç kesilmelidir.
Betaferon yan etkileri
Aşağıdakiler, klinik denemeler sırasında günde 0.25 mg veya 0.16 mg/m2 Betaferon® alan hastalarda plasebo (inaktif ilaç) grubundan %2 veya daha yüksek bir sıklıkta gözlenen advers olaylardır. üç yıla kadar. Genel reaksiyonlar: enjeksiyon bölgesinde reaksiyon, asteni (zayıflık), grip benzeri semptomlar kompleksi, baş ağrısı, ateş, titreme, karın ağrısı, göğüs ağrısı, çeşitli lokalizasyonlarda ağrı, genel halsizlik, enjeksiyon bölgesinde nekroz. Kardiyovasküler sistem: periferik ödem, vazodilatasyon, periferik vasküler hastalık, hipertansiyon, çarpıntı, taşikardi. Sindirim sistemi: mide bulantısı, kabızlık, ishal, hazımsızlık. Kan ve lenf sistemi: lenfositopeni (\u003d %10, sık sık - \u003d %1, bazen - \u003d %0,1, nadiren - \u003d %0,01 ve çok nadiren -
ilaç etkileşimi
Betaferon®'un diğer ilaçlarla etkileşimine ilişkin özel çalışmalar yapılmamıştır. Betaferon®'un gün aşırı 0.25 mg (8 milyon IU) dozunda multipl sklerozlu hastalarda ilaç metabolizması üzerindeki etkisi bilinmemektedir. Betaferon® kullanımının arka planına karşı, alevlenmelerin tedavisinde 28 güne kadar reçete edilen kortikosteroidler ve ACTH iyi tolere edilir. Betaferon®'un kortikosteroidlere veya ACTH'ye ek olarak diğer immünomodülatörlerle eşzamanlı kullanımı araştırılmamıştır. İnterferonlar, insanlarda ve hayvanlarda hepatik sitokrom P450'ye bağımlı enzimlerin aktivitesini azaltır. Dar bir terapötik indekse sahip olan ve klirensi büyük ölçüde hepatik sitokrom P450 sistemine (örneğin, antiepileptikler, antidepresanlar) bağlı olan ilaçlarla kombinasyon halinde reçete yazarken dikkatli olunmalıdır. Hematopoetik sistemi etkileyen herhangi bir ilacın eşzamanlı kullanımı ile dikkatli olunmalıdır.
Betaferon Dozajı
P / c, bir günde. Betaferon® tedavisi, multipl skleroz tedavisinde deneyimli bir doktorun gözetiminde başlatılmalıdır. Şu anda Betaferon® tedavisinin süresi sorunu çözülmemiştir. Klinik çalışmalarda, relapsing-remitting ve sekonder progresif multipl sklerozlu hastalarda tedavi süresi sırasıyla 5 ve 3 yıla ulaşmıştır. Kursun süresi doktor tarafından belirlenir. Enjeksiyon Solüsyonunun Hazırlanması A. Flakonlar ve kullanıma hazır şırıngalar içeren ilaç paketi: Enjeksiyon için liyofilize interferon beta-lb tozunu çözmek için, seyreltici ve iğne ile birlikte verilen hazır şırıngayı kullanın. B. Şişeler, kullanıma hazır şırıngalar, iğne şişesi adaptörü ve alkollü mendiller içeren ilaç paketi: Enjeksiyon için liyofilize beta-lb interferon tozunu çözmek için önceden paketlenmiş seyreltici şırıngayı ve iğne şişesi adaptörünü kullanın. 1.2 ml çözücü (%0.54 sodyum klorür çözeltisi), Betaferon® içeren bir şişeye enjekte edilir. Toz, sallamadan tamamen çözülmelidir. Kullanımdan önce bitmiş solüsyon incelenmeli, partikül varlığında veya solüsyonun renginde değişiklik olması durumunda kullanılmamalıdır. 1 ml hazırlanan çözelti, önerilen Betaferon® dozunu içerir - 0.25 mg (8 milyon IU). Enjeksiyon belirtilen zamanda yapılmadıysa, ilacı mümkün olan en kısa sürede vermek gerekir. Bir sonraki enjeksiyon 48 saat sonra yapılır.
aşırı doz
Betaferon®'un haftada 3 kez 5,5 mg'a (176 milyon IU) varan dozda intravenöz olarak kanserli erişkin hastalarda uygulanmasıyla, ciddi bir advers olay saptanmadı.
Artık internet üzerinden "Betaferon"u çok uygun fiyata satın alabilir ve Moskova'ya veya bölgeye teslimatını sipariş edebilirsiniz. Burdenko Eczanesi'nin kayıtlı kullanıcıları için ilaçların fiyatı daha düşüktür, Betaferon için indirim %2-5 olacaktır. Rusya'da ilaç teslimatının maliyeti yöneticimiz tarafından belirlenecektir.
"Betaferon" ilacının açıklaması
"Betaferon" ilacının aktif maddesi interferon beta-1b'dir. Antiviral ve immün düzenleyici aktivite gösterir. İlaç, gama-interferon için reseptörlerin bağlanma kapasitesinde ve ekspresyonunda bir azalmaya neden olur, bozulmalarını arttırır. Periferik kandaki mononükleer hücrelerin baskılayıcı aktivitesinde bir artışı teşvik eder.
Multipl sklerozlu hastalarda "Betaferon" un terapötik etkisinin mekanizması kesin olarak belirlenmemiştir. Bununla birlikte, aktif bileşeninin biyolojik etkisinin, hücre yüzeyindeki spesifik reseptörlerle etkileşime girerek aracılık ettiği bilinmektedir. Bu, interferon beta-1b'nin biyolojik etkilerinin aracıları olarak kabul edilen bir dizi maddenin ekspresyonuna neden olur.
Uygulama şekli
İlaç, esas olarak her gün s / c reçete edilir.
"Betaferon", multipl skleroz tedavisinde deneyimli bir doktorun gözetiminde alınmalıdır, bu nedenle "Betaferon" ilacını satın almadan önce bir uzmana danışın.
Dozaj rejimi
Betaferon ile tedavi süresi, ilgili doktor tarafından belirlenir. Talimatlara göre önerilen tek doz 250 mcg veya 8 milyon IU'dur. Bir enjeksiyonun yanlışlıkla atlanması durumunda, ilaç mümkün olan en kısa sürede uygulanmalıdır. Bir dahaki sefere ilaç 48 saat sonra uygulanmalıdır.
"Betaferon" kullanım endikasyonları
- CIS (klinik olarak izole edilmiş sendrom);
- aktif multipl skleroz, ikincil ilerleyici;
- RMS (multipl sklerozu hafifleten).
Sekonder ilerleyici ve tekrarlayan multipl sklerozlu hastalarda "Betaferon", patolojinin klinik alevlenmelerinin sıklığını (% 30) ve şiddetini azaltır. Hastaneye yatış sayısını azaltır ve steroid ihtiyacını azaltır. İlacın kullanımı remisyon süresini uzatır.
Sekonder ilerleyici multipl sklerozdan muzdarip hastaların Betaferon tedavisi koşulu altında, hastalığın daha da ilerlemesini ve sakatlığın başlamasını geciktirmede başarı elde etmek mümkündür.
Kontrendikasyonlar
İnsan albümininin yanı sıra rekombinant veya doğal beta-interferon'a karşı aşırı duyarlılık.
Yan etkiler
- baş ağrısı, göğüs ağrısı, titreme, karın ağrısı, enjeksiyon bölgesinde nekroz;
- miyalji, miyastenia gravis, bacak krampları;
- arteriyel hipertansiyon;
- koordinasyon eksikliği, uykusuzluk;
- nefes darlığı, cilt lezyonları;
- zorunlu idrara çıkma dürtüsü, iktidarsızlık.
İlaç hamilelik veya emzirme döneminde alınmamalıdır.
Özel Talimatlar
İlaç insan albümini içerir, bu nedenle viral hastalıkların bulaşma riski vardır.
Betaferon ile tedaviye başlamadan önce ve tedavi sırasında, lökosit sayısı ve trombositler dahil olmak üzere ayrıntılı bir kan testinin yapılması ve karaciğer fonksiyonunun izlenmesi gereklidir. Tedavi sırasında, hepatik transaminazların seviyesinde geçici olan asemptomatik bir artış gözlenebilir.
Dikkatle, Betaferon evre 3-4 kalp yetmezliği olan hastalara reçete edilmelidir (klinik çalışmalar yapılmamıştır). Kardiyomiyopati tedavisinin arka planına karşı gelişme ile ilaç iptal edilir.
Enjeksiyon bölgesinde bazen yağ dokusuna ve kas fasyasına derinlemesine yayılabilen nekroz alanları oluşur ve bu da daha sonra yara izlerinin gelişmesine yol açar. Bazen bundan sonra nekrotik doku ve deri grefti alanlarını çıkarmaya ihtiyaç vardır. Çoklu nekroz durumunda, Betaferon ile tedavi kesilmelidir.
Başvuru detayları talimatlardadır.
Sergey Mikhailenko 02.02.2016
Annem için Burdenko Eczanesi'nde birkaç kez Betaferon sipariş ettim. Birkaç yıldır nükseden-düzelten multipl sklerozdan acı çekiyor. Her seferinde hizmetten memnun kaldım. Oldukça hızlı teslimat, personel sakin ve özenli. Kurye, nakit ve MasterCard ile ödeme yaptım. Sorun değil. 6.000 ruble veya daha fazla değerinde ilaç alırsanız teslimat ücretsizdir.
Kira Frolova 05.03.2016Merhaba! Nisan ayı başlarında Burdenko Eczanesi'nden Betaferon sipariş ettim. Yaroslavl'da yaşıyoruz ama eczanelerimizde bu ilaç yok. İnternet üzerinden sipariş vermek zorunda kaldım, her şeyin yoluna gireceğinden biraz korktum, yoksa ilaç pahalı. Tarifin taranması ve e-postayla gönderilmesi gerekiyordu. Unicom Kargo ile bana gönderdiler. Parsel 2 günde geldi. Teslimatta nakit ödeme.
Mihail Prokudin 04/14/2016Betaferon ilacını Araştırma Enstitüsündeki Eczaneden aldım. Burdenko ve %5 indirim aldı. Kaydolursanız tasarruf edebileceğinizi bile beklemiyordum. İlaç adrese teslim edildi, banka kartıyla ödeme yaptım. İnternetten sipariş vermeme rağmen tarifin gösterilmesi istendi. Şu anda Betaferon alıyorum. Bir daha sipariş verirsem hemen buradan iletişime geçeceğim.
Antiviral - interferonlar.
Kompozisyon Betaferon
İnterferon beta - 1b.
Üreticiler
Boehringer Ingelheim Pharma KG, paketlenmiş Schering AG (Almanya)
farmakolojik etki
İmmünomodülatör.
Doğal proteinler olan sitokin ailesine ait interferonlar.
İnterferon beta-1b, antiviral ve immün düzenleyici aktiviteye sahiptir.
İnterferon beta-1b, gama-interferon için reseptörlerin bağlanma kapasitesini ve ekspresyonunu azaltır, bozulmalarını arttırır.
Ek olarak interferon beta-1b, periferik kan mononükleer hücrelerinin baskılayıcı aktivitesini arttırır.
Betaferon'un yan etkileri
Depresif durumlar, anksiyete, duygusal kararsızlık, duyarsızlaşma, kasılmalar, intihar girişimleri ve kafa karışıklığı, bilinen artan kas tonusu vakaları, olası lökopeni (lenfo-, nötropeni), anemi, nadir durumlarda - trombositopeni, kardiyomiyopati; bazı durumlarda - hipokalsemi, nadiren - nefes darlığı (enjeksiyondan sonra), bulantı, kusma, önerilen dozda kullanıldığında - AST, ALT, gammaglutamil transpeptidaz aktivitesinde artış; Hepatit vakaları (muhtemelen ilaç etiyolojisi) tanımlanmıştır, sıklıkla 0.25 mg (8.000.000 IU) dozunda tedavi ile lokal reaksiyonlar gelişebilir - kızarıklık, şişme, ciltte renk değişikliği, iltihaplanma, ağrı, aşırı duyarlılık, nekroz, lenfadenopati (tedavinin devam etmesiyle zamanla enjeksiyon bölgesindeki reaksiyonların sıklığı azalır).
Enjeksiyon bölgesinden sıvının şişmesi veya ekstravazasyonu ile birlikte cildin bütünlüğünün ihlali durumunda, hasta bir doktora danışmalıdır.
Nadir durumlarda alopesi gözlenmiştir, menopoza girmemiş kadınlarda adet düzensizlikleri mümkündür; bazı durumlarda - hiperürisemi, şiddetli aşırı duyarlılık reaksiyonları mümkündür (nadiren - bronkospazm, anafilaktik şok, ürtiker), nispeten sık - grip benzeri semptomlar (ateş, titreme, kas ağrısı, halsizlik veya terleme), zamanla semptomların sıklığı azalır; nadir durumlarda - tiroid bezinin işlev bozukluğu (hiper / hipotiroidizm).
Kullanım endikasyonları
Son 2 yılda hastalığın en az iki alevlenmesinin varlığında tekrarlayan seyirli multipl skleroz ve ardından nörolojik semptomların tam veya eksik iyileşmesi (olmadan hareket edebilen ayaktan hastalarda hastalığın alevlenmelerinin sıklığını ve şiddetini azaltmak için) yardım); sekonder ilerleyici multipl skleroz seyri (alevlenmelerin sıklığını ve şiddetini azaltmak, hastalığın ilerlemesini yavaşlatmak için).
Kontrendikasyonlar Betaferon
Doğal veya rekombinant interferon beta veya insan albüminine karşı aşırı duyarlılık öyküsü, şiddetli depresyon ve/veya intihar düşünceleri öyküsü, dekompanse karaciğer hastalığı, epilepsi (yeterince kontrol edilmemiş), hamilelik, emzirme.
aşırı doz
İnterferon beta-1b'nin 5.5 mg'a (176 milyon IU) varan dozlarda haftada 3 kez intravenöz olarak malign tümörlü erişkin hastalarda uygulanmasıyla, hayatı tehdit eden ciddi advers olaylar gözlenmedi.
Etkileşim
Kortikosteroidler veya adenokortikotropik hormon ile birlikte kullanılabilir.
İnterferonlar, hepatik sitokrom P-450'ye bağımlı enzimlerin aktivitesini azaltır.
Dar bir terapötik indeksi olan ve klirensi büyük ölçüde hepatik sitokrom P-450 sistemine bağlı olan ilaçlarla (örneğin antiepileptik ilaçlar) birlikte uygulandığında dikkatli olunmalıdır.
Hematopoetik sistemi etkileyen herhangi bir ilacın eşzamanlı kullanımı ile dikkatli olunmalıdır.
Özel Talimatlar
Hastalar Betaferon'un yan etkileri hakkında bilgilendirilmelidir.
Depresyon ve intihar düşünceleri ortaya çıkarsa, tedavi derhal durdurulmalıdır.
Betaferon'un atanmasından önce ve tedavi sırasında, lökosit sayısının yanı sıra ACT, ALT ve gammaglutamil transpeptidaz aktivitesinin belirlenmesi de dahil olmak üzere düzenli olarak ayrıntılı bir kan testi yapılmalıdır.
Kan plazmasındaki hepatik transaminazların aktivitesinde bir artış olması durumunda, hastanın dikkatli bir şekilde gözlemlenmesi ve muayenesi yapılmalıdır.
İlaç, enzim aktivitesinde önemli bir artış veya hepatit semptomlarının ortaya çıkması ile kesilmelidir.
Enjeksiyon bölgesinde nekroz gelişme riskini azaltmak için enjeksiyon yaparken asepsi kurallarına uymalı ve enjeksiyon bölgelerini sürekli değiştirmelisiniz.
Daha fazla bilgi için ilacın tıbbi kullanım talimatlarına bakın.
Dozaj formu
Solvent ile birlikte 0.3 mg (9.6 milyon IU) subkutan uygulama için bir çözeltinin hazırlanması için liyofilizat
Birleştirmek
aktif madde - interferon beta-1b - 0,3 mg (9,6 milyon IU)
%20'lik bir hesaplanmış taşma ile,
yardımcı maddeler: insan albümini, mannitol
çözücü
1.2 ml çözelti şunları içerir:
aktif madde - sodyum klorür 6.48 mg,
yardımcı maddeler - enjeksiyon için su.
Tanım
Liyofilizat: beyaz renkli liyofilizat
Çözücü: partikül içermeyen berrak çözelti.
Sulandırılmış çözelti: hafif opalesan ila opalesan çözelti, renksiz ila açık sarı
farmakoterapötik grup
İmmünomodülatörler. İmmün uyarıcılar. İnterferonlar.
interferon beta-1b
ATX kodu L03AB08
farmakolojik özellikler
farmakokinetik
Betaferon®'un önerilen 0.25 mg dozunda subkutan uygulamasından sonra, interferon beta-1b'nin serum konsantrasyonları düşüktür veya hiç saptanmaz. Bu bağlamda, önerilen dozda Betaferon alan multipl sklerozlu hastalarda ilacın farmakokinetiği hakkında bilgi yoktur.
0.5 mg Betaferon®'un deri altı uygulamasından sonra, maksimum plazma konsantrasyonuna enjeksiyondan 1-8 saat sonra ulaşılır ve yaklaşık 40 IU / ml'dir. Betaferon®'un deri altından uygulandığında mutlak biyoyararlanımı yaklaşık %50'dir. İnterferon beta-1b'nin intravenöz kullanımı ile, ilacın klirensi ve yarı ömrü serumdan sırasıyla ortalama 30 ml / dak / kg ve 5 saattir.
Betaferon'un her gün uygulanması, kan plazmasındaki ilacın seviyesinde bir artışa yol açmaz ve tedavi süresince farmakokinetiği değişmez.
Betaferon®'un gün aşırı 0.25 mg'lık bir dozda subkutan uygulanmasıyla, biyolojik yanıt belirteçlerinin (neopterin, beta2-mikroglobulin ve immünosupresif sitokin IL-10) seviyeleri, 6-12 saat sonra başlangıç değerlerine göre önemli ölçüde artar. ilacın ilk dozu. 40-124 saatte zirveye ulaşırlar ve 7 günlük (168 saat) bir süre boyunca yüksek kalırlar.
farmakodinamik
İnterferonlar, doğal proteinler olan sitokinleri ifade eder.
İnterferon beta-1b, antiviral ve immün düzenleyici aktivitelere sahiptir. Multipl sklerozda interferon beta-1b'nin etki mekanizmaları tam olarak belirlenmemiştir. Bununla birlikte, interferon beta-1b'nin biyolojik etkisine, insan hücrelerinin yüzeyinde bulunan spesifik reseptörlerle etkileşiminin aracılık ettiği bilinmektedir. İnterferon beta-1b'nin bu reseptörlere bağlanması, interferon beta-1b'nin biyolojik etkilerinin aracıları olarak kabul edilen bir dizi maddenin ekspresyonunu indükler. İnterferon beta-1b, gama-interferon için reseptörlerin bağlanma kapasitesini ve ekspresyonunu azaltır, bozulmalarını arttırır. Ek olarak interferon beta-1b, periferik kan mononükleer hücrelerinin baskılayıcı aktivitesini arttırır.
Hem relapsing-remitting hem de sekonder progresif multipl sklerozda Betaferon® ile tedavi, hastalığın klinik alevlenmelerinin sıklığını (%30) ve şiddetini, hastaneye yatış sayısını ve steroid tedavisi ihtiyacını azaltır ve ayrıca remisyon süresini uzatır. .
Sekonder progresif multipl sklerozlu (MS) hastalarda, Betaferon® ile tedavi, hastalığın daha fazla ilerlemesini ve ciddi sakatlık (yani hastalar sürekli tekerlekli sandalye kullanmaya zorlandıklarında) dahil sakatlıkların başlamasını 12 aya kadar geciktirebilir. Bu etki, hastalığın alevlenmesi olan ve olmayan hastalarda ve ayrıca herhangi bir sakatlık indeksi olan hastalarda (genişletilmiş sakatlık ölçeği EDSS'de 3,0 ila 6,5 puana sahip hastalar) gözlenir.
Betaferon® ile tedavi sırasında nükseden ve sekonder ilerleyici multipl sklerozlu hastaların beyninin manyetik rezonans görüntülemesinin sonuçları, ilacın patolojik sürecin ciddiyeti üzerinde önemli bir olumlu etkisinin yanı sıra yeni oluşumunda önemli bir azalma olduğunu doğrulamaktadır. aktif odaklar
Multipl sklerozun (klinik olarak izole edilmiş sendrom) ilk klinik belirtilerinden sonra hastalarda Betaferon® ile tedavi, önemli multipl skleroz gelişme riskini %50 azaltabilir ve önemli multipl skleroz gelişimine kadar geçen süreyi ortalama 363 gün artırabilir.
Kullanım endikasyonları
Alternatif tanıların dışlanması ve kesin multipl skleroz gelişme riskinin yüksek olması şartıyla, aktif bir inflamatuar süreci olan, intravenöz kortikosteroid tedavisini haklı çıkaracak kadar şiddetli, demiyelinizasyonun ilk belirtileri olan hastalar (bkz. bölüm Farmakodinamik özellikler)
Son 2 yılda en az 2 alevlenme ile tekrarlayan-düzelen multipl sklerozlu (RRMS) hastalar
Alevlenmelerle karakterize, hastalığın aktif seyri olan sekonder progresif multipl sklerozlu hastalar.
Dozaj ve uygulama
Betaferon® ile tedavi, multipl skleroz tedavisinde deneyimli bir doktor gözetiminde yapılmalıdır.
İlacın tanıtılması
Uygulama yöntemi: deri altı enjeksiyonlar için
Enjeksiyon çözeltisinin hazırlanması
Liyofilizatı çözmek için, verilen hazır şırıngayı bir çözücü ve iğneli bir flakon için bir adaptör ile kullanın. 1.2 ml çözücü (%0.54 sodyum klorür çözeltisi), Betaferon® içeren bir şişeye enjekte edilir. Liyofilizat sallamadan tamamen çözülmelidir.
Çözündükten sonra, 0.25 mg Betaferon® enjekte etmek için flakondan 1 ml solüsyonu şırıngaya çekin.
Enjeksiyondan önce şırıngayı flakondan ve adaptörden ayırın. Betaferon® uygun bir otomatik enjektör kullanılarak uygulanabilir.
Hasarlı şişeleri kullanmayın.
Kullanmadan önce bitmiş çözümü inceleyin. Partiküllerin varlığında veya solüsyonun renginde değişiklik olması durumunda kullanılmamalı ve imha edilmelidir.
İlaç, çözeltinin hazırlanmasından hemen sonra deri altından uygulanmalıdır. Enjeksiyon gecikirse solüsyon buzdolabında saklanmalı ve 3 saat içinde kullanılmalıdır, solüsyon dondurulmamalıdır.
Hastalar gün aşırı 62.5 mikrogram (0.25 ml)'lik bir başlangıç dozu ile başlamalı ve dozu iki günde bir 250 mikrograma (1.0 ml) yavaş yavaş artırmalıdır (titrasyon paketinin kullanımına ilişkin ayrıntılar ekte yer almaktadır).
Titrasyon süresinin süresi, toleransa bağlı olarak ayrı ayrı ayarlanır.
Doz titrasyon şeması*
*Titrasyon şeması, önemli advers reaksiyonlar meydana gelirse ayarlanabilir
İlacın optimal dozu tam olarak belirlenmemiştir.
Şu anda Betaferon® tedavisinin süresi sorunu çözülmemiştir.
Kontrollü koşullar altında, relapsing-remitting multipl sklerozlu hastalarda, Betaferon® ile tedavi süresi 5 yıla kadardı ve sekonder progresif multipl sklerozlu hastalarda kurs 3 yıla kadardı.
Relapsing-remitting multipl sklerozlu hastalarda, ilaç tedavisinin ilk 2 yılında etkinlik gösterilmiştir. Sonraki 3 yıllık tedaviye ilişkin mevcut veriler, tüm uzun süreli tedavi süresi boyunca Betaferon® ile tedavinin etkinliğine ilişkin verilere karşılık gelir.
Multipl skleroz şüphesi olan ilk klinik belirtileri olan hastalarda, Betaferon® ile 5 yıllık tedavi sırasında belirgin multipl skleroz gelişimi önemli ölçüde yavaşlamıştır.
Son 2 yılda 2'den az alevlenme öyküsü olan nükseden-düzelten multipl sklerozlu hastalarda veya son 2 yılda hastalık alevlenmesi yaşamamış sekonder progresif multipl sklerozlu hastalarda Betaferon® ile tedavi önerilmez. yıllar.
Hasta tedaviye yanıt vermezse, örneğin 6 ay boyunca EDSS ölçeğinde semptomların istikrarlı bir şekilde ilerlemesi durumunda veya en az 3 kür adrenokortikotropik hormon (ACTH) veya kortikosteroidin olduğu durumlarda Betaferon® ile tedavi kesilmelidir. bir yıl içinde tedavi gerekti.
Yan etkiler
Tedavinin başlangıcında, yan etkiler yaygındır, ancak kural olarak, tedavi sırasında zaman içinde sıklıkları azalır. En sık gözlenen advers reaksiyonlar, esas olarak ilacın farmakolojik etkilerine ve ayrıca enjeksiyondaki reaksiyonlara bağlı olarak ortaya çıkan grip benzeri semptomlar (ateş, titreme, artralji, halsizlik, terleme, baş ağrısı ve kas ağrısı) kompleksidir. alan. Betaferon® uygulamasından sonra enjeksiyon bölgesinde reaksiyonlar sıklıkla görülür. Kızarma, lokal ödem, ciltte renk değişikliği, iltihaplanma, ağrı, aşırı duyarlılık, nekroz ve spesifik olmayan reaksiyonlar, büyük ölçüde Betaferon® 250 mcg (8 milyon IU) ile tedavi ile ilişkilidir. Betaferon®'un tolere edilebilirliğini artırmak için genellikle tedavinin başlangıcında doz titrasyonu önerilir. Grip benzeri semptomların ortaya çıkması, steroid olmayan antienflamatuar ilaçların uygulanmasıyla da azaltılabilir. Bir otomatik enjektörün kullanılması, enjeksiyon bölgesindeki reaksiyonların sıklığını azaltır.
Aşağıda listelenen advers reaksiyonlar, klinik çalışmalardan ve pazarlama sonrası gözlemlerden elde edilen verilere dayanmaktadır. Betaferon® kullanımı sırasında gözlemlenen advers reaksiyonların sıklığı, aşağıdaki derecelendirmeye göre aşağıda verilmiştir: çok sık (³1/10) ve sık (³1/100 ila<1/10), нечастые (³1/1000 до <1/100, редкие (³1/10000 до <1/1000) и очень редкие (1/10000).
En uygun MedDRA terimi, belirli reaksiyonları ve bunların eşanlamlılarını ve ilişkili koşullarını tanımlamak için kullanılır.
Bilinmeyen frekansla:
İlaca bağlı lupus benzeri sendrom (eritematoz)
Şüpheli advers reaksiyon bildirimi
İlaç piyasaya arz edildikten sonra şüpheli bir advers reaksiyonu bildirmek çok önemlidir. Bu, tıbbi ürünün yarar/risk dengesinin uzun süreli izlenmesine olanak tanır. Sağlık uzmanları, herhangi bir şüpheli advers reaksiyon hakkında bilgilendirilmelidir.
Kontrendikasyonlar
Hamilelik sırasında tedaviye başlamak
Doğal veya rekombinantlara karşı aşırı duyarlılık reaksiyonları
interferon-beta veya ilacın diğer yardımcı maddeleri
Tarih
Mevcut şiddetli depresyon ve/veya intihar düşüncelerinin varlığı
Dekompansasyon aşamasında karaciğer hastalıkları
İlaç etkileşimleri
Betaferon®'un diğer ilaçlarla etkileşimine ilişkin özel çalışmalar yapılmamıştır.
İki günde bir 250 mcg (8 milyon ünite) Betaferon®'un multipl sklerozlu hastalarda diğer ilaçların metabolizması üzerindeki etkisi bilinmemektedir.
Betaferon® kullanımının arka planına karşı, alevlenmelerin tedavisinde 28 güne kadar reçete edilen kortikosteroidler ve ACTH iyi tolere edilir.
Multipl sklerozlu hastalarda yetersiz klinik deneyim nedeniyle, Betaferon®'un kortikosteroidlere veya ACTH'ye ek olarak diğer immünomodülatörlerle birlikte kullanılması önerilmez.
İnterferonlar, insanlarda ve hayvanlarda hepatik sitokrom P450'ye bağımlı enzimlerin aktivitesini azaltır. Bu nedenle, klirensi büyük ölçüde hepatik sitokrom P450 sistemine bağlı olan dar bir terapötik indekse sahip ilaçlarla (örneğin, antiepileptik ilaçlar) Betaferon® reçete edilirken dikkatli olunmalıdır. Hematopoetik sistemi etkileyen herhangi bir ilacın eşzamanlı kullanımı ile de dikkatli olunmalıdır.
Antiepileptik ilaçlarla özel etkileşim çalışmaları yapılmamıştır.
Özel Talimatlar
Bağışıklık bozuklukları
Monoklonal gamopatili hastalarda (kanda anormal proteinlerin ortaya çıkmasıyla karakterize bağışıklık sisteminin nadir bir hastalığı) sitokinlerin kullanımına bazen şok benzeri semptomlar ve ölümle birlikte kılcal geçirgenlikte sistemik bir artış eşlik etti.
· Gastrointestinal rahatsızlıklar
Betaferon® kullanımı sırasında, nadiren hipertrigliserideminin eşlik ettiği pankreatit vakaları gözlenmiştir.
Sinir sistemi bozuklukları
Betaferon®, depresif bozukluk öyküsü olan veya özellikle intihar düşünceleri olan hastalarda dikkatle uygulanmalıdır. Bilindiği gibi, interferon tedavisi sırasında da dahil olmak üzere multipl sklerozlu hasta popülasyonunda depresyon ve intihar düşünceleri daha yaygındır. Betaferon® tedavisi için endike olan hastalar, ilaçla tedavi sırasında depresif bozukluklar ve intihar düşüncelerinin ortaya çıkabileceği konusunda bilgilendirilmeli ve derhal ilgili doktora bildirilmelidir. Nadir durumlarda, bu semptomlar intihar girişimlerine yol açabilir. Depresyon belirtileri ve intihar düşünceleri olan hastalar yakın tıbbi gözetim altında olmalıdır. Gerekirse, bu tür hastalarda tedavinin kesilmesi düşünülmelidir.
Betaferon, nöbet öyküsü olan hastalarda ve antiepileptik tedavi alan hastalarda, özellikle epileptik nöbetler antiepileptik ilaçlarla yeterince kontrol edilmediğinde dikkatli kullanılmalıdır.
Müstahzar insan albümini içerir ve bu nedenle viral hastalıkların bulaşma riski vardır. Creutzfeldt-Jakob hastalığının bulaşma riski göz ardı edilemez.
Laboratuvar parametrelerindeki değişiklikler
Tiroid disfonksiyonu olan hastalara tiroid fonksiyonlarını düzenli olarak ve klinik olarak belirtildiği şekilde kontrol ettirmeleri tavsiye edilir.
Multipl sklerozlu hastaların yönetiminde, tedaviye başlamadan önce ve Betaferon® ile tedavi sırasında düzenli olarak ve daha sonra klinik semptomların yokluğunda periyodik olarak öngörülen standart laboratuvar testlerine ek olarak, aşağıdakileri de içeren ayrıntılı bir kan testi yapılması önerilir. lökosit sayısı, trombosit sayısı ve kan kimyası ve ayrıca karaciğer fonksiyonunu (örneğin, aspartat aminotransferaz (AST), alanin aminotransferaz (ALT) ve gammaglutamiltransferaz (GT) aktivitesini) kontrol eder.
Anemi, trombositopeni, lökopeni (tek veya kombine) olan hastaları yönetirken, diferansiyel analiz ve trombosit sayımı dahil olmak üzere ayrıntılı bir kan sayımının daha dikkatli izlenmesi gerekebilir.
Karaciğer ve safra yolları bozuklukları
Betaferon® tedavisi sırasında serum transaminazlarında çoğu durumda hafif ve geçici asemptomatik yükselmeler meydana gelebilir.
Diğer beta-interferonlarda olduğu gibi, Betaferon ile ciddi karaciğer hasarı (karaciğer yetmezliği dahil) nadirdir. En şiddetli karaciğer yetmezliği, hepatotoksisite ile ilişkili ilaç veya maddeler kullanan hastalarda veya komorbid durumların (örneğin, metastatik malignite, şiddetli enfeksiyonlar ve sepsis, alkol kötüye kullanımı) varlığında daha sık görülür.
Hastaları gözlemlerken, karaciğer fonksiyon bozukluğunu gösteren belirtilere dikkat edilmelidir. Serum transaminazlarının artan aktivitesi ile hastanın izlenmesi ve muayene edilmesi önerilir. Karaciğer enzimlerinin aktivitesinde önemli bir artış olduğunda veya bu artış sarılık gibi klinik semptomlarla birleştiğinde Betaferon®'un kesilmesi gerektiği düşünülmelidir. Bozulmuş karaciğer fonksiyonunun klinik belirtilerinin ortadan kalkmasıyla ve karaciğer enzimlerinin seviyesinin normale dönmesinden sonra, karaciğer fonksiyonunun uygun şekilde izlenmesi ile tedaviye devam etme olasılığı düşünülmelidir.
・Böbrek ve idrar rahatsızlıkları
Ciddi böbrek yetmezliği olan hastalarda ilaç reçete edilirken dikkatli olunmalı ve yakından takip edilmelidir.
nefrotik sendrom
Beta-interferon ile tedavi sırasında, fokal segmental glomerüloskleroz, lipoid nefroz, membranoproliferatif glomerülonefrit ve membranöz glomerülopati dahil majör nefropatiler şeklinde nefrotik sendrom vakaları bildirilmiştir.Bu hastalıklar tedavi sırasında farklı zamanlarda kaydedilmiştir ve birkaç yıl sonra ortaya çıkabilir. beta interferon kullanımı.
Özellikle böbrek hastalığı açısından yüksek risk altındaki hastalarda ödem, proteinüri veya böbrek fonksiyon bozukluğu gibi erken belirti veya semptomların düzenli olarak izlenmesi önerilir. Nefrotik sendrom derhal tedavi edilmeli ve Betaferon® ile tedavinin kesilmesi düşünülmelidir.
Kardiyovasküler sistem hastalıkları
Betaferon®, konjestif kalp yetmezliği, koroner arter hastalığı veya aritmiler gibi ciddi kalp hastalığı olan hastalarda dikkatle uygulanmalıdır. Betaferon®'un doğrudan kardiyotoksik etkisine dair bir kanıt olmamasına rağmen, bu hastalar kötüleşen kalp rahatsızlıkları açısından izlenmelidir. Betaferon®'un bilinen bir doğrudan kardiyotoksik etkisi yoktur, ancak genellikle beta-interferon kullanımıyla ilişkili grip benzeri semptomlar ateş, titreme, taşikardi nedeniyle kalpte strese neden olur. Bu, ciddi kalp hastalığı olan hastalarda semptomları şiddetlendirebilir. Ciddi kalp hastalığı olan hastalardaki pazarlama sonrası deneyimlere göre, Betaferon® tedavisinin başlamasıyla zamansal bir ilişki içinde, nadir vakalarda kalp fonksiyonunda bir bozulma bildirilmiştir.
Nadir durumlarda, kardiyomiyopati gelişimi bildirilmiştir. Kardiyomiyopatinin gelişmesi ve Betaferon® kullanımı ile olası bağlantısı nedeniyle ilaçla tedavi kesilmelidir.
Trombotik mikroanjiyopati (TMA)
İnterferon beta preparatları ile tedavi sırasında, ölümcül vakalar da dahil olmak üzere, trombotik trombositopenik purpura veya hemolitik üremik sendrom olarak kendini gösteren trombotik mikroanjiyopati vakaları bildirilmiştir.
Bu komplikasyonlar tedavi sırasında çeşitli zamanlarda meydana geldi ve interferon-beta tedavisinin başlamasından haftalar ila yıllar sonra ortaya çıkabilir.
Hastalığın erken klinik semptomları arasında trombositopeni, ani hipertansiyon başlangıcı, ateş, merkezi sinir sistemi bozukluklarının belirtileri (örn. konfüzyon, parezi) ve bozulmuş böbrek fonksiyonu bulunur.
TMA olasılığını düşündüren laboratuvar test sonuçları arasında trombosit sayısında azalma, hemolize bağlı serum laktat dehidrojenazda (LDH) artış ve kan yaymasında şistositler (kırmızı kan hücresi parçaları) bulunur.
Buna göre, TMA'nın klinik semptomları tespit edildiğinde, serumdaki trombosit ve LDH seviyesi, kan yayması ve böbrek fonksiyonunun göstergeleri hakkında bir çalışma yapılması önerilir. TMA doğrulanırsa, hemen tedavi (plazmaferez dahil) yapılmalı ve Betaferon® ile tedavinin hemen durdurulma olasılığı göz önünde bulundurulmalıdır.
Enjeksiyon bölgesinin genel bozuklukları ve durumu
Şiddetli aşırı duyarlılık reaksiyonları (bronkospazm, anafilaksi ve ürtiker gibi şiddetli akut reaksiyonlar) meydana gelebilir.
Betaferon® ile tedavi edilen hastalarda enjeksiyon bölgesinde nekroz vakaları olmuştur. Nekroz geniş olabilir ve kas fasyasının yanı sıra yağ tabakasına da uzanabilir ve bunun sonucunda yara izi oluşumuna yol açabilir. Bazı durumlarda, ölü derinin çıkarılması veya daha az yaygın olarak deri grefti gereklidir. İyileşme süreci 6 aya kadar uzayabilir.
Hastanın, enjeksiyon bölgesinden sıvı sızıntısı veya şişmesi ile ilişkili olabilecek cilt bütünlüğünde herhangi bir hasar varsa, Betaferon® enjeksiyonlarına devam etmeden önce ilgili hekime başvurmak gerekir.
Birden fazla nekroz odağı göründüğünde, hasarlı alanlar tamamen iyileşene kadar Betaferon® tedavisi kesilmelidir. Bir odak varlığında, nekroz çok yaygın değilse, bazı hastalarda Betaferon® kullanımı sırasında enjeksiyon bölgesindeki ölü bölgenin iyileşmesi meydana geldiğinden, Betaferon® kullanımına devam edilebilir.
Enjeksiyon bölgesinde reaksiyon ve nekroz gelişme riskini azaltmak için hastalara şunlar önerilmelidir:
Enjeksiyonları steril koşullar altında gerçekleştirin;
Her seferinde enjeksiyon bölgesini değiştirin;
İlacı kesinlikle deri altından enjekte edin.
Periyodik olarak, özellikle enjeksiyon bölgesinde reaksiyonlar meydana gelirse, bağımsız enjeksiyonların doğruluğu izlenmelidir.
Enjeksiyon bölgesindeki reaksiyonların sıklığı (örneğin, kızarma, lokal ödem, ciltte renk değişikliği, iltihaplanma, ağrı, aşırı duyarlılık, nekroz ve spesifik olmayan reaksiyonlar) genellikle tedaviye devam edildiğinde zamanla azalır. Bir otomatik enjektörün kullanılması, enjeksiyon bölgesindeki reaksiyonların sıklığını azaltır.
İmmünojenisite/nötralize edici antikorlar
Protein yapısındaki diğer ilaçlarda olduğu gibi, immünojenisite geliştirme olasılığı vardır. Kontrollü klinik çalışmalarda, Betaferon®'a karşı antikor gelişimini izlemek için her 3 ayda bir serum numuneleri alınmıştır.
Relapsing-remitting multiple skleroz ve sekonder progresif multipl skleroz ile ilgili çeşitli kontrollü klinik çalışmalarda, hastaların %23-41'i interferon beta-1b'ye nötralize edici aktivite geliştirdi ve bu en az iki ardışık pozitif titre ile doğrulandı.
Bu hastaların %43 ila %55'i, ilgili çalışmanın takip süresi boyunca stabil negatif duruma (arka arkaya iki negatif titreye dayalı olarak) ilerlemiştir.
Bu çalışmalarda nötralize edici aktivitenin gelişimi, yalnızca alevlenmelerle ilgili olarak klinik etkinlikte bir azalma ile ilişkilidir.
Bu etkinin, daha yüksek titre seviyeleri nötralize edici aktiviteye sahip hastalarda daha belirgin olabileceğine inanılmaktadır.
Multipl skleroz şüphesi olan ilk semptomatik hastalarda yapılan bir çalışmada, başlangıçta Betaferon® ile tedavi edilen hastaların en az %32'sinde (89) 6 ayda bir ölçülen nötralize edici aktivite gözlenmiştir. Bunların %60'ı (53) 5 yıllık bir süre içinde yapılan son değerlendirmede olumsuz duruma dönüş yaşadı. Bu süre içinde, nötralize edici aktivitenin gelişimi, manyetik rezonans görüntüleme sırasında yeni aktif lezyonlarda ve T2 lezyonlarının hacminde önemli bir artış ile ilişkilendirildi. Ancak bu, klinik etkinlikte bir azalma (kesin MS'e kadar geçen süre açısından), doğrulanmış EDSS semptom progresyonuna kadar geçen süre ve nüks oranı ile ilişkili değildi.
Nötralize edici aktivitenin gelişimi ile herhangi bir advers reaksiyon ilişkilendirilmemiştir.
In vitro çalışmalar, Betaferon®'un doğal kaynaklı interferon-beta ile çapraz reaksiyona girdiğini göstermiştir. Hiçbir in vivo çalışma yapılmadığından klinik önemi net değildir.
Nötralize edici aktivite geliştiren ve Betaferon® ile tedaviyi tamamlayan hastalarda nadir ve kesin olmayan veriler vardır.
Betaferon® ile tedaviye devam etme kararı, ayrı olarak nötralize edici aktivite durumuna değil, hastanın hastalık durumunun tüm yönlerine dayanmaktadır.
Pediatride uygulama
Çocuklarda ve ergenlerde hiçbir resmi klinik çalışma veya farmakokinetik çalışma yapılmamıştır. Bununla birlikte, sınırlı yayınlanmış veriler, gün aşırı Betaferon® 8.0 milyon IU subkutan kullanıldığında 12 ila 16 yaş arası ergenlerdeki güvenlik profilinin yetişkinlerdeki güvenlik profiline benzer olduğunu göstermektedir. Betaferon'un 12 yaşın altındaki çocuklarda kullanımına ilişkin bilgi bulunmamaktadır. Betaferon bu yaş grubunda kullanılmamalıdır.
Gebelik ve emzirme
Betaferon®'un hamilelik sırasında kullanımına ilişkin veriler sınırlıdır. Multipl sklerozlu kadınlarda spontan düşük raporları olmuştur. Hamilelik sırasında tedavinin başlatılması kontrendikedir ("Kontrendikasyonlar" bölümüne bakınız).
Üreme çağındaki kadınlar, ilaçla tedavi sırasında güvenilir doğum kontrol yöntemleri kullanmalıdır. Betaferon® ile tedavi sırasında veya hamileliğin planlanması sırasında hamilelik durumunda, kadın potansiyel risk konusunda bilgilendirilmeli ve ilacın kullanımına son verilmesi tavsiye edilmektedir. Tedaviden önce yüksek alevlenme insidansı olan hastalarda, hamileliğin başlangıcında Betaferon® tedavisinin kesilmesinden sonra şiddetli alevlenme riski, olası artan spontan düşük riskine karşı tartılmalıdır.
İnterferon beta-1b'nin anne sütüne geçip geçmediği bilinmemektedir.
Emzirilen bebeklerde Betaferon®'a karşı olumsuz reaksiyonlar geliştirme teorik olasılığı göz önüne alındığında, emzirmeyi durdurmak veya ilacı kesmek gerekir.
İlacın araç kullanma yeteneği ve potansiyel olarak tehlikeli mekanizmalar üzerindeki etkisinin özellikleri
İlacın araç kullanma ve mekanizma kullanma yeteneği üzerindeki etkisine ilişkin özel çalışmalar yapılmamıştır. Betaferon® kullanımının arka planına karşı sinir sisteminden olumsuz reaksiyonların gelişmesi, duyarlı hastalarda araç kullanma ve mekanizma kullanma yeteneğini etkileyebilir.
aşırı doz
Tanımlanamadı. İnterferon beta-1b erişkin kanser hastalarına 5500 mcg (176 milyon IU) düzeyinde yüksek dozlarda haftada üç kez intravenöz olarak hayati fonksiyonları etkileyen ciddi yan etkiler gelişmeden uygulanmıştır.
Çocukların erişemeyeceği yerlerde saklayın!
Raf ömrü
Liyofilizat - 2 yıl
Çözücü - 3 yıl
İlacın son kullanma tarihinden sonra kullanmayınız.
Eczanelerden dağıtım şartları
Reçetede
Üretici firma
Boehringer Ingelheim Pharma GmbH & Co. KG, Almanya
88397 Biberach an der Riss, Almanya
Catad_pgroup Multipl skleroz ilaçları
Betaferon - kullanım talimatları
KAYIT NUMARASI:
İLACIN TİCARET ADI:
Betaferon
ULUSLARARASI MÜLKİYETSİZ İSİM:
interferon beta-1b
FARMASÖTİK FORM:
Deri altı uygulama için çözeltinin hazırlanması için liyofilizat
BİRLEŞTİRMEK
Aktif madde içeren her şişe şunları içerir: İnterferon beta-1b (IFN-beta-1b) - 0.30 mg (9.6 milyon IU'ya karşılık gelir), insan albümini - 15.00 mg, mannitol - 15.00 mg.
1 ml hazırlanan çözelti 0.25 mg (8,0 milyon IU) rekombinant interferon beta-1b içerir.
1 ml sulu enjeksiyonluk çözelti, 5.4 mg sodyum klorür içerir.
TANIM
liyofilizat: Dondurularak kurutulmuş beyaz renkli kütle.
çözücü: Berrak, neredeyse renksiz çözelti.
Sulandırılmış çözüm: Hafif opalesan ila opalesan solüsyon, renksiz veya açık sarı.
FARMAKOTERAPÖTİK GRUBU
sitokin. Multipl skleroz tedavisi için araçlar.
ATH KODU: L03AB08
FARMAKOLOJİK ÖZELLİKLERİ
farmakodinamik
İnterferonlar, sitokin ailesine ait ve 15.000 ila 21.000 dalton moleküler ağırlığa sahip proteinlerdir. Üç interferon sınıfı vardır: farklı fakat örtüşen biyolojik aktivitelere sahip interferon alfa, interferon beta ve interferon gama. İnterferon beta-1b'nin aktivitesi türe özgüdür, bu nedenle interferon beta-1b ile ilgili en alakalı farmakolojik bilgiler, kültürlenmiş insan hücreleriyle yapılan çalışmalardan veya insanlarda in vivo çalışmalardan elde edilebilir.
Betaferon ilacının (interferon beta-1b) aktif maddesi, antiviral ve immünomodülatör aktiviteye sahiptir. Multipl sklerozda (MS) interferon beta-1b'nin etki mekanizmaları tam olarak kurulmamıştır. Bununla birlikte, interferon beta-1b'nin biyolojik etkisine, insan hücrelerinin yüzeyinde bulunan spesifik reseptörlerle etkileşiminin aracılık ettiği bilinmektedir. İnterferon beta-1b'nin bu reseptörlere bağlanması, interferon beta-1b'nin biyolojik etkilerinin aracıları olarak kabul edilen bir dizi maddenin ekspresyonunu indükler. Bu maddelerin bazılarının içeriği, interferon beta-1b ile tedavi edilen hastaların serum ve kan hücresi fraksiyonlarında belirlendi. İnterferon beta-1b, bağlanma kapasitesini azaltır ve ayrıca gama-interferon için reseptörlerin içselleştirilmesini ve bozulmasını arttırır. Ek olarak interferon beta-1b, periferik kan mononükleer hücrelerinin baskılayıcı aktivitesini arttırır. Betaferon'un kardiyovasküler, solunum ve endokrin sistemler üzerindeki etkisi üzerine ayrı çalışmalar yapılmamıştır.
Klinik araştırmalar:
Relapsing-remitting multipl skleroz
Relapsing-remitting multipl sklerozlu ve yardımsız hareket edebilen (başlangıç EDSS değeri 0'dan 5.5'e kadar) hastalarda yürütülen bir klinik çalışmada, Betaferon ile tedavinin klinik alevlenmelerin sıklığını (%30) ve şiddetini azalttığı gösterilmiştir. hastalığa bağlı olarak hastaneye yatış sayısını ve remisyon süresini de uzatmaktadır. Betaferon tedavisinin nüks süresi veya alevlenmeler arasındaki semptomların başlangıcı üzerindeki etkisinin yanı sıra nükseden-düzelten multipl sklerozda hastalığın ilerlemesi hakkında bilgi mevcut değildir.
İkincil ilerleyici multipl skleroz:
İkincil ilerleyici MS'li 1657 hastada (başlangıç EDSS 3 ila 6.5, yani yürüyebilen hastalar) iki kontrollü klinik çalışma yürütülmüştür. Hafif hastalığı olan ve hareket edemeyen hastalar çalışmaya dahil edilmedi. Her iki çalışmanın sonuçları, birincil son nokta, doğrulanmış hastalık ilerlemesine kadar geçen süre ve sakatlığın ilerlemesini geciktirme için çelişkili sonuçlar gösterdi.
İki çalışmadan birinde, Betaferon ile tedavi sırasında sakatlığın ilerlemesinde istatistiksel olarak anlamlı bir gecikme gösterilmiştir (tehlike oranı = 0.69, %95 güven aralığı (0.55; 0.86), p = 0.0010 %31'lik bir risk azalmasına karşılık gelir) Betaferon tedavisinin bir sonucu) ve ciddi sakatlık (yani hastalar sürekli tekerlekli sandalye kullanmaya zorlandıklarında) (tehlike oranı = 0,61, %95 güven aralığı (0,44; 0,85), p = 0,0036, riskin %39 oranında azalmasına karşılık gelir. Betaferon ile tedavinin sonucu). Bu etki, relaps sıklığına bakılmaksızın herhangi bir sakatlık indeksi olan hastalarda 33 ay boyunca gözlendi. İkincil ilerleyici MS hastalarını içeren ikinci bir çalışmada, Betaferon tedavisinin bir sonucu olarak sakatlığın başlangıcında herhangi bir gecikme olmamıştır. Bu çalışmaya dahil edilen hastaların, ilk çalışmaya katılan hastalara kıyasla hastalığın daha az aktif bir aşamasında olduğuna dair kanıtlar vardır.
Her iki çalışmanın retrospektif bir meta-analizi, genel olarak istatistiksel olarak anlamlı bir tedavi etkisi gösterdi (p=0,0076; 8 milyon IU Betaferon plaseboya karşı).
Geriye dönük bir alt grup analizi, Betaferon ile tedavinin, tedaviden önce aktif hastalığı olan hastalarda maluliyetin başlamasına kadar geçen süre üzerinde bir etkiye sahip olma olasılığının daha yüksek olduğunu göstermiştir (tehlike oranı 0.72, %95 güven aralığı (0.59; 0 ,88), p= 0,0011, plasebo ile tedavi edilen hastalarla karşılaştırıldığında, EDSS'nin nüksetmesi veya şiddetli ilerlemesi olan hastalarda Betaferon tedavisinde %28'lik bir risk azalmasına, 8 milyon IU Betaferon'a karşılık gelir). Retrospektif veriler, nükslerin yanı sıra belirgin EDSS ilerlemesinin (son iki yılda EDSS >6 için EDSS >1 veya EDSS >0.5) aktif hastalığı olan hastaların belirlenmesine yardımcı olabileceğini düşündürmektedir.
Sekonder progresif multipl sklerozlu hastalarda yapılan her iki çalışmada da Betaferon ile tedavi klinik alevlenmelerin sıklığını %30 oranında azaltmıştır. Tedavinin relaps süresi üzerindeki etkisine dair veri yoktu.
Multipl sklerozu düşündüren klinik olarak izole edilmiş sendrom
Klinik olarak izole bir sendromu olan ve multipl sklerozu düşündüren beyin manyetik rezonans görüntüleme (MRI) bulguları (T2 ağırlıklı MRG görüntülerinde klinik olarak belirgin olmayan en az iki lezyon) olan hastalarda bir kontrollü klinik çalışma yürütülmüştür. Çalışma, hastalığın monofokal veya multifokal başlangıcı olan hastaları içermiştir (yani, merkezi sinir sisteminin bir veya en az iki lezyonunun klinik belirtileri olan hastalar). Multipl skleroza benzer herhangi bir hastalık semptomu olan hastalar çalışma dışı bırakıldı.
Bu çalışma 2 aşamayı içeriyordu: plasebo kontrollü bir aşama (plaseboya karşı Betaferon), ardından önceden planlanmış bir takip aşaması. Plasebo kontrollü aşama, hangisi önce gelirse, 2 yıl veya klinik olarak anlamlı multipl skleroz (MSMS) gelişene kadar sürdü. Çalışmanın plasebo kontrollü aşamasının tamamlanmasından sonra, hastalar Betaferon tedavisinin erken ve geç başlatılmasının etkilerini karşılaştırmak için önceden planlanmış bir takip aşamasına girdiler. Karşılaştırmalar, başlangıçta Betaferon (betaferon erken başlama grubu) ve plaseboya (geç başlangıç grubu) randomize edilen hastalar arasında yapılmıştır.
Tablo 1.
RÇalışma Verilerine Dayalı Birincil Etkinlik Sonuçları FAYDA ve çalışmaya göre izlem sonuçlarıFAYDA Takip et- yukarı.

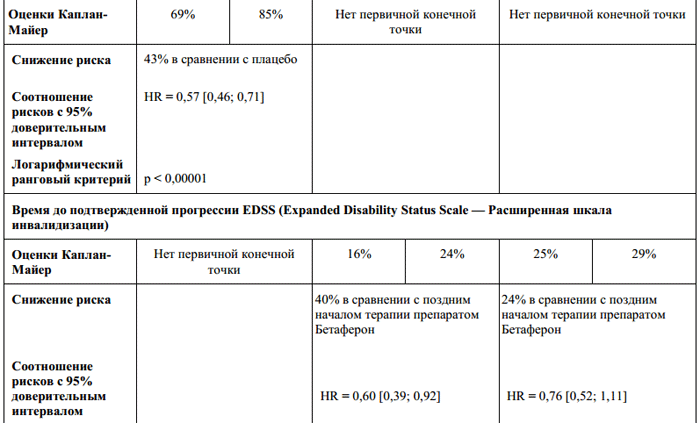
Çalışmanın plasebo kontrollü aşamasında, Betaferon, hastalığın ilk klinik tezahürden klinik olarak anlamlı multipl skleroza ilerlemesini yavaşlattı. Betaferon ile tedavi, McDonald kriterlerine göre multipl skleroz ilerlemesinde stabil bir gecikmeye neden olmuştur (Tablo 1).
Betaferon ile tedavi, analiz edilen tüm alt gruplarda hastalığın CRMS'ye ilerlemesi üzerinde bir etkiye sahipti. Monolezyonel formu ve T2 ağırlıklı görüntülerde en az dokuz lezyonu veya başlangıçtaki beyin MRG'sinde Gd artışı olan hastalarda, 2 yıl içinde CRMS'ye hastalık progresyonu riskinde artış vardı. Çok odaklı bir formu olan hastalarda, hastalığın CRMS'den önceki gelişiminin zamanlaması, temel alınan ilk MRG parametrelerine bağlı değildi.
klinik gözlemler nedeniyle yüksek bir CRMS riski gösterdihastalık seyri. Şu anda net bir tanım yok
"yüksek risk" kavramının tanımı. Daha konservatif bir yaklaşım, ilk taramada T2 ağırlıklı görüntülerde en az dokuz hiperintens lezyonu ve T2 ağırlıklı görüntülerde en az bir yeni lezyonu veya ilk taramadan en az bir ay sonra yeni bir Gd-arttırılmış lezyonu tanımlamak olacaktır. . Her durumda, tedavi sadece yüksek riskli hastalara verilmelidir.
Çalışmayı tamamlayan hastaların yüksek yüzdesi (Betaferon grubunun %93'ü), Betaferon tedavisinin iyi tolere edildiğini göstermiştir. Tedavinin başlangıcında ilacın tolere edilebilirliğini arttırmak için doz titrasyonu ve steroid olmayan antienflamatuar ilaçların tanıtımı yapıldı. Ayrıca, tüm çalışma boyunca, hastaların çoğuna ilaç bir oto-enjektör kullanılarak uygulandı.
Açık gözlemin sonraki aşamasında, plasebo grubundaki hastaların çoğunluğu en azından hastalığın ikinci yılından itibaren Betaferon ile tedavi görmüş olsa bile, tedavinin etkisi 3 ve 5 yıllık tedaviden sonra belirgindi (Tablo 1). Betaferon ile erken tedavi uygulanan grupta (Tablo 1, 3 yıldan sonra belirgin etki, 5 yıldan sonra anlamlı etki yok), EDSS ölçeğinde hastalık progresyonu (başlangıca kıyasla EDSS'de en az bir puanlık doğrulanmış artış) daha düşüktü. Her iki gruptaki hastaların çoğunda 5 yıl içinde sakatlık ilerlemesi görülmedi. "Tedavinin erken başlatılması" için, bu taban çizgisinde kalıcı bir etki gösterilmemiştir. Betaferon ile tedaviye erken başlanması nedeniyle, FAMS'ye (MS'nin Fonksiyonel Değerlendirmesi - multipl sklerozun fonksiyonel değerlendirmesi: tedavi indeksi, sonuç) göre belirlendiği üzere, yaşam kalitesi açısından herhangi bir fayda sağlanmamıştır.
Relapsing-remitting multiple skleroz, sekonder progresif multipl skleroz ve multipl sklerozu düşündüren klinik olarak izole bir sendrom.
Multipl sklerozlu hastalarda MRI sonuçları, tüm çalışmalarda Betaferon ilacının etkinliğini ve hastalığın seyrini yavaşlattığını göstermiştir. MRG değerlendirme sonuçlarına göre multipl skleroz seyri ile klinik sonuç arasındaki ilişki henüz aydınlatılamamıştır.
toksikolojik karakterizasyon
Akut toksisite çalışmaları yapılmamıştır. Kemirgenler insan interferon betasının etkilerine karşı duyarsız olduklarından, risk değerlendirmesi al yanaklı maymunlarda tekrarlanan doz toksisite çalışmalarına dayandırılmıştır. Lenfosit konsantrasyonunda belirgin bir geçici artış ve trombositlerde ve segmentli nötrofillerde geçici bir azalma ile birlikte geçici hipertermi gözlendi.
Uzun süreli toksisite çalışmaları yapılmamıştır. Rhesus maymunlarında yapılan üreme toksisitesi çalışmaları, maternal toksisite ve spontan düşük oranlarında bir artış göstermiştir. Canlı yavrularda herhangi bir malformasyon gözlenmedi. Doğurganlık üzerindeki etkisine ilişkin çalışmalar yapılmamıştır. Maymun kızgınlık döngüsü üzerinde herhangi bir etki gözlenmedi.
Ayrı bir genotoksisite çalışmasında (Ames testi), hiçbir mutajenik etki gözlemlenmemiştir. Karsinojenisite çalışmaları yapılmamıştır. Bir in vitro hücre transformasyonu testi, herhangi bir kanserojen potansiyel göstermedi.
farmakokinetik
Hastalarda ve gönüllülerde interferon beta-1b'nin plazma konsantrasyonu, spesifik bir biyolojik tahlil kullanılarak belirlendi.
0.5 mg (16,0 milyon IU) interferon beta-1b'nin subkutan enjeksiyonundan sonra, maksimum plazma konsantrasyonuna enjeksiyondan 1-8 saat sonra ulaşılır ve yaklaşık 40 IU / ml'dir. Çeşitli çalışmalara göre, intravenöz interferon beta-1b uygulamasıyla, plazmadan klirensi ve yarı ömrü sırasıyla ortalama 30 ml / dak / kg ve 5 saattir.
Betaferon ilacının her gün uygulanması, kan plazmasındaki interferon beta-1b konsantrasyonunda bir artışa yol açmaz ve tedavi süresince farmakokinetiği değişmez.
İnterferon beta-1b'nin deri altı uygulaması ile mutlak biyoyararlanım yaklaşık %50'dir.
KULLANIM ENDİKASYONLARI
Klinik olarak izole sendrom (CIS) (alternatif tanıların dışlanması şartıyla multipl sklerozu düşündüren tek klinik demiyelinizasyon epizodu) intravenöz kortikosteroid gerektirecek kadar inflamasyonu olan - için
CRMS geliştirme riski yüksek olan hastalarda klinik olarak anlamlı multipl skleroza (CRMS) geçişi yavaşlatmak.
Yüksek riskin genel kabul görmüş bir tanımı yoktur. Çalışmaya göre, monofokal CIS (CNS'de 1 lezyonun klinik belirtileri) ve MRG'de T2 ağırlıklı görüntülerde ≥ 9 odak ve/veya kontrast madde biriktiren odaklar olan hastalarda CRMS gelişme riski yüksektir. Multifokal CIS'li hastalar (CNS'de >1 lezyonun klinik belirtileri), MRG'deki odak sayısından bağımsız olarak CRMS geliştirme riski yüksektir.
Relapsing-remitting multipl skleroz (RRMS) - ayakta tedavi gören hastalarda (yani yardımsız yürüyebilen hastalarda) alevlenmelerin sıklığını ve şiddetini azaltmak için, son iki yıl içinde en az 2 alevlenme öyküsü ve ardından tam veya eksik restorasyon nörolojik eksiklik.
Son iki yılda nörolojik fonksiyonlarda alevlenmeler veya belirgin bir bozulma ile karakterize, hastalığın aktif seyri olan sekonder progresif multipl skleroz - hastalığın klinik alevlenmelerinin sıklığını ve şiddetini azaltmak ve ayrıca ilerleme hızını yavaşlatmak için hastalığın.
KONTRENDİKASYONLAR
- Gebelik.
- Emzirme.
- Tarihte doğal veya rekombinant interferon betaya karşı aşırı duyarlılık reaksiyonları ve ilacı oluşturan bileşenler.
- Şiddetli depresyon ve/veya intihar düşünceleri.
- Dekompansasyon aşamasında karaciğer hastalıkları.
- 18 yaşın altındaki çocuklar (interferon beta-1b'nin çocuklarda kullanımının etkinliği ve güvenliğine ilişkin bilgiler sınırlıdır).
DİKKATLİCE
Betaferon, aşağıdaki koşullara sahip hastalarda dikkatli kullanılmalıdır:
- kalp hastalıkları, özellikle kalp yetmezliği, New York Kalp Derneği'nin (NYHA) sınıflandırmasına göre III-IV fonksiyonel sınıf, kardiyomiyopati;
- epileptik nöbet öyküsü;
- monoklonal gamopati;
- anemi, trombositopeni, lökopeni;
- şiddetli böbrek yetmezliği.
GEBELİKTE VE EMZİRME SIRASINDA KULLANIM
Gebelik
Betaferon'un hamile kadınlarda tedavi edildiğinde fetusa zarar verme veya insan üreme fonksiyonunu etkileme potansiyeli hakkında sınırlı bilgi vardır. Multipl sklerozlu hastalarda yapılan kontrollü klinik çalışmalarda, spontan düşük vakaları olmuştur. Betaferon ilacının hamilelik sırasında kullanımı kontrendikedir.
Betaferon tedavisi sırasında üreme çağındaki kadınlar güvenilir doğum kontrol yöntemleri kullanmalıdır. Tedavi sırasında veya hamilelik planlanırken hamilelik durumunda, hasta fetusa yönelik potansiyel risk konusunda bilgilendirilmelidir. Bu durumda Betaferon kullanımının iptal edilmesi önerilir.
Öyküsünde nüks oranı yüksek olan hastalarda tedaviye başlamadan önce, gebelik sırasında ilaçla tedavi kesildikten sonra olası spontan düşük riskine karşı ciddi nüks gelişme riskinin değerlendirilmesi gerekir.
emzirme dönemi
İnterferon beta-1b'nin anne sütüne geçip geçmediği bilinmemektedir. Emzirilen bebeklerde Betaferon ilacına olumsuz reaksiyonlar geliştirme teorik olasılığı göz önüne alındığında, emzirmeyi durdurmak veya ilacı kesmek gerekir.
UYGULAMA ŞEKLİ VE DOZLARI
Betaferon tedavisi, multipl skleroz tedavisinde deneyimli bir doktorun gözetiminde başlatılmalıdır.
Tedavinin başlangıcında, genellikle dozun titre edilmesi önerilir. Tedavi, gün aşırı 0.0625 mg (0.25 mi) subkutan olarak verilmeli ve doz yavaş yavaş 0.250 mg'a (1.0 mi) yükseltilmelidir, yine gün aşırı uygulanmalıdır. Doz titrasyon periyodu, herhangi bir önemli advers reaksiyon durumunda değiştirilebilir. Tedavinin yeterli etkinliğini elde etmek için gün aşırı 0.250 mg (1.0 ml) doz uygulanmalıdır.
Doz titrasyonu tablosu:
Klinik çalışmalarda, relapsing-remitting ve sekonder progresif multipl sklerozlu hastalarda tedavi süresi sırasıyla 5 yıl ve 3 yıla ulaşmıştır.
Nükseden-düzelten multipl sklerozda, tedavinin ilk iki yılında Betaferon ile tedavinin etkinliği gösterilmiştir. İlave 3 yıllık tedavi periyoduna ilişkin mevcut veriler, tüm tedavi periyodu boyunca Betaferon ile tedavinin etkinliğine dair verilerle uyumludur.
Multipl sklerozu düşündüren klinik olarak izole bir sendromu olan hastalarda, hastalığın CRMS'ye ilerlemesi 5 yıllık bir süre gecikmiştir.
Betaferon tedavisi, son 2 yılda ikiden az nüks geçiren nükseden-düzelten multipl sklerozlu hastalarda ve son 2 yılda hastalığın aktif fazını geçirmemiş sekonder progresif multipl sklerozlu hastalarda önerilmez.
Hasta tedaviye yanıt vermezse, örneğin EDSS ölçeğinde (genişletilmiş sakatlık ölçeği) 6 ay içinde hastalıkta istikrarlı bir ilerleme varsa veya Betaferon ile tedaviye rağmen en az üç kür halinde Betaferon tedavisi kesilmelidir. ACTH (adrenokortikotropik hormon) tedavisi veya 1 yıl kortikosteroid tedavisi gereklidir.
Enjeksiyon çözeltisinin hazırlanması
A. İlaç içeren flakonlar ve kullanıma hazır şırıngaların ambalajlanması:
Enjeksiyon için liyofilize interferon beta-1b tozunu çözmek için, birlikte verilen hazır şırıngayı çözücü ve iğne ile kullanın.
B. İlaç içeren flakonlar, kullanıma hazır şırıngalar, iğne flakon adaptörü ve alkollü mendiller:
Enjeksiyon için liyofilize interferon beta-1b tozunu çözmek için, birlikte verilen hazır şırıngayı seyreltici ve iğneli bir flakon için bir adaptör kullanın.
1.2 ml çözücü (%0.54 sodyum klorür çözeltisi), Betaferon içeren bir şişeye enjekte edilir. Toz, sallamadan tamamen çözülmelidir. Kullanımdan önce, hafif opak ila yanardöner, renksiz veya açık sarı arasında olması gereken bitmiş çözelti incelenmelidir. Partiküllerin varlığında veya çözeltinin renginde değişiklik olması durumunda kullanılmamalıdır.
Kullanılmayan çözelti atılmalıdır.
1 ml hazırlanan çözelti 0.25 mg (8 milyon IU) interferon beta-1b içerir.
Çözeltinin hazırlanmasından sonra titre edilen doza göre gereken ilaç miktarı enjektöre çekilir.
Hastalar için kendi kendine enjeksiyon tekniği
Kendi Betaferon enjeksiyonunuzu ve enjeksiyonunuzu hazırlamak için lütfen talimatları dikkatlice okuyun ve adım adım izleyin. Doktor veya hemşire size kendi kendine enjeksiyon prosedürü ve tekniği hakkında bilgi verecek ve öğrenmenize yardımcı olacaktır. Çözeltinin hazırlanması için gereklilikleri ve kendi kendine enjeksiyon tekniğini doğru anladığınızdan emin olana kadar kendinize enjekte etmeye çalışmayın.
A. Şişeler ve kullanıma hazır şırıngalar içeren ilaç paketi.
- Enjeksiyon için hazırlık.
- Gerekli hacimde çözücünün (1.2 mi) Betaferon içeren flakona eklenmesi.
- Enjeksiyon için gerekli hacimde (1.0 mi) bir şırıngaya ayarlayın.
Enjeksiyon için hazırlanıyor
1. Bir enjeksiyon yapmadan önce, enjeksiyon için ihtiyacınız olan her şeyi toplayın.
Bunun için ihtiyacınız olacak:
- Betaferon seyreltici (%0.54 sodyum klorür çözeltisi) ile doldurulmuş şırınga
- Betaferon şişesi
- iğne 21G
- iğne 30G
- alkollü mendil
- kullanılmış şırıngalar ve iğneler için kap
2. Ellerinizi sabunla iyice yıkayın.
3. Betaferon flakonunun koruyucu kapağını çıkarın.
4. Betaferon flakonunun kapağını alkollü bir bezle silin (bir yönde silin ve bir mendil kullanın).
NOT: Alkol pedini flakon kapağında bırakın ve flakonu kullanmaya hazır olana kadar çıkarmayın.
Betaferon ilacı ile gerekli çözücü hacminin (1.2 mi) şişeye eklenmesi
NOT: Betaferon flakonunu alın ve üstündeki alkollü pedi atın.
1. Ellerinizi sabit bir yüzeyde tutarak solvent şırıngasını paketinden çıkarın. Şırınganın tabanından çıkarmak için kapağı çekin. Şırınganın açık ucuna dokunmayın. Pistona bastırmayın.
2. 21G iğneyi paketinden çıkarın ve şırınganın ucuna sıkıca yerleştirin. Koruyucu kapağı iğneden çıkarın. İğneye dokunmayın.
3. Betaferon flakonu stabil bir yüzey üzerindeyken, şırınganın iğnesini (1.2 ml solvent içeren) flakonun tıpasından sonuna kadar yavaşça sokun.
4. Pistonu yavaşça aşağı bastırın. İğne yan tarafa bakmalıdır, böylece
sıvının flakonun duvarından aşağı akması için (çözücüyü doğrudan
toz, daha sonra çok fazla köpük oluşur).
5. İğnenin toz veya ortaya çıkan toz ile temas etmediğinden emin olun.
çözüm.
6. Şırınganın tüm içeriğini Betaferon flakonuna enjekte ettiğinizde, flakonu iğne ve şırınga kolunuz üzerinde olacak şekilde başparmağınız, işaret parmağınız ve orta parmaklarınız arasında tutun.
7. Betaferon tozunu tamamen çözmek için flakonu elinizde dikkatlice döndürün. ÇALKALAMA!
8. Çözeltiyi dikkatlice inceleyin (şeffaf olmalıdır).
NOT: Karışım partikül içeriyorsa veya rengi değişmişse dökün ve tüm işleme en baştan başlayın.
Bir şırıngada enjeksiyon için gerekli hacimde çözelti (1.0 mi) seti
NOT: Hazırlanan solüsyonu çekmeden önce, şırınganın içinde kalmış olabilecek havayı çıkarmak için şırınganın pistonuna tamamen basın.
1. Betaferon solüsyonu flakonunu hafifçe eğin ve iğnenin ucunu
şişenin en alt noktası.
NOT: İğnenin ucunu her zaman solüsyonda tuttuğunuzdan emin olun.
2. Pistonu çekin ve işarete kadar şırıngaya 1.0 ml sıvı çekin.
3. Şişeyi ters çevirin ve şırıngayı iğne yukarıda olacak şekilde tutun.
4. Hava kabarcıklarını namlunun üstüne taşımak için şırıngaya hafifçe vurun.
5. Şırıngadan YALNIZCA HAVA çıkacak şekilde pistonu hafifçe aşağı bastırın.
6. Şırıngayı iğneden ayırın. İğneyi flakonda bırakın.
7. Şırıngayı (iğnesiz) düz bir yüzeye yerleştirin. Şırınganın ucunun yüzeye temas etmediğinden emin olun.
8. 30G'lik bir iğne alın, paketinden çıkarın ve şırınganın ucuna sıkıca yerleştirin.
9. Kalan solüsyonu ve iğneyi içeren şişeyi atın.
Artık enjekte etmeye hazırsınız.
B. Şişeler, kullanıma hazır şırıngalar, iğneli bir şişe için bir adaptör ve alkollü mendiller içeren ilaç paketi.
Çözüm hazırlama adımları:
1 - İşleme başlamadan önce ellerinizi sabunla iyice yıkayın.
2 - Şişeyi Betaferon ile açın - kırılabileceğinden tırnağınızla değil, baş parmağınızla daha iyi - ve masanın üzerine koyun.

3 - Şişe kapağını alkollü bezle silin. Mendili yalnızca bir yönde hareket ettirin ve ardından şişe kapağının üzerinde bırakın.

4 - Flakon adaptörünü içeren blister ambalajı açın, ancak adaptörü içeride bırakın.
Şişe adaptörünü blisterden çıkarmayın.ambalajlama.
Ayrıca flakon adaptörüne dokunmamaya dikkat edin. Steril kalması önemlidir.

5 - Adaptörü takarken flakonu düz bir yüzeyde tutun.
6 - Alkol pedini Betaferon flakonunun kapağından çıkarın. Flakon adaptörlü solüsyon transfer cihazını içeren blister ambalajı flakon kapağına yerleştirin. Başparmağınız ve işaret parmağınız veya avucunuzla, tık sesi gelene kadar blisterin üzerine bastırın.

7 - Blister paketin kenarlarını tutun ve flakon adaptöründen çıkarın. Artık kullanıma hazır solvent şırıngasını solüsyon transfer cihazına takmaya hazırsınız.

8 - Şırıngayı alın. Şırınganın ucundaki turuncu kapağı çevirin ve şırıngadan çekin. Kapağı atın.

9 - Şırınganın ucunu içine sokarak şırıngayı adaptörün yanındaki deliğe takın ve şırınga ile tertibatı oluşturmak için saat yönünde (okla gösterildiği gibi) çevirerek bastırarak dikkatlice sabitleyin.

10 - Şırınga flakonun alt kısmında olacak şekilde tertibatı tutun. Tüm seyrelticiyi flakon içine taşımak için şırınga pistonunu yavaşça tamamen aşağı itin. Pistonu serbest bırakın. Bu durumda piston orijinal konumuna dönebilir.

11 - Betaferon'un kuru tozunun tamamen çözülmesi için şişeyle birkaç hafif dönme hareketi yapın. Bu durumda, şırıngalı tasarım hala flakona bağlı kalır.
Şişeyi sallamayın.

12 - Çözeltiyi dikkatlice inceleyin. Şeffaf olmalı ve partikül içermemelidir. Eğer bir
solüsyonun rengi değiştiyse veya parçacıklar içeriyorsa, dökün ve yeni bir aksesuar paketi alarak tüm prosedürü baştan başlatın. Köpük belirirse - flakon çalkalanırsa veya
çok fazla döndürün - köpük çökene kadar şişeyi bekletin.
şırınga hazırlama

13 - Piston eski konumuna döndüyse tekrar iterek sabitleyin. Enjeksiyonu hazırlamak için, flakon üstte ve flakon kapağı aşağı bakacak şekilde tertibatı çevirin. Bu, çözeltinin şırıngaya akmasına izin verecektir.
Şırıngayı yatay tutun.
Tüm çözeltiyi flakondan şırıngaya çekmek için pistonu yavaşça geri çekin.
14 - Şırınga tertibatını iğne yukarı bakacak şekilde döndürün. Bu, hava kabarcıklarının çözeltinin yüzeyine çıkmasına neden olacaktır.

15 - Şırıngaya hafifçe vurarak ve pistonu 1 ml işaretine veya daha fazlasına hareket ettirerek hava kabarcıklarını giderin.
doktor tarafından reçete edilen miktar.
Hava kabarcıkları ile birlikte flakona çok fazla çözelti zorlanmışsa, çözeltiyi flakondan şırıngaya geri çekmek için pistonu biraz geri çekin. Tüm hava çıkana ve şırınga 1 ml hazırlanan çözeltiyi içerene kadar bunu yapın.
Önemli Not: Çözeltiyi tekrar toplarken, şırınga tertibatını flakonun üstte olduğu yatay bir konuma getirin.

16 - Ardından mavi flakon adaptörünü flakon ile birlikte kavrayın,
adaptörü kendinize doğru çevirin ve ardından şırıngadan ayırın.
Flakon adaptörünü şırıngadan ayırırken sadece mavi plastik adaptörü kavrayın. Şırıngayı yatay konumda tutun; flakon şırınganın altında olmalıdır.

17 - Enjeksiyon sırasında flakon ve adaptörün enjektörden ayrılması sonucunda solüsyon iğneden dışarı akar.
18 - Artık enjekte etmeye hazırsınız.
NOT: İlaç, çözeltinin hazırlanmasından hemen sonra deri altından uygulanmalıdır. Enjeksiyon gecikirse solüsyon buzdolabında saklanmalı ve 3 saat içinde kullanılmalıdır, solüsyon dondurulmamalıdır.
19 - Şişeyi ve kalan kullanılmamış solüsyonu bir kap içinde atın.
boşa harcamak.
Enjeksiyon için ilacın hazırlanmasının kısa açıklaması
1. İçeriği paketten çıkarın.
2. Şişe adaptörünü şişeye takın.
3. Şırıngayı flakon adaptörüne takın.
4. Seyrelticiyi şişeye taşımak için pistonu itin.
5. Şırınga tertibatını ters çevirin, ardından pistonu geri çekin.
6. Şişeyi şırıngadan ayırın - artık enjekte etmeye hazırsınız.
NOT: İlaç, çözeltinin hazırlanmasından hemen sonra deri altından uygulanmalıdır. Enjeksiyon gecikirse solüsyon buzdolabında saklanmalı ve 3 saat içinde kullanılmalıdır, solüsyon dondurulmamalıdır.
Enjeksiyon bölgesinin seçimi ve hazırlanması ve ilaç çözeltisinin uygulanması
Betaferon (1.0 mi) deri altından
- Enjeksiyon yeri seçimi
Betaferon (interferon beta-1b) deri altına uygulanmalıdır. Eklemlerden ve sinirlerden uzaktaki yumuşak noktalar bunun için en uygunudur.
Enjeksiyon yerleri çizim kullanılarak seçilebilir. İlk önce enjeksiyon bölgesini belirlemek ve ardından şırıngayı hazırlamak en iyisidir.
Herhangi bir yere ulaşmakta zorlanıyorsanız, enjeksiyon yapmayı bilen birinden yardım isteyin.
1 - Enjeksiyon bölgesini seçin (talimatların sonundaki "Alternatif enjeksiyonlar" şekline bakın).
ÖNEMLİ NOT: Darbe, şişlik, sert budak veya ağrı olan bölgelere enjeksiyon yapmayın. Ayrıca cilt renginde değişiklik, çöküntü, kabuklanma veya cilt bütünlüğünün bozulduğu bölgelere solüsyon enjekte edilmemelidir. Bu veya diğer olağandışı durumlarla karşılaşırsanız, sağlık uzmanınıza başvurun.
2 - Enjeksiyon bölgesindeki cildi alkollü bir ped ile silin ve cildin kurumasını bekleyin. Peçeteyi atın.
Cildi dezenfekte etmek için uygun bir dezenfektan kullanın.

3 - Koruyucu kapağı iğneden çıkarın. Bükmek yerine kapağı çekin.
4 - Dezenfekte alanın etrafındaki cildi nazikçe sıkıştırın (biraz yukarı kaldırmak için).

5 - İğneyi keskin ve emin bir hareketle cilde 90° açıyla düz bir şekilde sokun. Şırıngayı kalem gibi tutun veya
Dart oyunu.
6 - Pistonu yavaşça ve sürekli olarak iterek çözeltiyi yavaşça enjekte edin. (Şırınga boşalana kadar pistona sonuna kadar basın).
7- Şırıngayı atık kabına atın.
- Enjeksiyon bölgelerinin dönüşü
Her seferinde yeni bir enjeksiyon bölgesi seçmeniz gerekir, çünkü enjeksiyon bölgelerinin dönüşü cildin iyileşmesine izin verir ve ayrıca enfeksiyonu önlemeye yardımcı olur. Enjeksiyon bölgesini önceden seçmek ve ancak bundan sonra şırıngayı hazırlamak daha iyidir. Şekilde gösterilen şema, enjeksiyon bölgelerini doğru şekilde değiştirmenize yardımcı olacaktır. Örneğin, ilk enjeksiyonu karnın sağ yarısına yaptıysanız, ikincisini sol yarısında, üçüncüsü sağ uylukta vb. tüm olası enjeksiyon bölgelerini kullanana kadar şemaya göre. En son nereye ve ne zaman enjekte ettiğinizi kaydedin.


Önerilen şemayı takiben, 8. enjeksiyondan sonra (16 gün sonra), ilk enjeksiyonun yapıldığı yere (örneğin, karnın sağ tarafı) döneceksiniz. Buna "değişim döngüsü" denir. Örnek diyagramımızda, her bölge sırasıyla 6 enjeksiyon bölgesine ayrılmıştır (toplam 48 enjeksiyon bölgesi için): ilgili alanın sol ve sağ, üst, orta ve alt. Bir dönüşten sonra bölgelerden birine döndüğünüzde, bu bölgedeki en uzak enjeksiyon bölgesini seçin. Herhangi bir bölge ağrılı hale gelirse, doktorunuzla diğer olası enjeksiyon bölgelerini tartışın.
Interleaving şeması:
Enjeksiyon yerlerinizi doğru şekilde döndürmenize yardımcı olması için enjeksiyonun ne zaman ve nerede yapıldığını yazmanız önerilir. Bunu yapmak için, aşağıdaki serpiştirme şemasını kullanabilirsiniz:
1. döngümünavebeİlk 8 enjeksiyon, her bölgenin sadece sol üst segmenti kullanılarak 1. bölgeden 8. bölgeye sırayla yapılır.
2. döngümünavebe Sonraki 8 enjeksiyon tekrar 1. bölgeden başlar, ancak her bölgenin sağ alt segmentinde yapılması gerekir.
3. döngümünavebe Bu döngüdeki sonraki 8 enjeksiyon 1. bölgeden başlar ve sırayla her bölgenin orta sol bölümlerinde gerçekleştirilir.
Bu sıra takip edilirse, her bölge bir sonraki enjeksiyondan önce tamamen iyileşme fırsatına sahip olacaktır.
Yapılan enjeksiyonların kaydı
Yapılan enjeksiyonların yerlerini ve tarihlerini kaydetme talimatları
Bir enjeksiyon bölgesi seçin. Halihazırda Betaferon kullanıyorsanız, son değişim döngüsü sırasında kullanılmayan bölge ile başlayın, yani. son 16 gün içinde.
Enjeksiyondan sonra, kullanılan bölgeyi ve enjeksiyon tarihini not edin (kullanım talimatlarının sonundaki “Yapılan enjeksiyonların kayıt örneği” şekline bakın).


YAN ETKİ
Advers reaksiyonların ortaya çıkması genellikle tedavinin başlamasına eşlik eder. Sıklıkları zamanla azalır.
Çoğu zaman, Betaferon ilacının farmakolojik etkisinden dolayı bir grip benzeri semptomlar (ateş, titreme, artralji, genel halsizlik, terleme, baş ağrısı veya kas ağrısı) ortaya çıkabilir. Tedavinin başlangıcında dozun titre edilmesi önerilir. Grip benzeri semptomların şiddeti, steroid olmayan antienflamatuar ilaçlar kullanılarak azaltılabilir.
Genellikle 0.25 mg (8 milyon IU) dozunda Betaferon ilacının verilmesinden sonra hastalarda, enjeksiyon bölgesinde reaksiyonlar meydana gelir (örneğin, kızarıklık, şişme, ciltte renk değişikliği, iltihaplanma, ağrı, aşırı duyarlılık, nekroz ve -spesifik reaksiyonlar).
Enjeksiyon bölgesindeki reaksiyonların sıklığı, ilacın otomatik uygulanması için bir cihaz kullanılarak azaltılabilir.
Klinik çalışmalar sırasında gözlemlenen ve kayıt sonrası gözlem sürecinde tanımlanan Betaferon ilacının kullanımı ile advers reaksiyonlar (AR) ve bunların ortaya çıkma sıklığı aşağıda sunulmuştur.
Spesifik reaksiyonu, eşanlamlılarını ve ilgili koşulları tanımlamak için Regulatory Activity (MedDRA) Tıp Sözlüğünden en uygun terim kullanılır.
Tablo 1: Olumsuz olaylar ve laboratuvar parametrelerinin sapmaları, ≥ %10 oluşma oranı ve aşağıdaki advers olaylardan en az ikisini içeren bir sendromla klinik çalışmalarda gözlenmiştir:
ateş, titreme, kas ağrısı, halsizlik ve terleme;
3 - laboratuvar parametrelerinin normlarından sapma;
4
Betaferon, klinik olarak izole sendromu olan hastalarda,
multipl skleroz önermek, p< 0,05;
5
- büyük ölçüde ilacın kullanımıyla ilişkili advers olaylar
Relapsing-remitting multipl sklerozlu hastalarda Betaferon,
p< 0,05;
6
- büyük ölçüde ilacın kullanımıyla ilişkili advers olaylar
Sekonder progresif multipl sklerozlu hastalarda betaferon, p< 0,05;
7
- BENEFIT klinik çalışması sırasında profilde herhangi bir değişiklik gözlenmedi
Betaferon'un güvenliği.
Tablo 2: Kayıt sonrası gözlemler sırasında tanımlanan ve ortaya çıkma sıklığının belirlendiği advers reaksiyonlar, klinik çalışmalardan elde edilen havuzlanmış veriler temelinde belirlenir (
3 - interferon içeren tüm müstahzarları ifade eder (aşağıya bakınız
