Hemija natrijum hidroksida. Hemijske metode za dobijanje natrijum hidroksida
Uvod .
Natrijum hidroksid ili kaustična soda (NaOH), hlor, hlorovodonična kiselina HC1 i vodonik se trenutno proizvode u industriji elektrolizom rastvora natrijum hlorida.
Kaustična soda ili natrijum hidroksid - jaka lužina, obično nazvana kaustična soda, koristi se u proizvodnji sapuna, u proizvodnji glinice - međuproizvoda za proizvodnju aluminijumskog metala, u industriji boja i lakova, preradi ulja, u proizvodnji rajona, u industriji organske sinteze i drugim sektorima nacionalne privrede.
Kada radite s hlorom, klorovodikom, klorovodičnom kiselinom i kaustičnom sodom, morate se strogo pridržavati sigurnosnih pravila: udisanje hlora uzrokuje oštar kašalj i gušenje, upalu sluznice respiratornog trakta, plućni edem, a kasnije i nastanak upalnih žarišta u plućima.
Hlorovodonik, čak i pri niskim nivoima u vazduhu, izaziva iritaciju u nosu i larinksu, trnce u grudima, promuklost i gušenje. At hronično trovanje njegove male koncentracije posebno utiču na zube čija se caklina brzo uništava.
Trovanje hlorovodoničnom kiselinom je vrlo slično With trovanje hlorom.
Hemijske metode za proizvodnju natrijum hidroksida.
To hemijske metode proizvodnja natrijevog hidroksida uključuje vapnenačke i feritne.
Vapnena metoda za proizvodnju natrijevog hidroksida sastoji se u interakciji otopine sode s vapnenim mlijekom na temperaturi od oko 80 ° C. Ovaj proces se naziva kaustika; opisuje se reakcijom
Na 2 C0 3 + Ca (OH) 2 \u003d 2NaOH + CaC0 3 (1)
rješenje-nagodba
Prema reakciji (1) dobije se rastvor natrijum hidroksida i talog kalcijum karbonata. Kalcijum karbonat se odvaja od rastvora, koji se isparava da bi se dobio rastopljeni proizvod koji sadrži oko 92% NaOH. Rastopljeni NaOH se sipa u gvozdene bačve gde se stvrdnjava.
Feritna metoda je opisana sa dvije reakcije:
Na 2 C0 3 + Fe 2 0 3 = Na 2 0 Fe 2 0 3 + C0 2 (2)
natrijum ferit
Na 2 0 Fe 2 0 3 -f H 2 0 \u003d 2 NaOH + Fe 2 O 3 (3)
talog rastvora
reakcija (2) prikazuje proces sinterovanja sode pepela sa željeznim oksidom na temperaturi od 1100-1200°C. U tom slučaju nastaje speck - ferit natrij i oslobađa se ugljični dioksid. Zatim se kolač tretira (luži) vodom prema reakciji (3); dobijaju se rastvor natrijum hidroksida i talog Fe 2 O 3 koji se nakon odvajanja iz rastvora vraća u proces. Rastvor sadrži oko 400 g/l NaOH. Ispari se da se dobije proizvod koji sadrži oko 92% NaOH.
Hemijske metode Proizvodnja natrijum hidroksida ima značajne nedostatke: troši se velika količina goriva, nastala kaustična soda je kontaminirana nečistoćama, održavanje aparata je naporno, itd. Trenutno su ove metode gotovo u potpunosti zamijenjene elektrohemijskom metodom proizvodnje. .
Pojam elektrolize i elektrohemijski procesi.
Elektrohemijski procesi nazivaju se hemijski procesi koji se javljaju u vodenim rastvorima ili topljenima pod dejstvom konstante električna struja.
Otopine i otopine soli, otopine kiselina i lužina, koje se nazivaju elektroliti, su provodnici druge vrste, u kojima se prijenos električne struje vrši pomoću jona. (U provodnicima prve vrste, kao što su metali, struju nose elektroni.) Kada električna struja prođe kroz elektrolit, joni se ispuštaju na elektrodama i oslobađaju se odgovarajuće supstance. Ovaj proces se naziva elektroliza. Aparat u kojem se provodi elektroliza naziva se elektrolizer ili elektrolitička kupka.
Elektrolizom se dobijaju brojni hemijski proizvodi - hlor, vodonik, kiseonik, alkalije, itd. Treba napomenuti da se elektrolizom proizvodi hemijski proizvodi visok stepen čistoće, u nekim slučajevima nedostižan hemijskim metodama njihove proizvodnje.
Nedostaci elektrohemijskih procesa uključuju veliku potrošnju energije tokom elektrolize, što povećava cenu dobijenih proizvoda. U tom smislu, preporučljivo je provoditi elektrohemijske procese samo na bazi jeftine električne energije.
Sirovina za proizvodnju natrijum hidroksida.
Za proizvodnju natrijum hidroksida, hlora, vodika koristi se rastvor kuhinjska so, koja je podvrgnuta elektrolizi Kuhinjska so se u prirodi javlja u obliku podzemnih naslaga kamena sol, u vodama jezera i mora iu obliku prirodnih salamuri ili rastvora. Nalazišta kamene soli nalaze se u Donbasu, Uralu, Sibiru, Zakavkazju i drugim regionima. Bogata solju u našoj zemlji i neka jezera.
Ljeti voda isparava s površine jezera, a kuhinjska sol ispada u obliku kristala. Takva sol se naziva samosadjenjem. Morska voda sadrži do 35 g/l natrijum hlorida. Na mjestima s toplom klimom, gdje dolazi do intenzivnog isparavanja vode, formiraju se koncentrirani rastvori natrijum hlorida iz kojih kristališe. U utrobi zemlje, u slojevima soli, teku podzemne vode koje otapaju NaCl i formiraju podzemne slane vode koje kroz bušotine izlaze na površinu.
Rastvori soli, bez obzira na način na koji su dobijeni, sadrže nečistoće soli kalcija i magnezija, a prije nego što se prebace u radnje za elektrolizu, prečišćavaju se od tih soli. Prečišćavanje je neophodno jer se tokom procesa elektrolize mogu formirati slabo rastvorljivi kalcijum i magnezijum hidroksidi koji remete normalan tok elektrolize.
Čišćenje salamura vrši se rastvorom sode i krečnog mleka. Pored hemijskog prečišćavanja, rastvori se oslobađaju od mehaničkih nečistoća sedimentacijom i filtracijom.
Elektroliza rastvora soli vrši se u kupkama sa čvrstom gvozdenom (čeličnom) katodom i sa dijafragmama i u kupkama sa tečnom živinom katodom. U svakom slučaju, industrijski elektrolizatori koji se koriste za opremu modernih velikih postrojenja za klor moraju imati visoku produktivnost, jednostavan dizajn, biti kompaktni, raditi pouzdano i stabilno.
Elektroliza otopina natrijevog klorida u kupkama sa čeličnom katodom i grafitnom anodom .
Omogućava dobijanje natrijum hidroksida, hlora i vodonika u jednom aparatu (elektrolizeru). Prilikom propuštanja jednosmjerne električne struje kroz vodenu otopinu natrijevog klorida može se očekivati oslobađanje klora:
2CI - - 2ndÞ S1 2 (a)
kao i kiseonik:
20N - - 2ndÞ 1/2O 2 + H 2 O (b)
H 2 0-2eÞ1 / 2O 2 + 2H +
Normalni elektrodni potencijal pražnjenja OH - -jona je +0,41 u, a normalni elektrodni potencijal pražnjenja jona hlora je +1,36 in. U neutralnom zasićenom rastvoru natrijum hlorida, koncentracija hidroksilnih jona je oko 1 10 - 7 g-ekv/l. Na 25°C, ravnotežni potencijal za pražnjenje hidroksidnih jona bit će
Ravnotežni potencijal pražnjenja, joni klorida pri koncentraciji NaCI u rastvoru od 4,6 g-ekv/l jednaki
Stoga, na anodi s malim prenaponom, prvo treba isprazniti kisik.
Međutim, na grafitnim anodama prenapon kisika je mnogo veći od prenapona klora, pa će one uglavnom ispuštati C1 - ione uz oslobađanje plinovitog klora prema reakciji (a).
Oslobađanje hlora je olakšano povećanjem koncentracije NaCl u otopini zbog smanjenja vrijednosti ravnotežnog potencijala. To je jedan od razloga za korištenje koncentriranih otopina natrijum hlorida koji sadrže 310-315 g/l.
Na katodi u alkalnom rastvoru molekuli vode se ispuštaju prema jednačini
H 2 0 + e \u003d H + OH - (c)
Atomi vodika se nakon rekombinacije oslobađaju u obliku molekularnog vodika
2H Þ H 2 (d)
Pražnjenje jona natrijuma iz vodenih rastvora na čvrstu katodu je nemoguće zbog većeg potencijala njihovog pražnjenja u odnosu na vodonik. Prema tome, joni hidroksida koji ostaju u rastvoru formiraju alkalnu otopinu sa jonima natrijuma.
Proces razgradnje NaCl može se na ovaj način izraziti sljedećim reakcijama:
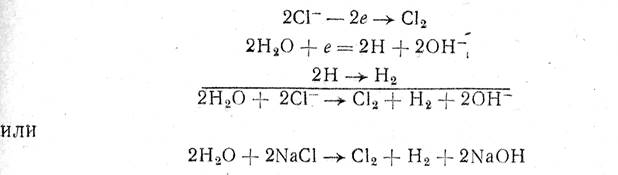
tj. na anodi nastaje hlor, a na katodi vodonik i natrijum hidroksid.
U toku elektrolize, uz glavne opisane procese, mogu se javiti i sporedni procesi, od kojih je jedan opisan jednačinom (b). Osim toga, klor koji se oslobađa na anodi se djelomično otapa u elektrolitu i hidrolizira reakcijom
U slučaju difuzije alkalija (OH - jona) na anodu ili pomicanja katode i anodnih proizvoda, hipohlorni i hlorovodonične kiseline neutralizira se alkalijom da nastane hipohlorit i natrijum hlorid:
NOS1 + NaOH \u003d NaOCl + H 2 0
HC1 + NaOH \u003d NaCl + H 2 0
Joni ClO - na anodi se lako oksidiraju u ClO 3 - . Zbog toga će se hipohlorit, natrijum hlorid i natrijum hlorat generisati usled sporednih procesa tokom elektrolize, što će dovesti do smanjenja strujne efikasnosti i energetske efikasnosti. U alkalnom okruženju, oslobađanje kiseonika na anodi je olakšano, što će takođe pogoršati performanse elektrolize.
Za smanjenje curenja neželjene reakcije, treba stvoriti uslove da se spriječi miješanje katodnih i anodnih proizvoda. To uključuje razdvajanje katodnog i anodnog prostora dijafragmom i filtraciju elektrolita kroz dijafragmu u smjeru suprotnom kretanju OH - jona prema anodi. Takve dijafragme se nazivaju filter dijafragme i napravljene su od azbesta.
Povećanje temperature elektrolize i koncentracije NaCl u elektrolitu, zbog čega se smanjuje topljivost klora, kao i smanjenje koncentracije NaOH u katolitu, smanjuju vjerojatnost sporednih procesa.
Povećanje temperature elektrolize povećava ne samo efikasnost struje, već i električnu provodljivost elektrolita, čime se smanjuje napon na kadi. Dakle, povećanje temperature smanjuje potrošnju električne energije i stoga se obično elektroliza otopina natrijevog klorida provodi na 70-80 ° C.
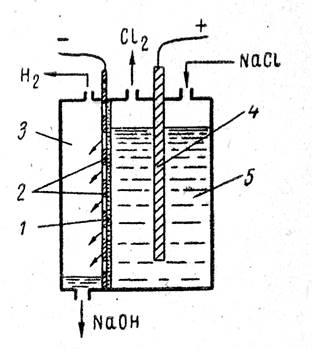
Industrijski elektrolizatori sa filterskom dijafragmom imaju široku primjenu u industriji. Dijagram takve kupke prikazan je na sl. 1 Kupatilo ima čeličnu perforiranu (sa rupom) katodu i grafitnu anodu. Filterska dijafragma od azbestnog kartona čvrsto je pričvršćena na katodu.
 Rastvor natrijum hlorida se dovodi u anodni prostor, filtrira kroz dijafragmu i dolazi do katode. Brzinu filtracije elektrolita karakterizira takozvano curenje dijafragme v
(cm 3 /h) i ovisi o površini poprečnog presjeka dijafragme F
(vidi 1), hidrostatički pritisak kolone elektrolita h
,
debljina dijafragme b (cm) i viskozitet elektrolita μ.
Rastvor natrijum hlorida se dovodi u anodni prostor, filtrira kroz dijafragmu i dolazi do katode. Brzinu filtracije elektrolita karakterizira takozvano curenje dijafragme v
(cm 3 /h) i ovisi o površini poprečnog presjeka dijafragme F
(vidi 1), hidrostatički pritisak kolone elektrolita h
,
debljina dijafragme b (cm) i viskozitet elektrolita μ.
Prolaskom jednosmjerne električne struje na anodi nastaje hlor, a na katodi nastaju vodik i lužina, koja, prolazeći kroz rupe katode, teče u katodni prostor i uklanja se iz kupke.
Dijagram kade sa filterskom dijafragmom:
1- dijafragma; 2 - čelična katoda;
3 - katodni prostor;
4 - anoda; 5 - anodni prostor
U kupkama ne dolazi do potpunog razlaganja kuhinjske soli i
uspostavlja se konstantna koncentracija alkalija i nerazgrađene kuhinjske soli.
Elektrolitička tečnost koja teče iz kupke sadrži 110-120 g/l NaOH i 180-170 g/l NaCl.
Industrijski elektrolizatori bi trebali imati veću produktivnost, što se postiže povećanjem opterećenja. Upotreba katoda sa vrlo razvijenom površinom omogućava stvaranje kompaktnih elektrolizera sa opterećenjem do 50.000 a. U ovom slučaju, dijafragma se usisava ili "talaže" na površini katode iz suspenzije azbestnih vlakana u hlorovodoničnim-alkalnim rastvorima pomoću vakuuma.

Rice. 2. Kupatilo sa deponovanom dijafragmom:
1- betonsko dno; 2 - čelična katoda; 3 - betonski poklopac; 4 - cijev za dovod slane vode; 5 - cijev za uklanjanje hlora; 6 - grafitne anode; 7 - priključak za uklanjanje vodonika; 8 - cijev za ispuštanje elektrolitičke tekućine; 9 - bakarni provodnik
kernel
Primjer kupke s taloženom dijafragmom je kupka za Hooker tipa S, sl. 2. Ova kada se sastoji od tri glavna dijela - betonskog dna, čelične katode i betonskog poklopca. Dno ima oblik pravokutnog korita, u kojem su donji krajevi grafitnih anoda ispunjeni olovom i bakrenom šipkom koja služi za napajanje strujom. Anode su grafitne ploče. Katoda je čelični okvir unutar kojeg je montiran niz ravnih čeličnih mrežastih džepova. Položaj džepova i njihova širina su takvi da kada je katoda postavljena na dno kade, džepovi se postavljaju tačno između anoda.
Na poklopcu kade postoje otvori za dovod slane vode i uklanjanje hlora. Elektrolizer ima toplinsku izolaciju koja smanjuje gubitke energije zbog prijenosa topline u okolinu.
Elektroliza rastvora natrijum hlorida u kupkama sa živinom katodom i grafitnom anodom.
Daje priliku da dobijete više koncentrisanih proizvoda, nego u kupkama sa dijafragmom.
Kada se konstantna električna struja propušta kroz otopinu NaCl, dolazi do pražnjenja C1 jona na grafitnoj anodi, nakon čega slijedi oslobađanje plinovitog klora.
2C1 - - 2nd Y S1 2
Na živinoj katodi dolazi do evolucije vodonika sa velikim prenaponom. Ako je na željeznoj katodi potencijal za evoluciju vodika iz neutralne otopine 0,415 u, tada je na živinoj katodi 1,7 - 1,85 in. Natrijum se oslobađa na živi sa velikim efektom depolarizacije zbog stvaranja natrijevog amalgama NaHg n, koji se rastvara u višku žive. Zbog toga je potencijal natrijumovog pražnjenja na živinoj katodi manji od ravnotežnog, odnosno 1,2 V, dok je njegov ravnotežni potencijal 2,71 in. Dakle, na živinoj katodi se odvijaju sljedeći procesi:
Na + + eÞ Na
Na+ n H g= NaHg n
i skoro da se ne oslobađa vodonik.
Natrijev amalgam se razgrađuje u posebnom aparatu - razlagaču s vodom prema reakciji
NaHg n + H 2 0 = NaOH + 1/2H 2 + nHg
Elektroliza u kadi sa živinom katodom teče u prosjeku na naponu od 4,3-4,4 in.
Kupka sa živinom katodom, čiji je shematski dijagram prikazan na sl. 3, sastoji se od dva dijela: elektrolizera i razlagača.
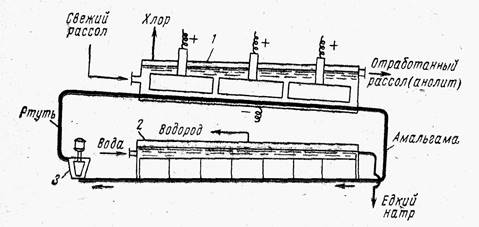 Elektrolizator i razlagač mogu biti strukturno odvojeni i međusobno komunicirati putem cjevovoda ili mogu biti smješteni u jednom zajedničkom kućištu.
Elektrolizator i razlagač mogu biti strukturno odvojeni i međusobno komunicirati putem cjevovoda ili mogu biti smješteni u jednom zajedničkom kućištu.
U svakom slučaju, ćelija je duga kutija pravokutnog poprečnog presjeka, zatvorena odozgo poklopcem, u koju su učvršćene grafitne anode. Rice. 3. Šema kupke sa živinom katodom:
1- elektrolizer; 2 - razlagač; 3 - pumpa
Na blago nagnuto dno kupke spojena je katodna magistrala, a duž nje se kontinuirano kreće tanak sloj žive. Dakle, dno kupke je katoda. Elektrolizer se napaja koncentrovanim (310-315 g/l) rastvor natrijum hlorida koji se u procesu elektrolize iscrpljuje kuhinjskom soli do koncentracije od 260-270 g/l, uklanja se iz kupke, dehloriše se pod vakuumom i duva komprimovanim vazduhom, zasićen je solju, čisti se od nečistoća (nije prikazano na dijagramu) i vraća se na elektrolizu. Nastali hlor se uklanja kroz poklopac kupke.
Kada se živa kreće duž dna ćelije tokom elektrolize, dobija se natrijum amalgam, koji se rastvara u živi i uklanja iz ćelije u razlagač. Dekompozitori mogu biti razni dizajni- horizontalno i vertikalno. Horizontalni razlagači su pravougaoni žlijeb zatvoren poklopcem. Voda ulazi u razlagač i iz njega se uklanjaju nastali proizvodi - vodik i alkalije. Dno razlagača ima blagi nagib, zbog čega se živa kreće po dnu, uklanja se iz dekompozitora i liftovima razne vrste prenosi u elektrolizer.
Kupka sa živinom katodom zauzima velike površine zbog horizontalnog rasporeda živine katode. Postoje kupke u kojima kao katode služe vertikalni spojeni diskovi. Ove kupke su kompaktne, ali složene u dizajnu i radu.
Usporedba glavnih pokazatelja performansi dvije vrste kupki pokazuje da je, zbog visokog napona u kupkama sa živinom katodom, potrošnja energije veća nego u membranskim kupkama. Osim toga, živine katodne kupke su teže za rukovanje od membranskih kupki, kapitalni troškovi za njihovu ugradnju su veći, a uslovi rada u radnjama opremljenim živinim kupkama su teži nego u radnjama u kojima su ugrađene membranske kupke.
Mogućnost dobijanja koncentriranih likera bez kuhinjske soli u živinim kupkama je suštinska prednost živinih kupki. Na osnovu toga, u svim slučajevima kada je potrebna čista alkalija (na primjer, za proizvodnju viskoznih vlakana), prednost treba dati kupkama sa živinom katodom. Zbog sve veće potražnje za čistim kaustikom, elektroliza u kupkama sa živinom katodom je postala široko rasprostranjena.
Alkalije dobijene elektrolizom, u obliku rastvora, podvrgavaju se koncentraciji u isparivačima. Alkalije iz dijafragmalnih kupki sadrže do 130-140 g/l NaOH i 180-170 g/l NaCl. Rastvorljivost kuhinjske soli opada s povećanjem koncentracije NaOH u otopini. Dakle, u lužini koja sadrži 50% (769 g/l) NaOH, na 20°C rastvorljivost NaCl je 13,9 g/l. Kao rezultat toga, tijekom isparavanja elektrolitičkih tekućina dobivenih u kupkama s dijafragmom, zajedno s koncentracijom otopine, dolazi do kristalizacije natrijevog klorida, koji se vraća u elektrolizu. Praktično nakon isparavanja i topljenja dobija se alkalija koja sadrži 92-94% NaOH, 2-3% NaCl.
Zaključak.
Dakle, natrijum hidroksid se trenutno proizvodi elektrolizom. vodeni rastvor natrijum hlorida. U ovom slučaju koriste se dvije vrste elektrolizera, od kojih svaki ima svoje prednosti i nedostatke. Ali u oba slučaja, proces dobijanja natrijum hidroksida je praćen proizvodnjom gasovitih nusproizvoda, koji su opasne supstance i za ljude i za ljude. okruženje. Stoga je u ovoj proizvodnji potrebno poštovati posebne sigurnosne mjere.
Književnost.
1. Opća hemijska tehnologija. Ed. I.P. Mukhlenov. Udžbenik za hemijsko-tehnološke specijalnosti univerziteta. M.: Viša škola.
2. Furmer I.E., Zaitsev V.N. Opća hemijska tehnologija. - M.: Viša škola, 1978.
Pronalazak se odnosi na hemijska industrija i može se koristiti u proizvodnji sapuna, boja, celuloze i drugim industrijama. Metoda uključuje dobijanje taline CaO·Na 2 O prženjem otpada proizvodnje sode sode koji sadrži CaO, CaCO 3 i Na 2 CO 3 na temperaturi od 1000-1100°C, nakon čega slijedi ispiranje i isparavanje formiranog natrijum hidroksida. Kalcijum hidroksid dobijen u fazi luženja podvrgava se karbonizaciji sa ugljičnim dioksidom koji se oslobađa u fazi dobijanja taline. Predložena metoda omogućava povećanje koncentracije natrijevog hidroksida u ciljnom proizvodu i odlaganje otpada iz proizvodnje sode pepela. 3 w.p. f-ly, 1 ill., 1 tab.
Pronalazak se odnosi na hemijsku industriju, a posebno na tehnologiju za proizvodnju natrijum hidroksida, koji se široko koristi u proizvodnji sapuna, boja, celuloze i drugim industrijama.
Čak i iz školskih udžbenika poznate su metode za dobivanje kaustične sode, na primjer, prema sljedećim reakcijama:
Na+HOH=NaOH+½H 2
[G. Remy. Kurs neorganske hemije. T.I, Izdavačka kuća strane književnosti, M., 1963].
Kaustična soda se dobija ili elektrolizom vodenih rastvora natrijum hlorida, ili hemijskim metodama.
Prilikom elektrolize vodenih otopina natrijum hlorida nastaje lužina: oslobađanje hlora na anodi i vodonika na katodi dovodi do povećanja koncentracije jona OH u katodnom prostoru. U industriji se za dobivanje kaustične sode i hlora koriste dvije vrste kupki: sa čvrstim elektrodama i tekućim elektrolitom koji se kreće od anode do katode (živine katode) [Kratka kemijska enciklopedija. Ed. " Sovjetska enciklopedija“, v.3, M., 1964, str.376-377].
Prema metodi dobijanja kaustične sode, opisanoj u knjizi "Tehnologija proizvoda od sode" [S.V. Belenky, S.M. Round, S.K. Sekovanny - Ed. "Chemistry", M., 1972, str. 205-258] kao rezultat elektrolize u dijafragmskim kupkama sa čvrstom katodom, dobijaju se elektrolitička alkalija, hlor i vodonik. Tehnološka shema procesa u radionici elektrolize data je u istom literarnom izvoru na stranicama 250-253. Elektrolitička alkalija dobijena u radnji elektrolizera, koja sadrži 110-135 g/l natrijum hidroksida i 170-190 g/l neraspadnutog natrijum hlorida, pumpa se u isparivačku radnju, gde se nalazi do 42-50% komercijalnog natrijum hidroksida. koncentrirano.
Proizvodnja natrijum hidroksida metodom elektrolize sa čvrstom katodom, koja se koristi kao živa, vrši se u mnogim industrijska preduzeća, posebno u gradu Sterlitamak u udruženju "Kaustik".
Glavni nedostatak gornje metode je korištenje živine katode, kao i oslobađanje velike količine klora kao nusproizvoda, koji je ekološki nesiguran.
Poznata metoda za proizvodnju natrijum hidroksida elektrolizom vodenog rastvora natrijum hlorida na povišenoj temperaturi u elektrolitičkoj ćeliji sa filterskom membranom koja odvaja anolit i katolit uz kontinuirano punjenje anolita pročišćenom koncentrovanom zagrijanom rastvorom natrijum hlorida do temperature od 35-80°C, prvo pri pH rastvora natrijum hlorida 2-3, tokom 24-48 sati, a zatim pri pH od 3,5-5,0.
Nedostaci poznatih metoda također bi trebali uključivati relativno nisku koncentraciju rezultirajućeg natrijum hidroksida.
Za povećanje koncentracije natrijum hidroksida predlaže se metoda za proizvodnju natrijum hidroksida koja uključuje elektrolizu obične soli, isparavanje elektrolitičke alkalije u prvoj fazi do koncentracije natrijum hidroksida u rastvoru od 22-30%, odvajanje soli. kristali uz naknadno isparavanje lužine, miješanje odstranjenog rastvora natrijum hidroksida koji sadrži sol i kristala natrijum sulfata sa ohlađenim rastvorom, dovođenje dela ohlađenog rastvora za mešanje sa jednim odstranjenim rastvorom natrijum hidroksida, odvajanje dobijenog ciljanog produkta.
Nedostaci poznatih metoda također treba uključiti nisku koncentraciju i čistoću rezultirajućeg natrijum hidroksida zbog sadržaja natrijum sulfata.
Poznata je poboljšana metoda za proizvodnju vodenog natrijum hidroksida, uključujući elektrolizu dovođenjem vodenog rastvora natrijum karbonata u anodnu komoru, a voda se dovodi u katodnu komoru, gde se kao anode koriste platina, platinizovani titan, titan prevučen oksidom platine. .
Ova metoda također karakterizira proizvodnja natrijum hidroksida u niskoj koncentraciji i, osim toga, skupa je zbog upotrebe skupih platinastih materijala, što omogućava primjenu ove metode u preparativnim primjenama.
Od hemijskih metoda poznata je feritna metoda za proizvodnju kaustične sode, koja se sastoji u kaustifikaciji natrijevog karbonata interakcijom sa željeznim oksidom na temperaturi od 1000-1100 °C, nakon čega slijedi gašenje, luženje rezultirajućeg natrijum ferita sa vode
[S.V. Belenky, S.M. Krugly, S.K. Sekovanny. Tehnologija soda proizvoda. Ed. "Hemija", M., 1972, str. 285-287] ili rastvor natrijum hidroksida koji sadrži 200-360 g/l NaOH.
Nedostaci feritne metode za proizvodnju natrijevog hidroksida uključuju neekonomičnost procesa zbog trajanja razgradnje natrijum ferita do ravnotežnog stanja, što zahtijeva opremu velikog kapaciteta i proces pri ključanju, što predstavlja određenu poteškoću.
Od hemijskih metoda najčešća je vapnena metoda za proizvodnju kaustične sode.
Metoda se temelji na reakciji interakcije otopine sode s gašenim vapnom ili krečnim mlijekom (kaustifikacija):
Ravnoteža reakcije je pomjerena prema stvaranju NaOH zbog slabe rastvorljivosti CaCO 3 . Ovako tretirana soda postaje kaustična (kaustična). Stoga se natrijum hidroksid dobijen na ovaj način naziva kaustična soda (obično 12-15%) [NS Akhmetov. Neorganska hemija. M.: Viša škola, 1975, str. 591-592].
Opskrba vapnom za kaustifikaciju vapnenog mlijeka omogućava vam korištenje topline gašenja CaO. Osim toga, koncentrisaniji rastvor natrijum hidroksida nastaje usled povlačenja iz procesa vode koja dolazi sa krečnim mlekom [IN Shokin, SA Krasheninnikov. soda tehnologija. M.: Hemija, 1975, str.205].
U istom izvoru, na stranicama 218-220, dat je opis tehnološka šema proizvodnja kaustične sode metodom vapna, uključujući interakciju spaljenog vapna sa rastvorom sode.
Glavni nedostatak ove metode je niska koncentracija nastali natrijum hidroksid i složenost tehnologije povezana sa koncentracijom natrijum hidroksida, što generalno povećava njegovu cenu.
Poznata je metoda za proizvodnju natrijum hidroksida reakcijom natrijum hidroksida sa vapnom, nakon čega sledi isparavanje nastalih tečnosti, odvajanje rastvora natrijum hidroksida.
Poznata je i metoda za proizvodnju natrijum hidroksida reakcijom normalnog rastvora sode sa krečnim mlekom u tri faze, nakon čega sledi isparavanje bistrene tečnosti prve i druge faze, a istaložene soli se mešaju sa suspenzijom treće faze kaustifikacije. i filtrat, odvajanje i ispiranje sode i kaustične sode iz suspenzija sa njihovim prelaskom u rastvor.
Nedostatak ove metode je nizak stepen regeneracije sode i kaustične sode (96,0-96,5%), kao i visok sadržaj natrijum sulfata koji se šalje na deponiju, a rezultat je niska koncentracija ciljne kaustične sode. .
Najbliže tehničko rešenje prototipu je metoda za proizvodnju natrijum hidroksida, uključujući interakciju natrijum karbonata sa vapnom, karbonizaciju vapna, odvajanje nastalog kalcijum karbonata, natrijum hidroksida, isparavanje rastvora natrijum hidroksida RU br. 2143398, IPC C 01 D 1/22, C 01 F 11 /18, 1995.].
Nedostaci poznate metode uključuju glavni nedostatak - malu koncentraciju rezultirajućeg natrijevog hidroksida, kao i visoku cijenu proizvoda dobivenih zbog upotrebe skupih sirovina.
Cilj izuma je razviti metodu za proizvodnju natrijum hidroksida korišćenjem jeftinih sirovina, povećanje koncentracije natrijum hidroksida u ciljnom proizvodu, recikliranje otpada proizvodnje sode.
Zadatak se postiže činjenicom da se talina CaO·Na 2 O, prethodno dobijena prženjem otpada proizvodnje sode sode koji sadrži CaO, CaCO 3 i Na 2 CO 3 , dovodi na ispiranje na temperaturi od 1000-1100°C, a isparavanje dobivene tekućine vrši se do koncentracije natrijum hidroksida ne manje od 40 mas.%, a nastali kalcijev hidroksid u fazi ispiranja se podvrgava karbonizaciji sa ugljičnim dioksidom koji se oslobađa u fazi dobijanja taline. .
Otpad od proizvodnje sode, koji nije našao široku kvalificiranu upotrebu, koristi se kao početni proizvodi koji se isporučuju za pečenje:
Kalcijum karbonat - mali "podgriz" (10-40 mm) nakon spaljivanja krečnjaka u pećima;
Kreč - otpad nakon peći;
Nestandardni natrijev karbonat (na primjer, razred "B")
Proces se izvodi na sljedeći način (crtanje).
Otpad od proizvodnje sode sode - otpad koji sadrži kalcij - nepal - sa gotovo konstantnim sadržajem CaCO 3 60-70%, veličine komada od 10-40 mm, kao i podstandardni Na 2 CO 3 (npr. , razred B) sa sadržajem Na 2 CO 3 99,2% i kreč nakon peći sa sadržajem CaO od 60-80% - u stehiometrijskom omjeru iz posuda 1-3 se ubacuju za miješanje i granulaciju u granulator 4.
Dobijene granule (veličine granula 5-30 mm) se zatim ubacuju u peć za pečenje 5. Granule se peku na temperaturi od 1000-1100°C 1,5-2,0 sata u struji dimnih gasova.
Primljeno topljenje CaO Na 2 O poslat na ispiranje u mlin sa kuglicama 6 na temperaturi od 80-95°C
Dobijeni natrijum hidroksid nakon odvajanja u radijalnom taložniku 7 kalcijum hidroksida se dovodi na isparavanje u postrojenje za isparavanje 8. Ciljni natrijum hidroksid se dobija u koncentraciji od 40%. Da bi se dobio natrijum hidroksid veće koncentracije, vrši se dodatno isparavanje u aparatu 9.
A izolovani kalcijum hidroksid iz taložnika 7 dovodi se u interakciju sa ugljičnim dioksidom koji nastaje kao rezultat prženja taline (I) u karbonizator 10, nakon čega se nastali kalcijum karbonat dovodi u vakuum filter 11, a zatim u sušaru 12 na sušenje, nakon čega - u skladište gotovih proizvoda.
Suštinu metode potvrđuju sljedeći primjeri.
Iz bunkera 1, iz bunkera 1 sa sadržajem CaCO 3 od 60 tež.% u količini od 71,4 kg, iz bunkera 3 marke sode sode, nedostajalo je vapno nakon pečenja sa 60 tež. % CaO u količini od 40 kg. B" sa sadržajem Na 2 CO 3 99,2 tež.% u količini od 100 kg se ubacuje u granulator 4 za granulaciju. 5 č. Zatim se dobijena talina dovodi u luženje, koje se vrši dovodom vode u kuglični mlin 6. Ispiranje se vrši na temperaturi od 90°C. Kao rezultat luženja dobija se natrijum hidroksid 300 kg koncentracije 25% i kalcijum hidroksid u količini od 111,6 kg. Natrijum hidroksid se usmerava na isparavanje i dobija se ciljna koncentracija natrijum hidroksida od 40%. A kalcijum hidroksid u količini od 111,6 kg sa sadržajem vlage od 45% se dovodi u karbonizator 10, gde se ugljični dioksid takođe dovodi nakon peći za pečenje 5. Dobijena suspenzija kalcijum karbonata se dovodi u vakuum filter 11, a zatim u sušaru 12. 150 kg kalcijum karbonata sa sadržajem glavne supstance 92%.
Ostali primjeri su prikazani u tabeli.
Na osnovu navedenih podataka može se vidjeti da je predložena metoda za proizvodnju natrijum hidroksida bez otpada i da će omogućiti dobijanje natrijum hidroksida visoke koncentracije. Osim toga, dobiva se kalcijum karbonat visoke čistoće, koji se može koristiti u medicini, za proizvodnju zubnih pasta. A također će predložena metoda omogućiti odlaganje otpadnih proizvoda iz proizvodnje sode, koji se trenutno nedovoljno vješto koriste.
| Table | ||||||||||||
| Primjer br. | Početne komponente, 1:1:1 (mol) po glavnoj supstanci | Temperatura pečenja, °S | Faza luženja | Parking stage | faza karbonizacije | |||||||
| nije uspio | kreč - posle peći | kalcijum soda (marka "B") | Količina plovka, kg | T-ra, °S | Količina NaOH, kg | Sa NaOH (dobijeno), % | T-ra, °S | C NaOH, (konačno), % | Količina Ca (OH) 2, kg | Količina CaCO 3, kg | ||
| 2 | 71,4 | 40 | 100 | 1000 | 186 | 80 | 322 | 25 | 80 | 40 | 111,6 | 150 |
| 3 | 80,4 | 45 | 100 | 1100 | 180 | 90 | 320 | 23 | 90 | 40 | 112,0 | 155 |
| 4 | 71,4 | 50 | 100 | 1050 | 184 | 95 | 323 | 20 | 85 | 40 | 111,6 | 155 |
| 5 | 70,0 | 50 | 150 | 1150 | Dolazi do sinterovanja i talina se ne istovaruje | |||||||
| 6 | 71,4 | 40 | 100 | 950 | Nedovoljna temperatura za formiranje taline | |||||||
| 7 | 71,4 | 45 | 100 | 1050 | 186 | 90 | 321 | 25 | 85 | 40 | 112,1 | 154 |
1. Metoda za proizvodnju natrijum hidroksida, uključujući interakciju natrijum karbonata sa vapnom, nakon čega sledi luženje dobijene smeše, isparavanje dobijene tečnosti i izolovanje ciljnog produkta, kao i dodatno dobijenog kalcijum karbonata, naznačen time što je CaO Na 2 O talina, prethodno dobijena, se dovodi u luženje spaljivanjem otpada proizvodnje sode sode koji sadrži CaO, CaCO 3 i Na 2 CO 3 na temperaturi od 1000-1100 °C, a nastala tečnost se isparava do koncentracije natrijum hidroksida od najmanje 40 tež.%, a nastali kalcijum hidroksid se podvrgava luženju u fazi luženja karbonizacije sa ugljičnim dioksidom koji se oslobađa u fazi dobijanja taline.
2. Postupak prema patentnom zahtjevu 1, naznačen time što se kao otpad od proizvodnje sode pepela koristi fini "nedopal" koji nastaje u fazi prženja kalcijum karbonata, frakcije 5-30 mm sa CaCO 3 sadržaja 60-70%, živog kreča nakon pečenja u pećima sa sadržajem CaO od 60-80%, kao i otpad iz proizvodnje sode pepela sa sadržajem Na 2 CO 3 od najmanje 92%.
3. Metoda prema zahtjevima 1 i 2, naznačena time, da se za dobivanje taline CaO Na 2 O, otpad od proizvodnje sode - "nepalo", živo vapno i podstandardni Na 2 CO 3 - prethodno miješaju u stehiometrijskom režimu. odnos, granulirano na veličinu granula 5-30 mm.
4. Postupak prema zahtjevima 1 i 2, naznačen time, što se ispiranje taline CaO·Na 2 O vrši vodom na temperaturi od 80-95°C.
Hemijske metode za proizvodnju natrijum hidroksida uključuju vapnenac i ferit.
Hemijske metode za proizvodnju natrijevog hidroksida imaju značajne nedostatke: troši se puno energetskih nosača, a rezultirajuća kaustična soda je jako kontaminirana nečistoćama.
Danas su ove metode gotovo potpuno zamijenjene metodama elektrohemijske proizvodnje.
metoda kreča
Metoda vapna za proizvodnju natrijevog hidroksida sastoji se u interakciji otopine sode s gašenim vapnom na temperaturi od oko 80 ° C. Ovaj proces se naziva kaustika; prolazi kroz reakciju:
N / A 2 SO 3 + Ca(OH) 2 = 2NaOH + CaCO 3
Kao rezultat reakcije dobivaju se otopina natrijum hidroksida i talog kalcijum karbonata. Kalcijum karbonat se odvaja iz rastvora, koji se isparava da bi se dobio rastopljeni proizvod koji sadrži oko 92% mase. NaOH. Nakon toga se NaOH topi i sipa u gvozdene bubnjeve, gde se skrućuje.
feritna metoda
Feritna metoda za proizvodnju natrijum hidroksida sastoji se od dvije faze:
N / A 2 SO 3 + Fe 2 O 3 = 2NaFeO 2 + CO 2
2NaFeO 2 +xH 2 O = 2NaOH + Fe 2 O 3 *xH 2 O
Reakcija 1 je proces sinterovanja sode pepela sa željeznim oksidom na temperaturi od 1100-1200 °C. Osim toga, formira se natrijeva mrlja i oslobađa se ugljični dioksid. Zatim se kolač tretira (luži) vodom prema reakciji 2; dobijaju se rastvor natrijum hidroksida i talog Fe 2 O 3 *xH 2 O, koji se nakon odvajanja iz rastvora vraća u proces. Dobijeni alkalni rastvor sadrži oko 400 g/l NaOH. Ispari se da se dobije proizvod koji sadrži oko 92% mase. NaOH, a zatim se dobije čvrsti proizvod u obliku granula ili pahuljica.
Elektrohemijske metode za proizvodnju natrijum hidroksida
Elektrohemijski se dobija natrijum hidroksid elektroliza rastvora halita(mineral koji se sastoji uglavnom od kuhinjske soli NaCl) uz istovremenu proizvodnju vodonika i hlora. Ovaj proces se može predstaviti zbirnom formulom:
2NaCl + 2H 2 Oko ±2e - → H 2 +Cl 2 + 2NaOH
Kaustična alkalija i hlor se proizvode pomoću tri elektrohemijske metode. Dvije od njih su elektroliza sa čvrstom katodom (metode dijafragme i membrane), treća je elektroliza sa tečnom živinom katodom (živa metoda).
Sve tri metode dobijanja hlora i kaustika koriste se u svetskoj proizvodnoj praksi, sa jasnim trendom povećanja udela membranske elektrolize.
7. Prečišćavanje sumpor-dioksida od katalitičkih otrova.
Emisije gasova veoma nepovoljno utiču na ekološku situaciju na lokacijama ovih industrijskih preduzeća, a takođe pogoršavaju sanitarno-higijenske uslove rada. Agresivne masovne emisije uključuju dušikove okside, vodonik sulfid, sumpor dioksid, ugljični dioksid i mnoge druge plinove.
Na primjer, dušična kiselina, sumporna kiselina i druge biljke u našoj zemlji godišnje ispuštaju u atmosferu desetine miliona kubnih metara dušikovih oksida, koji su jak i opasan otrov. Iz ovih oksida azota moglo bi se proizvesti hiljade tona azotne kiseline.
Jednako važan zadatak je i pročišćavanje plinova od sumpor-dioksida. Ukupna količina sumpora koja se u našoj zemlji emituje u atmosferu samo u obliku sumpordioksida iznosi oko 16 miliona tona . u godini. Od ove količine sumpora može se proizvesti do 40 miliona tona sumporne kiseline.
Značajna količina sumpora, uglavnom u obliku vodonik sulfida, sadržana je u koksnom plinu.
Sa dimnim plinovima iz fabričkih cijevi i elektrana, svake godine se u atmosferu ispusti nekoliko milijardi kubnih metara ugljičnog dioksida. Ovaj gas se može koristiti za proizvodnju efikasnih ugljenih đubriva.
Navedeni primjeri pokazuju kakve se ogromne materijalne vrijednosti emituju u atmosferu sa gasovitim emisijama.
Ali ove emisije izazivaju ozbiljniju štetu trovanjem vazduha u gradovima i preduzećima: otrovni gasovi uništavaju vegetaciju, izuzetno štetno utiču na zdravlje ljudi i životinja, uništavaju metalne konstrukcije i korodiraju opremu.
Iako u poslednjih godina domaća industrijska preduzeća ne rade punim kapacitetom, ali je problem suzbijanja štetnih emisija veoma akutan. A uzimajući u obzir opću ekološku situaciju na planeti, potrebno je poduzeti najhitnije i najradikalnije mjere za pročišćavanje izduvnih plinova od štetnih nečistoća.
Katalitički otrovi
kontaktni otrovi, tvari koje uzrokuju "trovanje" katalizatora (vidi. Katalizatori) (obično heterogene), odnosno smanjuju njihovu katalitičku aktivnost ili potpuno zaustavljaju katalitičko djelovanje. Trovanje heterogenih katalizatora nastaje kao rezultat adsorpcije otrova ili produkta njegove kemijske transformacije na površini katalizatora. Trovanje može biti reverzibilno ili nepovratno. Dakle, u reakciji sinteze amonijaka na željeznom katalizatoru, kisik i njegovi spojevi reverzibilno truju Fe; u ovom slučaju, kada se izloži čistoj mješavini N 2 + H 2, površina katalizatora se oslobađa kisika i trovanje se smanjuje. Jedinjenja sumpora nepovratno truju Fe; djelovanje čiste mješavine ne uspijeva vratiti aktivnost katalizatora. Da bi se spriječilo trovanje, reakciona smjesa koja se dovodi u katalizator temeljito se pročišćava. Među najčešćim K. I. metalni katalizatori uključuju supstance koje sadrže kiseonik (H 2 O, CO, CO 2), sumpor (H 2 S, CS 2, C 2 H 2 SH, itd.), Se, Te, N, P, As, Sb, kao i kao nezasićeni ugljovodonici (C 2 H 4 , C 2 H 2 ) i ioni metala (Cu 2+, Sn 2+, Hg 2+, Fe 2+, Co 2+, Ni 2+). Kiseli katalizatori se obično trovaju baznim nečistoćama, dok su bazični katalizatori otrovani kiselim nečistoćama.
8. Dobijanje azotnih gasova.
Oksidi dušika koji se oslobađaju nakon izbjeljivanja kondenziraju se u kondenzatorima vode i slane vode i koriste se za pripremu sirove mješavine. Pošto je tačka ključanja N 2 O 4 20,6 °C pri pritisku od 0,1 MPa, pod ovim uslovima, gasoviti NO 2 može biti potpuno kondenzovan (pritisak zasićene pare N 2 O 4 na 21,5 °C nad tečnim N 2 O 4 jednak 0,098 MPa, odnosno manji od atmosferskog). Drugi način za dobivanje tekućih dušikovih oksida je njihova kondenzacija pod pritiskom i na niskoj temperaturi. Ako se prisjetimo da tijekom kontaktne oksidacije NH 3 pri atmosferskom tlaku, koncentracija dušikovih oksida nije veća od 11% vol., Njihov parcijalni tlak odgovara 83,5 mm Hg. Pritisak azotnih oksida iznad tečnosti (pritisak pare) na temperaturi kondenzacije (–10 °C) je 152 mm Hg. To znači da se bez povećanja tlaka kondenzacije iz ovih plinova ne mogu dobiti tekući dušikovi oksidi, pa kondenzacija dušikovih oksida iz takvog azotnog plina na temperaturi od –10 °C počinje pri tlaku od 0,327 MPa. Stupanj kondenzacije naglo raste s povećanjem tlaka do 1,96 MPa, s daljnjim povećanjem tlaka, stupanj kondenzacije se neznatno mijenja.
Prerada azotnog gasa (tj. nakon konverzije NH 3) u tečne azotne okside je neefikasna, jer čak i kod R=2,94 MPa stepen kondenzacije je 68,3%.
U uslovima kondenzacije čistog N 2 O 4 hlađenje se ne sme vršiti ispod temperature od -10°C, jer na –10,8 °S N 2 O 4 kristalizira. Prisustvo nečistoća NO, NO 2 , H 2 O smanjuje temperaturu kristalizacije. Dakle, mješavina sastava N 2 O 4 + 5% N 2 O 3 kristalizira na -15,8 °C.
Rezultirajući tečni dušikovi oksidi se pohranjuju u čeličnim rezervoarima.
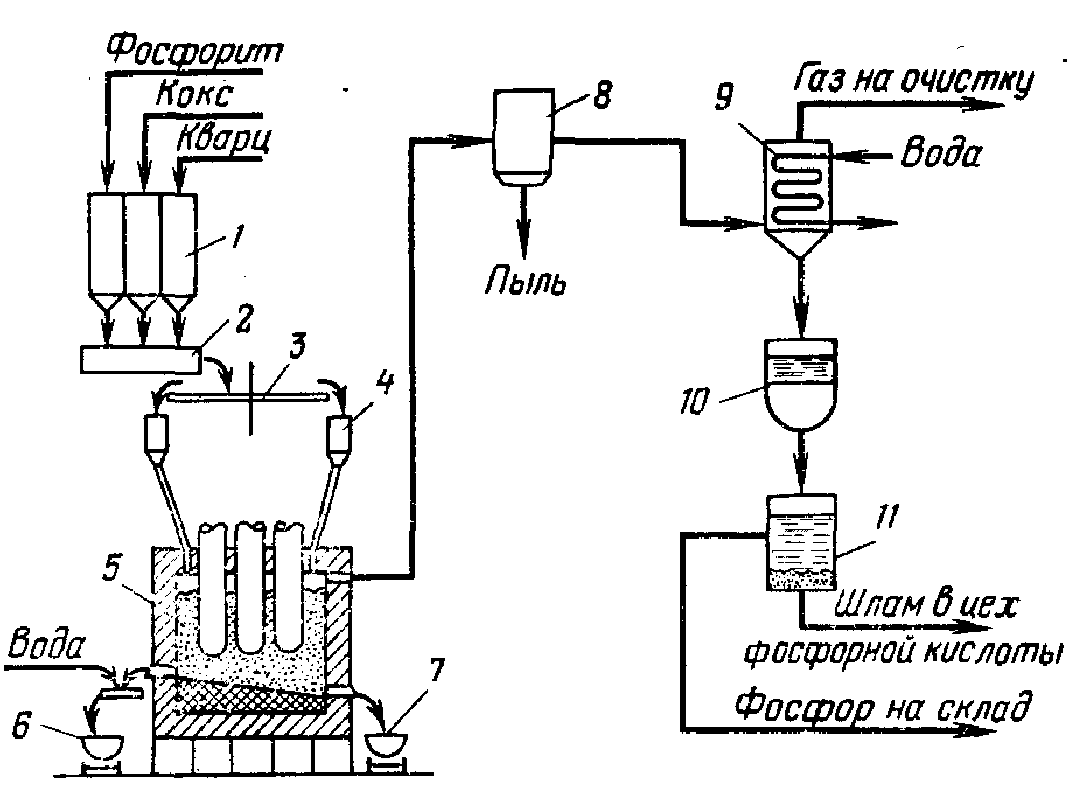
9. Dobivanje jednostavnog i dvostrukog superfosfata
"Superfosfat" - mješavina Ca (H 2 PO 4) 2 * H 2 O i CaSO 4. Najčešće jednostavno mineralno fosforno gnojivo. Fosfor u superfosfatu je uglavnom prisutan u obliku monokalcijum fosfata i slobodne fosforne kiseline. Đubrivo sadrži gips i druge nečistoće (gvožđe i aluminijum fosfate, silicijum dioksid, jedinjenja fluora, itd.). Jednostavan superfosfat se dobija iz fosforita tretiranjem sumpornom kiselinom, prema reakciji:
Sa 3 (RO 4 ) 2 + 2H 2 SO 4 = Sa(H 2 PO 4 ) 2 + 2CaSO 4 .
Jednostavan superfosfat- sivi prah, gotovo se ne zgrudva, umjereno disperzivan; u đubrivu 14-19,5% P 2 O 5 probavljivog od strane biljaka. Suština proizvodnje jednostavnog superfosfata je pretvaranje prirodnog fluorapatita, nerastvorljivog u vodi i zemljišnim rastvorima, u rastvorljiva jedinjenja, uglavnom u Ca(H 2 PO 4) 2 monokalcijum fosfat. Proces dekompozicije se može predstaviti sljedećom sumarnom jednačinom:
2Ca 5 F (PO 4) 3 + 7H 2 SO 4 + 3H 2 O \u003d 3Ca (H 2 PO 4) 2 * H 2 O] + 7 + 2HF; (1) ΔN= - 227,4 kJ.
U praksi, tokom proizvodnje jednostavnog superfosfata, razgradnja se odvija u dvije faze. U prvoj fazi, oko 70% apatita reaguje sa sumpornom kiselinom. Time nastaje fosforna kiselina i kalcijum sulfat hemihidrat:
Ca 5 F (PO 4) 3 + 5H 2 SO 4 + 2,5H 2 O \u003d 5 (CaSO 4 * 0,5H 2 O) + 3H3PO 4 + HF (2)
Funkcionalna shema za dobivanje jednostavnog superfosfata prikazana je na sl. Glavni procesi se odvijaju u prve tri faze: miješanje sirovina, formiranje i očvršćavanje superfosfatne pulpe, sazrijevanje superfosfata u skladištu.
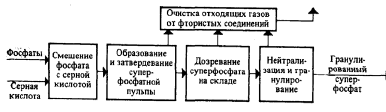
Rice. Funkcionalni dijagram proizvodnje jednostavnog superfosfata
Da bi se dobio komercijalni proizvod višeg kvaliteta, superfosfat se nakon zrenja podvrgava neutralizaciji čvrstim aditivima (vapnenac, fosfatni kamen, itd.) i granulira.
Dvostruki superfosfat- koncentrovano fosfatno đubrivo. Glavna komponenta koja sadrži fosfor je kalcijum dihidroortofosfat monohidrat Ca (H 2 PO 4) 2 H 2 O. Obično sadrži i druge kalcijum i magnezijum fosfate. U poređenju sa jednostavnim fosfatom, ne sadrži balast - CaSO 4 . Glavna prednost dvostrukog superfosfata je mala količina balasta, odnosno smanjuje troškove transporta, skladištenja, pakovanja
Dvostruki superfosfat nastaje djelovanjem sumporne kiseline H 2 SO 4 na prirodne fosfate. U Rusiji se uglavnom koristi protočna metoda: razlaganje sirovina, nakon čega slijedi granulacija i sušenje dobivene pulpe u bubanj granulatoru-sušilici. Komercijalni dvostruki superfosfat sa površine neutralizira se kredom ili NH 3 kako bi se dobio standardni proizvod. Određena količina dvostrukog superfosfata se proizvodi na komorni način. Komponente koje sadrže fosfor su u osnovi iste kao u jednostavnom superfosfatu, ali u više, a sadržaj CaSO 4 je 3-5%. Kada se zagrije iznad 135-140 °C, dvostruki superfosfat počinje da se raspada i topi u kristalizacijskoj vodi, nakon hlađenja postaje porozan i krt. Na 280-320 °C ortofosfati se pretvaraju u meta-, piro- i polifosfate, koji su u probavljivim i djelimično vodotopivim oblicima. Topi se na 980 °C, pretvarajući se nakon hlađenja u staklasti proizvod, u kojem je 60-70% metafosfata rastvorljivo u citratu. Dvostruki superfosfat sadrži 43-49% asimilabilnog fosfornog anhidrida (fosfor pentoksid) P 2 O 5 (37-43% rastvorljivo u vodi), 3,5-6,5% slobodne fosforne kiseline H 3 PO 4 (2,5-4,6% R 2 O 5) :
Ca 3 (PO 4) 2 + 2H 2 SO 4 \u003d Ca (H 2 PO 4) 2 + 2CaSO 4
Postoji i metoda za razgradnju fosfornom kiselinom sirovina koje sadrže fosfor:
Ca 5 (PO 4) 3 F + 7H 3 PO 4 \u003d 5Ca (H 2 PO 4) 2 + HF
Blok dijagram tehnološkog procesa za proizvodnju dvostrukog superfosfata: 1 - miješanje usitnjenog fosforita i fosforne kiseline; 2 - raspadanje fosforita 1. faze; 3 - razgradnja fosforita II stepen; 4 - granulacija pulpe; 5 - prečišćavanje gasova koji sadrže fosfor od prašine; 6 - sušenje granula pulpe; 7 - dobijanje dimnih gasova (u peći); 8 - prosijavanje suvog proizvoda; 9 - mljevenje velike frakcije; 10 - razdvajanje finih i srednjih (robnih) frakcija na drugom situ; 11 - miješanje drobljene krupne frakcije i finog; 12 - amonizacija (neutralizacija) zaostale fosforne kiseline; 13 - prečišćavanje gasova koji sadrže amonijak i prašinu; 14 - hlađenje neutralizovane robne frakcije dvostrukog superfosfata;

10. Dobivanje ekstrakcijske ortofosforne kiseline
Priprema ekstraktivne fosforne kiseline
Neposredno prije dobijanja EPA, fosfor se dobija posebnom tehnologijom
Slika 1. Šema proizvodnje fosfora: 1 - bunkeri za sirovine; 2 - mikser; 3 - prstenasti ulagač; 4 - rezervoar za punjenje; 5 - električna peć; 6 - kutlača za šljaku; 7 - kutlača za ferofosfor; 8 - elektrofilter; 5 - kondenzator; 10 - sakupljanje tečnog fosfora; 11 - korito
Metoda ekstrakcije (omogućava proizvodnju najčišće fosforne kiseline) uključuje glavne faze: sagorijevanje (oksidaciju) elementarnog fosfora u višku zraka, hidrataciju i apsorpciju nastalog P4O10, kondenzaciju fosforne kiseline i hvatanje magle iz gasne faze . Postoje dva načina za dobivanje P4O10: oksidacija para P (rijetko se koristi u industriji) i oksidacija tekućeg P u obliku kapljica ili filma. Stepen oksidacije P u industrijskim uslovima određen je temperaturom u zoni oksidacije, difuzijom komponenti i drugim faktorima. Druga faza u proizvodnji termalne fosforne kiseline - hidratacija P4O10 - izvodi se apsorpcijom kiselinom (vodom) ili interakcijom para P4O10 sa vodenom parom. Hidratacija (P4O10 + 6H2O4H3PO4) teče kroz faze formiranja polifosfornih kiselina. Sastav i koncentracija nastalih proizvoda zavise od temperature i parcijalnog pritiska vodene pare.
Sve faze procesa su kombinovane u jednom aparatu, osim sakupljanja magle, koje se uvek vrši u posebnom aparatu. U industriji se obično koriste sheme dva ili tri glavna aparata. U zavisnosti od principa gasnog hlađenja, postoje tri metode za proizvodnju termalne fosforne kiseline: evaporativni, cirkulaciono-evaporativni, toplotno-izmjenjivački-evaporativni.
Evaporativni sistemi zasnovani na odvođenju toplote tokom isparavanja vode ili razblažene fosforne kiseline su najjednostavniji u dizajnu hardvera. Međutim, zbog relativno velike zapremine izduvnih gasova, upotreba ovakvih sistema je preporučljiva samo u instalacijama malog jediničnog kapaciteta.
Sistemi cirkulacije i isparavanja omogućavaju kombinovanje faza sagorevanja P, hlađenja gasne faze cirkulišućom kiselinom i hidratacije P4O10 u jednom aparatu. Nedostatak sheme je potreba za hlađenjem velikih količina kiseline. Sistemi za izmjenu toplote i isparavanje kombinuju dva načina odvođenja toplote: kroz zid kula za sagorevanje i hlađenje, kao i isparavanjem vode iz gasne faze; značajna prednost sistema je odsustvo cirkulacionih krugova kiseline sa opremom za pumpanje i hlađenje.
Domaća preduzeća koriste tehnološke šeme sa cirkulacijsko-evaporativnom metodom hlađenja (sistem sa dvostrukim tornjem). Posebne karakteristike sheme: prisutnost dodatnog tornja za hlađenje plina, korištenje efikasnih pločastih izmjenjivača topline u cirkulacijskim krugovima; upotreba gorionika visokih performansi za sagorevanje P, koji obezbeđuje ujednačenu finu atomizaciju mlaza tečnog P i njegovo potpuno sagorevanje bez stvaranja nižih oksida.
Tehnološka šema instalacije kapaciteta 60 hiljada tona godišnje 100% H3PO4 prikazana je na sl. 2. Rastopljeni žuti fosfor se raspršuje zagrijanim zrakom pod pritiskom do 700 kPa kroz mlaznicu u tornju za sagorijevanje raspršenu cirkulirajućom kiselinom. Kiselina zagrijana u tornju se hladi cirkulirajućom vodom u pločastim izmjenjivačima topline. Proizvodna kiselina koja sadrži 73-75% H3PO4 ispušta se iz cirkulacijskog kruga u skladište. Osim toga, u rashladnom tornju se vrši hlađenje plinova iz tornja za sagorijevanje i apsorpcija kiseline (hidratacija), čime se smanjuje naknadno, temperaturno opterećenje elektrofiltera i doprinosi efikasnom prečišćavanju plina. Uklanjanje toplote u hidratacionom tornju vrši se cirkulacijom 50% H3PO4 ohlađenog u pločastim izmenjivačima toplote. Plinovi iz hidracijske kule nakon čišćenja od H3PO4 magle u pločastom elektrofilteru ispuštaju se u atmosferu. Za 1 tonu 100% H3PO4 troši se 320 kg P.

Rice. 2. Cirkulaciona dvotornja šema za proizvodnju ekstrakcije H3PO4: 1 - kolektor kisele vode; 2 - skladište fosfora; 3.9 - cirkulacioni kolektori; 4.10 - potopljene pumpe; 5.11 - pločasti izmjenjivači topline; 6 - toranj za sagorevanje; 7 - fosforna mlaznica; 8 - hidratacijski toranj; 12 - elektrofilter; 13 - ventilator.
11. Katalizatori za oksidaciju sumpor-dioksida u sumporni anhidrid. kontaktiranje
Sumporni anhidrid se dobija oksidacijom sumpordioksida atmosferskim kiseonikom:
2SO2 + O2 ↔ 2SO3,
Ovo je reverzibilna reakcija.
Odavno je uočeno da željezni oksid, vanadijev pentoksid i posebno fino usitnjena platina ubrzavaju reakciju oksidacije sumpor-dioksida u sumporni anhidrid. Ove tvari su katalizatori za oksidaciju sumpor-dioksida. Tako, na primjer, na 400 ° C u prisustvu platiniziranog azbesta (tj. azbesta, na čijoj se površini taloži fino usitnjena platina), gotovo 100% sumpor-dioksida oksidira se atmosferskim kisikom u sumporni anhidrid. Sa više visoke temperature izlaz sumpornog anhidrida se smanjuje kako se ubrzava backlash- reakcija razgradnje sumpornog anhidrida na sumpor dioksid i kiseonik. Na 1000°C, sumporni anhidrid se gotovo potpuno raspada u početne materijale. Dakle, glavni uvjeti za sintezu sumpornog anhidrida su upotreba katalizatora i zagrijavanje na određenu, ne previsoku temperaturu.
Sinteza sumpornog anhidrida također zahtijeva ispunjavanje još dva uvjeta: sumpor dioksid mora biti pročišćen od nečistoća koje inhibiraju djelovanje katalizatora; sumpor dioksid i zrak moraju se osušiti, jer vlaga smanjuje prinos sumpornog anhidrida.

