Tripsin razgrađuje masti. Velika enciklopedija nafte i plina
Slina sadrži enzim ptijalin, koji izuzetno snažno katalizira hidrolizu škroba. Za razliku od kisele hidrolize, hidroliza škroba ptijalinom nastavlja se samo do stvaranja disaharida maltoze.
Slina sadrži enzim ptijalin (amilazu) koji izuzetno snažno katalizira hidrolizu škroba.
Pod djelovanjem enzima ptijalina (amilaze) škrob se djelomično pretvara prvo u dekstrine, a zatim u disaharid maltozu. Drugi enzim pljuvačke maltaza dijeli altozu na dvije molekule glukoze.
Najvažniji enzim u slini je ptijalin, salivarna amilaza, koja katalizira hidrolizu škroba u dekstrine, a dijelom čak i u maltozu. Konačna hidroliza ovih produkata razgradnje u glukozu događa se u tankom crijevu.
Godine 1831. Leike je otkrio da ptijalin ima dijastatsku aktivnost i, konačno, 1833. A.
U ljudskom tijelu škrob se hidrolizira enzimom ptijalinom ili amilazom koji se nalazi u slini. Dakle, slina ne služi samo za vlaženje hrane kako bi se olakšao njen prolaz kroz jednjak, već je i važan probavni sok.
Strogo govoreći, pod djelovanjem enzima sline - ptijalina - škrob se hidrolizira ne u glukozu, već u maltozu, koja je disaharid. Međutim, nema potrebe fiksirati pozornost učenika na ovaj detalj, pogotovo jer maltoza, poput glukoze, obnavlja hidrat bakrenog oksida.
Objasniti sljedeće pojmove: duodenum, sekretin, ptijalin, enterokinaza, zimogen, lipaza, renin, steapsin, himus, žučne soli, tripsinogen, kolecistokinin.
Škrob je u početku izložen enzimu sline, ptalinu, ali većina hidrolize škroba događa se u tankom crijevu, gdje se škrob pretvara u glukozu djelovanjem pankreasnih i drugih visoko aktivnih enzima. Neki od jednostavnih šećera, uključujući glukozu, prenose se krvlju u jetru, gdje se talože kao dio glikogena. Drugi dio šećera ulazi izravno u opću cirkulaciju, gdje se sagorijeva uz oslobađanje energije, pretvara u masti ili se nakuplja u mišićima u obliku glikogena. Glikogen se može osloboditi kada je to potrebno i služi kao izvor energije. Metabolizam ugljikohidrata reguliran je hormonom poput inzulina. Mehanizmi pretvorbe ugljikohidrata u CO2 i H2O vrlo su složeni i nećemo ih razmatrati u ovoj knjizi.
Slina ima neutralnu reakciju, što odgovara optimalnom djelovanju ptijalina i maltoze. Sadrži klorovodičnu kiselinu, želučani sok zaustavlja djelovanje sline u želucu, jer u kiseloj sredini gube svoju aktivnost. Ipak, enzimi ptijalin i maltoza mogu još neko vrijeme nastaviti svoje djelovanje u želucu, budući da je bolus hrane tek postupno zasićen žučnim sokom.
Maltoza nastaje djelovanjem sladne dijastaze na škrob, kao i ptijalin sline. To je međuproizvod destilacijske i pivarske industrije.
Enzimska hidroliza odvija se pod djelovanjem enzima sadržanih u biljkama i životinjskim organizmima (sladna dijastaza, ptialin sline itd.), koji se nazivaju amilaze. Ovi enzimi cijepaju 1-4 veze, ali ne hidroliziraju 1-6 veze. Ostatak tvori niz intermedijarnih oligosaharida.
Hidrolitičku razgradnju škroba (amilolizu) tijekom muljanja katalizira sladna amiloza. Osim njih, slad sadrži nekoliko enzima iz skupine amiloglukozidaza i transferaza, koji napadaju neke od produkata razgradnje škroba; no u kvantitativnom omjeru imaju tek sporedan značaj pri muljanju.
Pri muljanju prirodni supstrat je škrob sadržan u sladu. Kao i svaki prirodni škrob, nije jednostruk kemijski, već mješavina koja sadrži, ovisno o podrijetlu, od 20 do 25% amiloze i 75-80% amilopektina.
Molekula amiloze tvori duge, nerazgranate, spiralno naborane lance koji se sastoje od molekula α-glukoze međusobno povezanih glukozidnim vezama na položaju α-1,4. Broj molekula glukoze je različit i kreće se od 60 do 600. Amiloza je topiva u vodi i boji se otopinom joda u Plava boja. Prema Meyeru, amiloza se potpuno hidrolizira u maltozu djelovanjem sladne β-amilaze.
Molekula amilopektina sastoji se od kratkih razgranatih lanaca. Uz veze u položaju α-1,4, na razgranatim mjestima nalaze se i α-1,6 veze. Glukoznih jedinica u molekuli ima oko 3000. Ječmeni amilopektin sadrži ih, prema McLeodu, od 24 do 26, dok ih slad sadrži samo 17-18. Amilopektin je netopljiv u vodi bez zagrijavanja, zagrijavanjem stvara pastu.
Slad sadrži dvije amilaze koje razgrađuju škrob na maltozu i dekstrine. Jedan od njih katalizira reakciju u kojoj plava boja brzo nestaje otopinom joda, ali nastaje relativno malo maltoze; ta se amilaza naziva dekstrinacijska ili α-amilaza (α-1,4-glukan-4-glukanohidrolaza, EC 3.2.1 L.). Pod djelovanjem druge amilaze, plava boja s otopinom joda nestaje tek kada se stvori velika količina maltoze; to je saharificirajuća amilaza ili β-amilaza (β-1,4-glukanmaltohidrolaza, EC 3.2.1.2) *.
* (Oznake α i β odnose se na optički oblik dobivenog šećera (α-maltoza ili β-maltoza).)
Deekstrinirajuća α-amilaza. Tipičan je sastojak slada. α-Amilaza se aktivira tijekom kuhanja slada, ali ju je Kneen otkrio u ječmu tek 1944. godine. Katalizira cijepanje α-1,4 glukozidnih veza. Molekule obje komponente škroba, tj. amiloze i amilopektina, iznutra su neravnomjerno razbijene; samo krajnje veze nisu hidrolizirane. Dolazi do razrjeđivanja i dekstrinizacije, što se očituje u brzom smanjenju viskoznosti otopine (ukapljivanje kaše). Ukapljivanje škrobne paste jedna je od funkcija sladne α-amilaze. Ideja da je uključen drugi enzim za ukapljivanje (amilofosfataza) trenutno se ne smatra potkrijepljenom. Karakteristično je da α-amilaza uzrokuje isključivo brzo opadanje viskoznost škrobne paste, čija sposobnost obnavljanja istodobno raste vrlo sporo. Reakcija plavog joda škrobne paste (tj. otopine amilopektina) pod djelovanjem α-amilaze brzo se mijenja kroz crvenu, smeđu i akroičnu točku, odnosno s niskom redukcijskom sposobnošću.
U prirodnom okruženju, tj. u sladnim ekstraktima i kašama, α-amilaza ima temperaturni optimum od 70 °C; inaktiviran na 80°C. Optimalna pH zona je između 5 i 6 s jasnim maksimumom na pH krivulji. Stabilna je u pH području od S do 9. aα-Amilaza je vrlo osjetljiva na hiperaciditet (kiselo labilna); inaktiviran oksidacijom da pH 3 na 0°C ili do pH 4,2-4,3 na 20°C.
Saharificirajuća β-amilaza. Sadrži ga ječam, a volumen mu se tijekom slada (klijanja) jako povećava. β-amilaza ima visoku sposobnost kataliziranja razgradnje škroba do maltoze. Ne razrjeđuje netopljivi nativni škrob pa čak ni škrobnu pastu.
S nerazgranatih lanaca amilaze, β-amilaza cijepa sekundarne α-1,4 glukozidne veze, naime s nereducirajućih (nealdehidnih) krajeva lanaca. Maltoza se postupno odvaja od pojedinačnih lanaca jednu po jednu molekulu. Dolazi i do cijepanja amilopektina, međutim, enzim napada razgranatu molekulu amilopektina istovremeno u nekoliko prostornih lanaca, odnosno na mjestima grananja gdje se nalaze α-1,6 veze, prije čega cijepanje prestaje.
Viskoznost škrobne paste pod djelovanjem α-amilaze polagano se smanjuje, dok se redukcijska sposobnost ravnomjerno povećava. Boja joda vrlo sporo prelazi iz plave u ljubičastu, a zatim u crvenu, ali uopće ne doseže akroičnu točku.
Temperaturni optimum za β-amilazu u sladnim ekstraktima i kašama je 60-65°C; inaktivira se na 75°C. Optimalna pH zona je 4,5-5, prema drugim podacima - 4,65 na 40-50 ° C s mekim maksimumom na pH krivulji.
Opće djelovanje α- i β-amilaze. Amilaza (dijastaza), koja se nalazi u običnom sladu i specijalnom dijastatskom sladu, prirodna je mješavina α- i β-amilaze, u kojoj β-amilaza kvantitativno prevladava nad α-amilazom.
Uz istovremeno djelovanje obiju amilaza, hidroliza škroba je mnogo dublja nego kod samostalno djelovanje jednog od tih enzima, a u ovom slučaju maltoze, dobije se 75-80%.
Saharifikacija amiloze i krajnjih skupina amilopektina β-amilazom počinje s kraja lanaca, dok α-amilaza napada supstratne molekule unutar lanaca.
Niži i viši dekstrini nastaju zajedno s maltozom djelovanjem α-amilaze na amilozu i amilopektin. Viši dekstrini također nastaju djelovanjem β-amilaze na amilopektin. Dekstrini su vrsta eritrogranuloze i α-amilaza ih razgrađuje na α-1,6 veze, tako da nastaju novi centri za djelovanje β-amilaze. Dakle, α-amilaza povećava aktivnost β-amilaze. Osim toga, α-amilaza napada dekstrine heksoznog tipa koji nastaju djelovanjem β-amilaze na amilozu.
Normalne dekstrine ravnog lanca saharificiraju obje amilaze. Pritom β-amilaza daje maltozu i malo maltotrioze, a α-amilaza - maltozu, glukozu i maltotriozu, koja se dalje razgrađuje na maltozu i glukozu. Dekstrini razgranatog lanca kidaju se na mjesta grananja. U tom slučaju nastaju niži dekstrini, ponekad oligosaharidi, uglavnom trisaharidi i izomaltoza. Takvih razgranatih zaostalih produkata, koje enzimi dalje ne hidroliziraju, ima oko 25-30% i nazivaju se konačni dekstrini.
Razlika u temperaturnom optimumu α- i β-amilaze koristi se u praksi za regulaciju interakcije oba enzima tako što odabir točne temperature podržava aktivnost jednog enzima na štetu drugoga.
Sladne amiloglukozidaze, na primjer α- i β-glukozidaza, β-h-fruktozidaza, su hidrolizirajući enzimi koji reagiraju na potpuno isti način kao i amilaze, koje međutim ne hidroliziraju škrob, već samo neke produkte cijepanja.
Transglukozidaze su prilično nehidrolizabilni enzimi, ali je mehanizam reakcija koje kataliziraju sličan onom hidrolaza. Slad sadrži transglukozidaze, fosforilirajuće ili fosforilaze, i nefosforilirajuće, npr. ciklodekstrinazu, amilomaltazu itd. Svi ti enzimi kataliziraju prijenos šećernih radikala. Njihov tehnološki značaj je od sekundarne važnosti.
Enzimi koji razgrađuju proteine
Cijepanje proteina (proteoliza) kataliziraju tijekom muljanja enzimi iz skupine peptidaza ili proteaza (peptidne hidrolaze, EK 34), hidrolizirajući peptidne veze = CO = NH =. Dijele se na endopeptidaze, odnosno proteinaze (peptidohidrolaza peptid, EC 3.44) i egzopeptidaze ili peptidaze (hidrolaza dipeptid, EC 3.4.3).
U kašama su supstrati ostaci proteinske tvari ječma, tj. leukozina, edestina, hordeina i glutelina, djelomično promijenjeni tijekom stvaranja slada (npr. koagulirani tijekom sušenja) i produkti njihovog cijepanja, tj. albumoze, peptoni i polipeptidi.
Neki bjelančevine tvore otvorene lance aminokiselina povezanih peptidnim vezama sa slobodnim terminalnim aminskim skupinama = NH 2 i karboksilnim skupinama = COOH. Osim njih, u molekuli proteina mogu se naći amino skupine diaminokarboksilnih kiselina i karboksilne skupine dikarboksilnih kiselina. Dok neki proteini imaju peptidne lance zatvorene u prstenove, nemaju terminalne aminske i karboksilne skupine.
Ječam i slad sadrže jedan enzim iz skupine endopeptidaza (proteinaza) i najmanje dvije egzopeptidaze (peptidaze). Njihovo hidrolizno djelovanje je međusobno komplementarno.
Endopeptidaza (proteinaza). Poput prave proteinaze, endopeptidaza ječma i slada hidrolizira unutarnje peptidne veze proteina. U tom se slučaju proteinske makromolekule cijepaju na manje čestice, odnosno polipeptide manje molekulske mase. Kao i druge proteinaze, proteinaze ječma i slada aktivnije djeluju na promijenjene proteine, poput denaturiranih, nego na prirodne proteine.
Proteinaze ječma i slada po svojim svojstvima su enzimi papainskog tipa koji su vrlo česti u biljkama. Njihova optimalna temperatura je između 50-60°C, optimalni pH se kreće od 4,6 do 4,9 ovisno o supstratu. Proteinaza je relativno stabilna na visokim temperaturama i po tome se razlikuje od peptidaza. Najstabilniji je u izoelektričnom području, tj. pri pH od 4,4 do 4,6. Prema Kolbachu, aktivnost enzima u vodenom mediju opada već nakon 1 sata na 30°C; na 70°C nakon 1 h potpuno se uništi.
Hidroliza katalizirana sladnom proteinazom odvija se postupno. Izolirano je nekoliko međuproizvoda između proteina i polipeptida, od kojih su najvažniji peptoni, koji se nazivaju i proteoze, albumoze, itd. To su viši proizvodi koloidna cijepanja koja imaju tipična svojstva proteina. Oni se talože u kiseloj sredini s taninom, međutim, tijekom reakcije biureta (tj. reakcija s bakrenim sulfatom u alkalnoj otopini proteina), obojeni su u ružičasta boja umjesto ljubičaste. Kod kuhanja peptoni ne koaguliraju. Otopine imaju aktivnu površinu, viskozne su i mućkanjem se lako pjene.
Posljednji stupanj cijepanja proteina kataliziranog sladnom proteinazom su polipeptidi. Samo su dijelom visokomolekularne tvari s koloidnim svojstvima. Normalno, polipeptidi tvore molekularne otopine koje se lako difuziraju. U pravilu ne reagiraju kao proteini i ne talože se taninom. Polipeptidi su supstrat za peptidaze koje nadopunjuju djelovanje proteinaza.
Egzopeptidaze (peptidaze). Kompleks peptidaze u sladu predstavljaju dva enzima, ali drugi su dopušteni.
Peptidaze kataliziraju cijepanje krajnjih aminokiselinskih ostataka iz peptida, s prvim dipeptidima i konačno aminokiselinama. Peptidaze karakterizira supstratna specifičnost. Među njima su dipeptidaze koje hidroliziraju samo dipeptide i polipeptidaze koje hidroliziraju više peptide koji sadrže najmanje tri aminokiseline u molekuli. U skupini peptidaza postoje aminopolipeptidaze čija aktivnost određuje prisutnost slobodne amino skupine i karboksipeptidaze za koje je potrebna prisutnost slobodne karboksilne skupine.
Sve peptidaze slada imaju optimalni pH u blago alkalnom području između pH 7 i 8 i optimalnu temperaturu od oko 40°C. Pri pH 6, pri kojem dolazi do proteolize u klijajućem ječmu, aktivnost peptidaza je izražena, dok pri pH 4,5-5,0 (optimum za proteinaze) peptidaze su inaktivirane. NA vodene otopine aktivnost peptidaza opada već na 50°C, a na 60°C peptidaze se brzo inaktiviraju.
Enzimi koji razgrađuju estere fosforne kiseline
Kod gnječenja veliki značaj vezani za enzime koji kataliziraju hidrolizu estera fosforne kiseline.
Uklanjanje fosforne kiseline tehnički je vrlo važno zbog njezina izravnog učinka na kiselost i sustav puferiranja međuproizvoda u proizvodnji piva i piva.
Prirodni supstrat sladnih fosfoesteraza su esteri fosforna kiselina, od koje u sladu prevladava fitin. To je mješavina kalcita i magnezijevih soli fitinske kiseline, koja je heksafosforni ester inozitola. U fosfatidima, fosfor je vezan kao ester na glicerol, dok nukleotidi sadrže ribozni fosforni ester vezan na pirimidinsku ili purinsku bazu.
Najvažnija fosfoesteraza slada je fitaza (mezoinozitol heksafosfat fosfohidrolaza, EC 3.1.3.8). Vrlo je aktivna. Od fitina fitaza postupno odvaja fosfornu kiselinu. Ovo proizvodi različite fosfatne estere inozitola, koji na kraju daju inozitol i anorganski fosfat. Uz fitazu, opisane su i saharofosforilaza, nukleotidna pirofosfataza, glicerofosfataza i pirofosfataza.
Optimalni pH sladnih fosfataza je u relativno uskom rasponu – od 5 do 5,5. Do visoke temperature osjetljivi su na različite načine. Optimalni temperaturni raspon od 40-50°C vrlo je blizu temperaturnog raspona peptidaza (proteaza).
Razgradnja proteina u gastrointestinalni trakt- ovo je dio metabolizma proteina, skup kontroliranih procesa koji se provode u probavnom sustavu, a to je kemijska obrada proteina koji ulaze u tijelo s hranom, za njihovu kasniju apsorpciju u krv i limfu.
Razgradnja proteinskih molekula počinje u želucu. Zahvaljujući prisutnosti klorovodične kiseline proteini bubre i denaturiraju. Na njih djeluje pepsin želučana kiselina, koji se ističe izvana aktivni oblik pepsinogen, a aktivira ga solna kiselina.
Pod djelovanjem pepsina protein se cijepa na albumoze i peptone.
Daljnja hidroliza albumoze i peptona odvija se u duodenumu.
Iz pankreasa u duodenum ulaze neaktivni oblici: tripsinogen, kimotripsinogen, polipeptidaze.
U šupljini duodenuma tripsinogen se pod djelovanjem enterokenaze pretvara u aktivni tripsin, stvara se aktivni tripsin, cijepa albumoze i peptone, a dio se troši na pretvorbu kimotripsinogena u kimotripsin.
Nadopunjuje djelovanje trinzina, stvaraju se mali peptidi, njihovu hidrolizu kataliziraju aminopolipeptidaze i karboksipolipeptidaze.
Istodobno, dipeptidi, dipeptidaze djeluju na njih i izlučuju ih stijenke tanko crijevo. Aminokiseline ulaze u krvotok, prolaze kroz jetru s krvlju, zatim kolaju tijelom i koriste se u stanicama za sintezu novih proteinskih molekula.
Neapsorbirani prelaze u debelo crijevo, gdje pod djelovanjem enzima mikroba nastaju otrovne tvari.
Probava se najprije odvija u želucu, zatim u lumenu tankog crijeva (kavitarna probava) i potom parijetalna probava – u parijetalnom sloju crijevnog epitela.
U usnoj šupljini dolazi do mehaničkog mljevenja hrane. Bolus hrane u želucu je izložen solnoj kiselini, pri čemu bubri i povećava površinu za djelovanje želučanih peptidnih hidrolaza – pepsina i gastriksina.
(Uglavnom vjeverice probavljaju se u crijevima pod djelovanjem peptidnih hidrolaza gušterače (tripsin, kimotripsin, elastaza, karboksipeptidaza) i crijevima (aminopeptidaza, dipeptidaza, tripeptidaza). Pod djelovanjem endopeptidaza (želučane peptidaze, tripsin, kimotripsin, elastaza) proteini se razlažu na polipeptide, a pod djelovanjem egzopeptidaza (karboksipeptidaza, aminopeptidaza, di- i tripeptidaza) polipeptidi se razlažu na aminokiseline.
Uništavanje aminokiselina tijekom truljenja može ići na 2 načina: 1) dekarboksilacija; 2) oksidacija bočnog lanca.
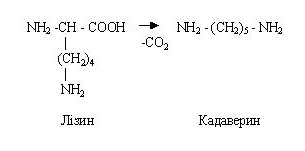
Aminokiseline se dekarboksiliraju u odgovarajuće amine. NA debelo crijevo diaminomonokarboksilne aminokiseline obično se dekarboksiliraju, na primjer, dekarboksilacijom ornitina nastaje putrescin, a dekarboksilacijom lizina nastaje kadaverin - reakcije koje treba znati.
Putrescin i kadaverin također nastaju tijekom raspadanja leševa, pa su se prvotno nazivali kadaverični otrovi. Naknadno se pokazalo da te tvari nisu otrovne i da se mogu izlučiti bez prethodne neutralizacije. U crijevima se ti amini stvaraju u malim količinama, izlučuju se urinom.
Drugi način truljenja je oksidacija bočnog lanca aminokiselina. Na taj način trule uglavnom cikličke aminokiseline - tirozin i triptofan. Tako pri oksidaciji bočnog lanca tira nastaju krezol i fenol, a pri oksidaciji trobočnog lanca indol i skatol. Ovi spojevi se nazivaju crijevni otrovi.)
PROBAVA PROTEINA U PROBAVNOM TRAKTU. Probava hranjivih tvari (bjelančevina, ugljikohidrata, lipida) je proces hidrolize odgovarajućih spojeva koji čine prehrambene proizvode, odvija se u biljnom kanalu i dovodi do stvaranja jednostavnih biomolekula, koje, zbog djelovanja posebnih mehanizama membrane transporta, apsorbiraju se u krv ili limfu.
Probava bjelančevina počinje u želucu pod djelovanjem želučanog soka. Sadrži solnu kiselinu, koju proizvode obkladovye stanice želučane sluznice. On denaturira protein, što olakšava njegovo naknadno cijepanje. U sastav želučanog soka ulaze kiseli fosfati i neke organske kiseline. Klorna kiselina potiče pretvorbu proenzima pepsinogena, kojeg izlučuju glavne stanice želučane sluznice, u aktivni proteolitički enzim pepsin.
Optimalna koncentracija vodikovih iona za pepsin je 1,5...2,5, što odgovara kiselosti želučanog soka tijekom probave. S povećanjem pH medija na 6,0 (u crijevima), pepsin gubi svoju aktivnost. Pepsin se odnosi na jednokomponentne enzime, odnosno proteinske enzime. U želucu se dnevno proizvodi oko 2 g pepsina. Katalitička aktivnost pepsina u želucu je vrlo visoka. Katalizira kvar peptidne veze u proteinskoj molekuli koju tvore amino skupine aromatskih i dikarboksilnih aminokiselina. Kao rezultat djelovanja pepsina nastaju polipeptidi različite veličine i pojedinačne slobodne aminokiseline.
Osim pepsina, želučani sok sadrži proteolitički enzim gastriksin, čija je optimalna pH vrijednost u rasponu od 3,5 do 4,5. Gastriksin djeluje u zadnjim fazama probave hrane u želucu.
Sirilo, kimozin, pronađeno je u želucu dojenčadi. Optimum djelovanja ovog enzima je pH 3,5...4,0. Pod utjecajem kimozina u prisutnosti kalcijevih soli kazeinogen mlijeka tijekom hidrolize prelazi u kazein i mlijeko se zgrušava.
Lakše od drugih u želucu se probavljaju albumini i globulini životinjskog i biljnog podrijetla; slabo se cijepaju proteini vezivnog tkiva (kolagen i elastin), a nikako se ne cijepaju keratin i protamin.
Djelomično probavljena polutekuća masa hranjivih spojeva formiranih u želucu (himus) povremeno ulazi kroz pilorični zalistak u duodenum. Ovaj dio probavnog kanala prima proteolitičke enzime i peptidaze iz gušterače, koji djeluju na peptide iz želuca. Katalitičko djelovanje ovih enzima događa se u blago alkalnom mediju (pH 7,5 ... 8,0), koji je formiran od bikarbonata prisutnih u crijevnom soku. Većina proteolitičkih enzima koji djeluju u tankom crijevu sintetiziraju se u egzokrinim stanicama gušterače u obliku proenzima koji se aktiviraju nakon ulaska u duodenum (tripsinogen, kimotripsinogen, proelastaza, prokarboksipeptidaza A i B). Hidroliza proteina i peptida koji dolaze iz želuca odvija se iu šupljini tankog crijeva i na površini enterocita - parijetalna ili membranska probava.
Pankreasni sok ulazi u duodenum i miješa se s crijevnim sokom. Ova mješavina sadrži proteolitičke enzime koji razgrađuju proteine, albumoze i peptone u male peptide, a zatim u aminokiseline. Proteolitički enzimi uključuju tripsin, kimotripsin, karboksipeptidaze, aminopeptidaze i veliku skupinu tri- i dipeptidaza.
Tripsin se nalazi u pankreasnom soku u neaktivnom obliku, u obliku proenzima tripsinogena. Aktivira se djelovanjem enzima crijevni sok- enterokinaze. Proces aktivacije zahtijeva ione Ca2+. Proces pretvorbe tripsinogena u tripsin provodi se cijepanjem malog peptida s N-kraja peptidnog lanca enzima.
Tripsin hidrolizira neprobavljene bjelančevine u želucu i peptide visoke molekularne težine, djelujući uglavnom na peptidne veze između arginina i lizina. Optimalni pH za tripsin je 7,0...8,0. Tripsin vrši relativno plitku hidrolizu proteina, stvara polipeptide i malu količinu slobodnih aminokiselina.
Aktivnost tripsina može se smanjiti pod utjecajem niza inhibitora. Tu spadaju bazični peptidi molekularne težine 9000 Da. Nalaze se u gušterači, krvi, plućima, soji. Smanjuje aktivnost tripsina i mukoproteina koji se nalaze u sirova jaja- avidin.
Kimotripsin je drugi proteolitički enzim gušterače. Također se izlučuje u neaktivnom obliku, kao kimotripsinogen. Pod djelovanjem tripsina kimotripsinogen se pretvara u aktivni enzim - kimotripsin. Djelovanje kimotripsina je slično djelovanju tripsina. pH optimum za oba enzima je približno isti, kimotripsin djeluje na proteine i polipeptide koji sadrže aromatske aminokiseline (tirozin, fenilalanin, triptofan), kao i na peptidne veze na koje tripsin ne utječe (metionin, leucin).
Peptidi nastali kao rezultat djelovanja pepsina, tripsina i kimotripsina na proteine u donjim dijelovima tanko crijevo, prolaze dalje cijepanje. Ovaj proces provode karboksipeptidaze, aminopeptidaze. Ovi enzimi se klasificiraju kao metaloenzimi. Aktiviraju ih dvovalentni ioni: Mg2+, Mn2+, Co2+ koji imaju važnu ulogu u stvaranju kompleksa enzim-supstrat.
Mehanizam djelovanja amino- i karboksipeptidaza sastoji se u cijepanju terminalnih peptida aminokiselina koje imaju slobodnu amino ili karboksilnu skupinu. Mali peptidi koji su ostali necijepani i sastoje se od tri do četiri aminokiselinska ostatka, hidrolizirani su specifičnim di- i triaminopeptidazama. U pankreasnom soku nalazi se enzim elastaza.
Elastaza je endopeptidaza koja također ima široku supstratnu specifičnost, cijepajući peptidne veze formirane od malih aminokiselinskih ostataka - glicina, alanina, serina.
Dakle, kao rezultat sekvencijalnog djelovanja proteolitičkih enzima na proteine, u crijevu nastaju slobodne aminokiseline koje se kroz crijevnu stijenku apsorbiraju u krv.
Stvaranje toksičnih produkata u debelom crijevu, njihova neutralizacija u jetri uz pomoć sumporne i glukuronske kiseline.
Aminokiseline koje se ne apsorbiraju u krv kroz sluznicu tankog crijeva izložene su mikroorganizmima u debelom crijevu. Istodobno, enzimi mikroorganizama razgrađuju aminokiseline i pretvaraju ih u amine, masne kiseline, alkohole, fenole i druge tvari, često otrovne za tijelo. Taj se proces ponekad naziva truljenjem proteina u crijevima. Temelji se na dekarboksilaciji aminokiselina, dok biološki amini nastaju iz aminokiselina. Dakle, putrescin se formira iz aminokiseline ornitina:
Iz lizina nastaje kadaverin:
Putrescin i kadaverin izlučuju se iz tijela fekalnim tvarima. Kada ovi spojevi uđu u krvotok, nepromijenjeni se izlučuju urinom.
Krezol nastaje iz tirozina, a ako proces ide dalje, onda fenol:

Triptofan se pretvara u skatol i indol:

Uz duboko uništavanje aminokiselina koje sadrže sumpor - cistina, cisteina i metionina - crijevnim mikroorganizmima, nastaju sumporvodik (H2S), merkaptan (CH3SH) i drugi spojevi koji sadrže sumpor.
Produkti raspadanja proteina apsorbiraju se u vensku krv, zatim ulaze u jetru, gdje se neutraliziraju sumpornom ili glukuronskom kiselinom.
Ovaj proces se provodi prema sljedećoj shemi:


Indol i skatol također se neutraliziraju u jetri uz sudjelovanje sumporne i glukuronske kiseline. Međutim, oni su prethodno oksidirani: skatol u skatoksil, indol u indoksil i u obliku parnih kiselina izlučuju se iz tijela mokraćom.

Neke otrovne tvari, poput benzojeve kiseline, nastale iz fenilalanina, neutraliziraju se u jetri uz pomoć glicina. Pritom nastaje hipopurična kiselina, bezopasni spoj koji se izlučuje urinom.

Mogućnosti jetre u neutralizaciji otrovnih tvari koje nastaju u debelom crijevu i apsorbiraju se u krv nisu neograničene. Sa smanjenjem njegove funkcionalne sposobnosti (na primjer, zbog prethodnih bolesti), unos značajne količine otrovnih tvari može se pokazati kao prekomjerno opterećenje, tada se dio neneutraliziranih otrovnih tvari širi (velikim krug cirkulacije krvi) u cijelom tijelu, uzrokujući njegovo trovanje. Dolazi do preranog starenja stanica i njihove smrti. Istodobno se primjećuje pogoršanje dobrobiti osobe, muče ga glavobolje.
Kako bi se spriječili negativni učinci otrovnih tvari na tijelo, potrebno je racionalno planirati dijeta. Treba uključiti proizvode koji sadrže ne samo proteine, već i masti i ugljikohidrate, korisne fermentirane mliječne proizvode, jer bakterije mliječne kiseline pomažu ubrzati smrt truležnih mikroorganizama u debelom crijevu. Dijeta zahtijeva hranu kao izvor pektina i vlakana, koji, povećavajući motoričku aktivnost crijeva, doprinose uklanjanju toksina (uključujući otrovne tvari) iz tijela.
Unutarstanični metabolizam proteina: deaminacija, dekarboksilacija, transaminacija.
Glavni dio aminokiselina, formiranih u crijevima iz proteina, ulazi u krv (95%), a mali dio - u limfu. Putem portalne vene aminokiseline ulaze u jetru, gdje se troše za biosintezu raznih specifičnih proteina (albumina, globulina, fibrinogena), ostale aminokiseline se prenose krvotokom u sve organe i tkiva, transportiraju u stanice, gdje se koriste se za biosintezu proteina. Neiskorištene aminokiseline oksidirane do krajnjih proizvoda metabolizma.
Proces cijepanja tkivnih proteina kataliziraju tkivni enzimi – katepsin proteinaze.
Omjer između aminokiselina u bjelančevinama koje se razgrađuju i sintetiziraju je različit, pa se dio slobodnih aminokiselina mora pretvoriti u druge aminokiseline ili oksidirati u jednostavne spojeve i izlučiti iz organizma. Dakle, u tijelu postoji intracelularna zaliha aminokiselina, koja se u velikoj mjeri nadopunjuje zahvaljujući procesima interkonverzije aminokiselina, hidrolize proteina, sinteze aminokiselina i njihovog ulaska iz izvanstanične tekućine. Istodobno, zbog sinteze proteina i drugih reakcija (stvaranje ureje, purina i dr.), slobodne aminokiseline se neprestano uklanjaju iz izvanstanične tekućine.
deaminacija aminokiselina. Suština deaminacije je razgradnja aminokiselina pod djelovanjem enzima na amonijak i ostatak bez dušika (masne kiseline, hidroksi kiseline, keto kiseline). Deaminacija može biti u obliku reduktivnih, hidrolitičkih, oksidativnih i intramolekularnih procesa. Posljednje dvije vrste prevladavaju kod ljudi i životinja.
Oksidativnu deaminaciju dijelimo u dva stupnja. Prvi stupanj je enzimski, završava stvaranjem nestabilnog međuproizvoda – iminokiseline, koja se u drugom stupnju spontano razgrađuje na amonijak i α-keto kiselinu u prisutnosti vode. Enzimi koji kataliziraju ovaj proces sadrže NAD ili FAD kao prostetičke skupine.
U ljudskom tijelu najaktivnija deaminacija glutaminske kiseline događa se pod djelovanjem enzima glutamat dehidrogenaze koji se nalazi u mitohondrijima stanica svih tkiva. Kao rezultat tog procesa nastaje -ketoglutarna kiselina koja je uključena u mnoge metaboličke procese.
Transaminacija (transaminacija) aminokiselina. Preduvjet za transaminaciju je sudjelovanje dikarboksilnih aminokiselina (glutaminske i asparaginske), u obliku njihovih odgovarajućih keto kiselina - -ketoglutarna i oksalna kiselina mogu djelovati sa svim aminokiselinama, s izuzetkom lizina, treonina i arginina.
Tijekom reaminacije dolazi do izravnog prijenosa amino skupine s amino kiseline na keto kiselinu, te keto skupine - keto kiseline pri čemu se aminokiselina ne oslobađa amonijaka.
Ovaj proces odvija se u nekoliko faza. Općenito, reakcija izgleda ovako:

Reakcija je katalizirana enzimima koji pripadaju klasi transferaza, njihova prostetička skupina je fosforpiridoksal, fosforni ester vitamina B6.
Proces transaminacije vrlo je raširen u prirodi. Njegova značajka je laka reverzibilnost.
Reakcije transaminacije igraju važnu ulogu u metabolizmu. Oni ovise o tako važnim procesima kao što je biosinteza mnogih esencijalnih aminokiselina iz njihovih odgovarajućih keto kiselina, razgradnja aminokiselina, sjedinjavanje putova metabolizma ugljikohidrata i aminokiselina, kada se aminokiselina alanin može formirati iz proizvoda razgradnje glukoze, za na primjer, pirogrožđana kiselina, i obrnuto.
Vidbudovne aminacije. Ovaj proces je suprotan od deaminga. Osigurava vezanje amonijaka ketokiselinama uz stvaranje odgovarajućih aminokiselina.
Vidbudovne aminacije katalizira dobro funkcionirajući enzimski sustav, koji osigurava aminaciju α-ketoglutarne ili oksalookularne kiseline uz stvaranje glutaminske ili asparaginske kiseline.

Pri neutralizaciji amonijaka anorganskim i organskim kiselinama dolazi do stvaranja amonijevih soli. Ovaj proces se odvija u bubrezima. Nastale amonijeve soli izlučuju se iz tijela mokraćom i znojem.
dekarboksilacija aminokiselina. Proces dekarboksilacije kataliziraju dekarboksilaze specifične za svaku aminokiselinu, čija je prostetska skupina piridoksal fosfat. Ovi enzimi pripadaju klasi liaza. Proces dekarboksilacije, koji se sastoji u uklanjanju CO2 iz aminokiselina uz stvaranje amina, može se prikazati na sljedećem dijagramu:

Mehanizam reakcije dekarboksilacije aminokiselina prema opća teorija piridoksal kataliza se svodi na stvaranje kompleksa piridoksal fosfat-supstrat u aktivnom mjestu enzima.
Na taj način iz triptofana nastaje triptamin, a iz hidroksitriptofana serotonin. Histamin nastaje iz aminokiseline histidina. Iz glutaminske kiseline tijekom dekarboksilacije nastaje -aminomaslačna kiselina (GABA).
Amini nastali iz aminokiselina nazivaju se biogeni amini jer imaju snažno biološko djelovanje na organizam.
Biogeni amini pokazuju fiziološke učinke u vrlo niskim koncentracijama. Dakle, unošenje histamina u tijelo dovodi do širenja kapilara i povećanja njihove propusnosti, sužavanja velike posude, kontrakcija glatkih mišića različitih organa i tkiva, pojačano lučenje klorovodične kiseline u želucu. Osim toga, histamin je uključen u prijenos živčane ekscitacije.
Serotonin povećava krvni tlak i steže bronhije; njegove male doze inhibiraju aktivnost središnjeg živčanog sustava, u velikim dozama ova tvar ima stimulirajući učinak. U različitim tkivima tijela velike količine histamina i serotonina nalaze se u vezanom, neaktivnom obliku. Biološko djelovanje pokazuju samo u slobodnom obliku.
-aminomaslačna kiselina (GABA) nakuplja se u moždanom tkivu i neurohumoralni je inhibitor-posrednik inhibicije središnjeg živčanog sustava.
Velike koncentracije ovih spojeva mogu predstavljati prijetnju normalnom funkcioniranju organizma. Međutim, u životinjskim tkivima prisutna je aminska oksidaza, koja razgrađuje amine do odgovarajućih aldehida, koji se zatim pretvaraju u masne kiseline i razgrađuju do konačnih proizvoda.
Neutralizacija amonijaka.

U procesu transformacije aminokiselina u tkivima nastaju njihovi krajnji produkti metabolizma - ugljikov monoksid, voda i amonijak. Tijelo koristi vodu za osiguravanje biokemijskih procesa. Ugljični monoksid se djelomično izlučuje iz tijela izdahnutim zrakom, a drugi dio se koristi u procesima sinteze (npr. u sintezi masnih kiselina, purinskih baza itd.). Amonijak, koji nastaje kao rezultat deaminacije aminokiselina, je otrovna tvar, povećanje njegove koncentracije u krvi i drugim tkivima nepovoljno djeluje, posebno na živčani sustav. Toksičnost amonijaka je zbog činjenice da on potiče metabolizam aminokiselina -ketoglutarne kiseline u mitohondrijima. To dovodi do njegovog uklanjanja iz Krebsovog ciklusa i, posljedično, do pada tkivnog disanja i prekomjernog stvaranja ketonskih tijela iz acetil-CoA.
U procesu evolucije, živi organizmi su razvili različite učinkovite mehanizme za neutralizaciju toksičnih učinaka amonijaka, od kojih su glavni: stvaranje amina glutamina ili asparagina, aminacija, neutralizacija kiseline, sinteza uree.
Sinteza glutamina ili asparagina od velike je važnosti za organizam. Javlja se na mjestima gdje se izravno stvara amonijak (primjerice u jetri, mozgu), a tu se nalazi i enzim koji katalizira taj proces, glutamin sintetaza, koji pripada klasi liga. Sinteza amida zahtijeva dostavu energije u obliku ATP-a, prisutnost glutaminske ili asparaginske kiseline, slobodnog amonijaka i odgovarajućih specifičnih enzima. Reakcija sinteze amida povezana je s razgradnjom ATP-a.

Dakle, jedna molekula amonijaka je fiksirana u citrulinu.

Druga faza. Još jedna molekula amonijaka vezana je za glutaminsku kiselinu reduktivnom aminacijom s α-ketoglutarnom kiselinom. Glutaminska kiselina prenosi fiksiranu molekulu amonijaka u obliku NH2 skupine u oksalocijalnu kiselinu, koja se pretvara u asparaginsku kiselinu (proces transaminacije):

Treća faza. U ovoj fazi se provodi sinteza uree. Citrulin, u interakciji s amino skupinom asparaginske kiseline, tvori argininoburstinsku kiselinu (arginin sukcinat).
Ovaj proces koristi energiju druge ATP molekule.

Argininoburstinska kiselina se cijepa na arginin i fumarnu kiselinu. Fumarna kiselina uključena je u metabolizam ugljikohidrata, pretvarajući se u jabučnu kiselinu, koja se dehidrogenacijom pretvara u oksalnu kiselinu.

Oksalna kiselina može na sebe vezati amonijak i ponovno se pretvoriti u asparaginsku kiselinu ili, dekarboksilacijom, u pirogrožđanu kiselinu, a zatim u koenzim A, koji se koristi u raznim reakcijama biosinteze ili oksidira u CO2 i H2O.
Arginin nastao pod djelovanjem arginaze hidrolitički se cijepa na ornitin i ureu. Oslobođeni ornitin može ponovno reagirati s novom molekulom karbomoil fosfata i proces će se ponoviti.
Procjenjuje se da u stanju ravnoteže dušika tijelo odrasle osobe troši i prema tome oslobađa 15 g dušika; Od dušika izlučenog u urinu, urea čini oko 85%, kreatinin - 5%, amonijeve soli - 3, mokraćna kiselina - 1 i njeni drugi oblici - 6.

