Hemijska svojstva reakcije mliječne kiseline. Hemijska i fizička svojstva mliječne kiseline Priručnik o kemijskim tvarima mliječne kiseline
Mliječna kiselina(2-hidroksipropionska kiselina) CH 3 CH(OH)COOH, molekulska težina 90,1; bezbojan. Poznate su L(+)-mliječna kiselina, D(-)-mliječna (mesno-mliječna) kiselina i racemična mliječna kiselina fermentacijske mliječne kiseline. Za D,L- i D-mliječnu kiselinu, tačka topljenja odgovara 18 °C i 53 °C; t. kip. odn. 85°C/1 mmHg i 103°C/2mm Hg; za D-mliječnu kiselinu [α] D 20 -2,26 (koncentracija 1,24% in. Za D,L-mliječnu kiselinu D H 0 arr - 682,45 kJ/mol; D H 0 pl 11,35 kJ/mol; D H test 110,95 kJ/mol (25°C), 65,73 kJ/mol (150°C). Za L-mliječnu kiselinu D H 0 sagorijevanje - 1344,8 kJ/mol; D H 0 arr -694,54 kJ/mol; D H 0 pl 16,87 kJ/mol.
Zbog visoke higroskopnosti mliječne kiseline, obično se koriste njezine koncentrirane vodene otopine - sirupaste, bezbojne, bez mirisa. Za vodeni rastvori mlečne kiseline d 20 4 1,0959 (40%), 1,1883 (80%), 1,2246 (100%); nD 25 1,3718 (37,3%), 1,4244 (88,6%); h 3,09 i 28,5 MPa. s (25 0 C) odn. za 45,48 i 85,32% rastvora; g 46.0. 10 -3 N/m (25°C) za 1 M rastvor; e 22 (17°C). Mliječna kiselina je slabo rastvorljiva u, slabo - u, i drugim halougljicima; R K a 3,862 (25°C); pH vodenih rastvora 1,23 (37,3%), 0,2 (84,0%).
Mliječna kiselina dehidrira se do akrilne kiseline, kada se zagreje sa HBr formira 2-bromopropionsku kiselinu, kada Ca-sol reaguje sa PCl 5 ili SOCl 2 -2-hloropropionil hloridom. U prisustvu mineralnih kiselina dolazi do samoesterifikacije mliječne kiseline sa stvaranjem formule I, kao i linearnih poliestera. Kada mliječna kiselina stupi u interakciju s, nastaju hidroksi kiseline RCH 2 CH (OH) COOH, a kada mliječna kiselina stupi u interakciju s alkoholima, nastaju estri. Soli i estri mliječne kiseline nazivaju se laktati (vidi tabelu).
mliječna kiselina nastaje kao rezultat mliječne kiseline (tokom kiselog mlijeka, kiseljenja kupusa, kiseljenja povrća, zrenja sira, siliranja hrane); D-mliječna kiselina se nalazi u tkivima životinja, biljaka, a također i u mikroorganizmima.
U industriji se mlečna kiselina dobija iz 2-hloropropionske kiseline i njene (100°C) ili laktonitrila CH 3 CH (OH) CN (100° C, H 2 SO 4) nakon čega sledi formiranje estera, izolovanje i hidroliza što vodi do proizvoda Visoka kvaliteta. Poznate su i druge metode za proizvodnju mliječne kiseline: oksidacija propilena dušikovim oksidima (15-20 °C) nakon čega slijedi tretman sa H 2 SO 4, interakcija CH 3 CHO sa CO (200 ° C, 20 MPa).
SVOJSTVA NEKIH LAKTATA
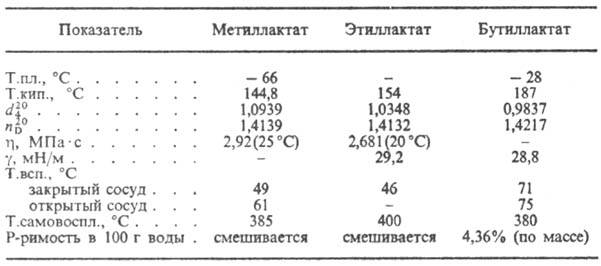
Mlečna kiselina se koristi u prehrambenoj industriji, u farbanju, u industriji kože, u fermentacionim radnjama kao baktericidno sredstvo, za dobijanje lijekovi, plastifikatori. Etil i butil laktati se koriste kao rastvarači celuloznih etera, ulja za sušenje, biljna ulja; butil laktat - također kao rastvarač za neke sintetičke polimere.
Svjetska proizvodnja mliječne kiseline iznosi 40 hiljada tona (1983).
Lit.: Holten C.H., Mliječna kiselina. svojstva i hemija. Mliječna kiselina i derivati, Weisheim, 1971. Yu. A. Treger.
Odaberite prvo slovo u naslovu članka:
Hidroksi kiseline (alkoholne kiseline) su derivati karboksilnih kiselina koji sadrže jednu, dvije ili više hidroksilnih grupa u radikalu povezanom s karboksilom.
U zavisnosti od broja karboksilnih grupa, hidroksi kiseline se dele na jednobazne, dvobazne itd.; ovisno o ukupnom broju hidroksilnih grupa, hidroksi kiseline se dijele na mono- ili polihidrične.
Prema prirodi radikala, hidroksi kiseline su zasićene i nezasićene, aciklične, ciklične ili aromatične.
U hidroksi kiselinama se javljaju sljedeće vrste izomerizma:
strukturalni(izomerizam radikalnog lanca, izomerizam međusobnog položaja karboksila i hidroksila);
optički(ogledalo) zbog prisustva asimetričnih atoma ugljika.
Nazivi hidroksi kiselina su dati po imenu kiseline uz dodatak "hidroksi" ili "dioksi" itd. Trivijalna nomenklatura je također u širokoj upotrebi.
HO–CH 2 –COOH
glikol (oksioctena kiselina)
mliječni proizvodi (α-hidroksipropionska)


α-hidroksimaslačna β-hidroksibutirna
(2-hidroksibutanska) (3-hidroksibutanska)
fizička svojstva. Niže hidroksi kiseline su najčešće guste, sirupaste supstance. Hidroksi kiseline se miješaju s vodom u bilo kojem omjeru, a s povećanjem molekularne mase, topljivost se smanjuje.
Hemijska svojstva.
1. Svojstva kiselina- hidroksi kiseline daju sve reakcije karakteristične za karboksil: stvaranje soli, estera, amida, kiselih halogenida itd. Hidroksi kiseline su jači elektroliti od odgovarajućih karboksilnih kiselina (učinak hidroksilne grupe).

2. Svojstva alkohola - reakcije supstitucije vodika hidroksilne grupe, formiranje jednostavnih i estri, supstitucija –OH za halogen, intramolekularna dehidracija, oksidacija.
hlorocteni glikol glioksal
kiselina kiselina kiselina
a) HO–CH 2 –COOH + CH 3 OHNO–CH 2 –CO–O–CH 3 + H 2 O
estar glikolne kiseline i metil alkohola
b) HO–CH 2 –COOH + 2CH 3 ONCH 3 –O–CH 2 –COOCH 3 + 2H 2 O
glikolni metil metil eter
kiseli alkohol metoksisirćetna kiselina
(cijela emisija)
3. Odnos hidroksi kiselina i zagrijavanja – kada se zagrije, α-hidroksi kiseline odvajaju vodu, formirajući ciklični estar, izgrađen kao id dva molekula α-hidroksi kiselina:

laktid α-hidroksipropionske kiseline
β-hidroksi kiseline pod istim uslovima lako gube vodu sa stvaranjem nezasićenih kiselina.
NO–CH 2 –CH 2 –COOH  CH 2 \u003d CH - COOH
CH 2 \u003d CH - COOH
β-hidroksipropionska akrilna kiselina
γ-hidroksi kiseline također mogu izgubiti molekulu vode formiranjem intramolekularnih estera - laktona.

NO–CH 2 –CH 2 –CH 2 –COOH
γ-hidroksibuterna kiselina
γ-butirolakton
Neke hidroksi kiseline se dobivaju iz prirodnih proizvoda. Dakle, mliječna kiselina se dobiva mliječno kiselom fermentacijom slatkih tvari. Metode sintetičke proizvodnje zasnivaju se na sljedećim reakcijama:
1) Cl–CH 2 –COOH + HOH  HO–CH 2 –COOH;
HO–CH 2 –COOH;
monohloroctena glikolna kiselina
kisela kiselina
2) CH 2 \u003d CH - COOH + HOH  NO-CH 2 -CH 2 -COOH.
NO-CH 2 -CH 2 -COOH.
akrilna kiselina β-hidroksipropionska kiselina
predstavnici hidroksi kiselina.
Glikolni (hidroksisirćetna) kiselina je kristalna supstanca koja se nalazi u nezrelom voću, soku cvekle, repi i drugim biljkama. U industriji se dobija redukcijom oksalne kiseline. Koristi se za bojenje (kaliko štampa).
Mliječna kiselina (α-hidroksipropionska) - gusta tečnost ili kristalna masa niskog taljenja. Mliječna kiselina nastaje u procesu mliječnokiselinske fermentacije šećera, pod djelovanjem bakterija mliječne kiseline. Sadrži u fermentisanim mlečnim proizvodima, kiselom kupusu, silaži. Koristi se u jedljivom bojenju, u proizvodnji kože, u medicini.
Meso-mliječna kiselina se nalazi u mišićnom soku životinja i mesnim ekstraktima.
dijatomski glicerinska kiselina učestvuje u životnim procesima biljaka i životinja.

Askorbinska kiselina (vitamin C) - kristalna supstanca sadržana u svježe voće, limun, crna ribizla, u svežem povrću - kupus, pasulj. Sintetički, vitamin C se dobija oksidacijom polihidričnog alkohola sorbitola.
 α-askorbinska kiselina
α-askorbinska kiselina
Askorbinska kiselina se lako razlaže atmosferskim kiseonikom, posebno kada se zagreje.
Aciklično dva-i trobazične hidroksi kiseline.
Apple (hidroksisukcinska) kiselina (HOOS-CHOH-CH 2 -COOH) je kristalna supstanca koja je visoko rastvorljiva u vodi; koristi se u medicini, nalazi se u nezrelom čamcu, žutici, rabarbari, soku od grožđa, vinu.
Vino (vinska, dioksijantarna) kiselina (HOOC–*CHOH–*CHOH–COOH) ima 2 asimetrična atoma ugljika i stoga ima 4 optička izomera. Formira kisele kalijeve soli, koje su slabo rastvorljive u vodi i talože se. U vinu (tartaru) mogu se uočiti kristali soli. Mešana kalijum-natrijumova so se zove Rochelle so. Soli vinske kiseline nazivaju se tartrati.

tartar, rošel so
Vinska kiselina je česta u biljkama (oren, grožđe, itd.).
Limunova kiselina
 nalazi u citrusnom voću. U industriji se dobija iz plodova limuna, oksidacijom šećera gljivama plijesni, pri preradi iglica smreke.
nalazi u citrusnom voću. U industriji se dobija iz plodova limuna, oksidacijom šećera gljivama plijesni, pri preradi iglica smreke.
Limunska kiselina je biološki važan spoj koji učestvuje u metabolizmu. Koristi se u medicini, prehrambenoj, tekstilnoj industriji kao dodatak bojama.
Ciklične monobazne polihidrične hidroksi kiseline su dio žučnih kiselina i drugih fiziološki važnih spojeva; na primjer, auksin pospješuje rast biljaka.
Aromatične hidroksi kiseline dijele se na fenolne kiseline i aromatične masne kiseline koje sadrže hidroksil u bočnom lancu.


o-hidroksibenzojeva bademova kiselina
(salicilna kiselina
Salicilna kiselina nalazi se u nekim biljkama u slobodnom obliku (kalendula), ali češće u obliku estera. U industriji se dobiva zagrijavanjem natrijevog fenolata s ugljičnim dioksidom. Koristi se kao dezinfekciono sredstvo i u sintezi boja. Mnogi derivati salicilne kiseline se koriste kao lijekovi (aspirin, salol).


aspirin salol (fenil eter
(acetilsalicilna kiselina) salicilna kiselina)
Galna kiselina (3,4,5-trioksibenzojev).

Sadrži u listovima čaja, hrastovoj kori, stablu nara. U industriji se dobiva iz tanina kuhanjem s razrijeđenim kiselinama. Koristi se za proizvodnju mastila, u fotografiji, u medicini kao antiseptik. Galna kiselina i njeni derivati se naširoko koriste kao konzervansi za mnoge prehrambeni proizvodi(masti, visokokvalitetni sapuni, mliječni proizvodi), ima taninska svojstva i od posebnog je značaja u proizvodnji kože i bojenju mrlja.
bademova kiselina odnosi se na aromatične masne kiseline (C 6 H 5 -CH (OH) -COOH), nalazi se u amigdalinu, senfu, bazgi itd.
Tanini često su derivati polihidričnih fenola. Oni su dio biljaka i dobivaju se iz ekstrakata kore, drveta, lišća, korijena, plodova ili izraslina (žuči).
Tanini su najvažniji tanini. Ovo je mješavina različitih hemijska jedinjenja, od kojih su glavni estri galne i digalne kiseline i glukoze ili polihidričnim alkoholima.

Dg-digalna kiselina

m-digalna kiselina
Tanin pokazuje svojstva fenola i estera. Sa otopinom željeznog klorida formira crni kompleksni spoj. Tanini se široko koriste kao ekstrakti za štavljenje, jedila za bojenje pamučnih tkanina, kao adstringensi u medicini (imaju baktericidna, hemostatska svojstva), te su konzervansi.
Lipidi uključuju organske tvari, od kojih su mnoge estri makromolekularnih masnih kiselina i polihidričnih alkohola - to su masti, fosfatidi, voskovi, steroidi, makromolekularne masne kiseline itd.
Lipidi se nalaze uglavnom u sjemenkama biljaka, jezgri orašastih plodova, te u životinjskim organizmima - u masnom i nervnom tkivu, posebno u mozgu životinja i ljudi.
Prirodne masti su mješavine estera trihidričnog alkohola glicerola i viših karboksilnih kiselina, tj. mješavine glicerida ovih kiselina.
O  Opća formula za masnoću:
Opća formula za masnoću:
gdje su R I R II R III ugljikovodični radikali viših masnih kiselina normalna struktura sa parnim brojem atoma ugljika. Masti mogu sadržavati ostatke i zasićenih i nezasićenih kiselina.
Zasićene kiseline:
S 15 H 31 COOH– palmitinska;
C 17 H 35 COOH - stearinska;
C 3 H 7 COOH - ulje (sadržano u puteru) itd.
Nezasićene kiseline:
C 17 H 33 COOH - oleinska;
C 17 H 31 COOH - linolna;
C 17 H 29 COOH - linolenski, itd.
Nabavite masti iz prirodnih izvora životinjskog i biljnog porijekla.
Fizička svojstva masti su kisele. Masti koje sadrže pretežno zasićene kiselinske ostatke su čvrste ili masnoće supstance (ovčetina, goveđa mast itd.) Masti, koje sadrže uglavnom ostatke nezasićenih kiselina, imaju tekuću konzistenciju na sobnoj temperaturi i nazivaju se uljima. Masti se ne rastvaraju u vodi, ali se dobro rastvaraju u organskim rastvaračima: eter, benzol, hloroform itd.
Hemijska svojstva. Kao i svi estri, masti podležu hidrolizi. Hidroliza se može odvijati u kiseloj, neutralnoj ili alkalnoj sredini.
1. Hidroliza kiseline.

Kataloški broj za mliječnu kiselinu: CAS 50-21-5
Opis mliječne kiseline:
Gotovo prozirna, blago žućkasta higroskopna sirupasta tekućina blago kiselkastog mirisa, koja podsjeća na miris jogurta. Rastvorljiv u vodi, etanolu, slabo - u benzenu, hloroformu i drugim halougljicima. Postoje različiti optički aktivni izomeri D i L oblika. Kao i optički neaktivna mješavina D i L. Potonji se dobiva kemijskom sintezom, a aktivni oblici bakterijskom. (enzimska metoda) U ljudskom organizmu u Krepsovom ciklusu učestvuje optički aktivan oblik L, zbog čega se preporučuje da se koristi kao aditiv (mliječna kiselina, E270), u drugim industrijama ne igra posebnu ulogu.
Svjetski naziv Mliječna kiselina nije se ukorijenio u Rusiji, ali naziv njenih laktatnih soli nalazi se posvuda, mnogo češće od kalcijum laktata smanjujemo kalcijum laktat.
Specifikacija za mliječnu kiselinu 80%.
Tačka ključanja (100% rastvor) 122 °C (115 mm Hg)
Specifična težina (20 °C) 1.22
Rastvorljivost u vodi Potpuno rastvorljiv
Gustina (na 20°C) 1,18-1,20 g/ml
Teški metali, ne više od 0,001%
Sadržaj gvožđa, ne više od 0,001%
Sadržaj arsena, ne više od 0,0001%
Sadržaj hlorida, ne više od 0,002% (stvarno 0,0015%)
Sadržaj sulfata, ne više od 0,01% (stvarno 0,004%)
Ostatak nakon kalcinacije, ne više od 0,1% (stvarno 0,06%)
Proizvođač: kina
Pakovanje: bačve 25 kg ili kocke 1200 kg
Glavna fizička svojstva mliječne kiseline:
Tačka topljenja: 17°C Za optički neaktivne (racemske),
25-26 °C optički aktivna + ili - forma
(razlike u temperaturama topljenja omogućavaju kvalitativno i brzo razlikovanje skupljih optički aktivnih oblika od jeftinijih neaktivnih!!)
Relativna gustina (voda = 1): 1.2
Rastvorljivost u vodi: miješa se
Molekulska težina: 90,08 g/mol
Tačka paljenja: 110°C c.c.
Koeficijent raspodjele oktanol/voda kao lg Pow: -0,6
Opasnost od eksplozije i požara:
Podržava sagorevanje na normalnim uslovima. spontano sagorevanje je malo verovatnoNe dozvoliti pušenje otvorenog plamena.
Gašenje požara: prah, pjena otporna na alkohol, vodeni sprej,
ugljen-dioksid.
Hemijska stabilnost: Stabilno na normalne temperature i pritisak.
Uslovi koje treba izbegavati: Stvaranje prašine, prekomerna toplota.
Nekompatibilnost sa drugim materijalima: Jaki oksidanti, mineralne kiseline.
Opasni proizvodi raspadanja: dušikovi oksidi, ugljen monoksid, ugljični dioksid, pare.
cijanid.
Opasna polimerizacija: Nije označeno.
Opasnost po ljude:
Putevi ulaska u organizam: Supstanca se može apsorbirati u tijelo udisanjem aerosola i gutanjem.
Kod kratkotrajnog izlaganja koncentracijama koje prelaze MPC: Supstanca iritira kožu i Airways, a također ima korozivnu
djelovanje na oči. Korozivno djelovanje ako se proguta.
U slučaju kontakta očima: Crvenilo. Bol. Teške duboke opekotine. Zaštitne naočare-maska, ili
zaštitna maska. Prvo isperite veliki iznos vode za nekoliko
minuta (ukloniti Kontaktne leće ako nije teško), odnesite ljekaru.
Standardi radnog područja:
TLV (maksimalna granična koncentracija, SAD) nije utvrđena.
karcinogenost: Nije na listi ACGIH, IARC, NTP ili CA Prop 65.
epidemiologija: Nema informacija.
tetragenost: Nema informacija.
reproduktivni efekti: Nema informacija.
mutagenost: nema informacija
Neurotoksičnost: Nema informacija.
Eksperimenti na životinjama su pokazali:
LD50/LC50:
Draize test, zec, oči: 100 mg Teška;
Draize test, zec, koža: 500 mg/24H Blagi;
Udisanje, pacov: LC50 = >26 mg/m(cc)/1H;
Oralno, miš: LD50 = 1940 mg/kg;
Oralno, pacov: LD50 = 1700 mg/kg;
Koža, kunić: LD50 = >10 gm/kg;
Pažnja. Podaci se daju o koncentratu tvari, u malim količinama i koncentracijama mliječne kiseline, prema dostupnim na ovog trenutka podaci su bezopasni!
Mliječna kiselina (laktat)- α-hidroksipropionska (2-hidroksipropanska) kiselina.
- t pl 25-26 °C optički aktivan (+)- ili (-)-oblik.
- t pl 18 °C racemični oblik.
- Hemijska formula: CH 3 CH(OH)COOH
- Racemska formula: C 3 H 6 O 3

Mliječna kiselina nastaje kada fermentacija mliječne kiselinešećera, posebno u kiselom mlijeku, tokom fermentacije vina i piva. Koristi se u hemijskoj i prehrambenoj industriji kao konzervans. U ljudskom tijelu, mliječna kiselina (laktat) nastaje razgradnjom glukoze.
Dakle, postoji li razlika između mliječne kiseline i laktata? br. IN organska hemijačesto se naziva mliječna kiselina, u biohemiji - laktat.
Laktat, vjerovatno okružuje najveći broj različitih mitova, večina od kojih nisu istinite. I iako na ruskom jeziku postoji dovoljno pouzdanih materijala o laktatu, brojni sportaši amateri (i neki profesionalci) tvrdoglavo nastavljaju vjerovati i ponavljati mitove prošlog stoljeća.
Hajde da ukratko i sažeto ponovimo osnovne činjenice o laktatu.
Laktat se uvijek stvara tokom proizvodnje energije u tijelu.
Glavni način na koji energija ulazi u ćelije je razgradnja glukoze. Molekula glukoze prolazi kroz niz od 10 uzastopnih reakcija kako bi proizvela piruvat u procesu koji se naziva glikoliza. Nadalje, jedan dio piruvata se djelomično oksidira i pretvara u ugljični dioksid i vodu. Drugi dio se pretvara u laktat pod kontrolom enzima laktat dehidrogenaze.
Ova reakcija je reverzibilna.

Dio laktata se koristi za sintezu energije.
Između 15 i 20 posto ukupnog laktata se pretvara u glikogen tokom glukoneogeneze.
Laktat je univerzalni nosilac energije.
U uslovima visoka proizvodnja energije u anaerobnom režimu, laktat je nosilac energije od onih mesta gde je nemoguće izvršiti transformaciju energije, zbog povećane kiselosti, do onih mesta gde se može transformisati u energiju (srce, respiratorni mišići, spora mišićna vlakna, dr. mišićne grupe).
Povećanje nivoa laktata nije posledica nedostatka kiseonika.
Studije na životinjama pokazuju da intracelularni nedostatak kiseonika u izolovanom mišiću ne pokazuje nikakva ograničenja aktivnosti mitohondrijalnog respiratornog lanca čak i tokom maksimalnog vežbanja. Uvek ćemo imati dovoljno kiseonika u mišićima.
Laktat je indikator opterećenja anaerobnom glikolizom.
Svaki put kada se formira piruvat, krajnji proizvod metabolizma glukoze tokom glikolize, nastaje laktat. Laktat se akumulira jednostavno zato što su stope transformacije energije u anaerobnim i aerobnim vježbama različite.
Što je veći intenzitet rada, proizvodi se više laktata.
Nivo laktata u krvi usko je povezan s intenzitetom vježbanja. Laktat se akumulira zbog razlike u brzini transformacije energije u anaerobnim i aerobnim vježbama. Brzina transformacije energije u anaerobnom energetskom metabolizmu je brža nego u aerobnom.
Laktat ne stvara kiselost, već je prati.
Proizvodnjom energije istovremeno proizvodimo kiselost. Energetske reakcije u našem tijelu odvijaju se uz sudjelovanje elektrona kao nosioca energije. Proizvodi glukolize su laktat i vodikov proton H+. Mjera aktivnosti (koncentracije) vodikovih jona (H+) u otopini izražava njenu kiselost.
Laktat samo privremeno uzima kiseli agens (H+) da izvrši reakciju, a zatim ga vraća u neutralnu sredinu.
90% laktata tijelo iskoristi u prvom satu nakon treninga.
60% laktata u tijelu se potpuno oksidira u CO2 i vodu. Oko 20% se pretvara u glikogen u procesu glukoneogeneze, dio se koristi za stvaranje novih aminokiselina. Samo mali dio (manje od 5%) laktata izlučuje se znojem i urinom.

Laktat u krvi neće sistematski odražavati prisustvo laktata u mišićima.
Poređenje koncentracije laktata u mišićima i krvi pokazuje da ako napor prelazi 75-80% VO2max, tada je koncentracija laktata u mišićima (biopsija mišića prednje površine bedra) veća nego u krvi. Za razliku od vježbanja umjerenog intenziteta 30%,50%,70% VO2max gdje je koncentracija laktata u arterijske krvi više nego u mišićima.
Laktat ne uzrokuje bol i grčeve u mišićima.
Bol u mišićima dan nakon intenzivnog treninga uzrokovan je oštećenjem mišića i upalom tkiva koja se javlja nakon vježbanja. Većinu grčeva u mišićima pokreću nervni receptori u mišićima koji postaju pretjerano uzbuđeni s početkom umora u mišićima.
Preuzeto sa cmtscience.com (2016).
