pH acido lattico di soluzioni acquose. Acido lattico (acido 2-idrossipropionico)
ACIDO LATTICO acido (2-idrossipropionico) CH 3 CH(OH)COOH, peso molecolare 90,1; cristalli incolori. Acido D(+)-lattico noto, acido D(-)-lattico (carne-lattico) e racemico. ACIDO LATTICO.-fermentazione dell'acido lattico. Per D,L- e D-M.k. punto di fusione, rispettivamente, 18 °C e 53 °C; punto di ebollizione, rispettivamente, 85 ° C / 1 mm Hg. e 103°C/2mm Hg; per D-M.k. [a] D 20 -2,26 (concentrazione 1,24% in acqua). Per D,L-M. K. DH 0 arr - 682,45 kJ / mol; DH 0 pl 11,35 kJ/mol; Test DH 110,95 kJ/mol (25°C), 65,73 kJ/mol (150°C). Per L-M.k. DH 0 bruciato - 1344,8 kJ/mol; DH 0 arr -694,54 kJ/mol; DH 0 pl 16,87 kJ/mol.
A causa dell'elevata igroscopicità dell'ACIDO LATTICO. di solito usa il suo concentratore. soluzioni acquose, sciroppose, incolori. liquidi inodori. Per soluzioni acquose ACIDO LATTICO. d 20 4 1,0959 (40%), 1,1883 (80%), 1,2246 (100%); n D 25 1,3718 (37,3%), 1,4244 (88,6%); h 3.09 e 28.5 MPa. s (25 0 C), rispettivamente, per soluzioni 45,48 e 85,32%; g 46,0. 10 -3 N/m (25°C) per soluzione 1 M; e 22 (17°C). ACIDO LATTICO solubile in acqua, etanolo, scarsamente in benzene, cloroformio e altri alocarburi; pKa 3,862 (25°C); pH delle soluzioni acquose 1,23 (37,3%), 0,2 (84,0%).
Ossidazione ACIDO LATTICO. solitamente accompagnato da decomposizione. Sotto l'azione di HNO 3 o O 2 si formano aria in presenza di Cu o Fe, HCOOH, CH 3 COOH, (COOH) 2, CH 3 CHO, CO 2 e acido piruvico. Recupero ACIDO LATTICO. HI porta all'acido propionico e la riduzione in presenza di Re nero porta al glicole propilenico.
M. a. si disidrata ad acido acrilico, quando riscaldato con HBr forma acido 2-bromopropionico, quando il sale di Ca reagisce con PCl 5 o SOCl 2 -2-cloropropionil cloruro. In presenza avviene l'autoesterificazione degli acidi minerali ACIDO LATTICO. con la formazione del lattone di formula I, nonché poliesteri lineari. Quando si interagisce con l'ACIDO LATTICO. con gli alcoli si formano idrossiacidi RCH 2 CH(OH)COOH e per interazione dei sali ACIDO LATTICO. con alcoli ed eteri. I sali e gli esteri dell'ACIDO LATTICO sono detti lattati (vedi tabella).
M.k. formata di conseguenza fermentazione dell'acido lattico(durante l'acidificazione del latte, dei crauti, delle verdure in salamoia, della stagionatura del formaggio, dell'insilaggio del foraggio); D-M.k. trovato nei tessuti di animali, piante e microrganismi.
Nell'industria, l'ACIDO LATTICO si ottiene per idrolisi dell'acido 2-cloropropionico e dei suoi sali (100 ° C) o del lattonitrile CH 3 CH (OH) CN (100 ° C, H 2 SO 4) seguita dalla formazione di esteri, l'isolamento e la cui idrolisi porta al prodotto Alta qualità. Esistono altri metodi per ottenere ACIDO LATTICO: ossidazione del propilene con ossidi di azoto (15-20 ° C) seguita da trattamento con H 2 SO 4, interazione di CH 3 CHO con CO (200 ° C, 20 MPa).
PROPRIETA' DI ALCUNI LATTATI
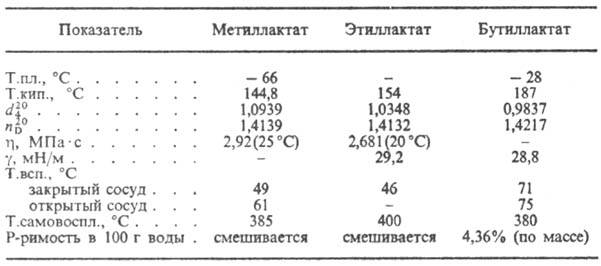
M.k. utilizzato nell'industria alimentare, nella tintura delle macchie, nell'industria del cuoio, nei negozi di fermentazione come agente battericida, per ottenere lek. Mer, plastificanti. I lattati etilici e butilici sono usati come solventi per eteri di cellulosa, oli essiccanti e crescono. oli; lattato di butile - anche come solvente per alcuni sintetici. polimeri.
Produzione mondiale ACIDO LATTICO. 40 mila tonnellate (1983).
Enciclopedia chimica. Tomo 3 >>
La nomenclatura razionale degli enzimi viene compilata aggiungendo alla radice latina del nome del substrato su cui agisce l'enzima, o al nome del processo catalizzato dall'enzima, la desinenza "aza".
Ad esempio, l'enzima che agisce sull'amido (amylum) è chiamato amilasi; urea (urea) - ureasi; fenoli - fenolasi, ecc.
Oltre al nome razionale, sono stati conservati termini precedentemente apparsi: pepsina, tripsina.
Nel 1961, un nuovo classificazione internazionale, in base al tipo di reazione catalizzata.
Attualmente sono noti circa 3000 diversi enzimi. Sono classificati in base al loro tipo di azione. Esistono 6 classi di enzimi:
1 .Ossidoreduttasi – redox
enzimi; catalizzare l'ossidazione biologica.
2.Transferasi - catalizzare reazioni di trasferimento di vario genere gruppi chimici da una molecola (donatore) ad un'altra molecola (accettore).
3. Idrolasi - effettuare trasformazioni chimiche di sostanze con la partecipazione di una molecola d'acqua.
4. Buio - scindere l'uno o l'altro gruppo dai substrati con mezzi non idrolitici.
5. Isomerasi - effettuare trasformazioni isomeriche di composti.
6. Ligasi (sintetasi) - catalizzare le reazioni di sintesi, accompagnate dall'eliminazione dell'acido fosforico dall'ATP o da un altro trifosfato.
io classe. Ossidoreduttasi sono enzimi delle reazioni redox che stanno alla base ossidazione biologica. Il nome degli enzimi è compilato nella seguente forma: il nome del substrato (donatore) da cui vengono scissi gli atomi di idrogeno (elettroni), il nome dell'accettore a cui vengono trasferiti gli atomi di idrogeno e termina con il nome "ossidoreduttasi": per esempio, lattato: NAD-ossidoreduttasi.
Si distinguono le seguenti sottoclassi:
1) deidrogenasi aerobiche che trasferiscono elettroni e protoni di idrogeno da un substrato ossidato all'ossigeno:
H 2 S + O 2 S ossidato + H 2 O 2
idrogeno solforato
questi includono enzimi ossidasi;
2) le deidrogenasi anaerobiche trasferiscono elettroni e protoni di idrogeno dal substrato ossidato ad un altro. Questi includono deidrogenasi piridina-dipendenti e flavina-dipendenti. Ad esempio, l'ossidazione dell'acido lattico avviene sotto l'azione della lattato deidrogenasi, mentre il NAD è ridotto a NADH 2:

acido lattico acido piruvico
L'ossidazione dell'acido succinico avviene sotto l'azione della succinato deidrogenasi, mentre il FAD è ridotto a FADH 2.

acido succinico acido fumarico
3) trasporto di elettroni - portatori di elettroni. Questi includono enzimi del citocromo, citocromo ossidasi della catena respiratoria mitocondriale
4) perossidasi e catalasi. La perossidasi catalizza l'ossidazione di un substrato con perossido di idrogeno. Ad esempio, sotto l'azione della perossidasi, l'idrogeno solforato viene ossidato con la partecipazione del perossido di idrogeno:
H 2 S + H 2 O 2 S ossidato + 2H 2 O
La catalasi negli animali scompone il perossido di idrogeno in acqua e ossigeno molecolare:
2H2O2 2H2O + O2
La catalasi neutralizza l'effetto del perossido ed è una fonte di ossigeno molecolare nei tessuti.
II classe. Transferasi- catalizzano le reazioni di trasferimento di atomi e gruppi di atomi, comprendono le seguenti sottoclassi:
1) Le aminoferasi sono enzimi che trasferiscono gruppi amminici da una sostanza all'altra. Il coenzima è un derivato della vitamina B6 (piridossina): ad esempio l'acido glutammico dona un gruppo amminico al piruvato, di conseguenza viene sintetizzata l'alanina e si forma l'acido a-chetoglutarico.

glutammina piruvato α - alanina chetoglutarica
acido acido
La piridossina, l'enzima che svolge questa reazione, si chiama 1-glutamil:piruvato aminotransferasi o, secondo la vecchia nomenclatura, aminoferasi.
2) Aciltransferasi: accelerano il trasferimento di acil (residui di acido carbossilico) ad amminoacidi, alcoli e altri composti. Ad esempio, la sintesi dell'acetilcolina viene effettuata con la partecipazione dell'enzima colina acetiltransferasi:

3) Fosfotransferasi - enzimi che accelerano la reazione di trasferimento di un residuo di acido fosforico. Il donatore più comune di residui di fosfato è l'ATP. Ad esempio, l'esochinasi accelera il trasferimento di un residuo di acido fosforico al glucosio:

α-D-glucosio glucosio-6-fosfato
4) Metilferasi - enzimi che trasferiscono un gruppo metilico da un composto all'altro: ad esempio, nella sintesi della creatina, la metionina è un donatore di gruppi metilici.
5) Glucosiltransferasi - portatori di glucosidi
avanzi:
11 (C 6 H 12 O 6) + UDP - glucosio (n + 1) (C 6 H 12 O 6) + UDP
questi includono glicogeno sintasi, glucosiltransferasi, fosforibosiltransferasi, ecc.
6) Alchiltransferasi - portatori di residui alcolici. Questi includono colina transferasi, fosfatildietanolammina transferasi, ecc.
classe III. Idrolasi- rompere i legami intramolecolari aggiungendo elementi di acqua:
R - R 1 + HOH R - H + R 1 - OH
Questi includono le seguenti sottoclassi:
1) Esterasi - enzimi che idrolizzano i legami estere secondo lo schema:
R 1 -0-R 2 + HOH R 1 -H + R 2 -OH
Ad esempio, le fosfodiesterasi - idrolizzano gli esteri del fosforo:
Acido diacilglicerolo 3-fosforico + HOH diacilglicerolo + H 3 PO 4.
Questa sottoclasse include: fosfatasi (acida, alcalina), glucosio-6-glucosio-1-fosfatasi, RNasi, ecc.
Carbossiesterasi - idrolizzano i legami esteri:

tristearina glicerina stearica
Questi enzimi includono lipasi, lecitinasi, semplici esterasi, ecc.
Sulfoesterasi - idrolizzano gli esteri di solfato secondo il seguente schema:
acido fenolo solforico acido fenolo solforico
2) Glicosidasi - idrolizzano i legami glicosidici, questi includono α- e β-amilasi, maltasi, lattasi, sucrasi.
3) Peptidasi. Esistono endopeptidasi: pepsina, tripsina, chemiotripsina; esopeptidasi - aminopeptidasi, carbossipeptidasi, dipeptidasi, tripeptidasi.
Le peptidasi idrolizzano legami peptidici dalla seguente reazione:
![]()
alanilalanina alanina
Come risultato dell'idrolisi, si formano due molecole di alanina.
4) Amidasi - enzimi che idrolizzano i legami ammidici di basi puriniche e pirimidiniche, ammidi di amminoacidi e
arginina. Esempi:
A) Adenina + H 2 O ipoxantina + NH 3
purina deaminasi

glutammina glutammica

arginina urea ornitina
5) Polifosfatasi - idrolizzano i legami di anidride fosforica:
ATP + H 2 O ADP + H 3 PO 4
Questo gruppo include Na + , K + , Mg 2+ -ATPase, ecc.
Classe IV. Le liasi sono enzimi che scindono i legami senza la partecipazione dell'acqua, mentre si rompono Connessioni C-C, obbligazioni CN, Connessioni C-O. Questi includono gli enzimi aldolasi, decarbossilasi e altri. Ad esempio, l'aldolasi rompe i legami C-C dell'esoso (1,6-difosfofruttosio) per formare due triosi, fosfodiossiacetone e fosfogliceraldeide:

Classe V. Isomerasi: catalizzano l'isomerizzazione, la trasformazione isomerica di molecole, come il glucosio in fruttosio. Le mutasi cambiano la posizione di diversi gruppi o atomi in una molecola. Questi includono: fosfogliceromutasi, fosfoglucomutasi, fosfofruttomutasi, ecc. Ad esempio, il fosfodiossiacetone viene convertito dall'isomerasi in fosfogliceraldeide:

fosfodiossiacetone fosfogliceraldeide
VI classe. Le ligasi (sintetasi) sono enzimi che catalizzano l'attaccamento delle molecole l'una all'altra. Per esempio:
Amminoacido + tRNA amminoacil-tRNA
Questi includono enzimi: DNA polimerasi, RNA polimerasi, enzimi che catalizzano la sintesi proteica, ecc.
Reagenti:
Acido ftalico
Progresso:
~ 0,1-0,2 g di acido ortoftalico vengono posti in una provetta asciutta e riscaldati sulla fiamma di una lampada ad alcool, tenendo la provetta orizzontalmente. Si forma anidride ftalica, che sublima e condensa nuovamente sulle pareti fredde della provetta. Il tubo viene raffreddato, quindi il precipitato di anidride ftalica viene accuratamente riscaldato, si scioglie facilmente e scorre verso il fondo del tubo.
Esperienza n. 56. Ottenere fenolftaleina
Reagenti:
Anidride ftalica
Progresso:
~ 0,2 g di fenolo, ~ 0,1 g di anidride ftalica, ~ 5 gocce di acido solforico concentrato vengono posti in una provetta asciutta e riscaldati delicatamente sulla fiamma di una lampada ad alcool. La miscela si scioglie, il fenolo si condensa con l'anidride ftalica:

Quindi, il tubo viene raffreddato in aria. Aggiungere mezza provetta d'acqua alla miscela raffreddata e agitare energicamente. La soluzione risultante viene trasferita in un'altra provetta e vengono aggiunte alcune gocce di soluzione alcalina. In un ambiente alcalino appare un colore rosso cremisi, che indica la presenza di fenolftaleina in soluzione.
In un ambiente alcalino si verifica l'isomerizzazione di uno dei nuclei benzenici, si forma un gruppo chinoide che provoca la comparsa del colore. Quando la soluzione è acidificata, il colore scompare; quando si aggiunge l'alcali, riappare. La proprietà specificata della fenolftaleina viene utilizzata in chimica analitica come indicatore (indicatore) della reazione del mezzo.
Se invece del fenolo prendiamo il resorcinolo (fenolo diidrico) ed eseguiamo l'esperimento nello stesso modo descritto sopra, allora si forma la fluoresceina. Una soluzione di fluoresceina in un mezzo alcalino ha un bel colore, rosso in luce trasmessa, verde in luce riflessa (fluorescenza).
VIII. IDROSSIACIDI
Esperienza n. 57. Rilevazione dell'acido lattico
Reagenti:
Soluzione di 1% di fenolo
Una soluzione di cloruro ferrico all'1%.
Acido lattico
Progresso:
A ~ 3 ml di una soluzione all'1% di fenolo, aggiungere alcune gocce di una soluzione all'1% di cloruro di ferro (III). Il liquido diventa viola brillante a causa della formazione di fenolati ferrici complessi. Al liquido risultante vengono aggiunte alcune gocce di acido lattico e il colore della soluzione vira al verde-giallo per la formazione di lattato di ferro (CH 3 CH (OH) COO) 3 Fe.
Esperienza n. 58. Decomposizione dell'acido lattico quando riscaldato con acido solforico concentrato
Reagenti:
Acido lattico
acido solforico concentrato
Progresso:
Una miscela di volumi uguali (~0,5 ml ciascuno) di acido lattico e solforico viene accuratamente riscaldata in una provetta con un tubo di uscita del gas. Il monossido di carbonio rilasciato (II) si accende all'apertura del tubo di uscita del gas, brucia con una fiamma bluastra.
- Acido α-idrossipropionico (2-idrossipropanoico), CH 3 CH(OH)COOH. Acido idrossicarbossilico monobasico; un importante intermedio metabolico in animali, piante e microrganismi; acido monocarbossilico limitante della serie aciclica

Fu scoperto dal chimico svedese Carl Scheele nel 1780.
Nel 1807, Jens Jakob Berzelius isolò il sale di zinco dell'acido lattico dai muscoli.
Descrizione e proprietà
Cristalli incolori, facilmente solubili in acqua, etanolo, scarsamente - in benzene, cloroformio. Esiste in due forme otticamente attive (-) e (+) ( T pl 25-26 °C) e sotto forma di una forma racemica (±) inattiva (t pl 18 °C).
Reazioni

Acido lattico nell'uomo e negli animali
L'acido lattico si forma dalla scomposizione del glucosio. A volte indicato come "zucchero nel sangue", il glucosio è la principale fonte di carboidrati del nostro corpo. È il carburante principale per il cervello e sistema nervoso, così come per i muscoli durante l'esercizio. Quando il glucosio viene scomposto, le cellule producono ATP (adenosina trifosfato), che fornisce energia per la maggior parte delle persone reazioni chimiche nell'organismo. Il livello di ATP determina quanto velocemente e per quanto tempo i nostri muscoli possono contrarsi quando attività fisica. La produzione di acido lattico non richiede la presenza di ossigeno, motivo per cui questo processo viene spesso definito "metabolismo anaerobico". Molte persone credono che i muscoli producano acido lattico quando non ricevono abbastanza ossigeno dal sangue. In altre parole, sei in uno stato anaerobico. Tuttavia, gli scienziati affermano che l'acido lattico si forma anche nei muscoli che ricevono abbastanza ossigeno. Un aumento della quantità di acido lattico nel flusso sanguigno indica solo che il livello della sua assunzione supera il livello di rimozione. L'ossigeno non gioca un ruolo significativo qui. La produzione di ATP dipendente dal lattato è molto piccola, ma ha un tasso elevato. Questa circostanza lo rende ideale per l'utilizzo come combustibile quando il carico supera il 50% del massimo. Durante il riposo e il carico submassimale (piuttosto moderato, submassimale è generalmente inteso come il 90% del massimo), il corpo preferisce abbattere i grassi per produrre energia. A carichi del 50% del massimo (la soglia di intensità per la maggior parte dei programmi di allenamento), il corpo viene ricostruito al consumo preferenziale di carboidrati. Più carboidrati usi come carburante, più più produzione acido lattico.
Per consentire il passaggio del glucosio membrane cellulari Ha bisogno di insulina. La molecola di acido lattico è grande la metà della molecola di glucosio e non ha bisogno di supporto ormonale: passa facilmente attraverso le membrane cellulari da sola.
Applicazione.
L'acido lattico è utilizzato nell'industria alimentare, nella tintura delle macchie, nell'industria del cuoio, nei negozi di fermentazione come agente battericida, per ottenere medicinali, plastificanti. I lattati di etile e butile sono usati come solventi per eteri di cellulosa, olio essiccante, oli vegetali; lattato di butile - utilizzato anche come solvente per alcuni polimeri sintetici.
Produzione mondiale di acido lattico - 40 mila tonnellate (1983).
 Heinrich Otto Wieland
Heinrich Otto Wieland
 Adolf Johann Friedrich Wilhelm von Bayer
Adolf Johann Friedrich Wilhelm von Bayer
 Federico Bergius
Federico Bergius  caratteristiche generali metalli. Occorrenza in natura e prevalenza. Metodi per l'ottenimento e la pulizia
caratteristiche generali metalli. Occorrenza in natura e prevalenza. Metodi per l'ottenimento e la pulizia
 Cromo come elemento chimico
Cromo come elemento chimico
Pagina 1
L'ossidazione dell'acido lattico con biossido di piombo porta alla produzione di acetaldeide.
Quando l'acido lattico viene ossidato con bicromato di potassio in presenza di acido solforico, si forma acetaldeide, che viene catturata per distillazione con il reagente di Nessler. Il colore di quest'ultimo indica solo l'eventuale presenza di acido lattico nel campione.
Compito 10.7. L'ossidazione dell'acido lattico in acido poligrado (2-ossopropanoico) si verifica negli organismi viventi come una delle fasi dello scongelamento biologico dei carboidrati.
L'acido piruvico può essere sintetizzato dall'ossidazione dell'acido lattico (vedi Sez.
L'energia rilasciata durante l'ossidazione dell'acido lattico viene utilizzata nel muscolo per la risintesi del glicogeno.
Un esempio di questa reazione è l'ossidazione dell'acido lattico ad acido piruvico.
Abbiamo studiato in dettaglio l'influenza dell'acidità del mezzo e l'eccesso dell'agente ossidante durante l'ossidazione dell'acido lattico con bicromato di potassio.
Se il muscolo avvelenato dal prodotto della propria attività vitale viene trasferito in un'atmosfera di ossigeno, il quadro cambia. Iniziano due processi: l'ossidazione dell'acido lattico, che si traduce in un ulteriore e molto significativo rilascio di energia, e la sintesi del glicogeno. Si scopre che i processi di conversione graduale del glicogeno in glucosio e poi in acido lattico sono reversibili in tutte le loro fasi più importanti. La macchina biochimica può lavorare all'indietro e creare di nuovo materie prime dai prodotti finali. Una parte dell'acido lattico - il prodotto finale della glicogenolisi (decomposizione del glicogeno) passa nuovamente alla materia prima - il glicogeno.
Il metodo si basa sulla misurazione dell'intensità del colore del composto formato durante la reazione di una cetaldeide, che si è formata a causa dell'ossidazione dell'acido lattico con il paraossidifenile.
Sebbene il citocromo b2 catalizzi la decomposizione di altri substrati (a-idrossi-n-butirrati, a-idrossi-m-caproati, oc-idrossiisocaproati), la loro concentrazione nei mezzi biologici è di diversi ordini di grandezza inferiore alla concentrazione di acido lattico, quindi l'effetto interferente è trascurabilmente piccolo. Un gran numero di metaboliti con proprietà riducenti, per esempio acido urico, glutatione, cisteina, adrenalina, acido ascorbico, p-alanina, vengono ossidati o [Fe (CN) 6 ] 3, o su un elettrodo di platino, e la loro corrente di ossidazione viene aggiunta alla corrente corrispondente all'ossidazione dell'acido lattico. Pertanto, in presenza di questi metaboliti, non è desiderabile effettuare la determinazione dell'acido lattico.
Tale apparato è descritto per la microdeterminazione della treonina usando t-idrossidifenile (vedi Cap. L'ossidazione dell'acido lattico ad acetaldeide termina a 50 bagnomaria per 30 minuti. Nello stesso tempo, l'acetaldeide viene soffiata in 15 ml di HtaSCh forte contenente un eccesso di n-ossidifenile L'intera operazione eseguita come descritto nel cap.
Le provette con il filtrato vengono poste in acqua ghiacciata e lentamente, goccia a goccia, si aggiungono 1 ml di acido solforico concentrato. Le provette devono essere agitate delicatamente per tutto il tempo e assicurarsi che il loro contenuto non si riscaldi. Per accelerare l'ossidazione dell'acido lattico, entrambe le provette vengono trasferite in un bagno bollente per 4 minuti, quindi raffreddate rapidamente in acqua ghiacciata. Dopo il raffreddamento, aggiungere 1 - 2 gocce di soluzione 0,1% di veratrol a ciascuna provetta, agitare delicatamente per diversi minuti. Nel campione sperimentale si sviluppa un colore rosa brillante, poiché la glicolisi si è verificata sotto l'influenza degli enzimi del tessuto muscolare. Nel campione di controllo, il colore è leggermente rosato a causa dell'acido lattico, che era presente nella polpa muscolare prima dell'inizio dell'esperimento.
Il gruppo di Luria ha mostrato che l'attaccamento delle molecole proteiche della colicina K ed E1 alle cellule del batterio E-coli è accompagnato dalla cessazione della sintesi delle macromolecole: proteine, DNA, RNA e glicogeno. Il trasporto attivo di zucchero del latte (lattosio), glutammina, vari amminoacidi e ioni di potassio e magnesio. Allo stesso tempo, la cellula continua ad accumulare glucosio, il cui trasporto attivo è fornito direttamente dall'energia di ossidazione dell'acido lattico.
È anche uno dei prodotti intermedi dell'acido lattico e fermentazione alcolica carboidrati. Può essere ottenuto dall'interazione del cloruro di acetile con il cianuro di potassio, seguita dall'idrolisi del chetononitrile risultante, o dall'ossidazione dell'acido lattico.
La reazione viene condotta con i filtrati in presenza di acido lattico. Per fare questo, prendi 2 provette numerate pulite: nella prima - 10 gocce di filtrato campione di controllo, nel secondo - 10 gocce del filtrato del campione sperimentale. Non dobbiamo dimenticare che un forte surriscaldamento può portare alla carbonizzazione dell'acido lattico. Per accelerare l'ossidazione dell'acido lattico, entrambe le provette vengono trasferite in un bagno d'acqua bollente per 4-5 minuti e poi raffreddate rapidamente in acqua ghiacciata. Aggiungere 3 gocce di soluzione alcolica allo 0,2% di veratrolo o guaiacolo in ogni provetta ai liquidi raffreddati.
