Скорость ферментативной реакции зависит от. Зависимость скорости ферментативной реакции от температуры
Лекция №6
Основы ферментативного катализа.
Краткая история изучения кинетики ферментативных реакций. Зависимость скорости ферментативной реакции от температуры, рН, концентрации фермента и концентрации субстрата. Вывод уравнения Михаэлиса-Ментен. Ферментативная активность. Каталитическая константа - число оборотов фермента. Максимальная скорость ферментативной реакции (V max). Константа диссоциации фермент-субстратного комплекса (K s). Константа Михаэлиса-Ментен (K m).
Краткая история изучения кинетики ферментативных реакций.
Ферментативная кинетика занимается исследованием закономерностей влияния химической природы реагирующих веществ (ферментов, субстратов) и условий их взаимодействия (концентрация, рН среды, температуры, присутствие активаторов или ингибиторов) на скорость ферментативной реакции. Главной целью изучения кинетики ферментативных реакций является получение информации, которая может способствовать выяснению молекулярного механизма действия фермента.
Общие принципы кинетики химических реакций применимы и к ферментативным реакциям.
Самая ранняя попытка математически описать ферментативные реакции была предпринята Дюкло в 1898 г. Браун (1902) и независимо от него Анри (1903) впервые выдвинули гипотезу об образовании в ходе реакции фермент-субстратного комплекса. Это предположение основывалось на трех экспериментальных фактах:
1. папаин образовывает нерастворимое соединение с фибрином (Вюрц, 1880);
2. сахароза защищает фермент инвертазы от тепловой денатурации (О`Салливан и Томпсон, 1890);
3. Фишер в 1898-1899 показал, что ферменты являются стереохимически специфическими катализаторами.
МИХАЭЛИС (Michaelis), Леонор
Леонор Михаэлис – немецкий биохимик и химик-органик, основатель кинетики ферментативных процессов. Основные работы посвящены изучению ферментативных реакций. В 1913 г. ввёл константу (константа Михаэлиса) в уравнение зависимости скорости ферментативной реакции от концентрации субстрата в стационарном состоянии (уравнение Михаэлиса – Ментен).
Зависимость скорости ферментативной реакции от температуры, рН, концентрации фермента и концентрации субстрата.
Предварительные эксперименты по изучению кинетики ферментативных реакций показали, что скорость реакции E + S E + P, вопреки теоретическим ожиданиям, не зависит от концентрации фермента и субстрата так, как в случае обычной реакции второго порядка.
В тоже время к ферментам применимы три основных критерия, характерных и для неорганических катализаторов, а именно:
1. Они остаются неизмененными после реакции, т.е. освобождаясь, могут вновь реагировать с новыми молекулами субстрата (хотя нельзя исключить побочных влияний условий среды на активность фермента).
2. Ферменты способны оказывать действие в ничтожно малых концентрациях (например, одна молекула фермента ренина, содержащегося в слизистой оболочке желудка теленка, створаживает около 10 6 молекул казеиногена молока за 10 мин при температуре 37°С). Наличие либо отсутствие фермента или любого другого катализатора не оказывает влияния на величину константы равновесия и свободной энергии (ΔG).
3. Катализаторы лишь повышают скорость, с которой система приближается к термодинамическому равновесию, не сдвигая точки равновесия.
На активность фермента оказывают влияние все те факторы, которые могут вызвать изменение его структуры, а именно, к числу таких факторов относятся:
3. Силы, действующие в текучих средах (гидродинамические силы, гидростатическое давление и поверхностное натяжение)
4. Химические агенты (спирт, мочевина или пероксид водорода и др.)
5. Облучение (свет, звук, ионизирующая радиация)
6. Различные химические соединения, которые связываясь с ферментами, могут изменять скорость катализируемых ферментами реакций.
Иногда снижение каталитической активности, вызванное, например изменением рН, обратимо. В таких случаях возврат к первоначальным условиям сопровождается восстановлением активности фермента. Возможно и необратимое изменение активности фермента.
Рассмотрим влияние различных факторов на скорость ферментативной реакции.
Влияние температуры
Одним из основных уравнений химической кинетики является уравнение Аррениуса, выражающее зависимость константы скорости реакции от температуры:
Однако, температурный диапазон ферментативных реакций, для которого применимо уравнение Аррениуса, очень узок для большинства ферментов. Что же произойдет, если мы попытаемся заставить фермент катализировать процесс еще быстрее, подняв температуру выше физиологически допустимой? При высокой температуре, когда начинает доминировать процесс термической инактивации фермента, нарушается зависимость скорости реакции от температуры, описываемая уравнением Аррениуса – а именно, после определенного температурного максимума скорость реакции быстро падает дот нуля. С другой стороны при снижении температуры ниже 0°С скорость реакции также падает до нуля, т.е. реакция полностью прекращается. Таким образом ферментативные реакции имеют колоколообразную зависимость скорости реакции от температуры, что объясняется наложением двух эффектов - возрастанием скорости реакции при увеличении температуры и ускорением тепловой денатурации белковой молекулы, приводящей к инактивации фермента при высоких температурах. Денатурация большинства белков начинается в диапазоне температур от 45 до 50°С и завершается очень быстро при 55°С. Прекращение ферментативных реакции при низких температурах обусловлено тем, что водные растворы замерзают.
Таким образом, термолабильность, или чувствительность к повышению температуры, является одним из характерных свойств ферментов, резко отличающих их от неорганических катализаторов. При температуре 90°С почти все ферменты утрачивают свою активность (исключение составляет только два фермента – миокиназа, которая выдерживает нагревание до 100°С, ДНК-полимераза из термофильных бактерий макс. при 90°С). Оптимальной для действия большинства ферментов теплокровных животных является температура 40-45°С; в этих условиях скорость реакции оказывается максимальной вследствие увеличения кинетической энергии реагирующих молекул. При низких температурах (4°С и ниже) ферменты, как правило, не разрушаются, хотя активность их падает почти до нуля. Это явление обусловлено изменением строения активного центра фермента вследствие уменьшения плотности воды. Во всех случаях имеет значение время воздействия соответствующей температуры. В настоящее время для пепсина, трипсина и ряда других ферментов доказано существование прямой зависимости между скоростью инактивации фермента и степенью денатурации белка. Таким образом, влияние температуры на скорость ферментативной реакции подчиняется уравнению Аррениуса лишь в сравнитель узком диапазоне температур 4-45°С. Вне этого диапазана скорости ферментативных реакций резко снижаются, что учитывается и используется в пищевых технологиях и при хранении пищевых продуктов и лекарственных средств, содержащих ферменты. Привести примеры.

Влияние рН среды.
Ферменты, как и все белки, состоят из аминокислот. В зависимости от рН радикалы некоторых аминокислот, а значит, и белок в целом могут приобретать заряд. Заряженные группы часто входят в состав активных центров ферментов, так как в основе целого ряда механизмов ферментативного катализа лежит катализ кислотного или основного типа. Необходимым условием для осуществления кислотного или основного катализа может быть наличие определенного заряда на ионизируемых группах активного центра. Отсюда следует, что каталитически активная форма фермента существует только в одном строго определенном состоянии ионизации, и в зависимости от рН в нее может превращаться большая или меньшая часть всего имеющегося в смеси фермента.
Зависимость активности фермента от рН имеет колоколообразную форму с довольно узким максимумом. Для разных ферментов значение рН, при котором фермент имеет максимальную активность различно. В эксперименте достаточно часто используется исследование рН-зависимостей ферментативных реакций для изучения числа и свойств ионогенных групп.
При определении зависимости активности фермента от концентрации водородных ионов реакцию проводят при разных значениях рН среды, обычно при оптимальной температуре и наличии достаточно высоких (насыщающих) концентраций субстрата. На рисунке и в таблице приводятся оптимальные значения рН среды для ряда ферментов.

Рис. Зависимость активности ферментов от рН.
 |
Из данных табл. 4.3 видно, что рН-оптимум действия ферментов лежит в пределах физиологических значений. Исключение составляют пепсин, рН-оптимум которого 2,0 (при рН 6,0 он не активен и не стабилен). Объясняется это, во-первых, структурной организацией молекулы фермента и, во-вторых, тем, что пепсин является компонентом желудочного сока, содержащего свободную соляную кислоту, которая создает оптимальную кислую среду для действия этого фермента. С другой стороны, рН-оптимум аргиназы лежит в сильнощелочной зоне (около 10,0); такой среды нет в клетках печени, следовательно, in vivo аргиназа функционирует, по-видимому, не в своей оптимальной зоне рН среды.
Согласно современным представлениям, влияние изменений рН среды на молекулу фермента заключается в воздействии на состояние и степень ионизации кислотных и основных групп (в частности, СООН-группы дикарбоновых аминокислот, SH-группы цистеина, имидазольного азота гистидина, NH 2 -группы лизина и др.). При резких сдвигах от оптимума рН среды ферменты могут подвергаться конформационным изменениям, приводящим к потере активности вследствие денатурации или изменения заряда молекулы фермента. При разных значениях рН среды активный центр может находиться в частично ионизированной или неионизированной форме, что сказывается на третичной структуре белка и соответственно на формировании активного фермент-субстратного комплекса. Имеет значение, кроме того, состояние ионизации субстратов и кофакторов.
Белковая природа ферментов обусловливает появление у них ряда свойств, в целом нехарактерных для неорганических катализаторов: олигодинамичность, специфичность, зависимость скорости реакции от температуры, рН среды, концентрации фермента и субстрата, присутствия активаторов и ингибиторов.
Под олигодинамичностью ферментов понимают высокую эффективность действия в очень малых количествах. Такая высокая эффективность объясняется тем, что молекулы ферментов в процессе своей каталитической деятельности непрерывно регенерируют. Типичная молекула фермента может регенерировать миллионы раз в минуту. Надо сказать, что и неорганические катализаторы также способны ускорять превращение такого количества веществ, которое во много раз превышает их собственную массу. Но ни один неорганический катализатор не может сравниться с ферментами по эффективности действия.
Примером может служить фермент реннин, вырабатываемый слизистой оболочкой желудка жвачных животных. Одна молекула его за 10 минут при 37°С способна вызывать коагуляцию (створаживание) порядка миллиона молекул казеиногена молока.
Другой пример высокой эффективности ферментов даёт каталаза. Одна молекула этого фермента при 0°С расщепляет за секунду около 50 000 молекул пероксида водорода:
2 Н2О2 2 Н2О + О2
Действие каталазы на пероксид водорода заключается в изменении величины энергии активации этой реакции приблизительно от 75 кДж/моль без катализатора до 21 кДж/моль в присутствии фермента. Если же в качестве катализатора этой реакции используется коллоидная платина, то энергия активации составляет всего 50 кДж/моль.
7.2.2. При изучении влияния какого-либо фактора на скорость ферментативной реакции все прочие факторы должны оставаться неизменными и по возможности иметь оптимальное значение.
Мерой скорости ферментативных реакций служит количество субстрата, подвергшегося превращению в единицу времени, или количество образовавшегося продукта. Изменение скорости проводят на начальной стадии реакции, когда продукт ещё практически отсутствует, и обратная реакция не идёт. Кроме того, на начальной стадии реакции концентрация субстрата соответствует его исходному количеству.
7.2.3. Зависимость скорости ферментативной реакции (V) от концентрации фермента [Е] (рисунок 7.3). При высокой концентрации субстрата (многократно превышающей концентрацию фермента) и при постоянстве других факторовскорость ферментативной реакции пропорциональна концентрации фермента. Поэтому зная скорость реакции, катализируемой ферментом, можно сделать вывод о его количестве в исследуемом материале.
Рисунок 7.3. Зависимость скорости ферментативной реакции от концентрации фермента
7.2.4. Зависимость скорости реакции от концентрации субстрата [S] . График зависимости имеет вид гиперболы (рисунок 7.4). При постоянной концентрации фермента скорость катализируемой реакции возрастает с увеличением концентрации субстрата до максимальной величины Vmax, после чего остаётся постоянной. Это следует объяснить тем, что при высоких концентрациях субстрата все активные центры молекул фермента оказываются связанными с молекулами субстрата. Любое избыточное количество субстрата может соединиться с ферментом лишь после того, как образуется продукт реакции и освободится активный центр.

Рисунок 7.4. Зависимость скорости ферментативной реакции от концентрации субстрата.
Зависимость скорости реакции от концентрации субстрата может быть выражена уравнением Михаэлиса - Ментен:
 ,
,
где V - скорость реакции при концентрации субстрата [S] , Vmax -максимальная скорость и KM -константа Михаэлиса.
Константа Михаэлиса равна концентрации субстрата, при которой скорость реакции составляет половину максимальной. Определение KM и Vmax имеет важное практическое значение, так как позволяет количественно описать большинство ферментативных реакций, включая реакции с участием двух и более субстратов. Различные химические вещества, изменяющие активность ферментов, по-разному воздействуют на величины Vmax и KM.
7.2.5. Зависимость скорости реакции от t – температуры, при которой протекает реакция (рисунок 7.5), имеет сложный характер. Значение температуры, при котором скорость реакции максимальна, представляет собой температурный оптимум фермента. Температурный оптимум большинства ферментов организма человека приблизительно равен 40°С. Для большинства ферментов оптимальная температура равна или выше тойц температуры, при которой находятся клетки.
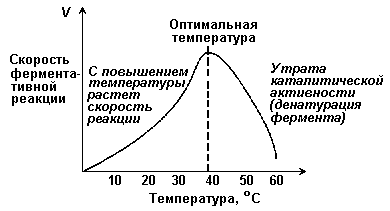
Рисунок 7.5. Зависимость скорости ферментативной реакции от температуры.
При более низких температурах (0° - 40°С) скорость реакции увеличивается с ростом температуры. При повышении температуры на 10°С скорость ферментативной реакции удваивается (температурный коэффициент Q10 равен 2). Повышение скорости реакции объясняется увеличением кинетической энергии молекул. При дальнейшем повышении температуры происходит разрыв связей, поддерживающих вторичную и третичную структуру фермента, то есть тепловая денатурация. Это сопровождается постепенной потерей каталитической активности.
7.2.6. Зависимость скорости реакции от рН среды (рисунок 7.6). При постоянной температуре фермент работает наиболее эффективно в узком интервале рН. Значение рН, при котором скорость реакции максимальна, представляет собой оптимум рН фермента. У большинства ферментов организма человека оптимум рН находится в пределах рН 6 – 8, но есть ферменты, которые активны при значениях рН, лежащих за пределами этого интервала (например, пепсин, наиболее активный при рН 1,5 - 2,5).
Изменение рН как в кислую, так и в щелочную сторону от оптимума приводит к изменению степени ионизации кислых и основных групп аминокислот, входящих в состав фермента (например, СООН-группы аспартата и глутамата, NН2-группы лизина и т.д.). Это вызывает изменение конформации фермента, в результате чего изменяется пространственная структура активного центра и снижение его сродства к субстрату. Кроме того, при экстремальных значениях рН происходит денатурация фермента и его инактивация.

Рисунок 7.6. Зависимость скорости ферментативной реакции от рН среды.
Следует отметить, что свойственный ферменту оптимум рН не всегда совпадает с рН его непосредственного внутриклеточного окружения. Это позволяет предположить, что среда, в которой находится фермент, в какой-то мере регулирует его активность.
7.2.7. Зависимость скорости реакции от присутствия активаторов и ингибиторов . Активаторы повышают скорость ферментативной реакции. Ингибиторы понижают скорость ферментативной реакции.
В качестве активаторов ферментов могут выступать неорганические ионы. Предполагают, что эти ионы заставляют молекулы фермента или субстрата принять конформацию, способствующую образованию фермент-субстратного комплекса. Тем самым увеличивается вероятность взаимодействия фермента и субстрата, а следовательно и скорость реакции, катализируемой ферментом. Так, например, активность амилазы слюны повышается в присутствии хлорид-ионов.
Механизм действия ферментов. Каталитический (активный) центр. Коферменты и кофакторы. Конкурентное и неконкурентное ингибирование. Использование конкурентных ингибиторов как лекарственных препаратов.
Активный центр (Ац) – это часть молекулы фермента, которая специфически взаимодействует с субстратом и принимает непосредственное участие в катализе. Ац, как правило, находиться в нише (кармане). В Ац можно выделить два участка: участок связывания субстрата – субстратный участок (контактная площадка) и собственно каталитический центр .
Большинство субстратов образует, по меньшей мере, три связи с ферментом, благодаря чему молекула субстрата присоединяется к активному центру единственно возможным способом, что обеспечивает субстратную специфичность фермента. Каталитический центр обеспечивает выбор пути химического превращения и каталитическую специфичность фермента.
У группы регуляторных ферментов есть аллостерические центры , которые находятся за пределами активного центра. К аллостерическому центру могут присоединяться “+” или “–“ модуляторы, регулирующие активность ферментов.
Различают ферменты простые, состоят только из аминокислот, и сложные, включают также низкомолекулярные органические соединения небелковой природы (коферменты) и (или) ионы металлов (кофакторы).
Коферменты – это органические вещества небелковой природы, принимающие участие в катализе в составе каталитического участка активного центра. В этом случае белковую составляющую называют апоферментом , а каталитически активную форму сложного белка – холоферментом . Таким образом: холофермент = апофермент + кофермент.
В качестве коферментов функционируют:
· нуклеотиды,
· коэнзим Q,
· Глутатион
· производные водорастворимых витаминов:
Кофермент, который присоединен к белковой части ковалентными связями называется простетической группой . Это, например, FAD, FMN, биотин, липоевая кислота. Простетическая группа не отделяется от белковой части. Кофермент, который присоединен к белковой части нековалентными связями называется косубстрат . Это, например, НАД + , НАДФ + . Косубстрат присоединяется к ферменту в момент реакции.
Кофакторы ферментов – это ионы металлов, необходимые для проявления каталитической активности многих ферментов. В качестве кофакторов выступают ионы калия, магния, кальция, цинка, меди, железа и т.д. Их роль разнообразна, они стабилизируют молекулы субстрата, активный центр фермента, его третичную и четвертичную структуру, обеспечивают связывание субстрата и катализ. Например, АТФ присоединяется к киназам только вместе с Mg 2+ .
Концентрация фермента оказывает существенное влияние на скорость ферментативной реакции. При насыщающей концентрации субстрата, обеспечивающей V max , начальная скорость ферментативной реакции будет, в первую очередь, зависеть от концентрации фермента. Эта зависимость прямо пропорциональная, что свидетельствует о том, что начальная скорость является мерой количества фермента. Графически это представлено на рис. 8.5.
Рис. 8.5. Влияние концентрации фермента [E] на скорость ферментативной реакции (V 0)
Влияние температуры на активность ферментов. Общий вид кривой, характеризующей влияние температуры на активность фермента, можно представить в виде графика, изображенного на рис. 8.6.
Оптимальная температура, при которой наблюдается максимальная активность, для большинства ферментов находится в пределах 37-50 0 C, но некоторые ферменты имеют температурный оптимум за пределами этой зоны.

Рис. 8.6.
Влияние температуры на активность фермента
Влияние температуры на активность фермента, которое может быть легко изучено экспериментально, имеет очень сложный характер, так как обусловлено целым рядом факторов, а именно:
Влиянием температуры на скорость расщепления комплекса ES на свободный фермент и продукт реакции, т. е. на константу скорости реакции
Влиянием температуры на сродство фермента к субстрату, то есть на константы k +1 и k _,;
Влиянием на теплоту ионизации, а, следовательно, на процессы ионизации всех компонентов реакции: самого фермента, субстрата, промежуточных и конечных продуктов реакции;
Влиянием на образование таких соединений, как "фермент-активатор" или "фермент-ингибитор";
Влиянием на процесс денатурации ферментного белка.
Известное уравнение Аррениуса, характеризующее влияние температуры на скорость химической реакции, может быть приложено к левой части температурной кривой (см. рис. 8.6):
Это уравнение дает возможность определить энергию активации путем определения значений Q 10 для данной ферментативной реакции.
Для обычных химических реакций Q 10 = 2-3, для ферментативных реакций (левая часть температурной кривой) Q 10 = 1-2, причем значение Q 10 = 1 характерно для температур, близких к оптимальным.
Правая часть температурной кривой показывает резкое снижение скорости ферментативной реакции при температурах, превышающих оптимальную. И это зависит, в первую очередь, от денатурации ферментного белка. Поэтому очень важным показателем, характеризующим отношение фермента к температуре, является его термостабильность.
Термостабильность фермента складывается как бы из двух критериев: величины температуры и времени ее воздействия на фермент. Кроме того, на термостабильность различных ферментов могут оказывать влияние и такие факторы, как рН среды, ее солевой состав, защитное действие субстрата.
Влияние рН на активность ферментов. Для каждого фермента характерна определенная узкая область значений рН, при которой он проявляет максимальную активность.
Форма кривых, описывающих зависимость активности фермента от рН, отражает способность важных для данного фермента протон-донорных или протон-акцепторных групп в активном центре фермента переходить в состояние с требуемой степенью ионизации при определенных значениях рН (см. рис. 8.7).

Рис. 8.7.
Кривые, характеризующие зависимость активности фермента от рН
Кроме влияния рН на состояние ионизации активного центра фермента, ход представленных кривых будет зависеть и от других факторов. В частности, изменение рН среды изменяет состояние ионизации субстрата (если это заряженное вещество), комплексов ES и EP, в некоторых, например, окислительно-восстановительных реакциях, ионы H +
сами могут принимать участие в реакции; помимо этого, скорость денатурации ферментативного белка зависит от рН.
При экспериментальном изучении активности фермента от рН следует помнить, что рH-оптимум зависит от состава среды (от природы используемого буфера); оптимумы рН прямой и обратной реакции могут быть совершенно различными; при действии одного и того же фермента на различные субстраты рН-оптимумы также могут быть различными. Кроме понятия оптимума рН, очень важным является понятие рН-стабильности. Это тот диапазон рН, при котором фермент или ферментативный препарат сохраняет свою активность в течение определенного периода времени. рН-Стабильность также зависит от ряда факторов, среди которых, кроме уже названных, форма ферментного препарата, степень его очистки и др.
Все выше сказанное позволяет утверждать, что варьируя температурный режим и изменяя рН, можно в какой-то мере регулировать каталитическую активность фермента.
Влияние активаторов и ингибиторов. Активаторами называют вещества, которые повышают активность ферментов. Хорошим примером таких соединений являются аминокислота цистеин и восстановленный глутатион, содержащие свободную SH-группу. Их активирующее действие заключается в том, что они восстанавливают дисульфидные связи с образованием SH-групп, необходимых для проявления каталитической активности тиоловых ферментов. Кроме того, некоторые ферменты активируются металлами, которые либо участвуют в построении активного центра, либо стабилизируют пространственную конформацию ферментного белка и тем самым обеспечивают проявление каталитических функций.
Ингибиторами называют вещества, специфически снижающие активность ферментов. Снижение или полная потеря активности ферментов могут быть вызваны разного рода денатурирующими воздействиями, в этом случае правильнее употреблять термин "инактивация" фермента.
Механизм действия ингибиторов может быть самым разнообразным:
Ингибитор взаимодействует с апоферментом, при этом возможны такие варианты, как связывание функциональных групп белка, изменение третичной и четвертичной структуры апофермента, специфическое связывание с определенным участком апофермента, неспецифическая адсорбция на белке;
Ингибитор образует комплекс с субстратом;
Ингибитор связывает кофермент;
Ингибитор связывает активатор;
Ингибитор связывает кофактор.
Чаще всего ингибитор взаимодействует с ферментом, образуя комплекс. Это можно выразить следующим уравнением:
Константа диссоциации комплекса фермент-ингибитор (или константа ингибирования) K i .определяется выражением:
К i прямо пропорциональна концентрации фермента и ингибитора и обратно пропорциональна концентрации комплекса фермент-ингибитор.
Существует ингибирование двух основных типов: необратимое и обратимое. Теоретически, в случае необратимого ингибирования k -1 = 0, то есть комплекс EI настолько прочен, что совершенно не диссоциирует. Но для большинства необратимых ингибиторов величина k -1 _, хотя и очень мала, но не равна нулю.
Обратимое ингибирование, в свою очередь, бывает конкурентным и неконкурентным.
Конкурентный ингибитор конкурирует с субстратом на основе структурного сходства, связываясь с активным центром фермента с образованием неактивного комплекса фермент-ингибитор. Отличительная особенность конкурентного ингибирования состоит в том, что его можно устранить или ослабить, повысив концентрацию субстрата. Конкурентный ингибитор снижает сродство фермента к субстрату, следовательно, величина К m в присутствии конкурентного ингибитора увеличивается.
Графически это выглядит так, как изображено на рис. 8.8

Рис. 8.8.
Конкурентное ингибирование: 1
- без ингибитора; 2-
с конкурентным ингибитором
При неконкурентном торможении ингибитор связывается не с активным центром фермента (то есть не там, где присоединяется субстрат), а с другим участком молекулы фермента. Очевидно, что в этом случае ингибитор не оказывает влияние на величину константы Михаэлиса К т, но будет снижать максимальную скорость реакции - V max
Графически это можно изобразить следующим образом (см. рис. 8.9):

Рис. 8.9.
Неконкурентное ингибирование:1- без ингибитора; 2-е неконкурентным ингибитором
Одними из самых распространенных неконкурентных ингибиторов являются аллостерические ингибиторы. Присоединяясь не к активному, а к другому, так называемому аллостерическому центру молекулы фермента, ингибитор вызывает конформационные изменения в структуре активного центра, вследствие чего становится невозможным образование комплекса фермент- субстрат.
Изучение взаимодействия ферментов с ингибиторами и активаторами ферментов позволяет получать ценные сведения о субстратной специфичности ферментов, природе функциональных групп активного центра, механизмах каталитической активности.
Так как в качестве ингибиторов могут выступать конечные продукты реакции, различные промежуточные продукты метаболизма, нет сомнения в той огромной роли, которую выполняют ингибиторы в регуляции ферментативной активности.
Это подтверждает и факт широкого распространения ингибиторов белковой природы (см. гл. 2). Кроме того, по принципу специфического ингибирования действуют многие лекарственные препараты, антибиотики, токсичные вещества, антиалиментарные факторы питания.
Специфические ингибиторы, встречающиеся в пищевом сырье и пищевых продуктах, присутствуют в качестве составляющих как в традиционных рецептурах, так и в сложных композиционных составах
новых, модифицированных продуктов питания. Поэтому нельзя не учитывать их влияние на активность отдельных ферментов и на биохимические процессы в целом, протекающие при хранении и переработке пищевого сырья.
Все это лишний раз говорит о множестве сложных проблем, которые встречаются в экспериментальной работе с ферментами и использовании ферментных препаратов на практике.
281:: 282:: 283:: 284:: 285:: 286:: 287:: 288:: 289:: 290:: 291:: 292:: 293:: 294:: 295:: Содержание
295:: 296:: 297:: 298:: Содержание
Конец работы -
Эта тема принадлежит разделу:
Теоретические основы пищевых производств. Исследования
Пищевая химия Учебник для студентов вузов обучающихся по направлениям Технология продуктов питания А П Нечаев Светлана Евгеньевна... В книге рассматривается химический состав пищевых систем его полноценность и... Теоретические основы пищевых производств Исследования Пищевая химия...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ:
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Все темы данного раздела:
БЕЛКИ В ПИТАНИИ ЧЕЛОВЕКА. ПРОБЛЕМА БЕЛКОВОГО ДЕФИЦИТА НА ЗЕМЛЕ
Белки в питании человека занимают особое место. Они выполняют ряд специфических функций, свойственных только живой материи. Белковые вещества наделяют организм пластическими свойствами, заключающим
БЕЛКОВО-КАЛОРИЙНАЯ НЕДОСТАТОЧНОСТЬ И ЕЕ ПОСЛЕДСТВИЯ. ПИЩЕВЫЕ АЛЛЕРГИИ
Белковая недостаточность является важнейшей проблемой питания. Бедно живущие семьи на фоне недостаточно калорийной пищи потребляют мало белка, в результате чего возникает синдром дистрофии, который
АМИНОКИСЛОТЫ И ИХ НЕКОТОРЫЕ ФУНКЦИИ В ОРГАНИЗМЕ
Общее число встречающихся в природе аминокислот достигает около 300. Среди них различают: а) аминокислоты, входящие в состав белков; б) аминокислоты, образующиеся из других аминокислот, но только п
НЕЗАМЕНИМЫЕ АМИНОКИСЛОТЫ. ПИЩЕВАЯ И БИОЛОГИЧЕСКАЯ ЦЕННОСТЬ БЕЛКОВ
Все живые организмы различаются по способности синтезировать аминокислоты, необходимые для биосинтеза белков. В организме человека синтезируется только часть аминокислот, другие должны доставляться
СТРОЕНИЕ ПЕПТИДОВ И БЕЛКОВ. ФИЗИОЛОГИЧЕСКАЯ РОЛЬ ПЕПТИДОВ
До середины XX в. считалось, что пептиды не являются самостоятельным классом органических соединений, а представляют собой продукты неполного гидролиза белков, которые образуются в ходе перевариван
Белки пищевого сырья
Белки злаков
Анализируя аминокислотный состав суммарных белков различных злаковых культур с точки зрения состава эталонного белка для питания людей (ФАО, 1973) следует отметить, что все он
Белки бобовых культур
Основную часть семядолей бобовых культур (сои, гороха, фасоли, вики) составляют запасные белки, являющиеся в соответствии с классификацией Осборна глобулинами. Кроме того, в семенах содержится небо
Белки масличных культур
У масличных семян основной запасающей тканью для белков и ли-пидов является паренхима семядолей (подсолнечник, хлопчатник, рапс), эндосперм (семена клещевины, кориандра) или одновременно паренхима
Белки картофеля, овощей и плодов
Относительно низкое содержание азотистых веществ в картофеле (около 2%), овощах (1,0-2,0%) и плодах (0,4- 1,0%) свидетельствует о том, что данные виды пищевого растительного сырья не играют значите
Баклажаны Перец
РНК................................. 0,27-0,32 ..... 0,13-0,31
ДНК................................. 0,21-0,36 ..... 0,14-0,22
Фосфор.............................. 5,5-7,2 .....
Белки мяса и молока
Мясо, молоко и получаемые из них продукты содержат необходимые организму белки, которые благоприятно сбалансированы и хорошо усваиваются. Белки мышечной ткани мяса животных полноценны, по
НОВЫЕ ФОРМЫ БЕЛКОВОЙ ПИЩИ. ПРОБЛЕМА ОБОГАЩЕНИЯ БЕЛКОВ ЛИМИТИРУЮЩИМИ АМИНОКИСЛОТАМИ
Основным направлением научно-технического прогресса в области производства продовольствия в последние три десятилетия является интенсификация процессов приготовления пищи с одновременным приданием
ФУНКЦИОНАЛЬНЫЕ СВОЙСТВА БЕЛКОВ
Растительные белки находят применение в производстве пищевых продуктов в качестве ингредиентов питательной, технологической и лечебно-профилактической значимости благодаря присущим им уникальным фу
ПРЕВРАЩЕНИЯ БЕЛКОВ В ТЕХНОЛОГИЧЕСКОМ ПОТОКЕ
Нативная трехмерная структура белков поддерживается разнообразием внутри- и межмолекулярных сил и поперечных связей. Любое изменение условий среды в технологических потоках производства пищевых про
КАЧЕСТВЕННОЕ И КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ БЕЛКА
Присутствие белков в пищевых объектах устанавливается с помощью качественных реакций, которые условно разделяют на две группы: а) цветные реакции; б) реакции осаждения.
Среди первой группы
Моносахариды
Моносахариды обычно содержат от 3 до 9 атомов углерода, причем наиболее распространены пентозы и гексозы. По функциональной группе они делятся на альдозы и кетозы.
Моносахариды находятся о
Полисахариды
Олигосахариды.Это полисахариды 1-го порядка, молекулы которых содержат от 2 до 10 остатков моносахаридов, соединенных гликозидными связями. В соответствии с этим различают дисахари
ФИЗИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ УГЛЕВОДОВ
Углеводам в питании человека принадлежит чрезвычайно важная роль. Они являются главным источником энергии для человеческого организма, необходимой для жизнедеятельности всех клеток, тканей и органо
Усваиваемые и неусваиваемые углеводы
С точки зрения пищевой ценности углеводы подразделяются на усваиваемые и неусваиваемые. Усваиваемые углеводы – моно- и олигосахариды, крахмал, гликоген. Неусваиваемые – целлюлоза, гемицеллюлозы, ин
Углеводы в пищевых продуктах
Углеводы составляют 3/4 сухой массы растений и водорослей, они содержатся в зерновых, фруктах, овощах и в других продуктах.
Главными усваиваемыми углеводами в питании человека являются кра
Гидролиз углеводов
Во многих пищевых производствах имеет место гидролиз пищевых гликозидрв, олигосахаридов и полисахаридов. Гидролиз зависит от многих факторов: рН, температуры, аномерной конфигурации, комплекса ферм
Реакции дегидратации и термической деградации углеводов
При переработке пищевого сырья в пищевые продукты эти реакции занимают важное место. Они катализируются кислотами и щелочами, и многие из них идут по типу β-элиминации. Пентозы, как главный пр
Реакции образования коричневых продуктов
Потемнение пищевых продуктов может иметь место в результате окислительных или неокислительных реакций. Окислительное или ферментативное потемнение – это реакция между фенольным субстратом и кислоро
Окисление в альдоновые, дикарбоновые и урановые кислоты
Действие окислителей.Способность альдоз к окислению также имеет значение для пищевых продуктов. При определенных условиях возможно окисление в альдоновые кислоты, причем β-фор
Процессы брожения
Брожение – процесс (в котором участвуют углеводы), используемый в ряде пищевых технологий: во время тестоприготовления при изготовлении хлеба, в производстве пива, кваса, спирта, вина и других прод
Гидрофильность
Гидрофильность – одно из основных физических свойств углеводов, полезных для пищевых продуктов. Гидрофильность обусловлена наличием многочисленных ОН-групп. Они взаимодействуют с молекулой воды пос
Связывание ароматических веществ
Для многих пищевых продуктов, при получении которых используются разные виды сушки, углеводы являются важным компонентом,
способствующим сохранению цвета и летучих ароматических веществ
Образование продуктов неферментативного потемнения и пищевого аромата
Как уже отмечалось, реакции неферментативного потемнения дают окрашенные меланоидиновые пигменты и много разнообразных летучих
компонентов. Именно они ответственны за тот или иной запах
Сладость
Ощущение сладости во рту при потреблении низкомолекулярных углеводов характеризует еще одну важную функцию их в пищевых продуктах. В табл. 3.12 дана характеристика относительной сладости различных
Структурно-функциональные свойства полисахаридов
Все полисахариды, присутствующие в пищевых продуктах, выполняют ту или иную полезную роль, связанную с их молекулярной архитектурой, размером и наличием межмолекулярных взаимодействий, обусловленны
Крахмал
Крахмал – растительный полисахарид со сложным строением. Он состоит из амилозы и амилопектина; их соотношение различно в различных крахмалах (амилозы 13–30%; амилопектина 70–85%).
Амилоза
Гликоген
Гликоген находится в пищевых продуктах в очень небольших количествах, благодаря малому содержанию в мясной ткани и печени. Это гомоглюкан, подобный по структуре крахмальному амилопектину; он содерж
Целлюлоза
Целлюлоза – компонент клеточных стенок. Она обычно ассоциируется с различными гемицеллюлозами и лигнином; и тип и размер этих ассоциаций образует характерную текстуру пищевых растений. Однако больш
Гемицеллюлозы
Известно, что клеточные стенки растений представляют собой комплексную матрицу, состоящую из целлюлозы, лигнина и гемицеллюлоз. Гемицеллюлозы – класс полисахаридов, неусваиваемых человеческим орган
Пектиновые вещества
Пектин содержится в растительных пищевых продуктах, например, в фруктах и овощах. В растительной клетке пектин выполняет функцию структурирующего агента в центральном слое клеточной стенки. Кроме т
МЕТОДЫ ОПРЕДЕЛЕНИЯ УГЛЕВОДОВ В ПИЩЕВЫХ ПРОДУКТАХ
Моно- и олигосахариды.Для определения этих углеводов используют их восстанавливающую способность. Сначала их извлекают из пищевых продуктов 80%-м этиловым спиртом. Спиртовые экстра
СТРОЕНИЕ И СОСТАВ ЛИПИДОВ. ЖИРНОКИСЛОТНЫЙ СОСТАВ МАСЕЛ И ЖИРОВ
Липидами (от греч. lipos – жир) называют сложную смесь органических соединений с близкими физико–химическими свойствами, которая содержится в растениях, животных и микроорганизмах. Липиды широко ра
Гидролиз триацилглицеринов
Под влиянием щелочей, кислот, фермента липазы триацилглицерины гидролизуются с образованием ди–, затем моноацилглицеринов и, в конечном счете, жирных кислот и глицерина.
Переэтерификация
Большое практическое значение имеет группа реакций, при которых идет обмен ацильных групп (ацильная миграция), приводящий к образованию молекул новых ацилглицеринов. Триацилглицерины при температур
РЕАКЦИИ АЦИЛГЛИЦЕРИНОВ С УЧАСТИЕМ УГЛЕВОДОРОДНЫХ РАДИКАЛОВ
Присоединение водорода (гидрирование ацилглицеринов)
Гидрирование масел и жиров молекулярным водородом в промышленности проводят при температурах 180–240°C в присутствии н
Окисление ацилглицеринов
Жиры и масла, особенно содержащие радикалы ненасыщенных жирных кислот, окисляются кислородом воздуха. Первыми продуктами окисления являются разнообразные по строению гидропероксиды. Они получили на
СВОЙСТВА И ПРЕВРАЩЕНИЯ ГЛИЦЕРОФОСФОЛИПИДОВ
Глицерофосфолипиды – бесцветные вещества, без запаха, хорошо растворимы в жидких углеводородах и их галогенпроизводных, отдельные группы различаются растворимостью в спиртах, ацетоне. Они существую
МЕТОДЫ ВЫДЕЛЕНИЯ ЛИПИДОВ ИЗ СЫРЬЯ И ПИЩЕВЫХ ПРОДУКТОВ И ИХ АНАЛИЗ
Анализ липидов и продуктов их превращений является сложной задачей, требующей применения, наряду с классическими химическими методами, современных физико–химических методов исследования (хроматогра
ПИЩЕВАЯ ЦЕННОСТЬ МАСЕЛ И ЖИРОВ
Растительные жиры и масла являются обязательным компонентом пищи, источником энергетического и пластического материала для человека, поставщиком ряда необходимых для него веществ (непредельных жирн
ПРЕВРАЩЕНИЯ ЛИПИДОВ ПРИ ПРОИЗВОДСТВЕ ПРОДУКТОВ ПИТАНИЯ
При получении продуктов питания, как в промышленности, так и в домашних условиях, в ходе технологического потока липиды исходного сырья (зерно, крупа, мясо и молоко, жиры и масла, плоды и овощи и д
РОЛЬ МИНЕРАЛЬНЫХ ВЕЩЕСТВ В ОРГАНИЗМЕ ЧЕЛОВЕКА
Многие элементы в виде минеральных солей, ионов, комплексных соединений и органических веществ входят в состав живой материи и являются незаменимыми нутриентами, которые должны ежедневно потреблять
Макроэлементы
Кальций.Это основной структурный компонент костей и зубов; входит в состав ядер клеток, клеточных и тканевых жидкостей, необходим
для свертывания крови. Кальций образуе
Микроэлементы
Железо.Этот элемент необходим для биосинтеза соединений, обеспечивающих дыхание, кроветворение; он участвует в иммунобиологических и окислительно–восстановительных реакциях; входит
ВЛИЯНИЕ ТЕХНОЛОГИЧЕСКОЙ ОБРАБОТКИ НА МИНЕРАЛЬНЫЙ СОСТАВ ПИЩЕВЫХ ПРОДУКТОВ
При переработке пищевого сырья, как правило, происходит снижение содержания минеральных веществ (кроме добавления пищевой соли). В растительных продуктах они теряются с отходами. Так, содержание ря
МЕТОДЫ ОПРЕДЕЛЕНИЯ МИНЕРАЛЬНЫХ ВЕЩЕСТВ
Для анализа минеральных веществ в основном используются физико–химические методы – оптические и электрохимические.
Практически все эти методы требуют особой подготовки проб для анализа, ко
Электрохимические методы анализа
Ионометрия.Метод служит для определения ионов K+, Na+, Ca2+, Mn2+, F–, I–, Сl– и т. д.
Метод о
ВОДОРАСТВОРИМЫЕ ВИТАМИНЫ
Витамин С(L–аскорбиновая кислота). Впервые выделен из лимона. В химическом отношении представляет собой γ–лактон 2,3–дегидро–4–гулоновой кислоты, легко переходит в окисленную
ЖИРОРАСТВОРИМЫЕ ВИТАМИНЫ
Витамин А.Встречается в качестве четырех индивидуальных представителей: ретинол, ретин ил ацетат, ретиналь, ретиноевая кислота. Ретинол в химическом отношении – непредельный одноат
ВИТАМИНОПОДОБНЫЕ СОЕДИНЕНИЯ
Витаминоподобные соединения, как уже указывалось, относятся к биологически активным соединениям, выполняющим важные и
разнообразные функции в организме. Их можно разделить на несколько
ВИТАМИНИЗАЦИЯ ПРОДУКТОВ ПИТАНИЯ
Здоровое питание населения является одним из важнейших условий здоровья нации. Массовые обследования, проведенные Институтом питания РАМН, свидетельствуют о дефиците витаминов у большей части насел
ОБЩАЯ ХАРАКТЕРИСТИКА КИСЛОТ ПИЩЕВЫХ ОБЪЕКТОВ
Основные источники пищевых кислот – растительное сырье и продукты его переработки. Органические пищевые кислоты содержатся в большинстве видов растительных пищевых объектов – ягодах, фруктах, овоща
ПИЩЕВЫЕ КИСЛОТЫ И ИХ ВЛИЯНИЕ НА КАЧЕСТВО ПРОДУКТОВ
Пищевые кислоты в составе продовольственного сырья и продуктов выполняют различные функции, связанные с качеством пищевых объектов.
В составе комплекса вкусоароматических веществ они участ
РЕГУЛЯТОРЫ КИСЛОТНОСТИ ПИЩЕВЫХ СИСТЕМ
Наличие пищевых кислот в продукте может являться следствием преднамеренного введения кислоты в пищевую систему в ходе технологического процесса для регулирования ее рН.
В этом случае пищев
ПИЩЕВЫЕ КИСЛОТЫ В ПИТАНИИ
Значение пищевых кислот в питании человека определяется их энергетической ценностью (табл. 7.5) и участием в обмене веществ. Обычно они не вызывают дополнительной кислотной нафузки в организме, оки
МЕТОДЫ ОПРЕДЕЛЕНИЯ КИСЛОТ В ПИЩЕВЫХ ПРОДУКТАХ
В основе определения рН различных пищевых систем лежат стандартные методы, описанные в руководствах по аналитической химии. К ним относятся калориметрический и электрометрический методы.
О
ОБЩИЕ СВОЙСТВА ФЕРМЕНТОВ
Ферменты - биологические катализаторы белковой природы. Они значительно повышают скорость химических реакций, которые в отсутствие ферментов протекают очень медленно. При этом ферменты не расходуют
Ферментативная кинетика
Ферментативный катализ существенно отличается от неферментативного, в связи с чем в кинетике ферментативных реакций разработаны совершенно особые закономерности. Они позволяют выделить ферментативн
Оксидоредуктазы
Полифенолоксидаза (Н.Ф. 1.14.18.1). Этот фермент известен под различными тривиальными названиями: о-дифенолоксидаза, тирозиназа, фенолаза, катехолаза и др. Фермент может катализировать окисл
Гидролитические ферменты
Роль ферментов класса гидролаз в пищевых технологиях очень велика. Это находит отражение в специальной литературе, монографиях, технических инструкциях, стандартах. Поэтому в этом разделе остановим
ПРИМЕНЕНИЕ ФЕРМЕНТОВ В ПИЩЕВЫХ ТЕХНОЛОГИЯХ
Ферментные препараты в отличие от ферментов содержат помимо активного фермента множество балластных веществ, в том числе и других белков. Кроме того, большинство ферментных препаратов являются комп
Мукомольное производство и хлебопечение
Качество хлеба определяется особенностями химического состава муки и активностью ее ферментного комплекса. Значительное влияние
оказывают также условия брожения и выпечки. Получить хлеб
Производство крахмала и крахмалопродуктов
Современная крахмал о-паточная промышленность, используя в основном традиционные источники сырья - картофель и кукурузу, - вырабатывает большой ассортимент продукции, включающий десятки наименовани
Кондитерское производство
Кондитерские изделия в зависимости от вида сырья и типа технологического процесса подразделяют на две группы: мучные и сахаристые. К мучным изделиям относятся печенье, галеты, крекеры, вафли, пряни
Производство плодово-ягодных соков, безалкогольных напитков и вин
Применение ферментных препаратов при производстве плодово-ягодных соков, вин и безалкогольных напитков осуществляется с целью повышения выхода сока, осветления и стабилизации соков,
без
Спиртные напитки и пивоварение
Производство спиртных напитков.Производство спиртных напитков из крахмалсодержащего сырья практикуется почти во всех странах мира. Основными видами сырья являются картофель и рожь
ИММОБИЛИЗОВАННЫЕ ФЕРМЕНТЫ
В различных пищевых технологиях долгое время применялись лишь препараты свободных ферментов, срок использования которых - один производственный цикл. Однако достижения молекулярной биологии, биохим
ФЕРМЕНТАТИВНЫЕ МЕТОДЫ АНАЛИЗА ПИЩЕВЫХ ПРОДУКТОВ
Ферментативный анализ представляет собой один из основных аналитических инструментов в международной и отечественной практике научных исследований, современного производственного и сертификационног
ОБЩИЕ СВЕДЕНИЯ О ПИЩЕВЫХ ДОБАВКАХ
Пищевые добавки - природные, идентичные природным или искусственные (синтетические) вещества, сами по себе не употребляемые как пищевой продукт или обычный компонент пищи. Они преднамеренно добавля
Общие подходы к подбору технологических добавок
Эффективность применения пищевых добавок, особенно проявляющих технологические функции, требует создания технологии их подбора и внесения с учетом особенностей химического строения, функциональных
О безопасности пищевых добавок
Пищевые добавки, спектр применения которых непрерывно расширяется, выполняют разнообразные функции в пищевых технологиях и продуктах питания. Использование добавок возможно только после
ВЕЩЕСТВА, УЛУЧШАЮЩИЕ ВНЕШНИЙ ВИД ПИЩЕВЫХ ПРОДУКТОВ
Пищевые красители
Основной группой веществ, определяющих внешний вид продуктов питания, являются пищевые красители (функциональный класс 7, табл. 9.1).
Потребитель давно привык к
Цветокорректирующие материалы
В пищевой промышленности применяются соединения, изменяющие окраску продукта в результате взаимодействия с компонентами сырья и готовых продуктов. Среди них отбеливающие вещества - добавки, предотв
ВЕЩЕСТВА, ИЗМЕНЯЮЩИЕ СТРУКТУРУ И ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ПИЩЕВЫХ ПРОДУКТОВ
К этой группе пищевых добавок могут быть отнесены вещества, используемые для создания необходимых или изменения существующих реологических свойств пищевых продуктов, т. е. добавки, регулирующие или
Эмульгаторы
В эту группу пищевых добавок (функциональный класс 9) входят вещества, которые, будучи добавленными к пищевому продукту, обеспечивают возможность образования и сохранения однородной дисперсии двух
ВЕЩЕСТВА, ВЛИЯЮЩИЕ НА ВКУС И АРОМАТ ПИЩЕВЫХ ПРОДУКТОВ
При оценке пищевых продуктов особое внимание потребитель уделяет их вкусу и аромату. Большую роль тут играют традиции, привычки, ощущение гармонии, которое возникает в организме человека при употре
Подслащивающие вещества
В пищевой промышленности, кулинарии, при приготовлении пищи в домашних условиях с давних времен широко применяются вещества, обладающие сладким вкусом, - подслащивающие вещества (подсластители). По
Ароматизаторы
Аромат пищевого продукта - интегральный фактор, обусловленный присутствием в нем сложной смеси органических соединений, содержавшихся ранее в сырье (I), образовавшихся под влиянием ряда факторов в
Пищевые добавки, усиливающие и модифицирующие вкус и аромат
Пищевые добавки, усиливающие и модифицирующие вкус и запах продуктов питания - функциональный класс 12 (табл. 9.1), включают соединения, усиливающие и модифицирующие вкус пищевых продуктов, и вещес
ПИЩЕВЫЕ ДОБАВКИ, ЗАМЕДЛЯЮЩИЕ МИКРОБИОЛОГИЧЕСКУЮ И ОКИСЛИТЕЛЬНУЮ ПОРЧУ ПИЩЕВОГО СЫРЬЯ И ГОТОВЫХ ПРОДУКТОВ
Порча пищевого сырья и готовых продуктов является результатом сложных физико-химических и микробиологических процессов: гидролитических, окислительных, развития микробиальной флоры. Они тесно связа
Консерванты
Консерванты - вещества, продлевающие срок хранения продуктов, защищая их от порчи, вызванной микроорганизмами (бактерии, плесневые грибы, дрожжи, среди которых могут быть патогенные и непатогенные
Антибиотики
Особую группу пищевых добавок, замедляющих порчу пищевых продуктов (мяса, рыбы, птицы, овощей и т. д.), составляют антибиотики. Антибиотики, разрешенные для применения с медицинскими целями, не доп
Пищевые антиокислители
К пищевым антиокислителям (антиоксидантам) относятся вещества, замедляющие окисление в первую очередь ненасыщенных жирных кислот, входящих в состав липидов (функциональный класс 5). Этот класс пище
БИОЛОГИЧЕСКИ АКТИВНЫЕ ДОБАВКИ
Биологически активные добавки (БАД) или food supplements - природные (идентичные природным) биологически активные вещества, предназначенные для употребления одновременно с пищей или введения в сост
Физические свойства воды и льда
Вода имеет молекулярную массу примерно равную 18,02 и может существовать в состояниях жидкости, пара и льда, характеризующихся следующими показателями фазовых переходов:
Точ
Диаграмма состояния воды
Диаграмма состояния (или фазовая диаграмма) представляет собой графическое изображение зависимости между величинами,
характеризующими состояние системы, и фазовыми превращениями в систе
Строение молекулы и свойства воды
Аномальные свойства воды предполагают существование прочных сил между молекулами воды. Это можно объяснить уже при рассмотрении природы единичной молекулы воды, а затем и группы молекул. Шесть вале
Взаимодействие вода - растворенное вещество
При добавлении различных веществ к воде изменяются свойства как самого вещества, так и воды. Гидрофильные вещества взаимодействуют с водой путем ион-дипольного или диполь-дипольного механизма, вызы
Структура и свойства льда
Молекула воды, кристаллизуясь, может связывать четыре других молекулы воды в тетраэдрической конфигурации. Поэтому образующийся лед имеет гексагональную кристаллическую решетку. Структура льда была
СВОБОДНАЯ И СВЯЗАННАЯ ВЛАГА В ПИЩЕВЫХ ПРОДУКТАХ
Вода в пищевых продуктах играет, как уже отмечалось, важную роль, т. к. обусловливает консистенцию и структуру продукта, а ее взаимодействие с присутствующими компонентами определяет устойчивость п
АКТИВНОСТЬ ВОДЫ
Давно известно, что существует взаимосвязь (хотя и далеко не совершенная) между влагосодержанием пищевых продуктов и их сохранностью (или порчей). Поэтому основным методом удлинения сроков хранения
Изотермы сорбции
Кривые, показывающие связь между содержанием влаги (масса воды, г Н2О/г С В) в пищевом продукте с активностью воды в нем при постоянной температуре, называются изотермами сорбции. Информ
Активность воды и стабильность пищевых продуктов
С учетом вышесказанного ясно, что стабильность пищевых продуктов и активность воды тесно связаны.
На рис. 10.8 показано отношение между aw и скоростью различных реакций, происхо
РОЛЬ ЛЬДА В ОБЕСПЕЧЕНИИ СТАБИЛЬНОСТИ ПИЩЕВЫХ ПРОДУКТОВ
Замораживание является наиболее распространенным способом консервирования (сохранения) многих пищевых продуктов. Необходимый эффект при этом достигается в большей степени от воздействия низкой темп
Определение общего содержания влаги
Высушивание до постоянной массы.Содержание влаги рассчитывают по разности массы образца до и после высушивания в сушильном шкафу при температуре 100 - 105°С. Это - стандартный мето
Загрязнение продовольственного сырья и пищевых продуктов чужеродными веществами или ксенобиотиками напрямую зависит от степени загрязнения окружающей среды.
В результате хозяйственной деят
Меры токсичности веществ
Количественная характеристика токсичности веществ достаточно сложна и требует многостороннего подхода. Судить о ней приходится по результатам воздействия вещества на живой организм, для которого ха
Токсичные элементы
Токсичные элементы (в частности, некоторые тяжелые металлы) составляют обширную и весьма опасную в токсикологическом отношении группу веществ. Обычно рассматривают 14 элементов: Hg, Pb, Cd, As, Sb,
Радиоактивное загрязнение
Источники радиоактивности, как и другие загрязнители, являются компонентами пищевых цепей: атмосфера-ветер-дождь-почва-растения-животные-человек. Анализируя данные о взаимодействии радионуклидов с
Диоксины и диоксинподобные соединения
Диоксины - высокотоксичные соединения, обладающие мутагенными, канцерогенными и тератогенными свойствами. Они представляют реальную угрозу загрязнения пищевых продуктов, включая воду.
Полициклические ароматические углеводороды
Полициклические ароматические углеводороды (ПАУ) - насчитывают более 200 представителей, которые являются сильными канцерогенами.
К наиболее активным канцерогенам относят 3,4-бенз(а)пирен,
Загрязнения веществами, применяемыми в растениеводстве
Остатки сельскохозяйственных ядохимикатов представляют наиболее значительную группу загрязнителей, так как присутствуют почти во всех пищевых продуктах. В эту группу загрязнителей входят пестициды
Загрязнение веществами, применяемыми в животноводстве
С целью повышения продуктивности сельскохозяйственных животных, профилактики заболеваний, сохранения качества кормов в животноводстве широко применяются различные лекарственные и химические препара
ПРИРОДНЫЕ ТОКСИКАНТЫ
Природные токсины, не уступающие по канцерогенной активности антропогенным ксенобиотикам, из-за своей широкой распространенности и очень высокой степени нагрузки на организм человека представляют о
Микотоксины
Микотоксины (от греч. mukes - гриб и toxicon - яд) - это вторичные метаболиты микроскопических плесневых грибов, обладающие выраженными токсическими свойствами. Они не являются эссенциальны-ми для
Методы определения микотоксинов и контроль за загрязнением пищевых продуктов
Методы определения микотоксинов.Современные методы обнаружения и определения содержания микотоксинов в пищевых продуктах и кормах включают скрининг-методы, количественные аналитиче
АНТИАЛИМЕНТАРНЫЕ ФАКТОРЫ ПИТАНИЯ
Помимо чужеродных соединений, загрязняющих пищевые продукты, так называемых контаминантов-загрязнителей, и природных токсикантов, необходимо учитывать действие веществ, не обладающих общей
МЕТАБОЛИЗМ ЧУЖЕРОДНЫХ СОЕДИНЕНИЙ
Механизм детоксикации ксенобиотиков - две фазы.Изучение метаболизма чужеродных соединений, превращений, которые они претерпевают, попадая в организм человека, важны, в первую очере
Фальсификация: аспект безопасности
С точки зрения безопасности продуктов питания значительную опасность могут представлять и некоторые виды фальсификации пищевых продуктов. Как правило, это виды ассортиментной фальсификации, которые
Генетически модифицированные продукты питания
Генетически модифицированные (трансгенные) продукты питания представляют особый интерес. Сообщения о генетически модифицированных растениях и полученных из них продуктах питания появились в начале
ФИЗИОЛОГИЧЕСКИЕ АСПЕКТЫ ХИМИИ ПИЩЕВЫХ ВЕЩЕСТВ
Продукты, употребляемые человеком в пищу в натуральном или переработанном виде (пищевые продукты), представляют собой сложные системы с единой внутренней структурой и общими физико-химическими свой
ПИТАНИЕ И ПИЩЕВАРЕНИЕ
Пищеварение является начальным этапом ассимиляции пищевых веществ, который состоит в превращении исходных пищевых структур сложного химического состава в компоненты, лишенные видовой специфичности,
Основные пищеварительные процессы
В общем случае физические и физико-химические изменения пищи заключаются в ее размельчении, перемешивании, набухании, частичном растворении, образовании суспензий и эмульсий; химические изменения с
Схемы процессов переваривания макронутриентов
Основными конечными продуктами гидролитического расщепления высокомолекулярных веществ, содержащихся в пище, являются мономеры. Каждый из трех видов макронутриентов имеет свою схему процесса перева
Метаболизм макронутриентов
Основными конечными продуктами гидролитического расщепления содержащихся в пище макронутриентов являются мономеры (сахара, аминокислоты, высшие жирные кислоты), которые, подвергаясь всасыванию на у
ТЕОРИИ И КОНЦЕПЦИИ ПИТАНИЯ
Формирование научных представлений о питании и роли пищевых веществ в процессах жизнедеятельности началось лишь в середине XIX в.
Первый принцип рационального питания
Пища для человеческого организма, прежде всего, является источником энергии. Именно при ее превращениях - окислении и распаде сложных веществ на более простые - происходит выделение энергии, необхо
Второй принцип рационального питания
В соответствии со вторым принципом рационального питания, должно быть обеспечено удовлетворение потребности организма в основных пищевых веществах, включающих источники энергии (белки, жиры, углево
Третий принцип рационального питания
Согласно третьему принципу рационального питания, принципиальным для нормального функционирования организма является не только какие продукты питания и в каком количестве потребляет человек, но и т
РЕКОМЕНДУЕМЫЕ НОРМЫ ПОТРЕБЛЕНИЯ ПИЩЕВЫХ ВЕЩЕСТВ И ЭНЕРГИИ
Согласно принципам рационального питания, чтобы сохранить здоровье на многие годы, человек должен поддерживать баланс энергии, потреблять разнообразный и сбалансированный рацион, соблюдать режим пи
ПИЩЕВОЙ РАЦИОН СОВРЕМЕННОГО ЧЕЛОВЕКА. ОСНОВНЫЕ ГРУППЫ ПИЩЕВЫХ ПРОДУКТОВ
Пищевой рацион современного человека, определяющий в итоге его здоровье, формируется на базе физиологических потребностей в энергии, макро- и микронутриентах с учетом трех принципов рационального п
КОНЦЕПЦИЯ ЗДОРОВОГО ПИТАНИЯ. ФУНКЦИОНАЛЬНЫЕ ИНГРЕДИЕНТЫ И ПРОДУКТЫ
Концепция здорового (позитивного, функционального) питания была сформулирована в начале 80-х гг. в Японии, где приобрели большую популярность так называемые функциональные продукты (сокращенное наз
При t=36-38 0 ферменты обладают наибольшей активностью. Эта температура называется температурный оптимум:
С повышением t 0 до оптимума активность ферментов повышается.
Высокие t вызывают денатурацию ферментов.
Низкие t снижают активность ферментов.
Изменение t 0 приводит к нарушению связей, закрепляющих белковую структуру ферментов (третичную, четвертичную), т.е. вызывает денатурацию.
Обратимая денатурация наблюдается при понижении t 0 . Это позволяет хранить ферменты, биологические жидкости, кровь.
Повышение температуры необратимо нарушает белковую структуру фермента. Это свойство используется при стерилизации материалов, инструментов.
Лихорадка – защитное свойство организма, т.к. происходит денатурация ферментов микроорганизмов и поэтому нецелесообразно применять жаропонижающие средства.
Зависимость скорости реакции от рН
На графике эта зависимость имеет вид колокола. На вершине кривой есть точка оптимума рН, где фермент имеет наибольшую активность. рН оказывает воздействие на степень ионизации кислотных и основных групп. При различных значениях рН активный центр может находиться в частично ионизированной или неионизированной форме, что оказывает влияние на третичную структуру активного центра и на формирование фермент-субстратного комплекса.
Влияние рН.
Ферменты, как и все белки содержат много зараженных положительно и отрицательно групп (-NH 2 ,-COOH), которые входят в состав аминокислот арг, лиз, асп, глу. Общий заряд зависит от соотношения между этими группами. Заряд белка-фермента изменяется в зависимости от концентрации в клетке ионов водорода, которые нейтрализуют (подавляют диссоциацию) карбоксильной группы:
и образуют положительно заряженные группы:
Таким образом увеличение положительного заряда или уменьшение отрицательного заряда на поверхности фермента обусловлено повышением концентрации ионов водорода.
Состояние белковой молекулы, при котором суммарный заряд белка равен 0, называется изоэлектрическим состоянием.
Значение рН, при котором заряд белковой молекулы равен 0, называется изоэлектрической точкой (ИЭТ).
Большинство ферментов отличаются наибольшей активностью и стабильностью в области изоэлектрической точки.
Резкие колебания рН способствуют денатурации белка, т.е. уменьшению ферментативной активности.
Значение рН, при котором фермент проявляет максимальную активность, называется оптимумом рН, который характерен для данного фермента, реагирующего с определенным субстратом.
Внутриклеточные ферменты обычно имеют оптимум рН соответствующий нейтральной среде (рН =7) близкой к нормальному значению рН для жидкостей организма. Есть ферменты оптимум рН которых находится в сильнокислой и сильнощелочной среде
Классификация ферментов.
Выделяют шесть классов ферментов:
1. Гидролазы – ферменты, расщепляющие субстрат при участии молекул воды.
2. Лиазы – ферменты, расщепляющие молекулы субстрата без участия воды, при этом часто образуются низкомолекулярные продукты – СО 2 , NH 3 , Н 2 О.
3. Изомеразы – ферменты, вызывающие в молекуле изомерные превращения.
4. Феразы (трансферазы) – ферменты, переносящие группы от одной молекулы на другую или из одного положения в другое в пределах одной молекулы.
5. Оксидоредуктазы - ферменты, катализирующие перенос протонов и электронов (т.е.окислительно-восстановительные реакции).
6. Лигазы(синтетазы) – ферменты, катализирующие синтез крупных молекул из более мелких.
Номенклатура ферментов.
Рабочее название фермента складывается из названия субстрата, типа катализируемой реакции и окончания –аза.
Систематическое название складывается из названия субстратов, названия типа катализируемого химического превращения и окончания –аза.
Название класса указывает на тип химической реакции, катализируемой ферментами. Классы делятся на подклассы – уточняет действие фермента, так как указывает на природу химической группы субстрата, атакуемой ферментом. Подкласс делится на подподклассы. Подподклассы конкретизируют действие фермента, уточняя природу атакуемой связи субстрата или природу акцептора.
I. Оксидоредуктазы катализируют окислительно-восстановительные реакции. Оксидоредуктазы называют также дегидрогеназами или редуктазами. Оксидоредуктазы переносят протоны и электроны. Оксидоредуктазы делят на подклассы:
1. Аэробные дегидрогеназы – переносят протоны и электроны на кислород.
Коферментами оксидоредуктаз являются:
НАД – никотинамидадениндинуклеотид – содержит витамин В 5 – никотинамид.
НАДФ – никотинамидадениндинуклеотид фосфат, содержит витамин В 5 .
ФАД – флавинадениндинуклеотид, содержит витамин В 2 – рибофлавин.
ФМН – флавинмононуклеотид, содержит витамин В 2 – рибофлавин.
Оксидоредуктазы катализируют реакции дегидрирования, т.е. отщепление водорода.
Оксидоредуктазы окисляют следующие функциональные группы:
ОН, -С=О, -NH 2
Коферменты дегидрогеназ присоединяют протоны и электроны.
НАД-зависимые дегидрогенизы окисляют следующие функциональные группы: спиртовый гидроксил (ОН), альдегидную группу (СОН), аминогруппу (NH 2).
НАД-зависимые дегидрогеназы катализируют следующие типы реакций:
1. Дегидрирование гидроксильных групп
| лактатдегидрогеназа |
COOH НАД + НАДН +Н + СН 3
Лактат пируват
Молочная кислота
2. Дегидрирование альдегидных групп (дегидрирование глицеральдегид – 3 – фосфата)
| + НАД + + Н 3 РО 4 | + НАДН + Н +
CH 2 OPO 3 H 2 CH 2 OPO 3 H 2
Глицеральдегид-3-фосфат 1,3-бифосфоглицериновая кислота
3. Дегидрирование аминогрупп
СООН СООН
СН 2 +НАД СН 2
| | + НАДН + Н +
СН 2 глутаматдегидрогеназа СН 2
ФАД – зависимые дегидрогеназы окисляют (дегидрируют) следующие функциональные группы: отщепление водорода от групп –СН 2 - СН 2 - с образованием двойной связи.
СООН СООН
| ФАД ФАДН 2 |
СН 2 сукцинатдегидрогеназа СН
СООН СООН
Сукцинат фумарат
2. Анаэробные дегидрогеназы переносят протоны и электроны не на кислород, а на какой-то другой субстрат. Эти ферменты называют также оксигеназами.
II. Трансферазы – ферменты, катализирующие реакции переноса различных групп от одного субстрата к другому.
Подклассы трансфераз:
1. Аминотрансферазы осуществляют перенос аминогруппы с аминокислоты на кетокислоту. Катализируют реакцию трансаминирования.
2. Метилтрансферазы катализируют перенос метильных групп (СН 3 -).
3. Фосфотрансферазы катализируют перенос остатка фосфорной кислоты. В подкласс фосфотрансфераз входят киназы, которые используют АТФ в качестве донора фосфатного остатка.
III. Лиазы – ферменты, катализирующие разрыв С-О, С-С, С-N и других связей, а также обратимые реакции отщепления различных групп, без участия воды.
1. Карбоксилазы – присоединение карбоксильной группы (СО 2).
2. Дегидратазы – отнятие молекулы воды от субстрата.
3. Альдолазы – расщепляют связь С-С.
4. Гидратазы – ферменты воды по двойной связи.
IV. Изомеразы – ферменты, катализирующие превращение в пределах одной молекулы.
Катализируют реакции изомеризации. Подклассы: мутазы, таутомеразы, рацемазы, эпимеразы, изомеразы.
V. Гидралазы – ферменты, катализирующие разрыв связей в присутствии воды.
VI. Лигазы (синтетазы) – ферменты, катализирующие соединение двух молекул с использованием энергии фосфатной связи АТФ.
Влияние низкомолекулярных веществ на активность фенрментов.
Низкомолекулярные вещества, изменяющие скорость ферментативных реакций делят на 2 группы:
1. Активаторы – ускоряющие протекание ферментативной реакции.
2. Ингибиторы – замедляют протекание ферментативных реакций.
Активаторы делят на 2 группы:
1. В качестве активатора могут выступать коферменты или простетическая группа (в основном витамины).
Для этой группы характерны те же закономерности, что описаны для взаимодействия фермента и субстрата F+S и A+Ko подчиняются одним закономерностям
K m определяет сколько вводить Ko.
2. Активаторы, являющиеся связующим звеном между F и S (ориентирование фермента и субстрата) и обеспечивающим взаимодействие фермента и субстрата (F A S), взаимодействие апофермента и кофактора Апоф А Ко
Часто это ионы Ме – Со, Mn, Mg, Zn.
Значение ингибирования активности ферментов.
1. Ингибирование лежит в основе действия лекарственных веществ и токсических агентов.
2. Ингибирование – один из подходов к изучению ферментативного действия (например, структуры активного центра).
Ингибирование бывает 2-х видов:
1. Необратимое
2. Обратимое
Необратимое ингибирование имеет место тогда, когда присоединение ингибитора к ферменту носит необратимый характер.
Например: это действие алкилирующих агентов (подацетамид) необратимо действующих на тиогруппу ферментов. Необратимость связана с тем, что равновесие смещено вправо, в сторону образования ковалентного производного фермента:
F-S-H + J-CH 2 CONH 2 F-S-CH 2 -CONH 2 + HJ
Необратимым является действие токстческих фосфоорганических соединений, которые называют нервно-паралитическими ядами, они ингибируют ацетилхолинэстеразу, участвующую в передаче нервных импульсов.
Необратимое ингибирование
Многие ингибиторы необратимо связываются с Е или ES, и, поскольку это влияет на V max , такое ингибирование относят к неконкурентному.
Ингибиторы этого типа часто ковалентно связываются с ферментом или с комплексом фермент-субстрат, необратимо изменяя нативную конфигурацию. Это объясняет токсическое действие Hg 2+ , Pb 2+ и соединений мышьяка.
На необратимом ингибировании основано действие пенициллина. Пенициллин ингибирует действие одного из ферментов, участвующих в сборке клеточной стенки бактерий. Клетки, ен имеющие клеточной стенки, легко лизируются.
Действие аспирина основано на ковалентной модификации фермента. Аспирин снижает скорость синтеза простагландинов, выступая в роли ингибитора циклооксигеназного компонента эндопероксид-синтетазы. Считается, что возникновение болей, воспалений, температуры связано с простагландинами.
При интоксикации связывание яда или его вытеснение из комплекса фермент-ингибитор возможно с помощью реактиваторов, или противоядий. К ним относятся все SH – содержащие комплексоны (цистеин, димеркаптопропанол), лимонная кислота.
Обратимое ингибирование бывает 2-х видов:
1. Конкурентное
2. Неконкурентное
Обратимое конкурентное ингибирование – активность фермента восстанавливается после удаления ингибитора путем увеличения концентрации субстрата.
Отличительный признак конкурентного ингибитора – конкурентный ингибитор по структуре близок субстрату. Конкурентный ингибитор конкурирует с субстратом за активный центр фермента.
Пример: сукцинатдегидрогеназа катализирует превращение сукцината в фумарат. Конкурентным ингибитором сукцинатдегидрогеназы является малоновая кислота, которая содержит на одну группу СН 2 меньше, чем сукцинат.
СООН СООН COOH
СН 2 СН CH 2
СН 2 СН COOH
| | малоновая кислота
СООН СООН
Сукцинат и малоновая кислота являются структурными аналогами и конкурируют за активный центр фермента. (Это является подтверждением тому, что активный центр не является жестким образованием, подходящим субстрату, как «ключ-замок».)
При конкурентном ингибировании степень ингибирования фермента не зависит от абсолютной концентрации ингибитора, а от соотношения ингибитора и субстрата, если это соотношение J:S=1:50, то активность фермента ингибируется на 50%.
Действие конкурентного ингибитора снимается повышением концентрации субстрата, так как сродство фермента и субстрата выше, чем сродство фермента и ингибитора.
Кm F и S и Km F и J различны и это узнают путем построения графиков Михаэлиса-Ментен и Лайнуэвера-Бэрка
V max – одинакова
K m с ингибитором увеличивается.
Действие многих химиотерапевтических средств основано на конкурентном ингибировании. Например, сулфаниламидные препараты, используемые для лечения болезней, вызываемых микробными инфекциями. Сульфаниламидные препараты по структуре сходны с п-аминобензойной кислотой. ПАБК является предшественником в микробиологическом синтезе фолиевой кислоты, из которой кофермент, необходимый для синтеза нуклииновых кислот микроорганизмов. При введении сульфаниламидных препаратов наблюдается угнетение фермента и гибель микроорганизмов.
На конкурентном ингибировании основано применение и фторурацила, который используется при лечения рака.
Неконкурентное, обратимое ингибирование.
Действие неконкурентного ингибитора не может быть устранено увеличением концентрации субстрата.
Неконкурентный ингибитор не связывается с активным центром, он может связываться со свободным ферментом , либо с комплексом FS , либо с тем и другим, но обе формы JF и JFS – не активны.
K m - не изменяется, т.к. нет связывания с активным центром.
V max – уменьшается.
Наиболее общий тип неконкурентного ингибирования имеет место при действии реагентов, обратимо связывающих SH-группы цис, входящего в каталитический центр или близко от него. Это ионы Cu 2+ , Hg 2+ , Ag + и их производные с образованием меркаптидов:
Ферменты, для активации которых необходимы ионы Ме ингибируются по такому способу агентами связывающими эти ионы:
ферро или ферроцианид.
Регуляция активности ферментов.
Использование ферментов в фармации, медицине.
Виды регуляции активности ферментов:
1. Аллостерическая модификация.
2. Активация зимогенов.
3. Регуляция путем химической модификации.
Конец работы -
Эта тема принадлежит разделу:
Структура, свойства и функции белков
Выяснение структуры белков является одной из главных проблем современной биохимии... Белковые молекулы представляют собой высокомолекулярные соединения... Большинство белков имеют уровня организации структуры белковой молекулы...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ:
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
