Что характерно для ферментов. Структурно-функциональная организация ферментов. Регуляция активности ферментов. Определение амилазной активности мочи
Ферменты
ФЕРМЕ́НТЫ -ов; мн. (ед. ферме́нт, -а; м.). [от лат. fermentum - закваска] Биол., хим. Специфические белковые катализаторы, присутствующие во всех живых клетках, регулирующие обмен веществ и поэтому играющие важную роль во всех процессах жизнедеятельности; энзимы. Бродильный фермент. Ф. гниения. Ф. окисления. Активность ферментов зависит от поступления в организм витаминов. Изучение свойств отдельных ферментов.
◁ Ферме́нтный, -ая, -ое. Биол., хим. Ф-ая реакция. Ф-ые яды. Ферментати́вный, -ая, -ое. Ф-ые вещества. Изучение ферментативных процессов.
ферме́нты(от лат. fermentum - закваска) (энзимы), биологические катализаторы, присутствующие во всех живых клетках. Осуществляют превращения веществ в организме, направляя и регулируя тем самым его обмен веществ. По химической природе - белки. Ферменты обладают оптимальной активностью при определённых значениях рН, нередко наличии необходимых коферментов и кофакторов, отсутствии ингибиторов. Каждый вид ферментов катализирует превращение определённых веществ (субстратов), иногда лишь единственного вещества. Поэтому многочисленные биохимические реакции в клетках осуществляет огромное число различных ферментов. Все ферменты подразделяются на 6 классов: оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы и лигазы. Многие ферменты выделены из живых клеток и получены в кристаллическом виде (впервые в 1926). Ферментные препараты применяют в медицине, в пищевой и лёгкой промышленности. Изучает ферменты энзимология.
ФЕРМЕНТЫФЕРМЕ́НТЫ (от лат. «fermentum» - брожение, закваска), энзимы, специфические белки, увеличивающие скорость протекания химических реакций в клетках всех живых организмов.
По химической природе - белки, обладающие оптимальной активностью при определенном рН, наличии необходимых коферментов и кофакторов и отсутствии ингибиторов. Ферменты называют также биокатализаторами по аналогии с катализаторами (см.
КАТАЛИЗАТОРЫ)
в химии. Каждый вид ферментов катализирует превращение определенных веществ (субстратов), иногда лишь единственного вещества в единственном направлении. Поэтому многочисленные биохимические реакции в клетках осуществляет огромное число различных ферментов. Подразделяются на 6 классов: оксидоредуктазы, трансферазы, гидролазы (см.
ГИДРОЛАЗЫ)
, лиазы (см.
ЛИАЗЫ)
, изомеразы (см.
ИЗОМЕРАЗЫ)
и лигазы (см.
ЛИГАЗЫ)
. Многие ферменты выделены из живых клеток и получены в кристаллическом виде (впервые в 1926).
Роль ферментов в организме
Ферменты участвуют в осуществлении всех процессов обмена веществ, в реализации генетической информации. Переваривание и усвоение пищевых веществ, синтез и распад белков (см.
БЕЛКИ (органические соединения))
, нуклеиновых кислот (см.
НУКЛЕИНОВЫЕ КИСЛОТЫ)
, жиров (см.
ЖИРЫ)
, углеводов (см.
УГЛЕВОДЫ)
и других соединений в клетках и тканях всех организмов - все эти процессы невозможны без участия ферментов. Любое проявление функций живого организма - дыхание, мышечное сокращение, нервно-психическая деятельность, размножение и др. - обеспечивается действием ферментов. Индивидуальные особенности клеток, выполняющих определенные функции, в значителной мере определяются уникальным набором ферментов, производство которых генетически запрограммировано. Отсутствие даже одного фермента или какой-нибудь его дефект могут привести к серьезным отрицательным последствиям для организма.
Каталитические свойства ферментов
Ферменты - самые активные среди всех известных катализаторов. Большинство реакций в клетке протекает в миллионы и миллиарды раз быстрее, чем если бы они протекали в отсутствие ферментов. Так, одна молекула фермента каталазы (см.
КАТАЛАЗА)
способна за секунду превратить в воду и кислород до 10 тыс. молекул токсичной для клеток перекиси водорода, образующейся при окислении различных соединений. Каталитические свойства ферментов обусловлены их способностью существенно уменьшать энергию активации вступающих в реакцию соединений, то есть в присутствии ферментов требуется меньше энергии для «запуска» данной реакции.
История открытия ферментов
Процессы, протекающие при участии ферментов, известны человеку с глубокой древности, ведь в основе приготовления хлеба, сыра, вина и уксуса лежат ферментативные процессы. Но только в 1833 году впервые из прорастающих зерен ячменя было выделено активное вещество, осуществляющее превращение крахмала в сахар и получившее название диастазы (ныне этот фермент называется амилазой (см.
АМИЛАЗЫ)
). В конце 19 в. было доказано, что сок, получаемый при растирании дрожжевых клеток, содержит сложную смесь ферментов, обеспечивающих процесс спиртового брожения. С этого времени началось интенсивное изучение ферментов - их строения и механизма действия. Так как роль биокатализа была выявлена при изучении брожения, то именно с этим процессом были связаны два установившихся еще с 19 в. названия - «энзим» (в переводе с греч. «из дрожжей») и «фермент». Правда, последний синоним применяется только в русскоязычной литературе, хотя научное направление, занятое изучением ферментов и процессов с их участием, традиционно называется энзимологией. В первой половине 20 в. было установлено, что по химической природе ферменты yвляются белками, а во второй половине века для многих сотен ферментов уже была определена последовательность аминокислотных остатков, установлена пространственная структура. В 1969 впервые был осуществлен химический синтез фермента рибонуклеазы. Огромные успехи были достигнуты в понимании механизма действия ферментов.
Местонахождение ферментов в организме
В клетке часть ферментов находится в цитоплазме, но в основном ферменты связаны с определенными клеточными структурами, где и проявляют свое действие. В ядре, например, находятся ферменты, ответственные за репликацию - синтез ДНК (см.
ДЕЗОКСИРИБОНУКЛЕИНОВЫЕ КИСЛОТЫ)
(ДНК-полимеразы), за ее транскрипцию - образование РНК (см.
РИБОНУКЛЕИНОВЫЕ КИСЛОТЫ)
(РНК-полимеразы). В митохондриях присутствуютферменты, ответственные за накопление энергии, в лизосомах - большинство гидролитических ферментов, участвующих в распаде нуклеиновых кислот и белков.
Условия действия ферментов
Все реакции с участием ферментов протекают, в основном, в нейтральной, слабощелочной или слабокислой среде. Однако максимальная активность каждого отдельного фермента проявляется при строго определенных значениях pH. Для действия большинства ферментов теплокровных животных наиболее благоприятной температурой является 37-40 o С. У растений при температуре ниже 0 o С действие ферментов полностью не прекращается, хотя жизнедеятельность растений при этом резко снижается. Ферментативные процессы, как правило, не могут протекать при температуре выше 70 o С, так как ферменты, как и всякие белки подвержены тепловой денатурации (разрушению структуры).
Размеры ферментов и их строение
Молекулярная масса ферментов, как и всех остальных белков, лежит в пределах 10 тыс. - 1 млн. (но может быть и больше). Они могут состоять из одной или нескольких полипептидных цепей и могут быть представлены сложными белками. В состав последних наряду с белковым компонентом (апоферментом) входят низкомолекулярные соединения - коферменты (кофакторы, коэнзимы), в том числе ионы металлов, нуклеотиды, витамины и их производные. Некоторые ферменты образуются в форме неактивных предшественников (проферментов) и становятся активными после тех или иных изменений в структуре молекулы, например, после отщепления от нее небольшого фрагмента. К их числу относятся пищеварительные ферменты трипсин (см.
ТРИПСИН)
и химотрипсин (см.
ХИМОТРИПСИН)
, которые синтезируются клетками поджелудочной железы в форме неактивных предшественников (трипсиногена и химотрипсиногена) и обретают активность в тонком кишечнике в составе поджелудочного сока. Многие ферменты образуют так называемые ферментные комплексы. Такие комплексы, например, встроены в мембраны клеток или клеточных органелл и участвуют в транспорте веществ.
Подвергающееся превращению вещество (субстрат) связывается с определенным участком фермента, aго активным центром, который формируется боковыми цепями аминокислот, находящимися часто в значительно удаленных друг от друга участках полипептидной цепи. Например, активный центр молекулы химотрипсина образуют остатки гистидина (см.
ГИСТИДИН)
, находящегося в полипептидной цепи в положении 57, серина (см.
СЕРИН)
в положении 195 и аспарагиновой кислоты в положении 102 (всего в молекуле химотрипсина 245 аминокислот). Таким образом, сложная укладка полипептидной цепи в молекуле белка - ферменте обеспечивает возможность нескольким боковым цепям аминокислот оказаться в строго определенном месте и на определенном расстоянии друг от друга. Коферменты также входят в состав активного центра (белковая часть и небелковый компонент в отдельности ферментативной активностью не обладают и приобретают свойства фермента, лишь соединившись вместе).
Протекание процессов с участием ферментов
Большинство ферментов отличается высокой специфичностью (избирательностью) действия, когда превращение каждого реагирующего вещества (субстрата) в продукт реакции осуществляется специальным ферментом. При этом действие фермента может быть строго ограничено одним субстратом. Например, фермент уреаза (см.
УРЕАЗА)
, участвующий в распаде мочевины до аммиака и углекислого газа, не реагирует на сходную по строению метилмочевину. Многие ферменты aействуют на несколько родственных по структуре соединений или на один тип химической связи (например, расщепляющие фосфодиэфирную связь фермент фосфатазы (см.
ФОСФАТАЗЫ)
).
Фермент осуществляет свое действие через образование фермент-субстративного комплекса, который затем распадается с образованием продуктов ферментативной реакции и освобождением фермента. A результате образования фермент-субстратного комплекса субстрат изменяет свою конфигурацию; при этом преобразуемая фермент-химическая связь ослабляется и реакция протекает с меньшей начальной затратой энергии и, следовательно, с намного большей скоростью. Мерой скорости ферментативной реакции служит количество субстрата, подвергшегося превращению в единицу времени, или количество образовавшегося продукта. Многие ферментативные реакции в зависимости от концентрации в среде субстрата и продукта реакции могут протекать как в прямом, так и в обратном направлении (избыток субстрата сдвигает реакцию в сторону образования продукта, в то время как при чрезмерном накоплении последнего будет происходить синтез субстрата). Это означает, что ферментативные реакции могут быть обратимыми. Например, карбоангидраза (см.
КАРБОАНГИДРАЗА)
крови превращает поступающий из тканей углекислый газ в угольную кислоту (H 2 CO 3), а в легких, напротив, катализирует превращение угольной кислоты в воду и углекислый газ, который удаляется при выдохе. Однако следует помнить, что ферменты, как и другие катализаторы, не могут сдвигать термодинамическое равновесие химической реакции, а лишь значительно ускоряют достижение этого равновесия.
Номенклатура названий ферментов
При наименовании фермента cа основу берут название субстрата и добавляют суффикс «аза». Так появились, в частности, протеиназы - ферменты, расщепляющие белки (протеины), липазы (расщепляют липиды, или жиры) и т. д. Некоторые ферменты получили специальные (тривиальные) названия, например, пищеварительные ферменты- пепсин (см.
ПЕПСИН)
, химотрипсин (см.
ХИМОТРИПСИН)
и трипсин (см.
ТРИПСИН)
.
В клетках организма протекает несколько тысяч различных реакций обмена веществ и, следовательно, имеется столько же ферментов. Aля того, чтобы привести такое многообразие в систему, было принято международное соглашение о классификации ферментов. A соответствии с этой системой все ферменты a зависимости от типа катализируемых ими реакций были поделены на шесть основных классов, каждый из которых включает ряд подклассов. Кроме того, каждый фермент получил четырехзначный кодовый номер (шифр) и название, указывающее на реакцию, которую yтот фермент катализирует. Ферменты, катализирующие одну и ту же реакцию у организмов разных видов, могут существенно различаться между собой по своей белковой структуре, но в номенклатуре имеют общее название и один кодовый номер.
Болезни, связанные с нарушением выработки ферментов
Отсутствие или снижение активности какого-либо фермента (нередко и избыточная активность) у человека приводит к развитию заболеваний (энзимопатий) или гибели организма. Так, передаваемое по наследству заболевание детей - галактоземия (приводит к умственной отсталости) - развивается вследствие нарушения синтеза фермента, ответственного за превращение галактозы (см.
ГАЛАКТОЗА)
в легко усваиваемую глюкозу (см.
ГЛЮКОЗА)
. Причиной другого наследственного заболевания - фенилкетонурии, сопровождающегося расстройством психической деятельности, является потеря клетками печени способности синтезировать фермент, катализирующий превращение аминокислоты фенилаланина (см.
ФЕНИЛАЛАНИН)
в тирозин (см.
ТИРОЗИН)
. Определение активности многих ферментов a крови, моче, спинно-мозговой, семенной и других жидкостях организма используется для диагностики ряда заболеваний. С помощью такого анализа сыворотки крови возможно обнаружение на ранней стадии инфаркта миокарда, вирусного гепатита, панкреатита, нефрита и других заболеваний.
Использование ферментов человеком
Так как ферменты сохраняют свои свойства и вне организма, их успешно используют в различных отраслях промышленности. Например, протеолитический фермент папайи (из сока папайи (см.
ПАПАЙЯ)
) - в пивоварении, для мягчения мяса; пепсин - при производстве «готовых» каш и как лекарственный препарат; трипсин - при производстве продуктов для детского питания; реннин (сычужный фермент из желудка теленка) - в сыроварении. Каталаза широко применяется в пищевой и резиновой промышленности, а расщепляющие полисахариды целлюлазы и пектидазы - для осветления фруктовых соков. Ферменты необходимы при установлении структуры белков, нуклеиновых кислот и полисахаридов, в генетической инженерии и т. д. С помощью ферментов получают лекарственные препараты и сложные химические соединения.
Обнаружена способность некоторых форм рибонуклеиновых кислот (рибозимов) катализировать отдельные реакции, то есть выступать в качестве ферментов. Возможно, в ходе эволюции органического мира рибозимы служили биокатализаторами до того, как ферментативная функция перешла к белкам, более приспособленным к выполнению этой задачи.
- (от лат. fermentum брожение, закваска), энзимы, биокатализаторы, специфич. белки, присутствующие во всех живых клетках и играющие роль биол. катализаторов. Через их посредство реализуется генетич. информация и осуществляются все процессы обмена… … Биологический энциклопедический словарь
- (лат. Fermentum закваска, от fervere быть горячим). Органические вещества, производящие брожение других органических тел, не подвергаясь сами гниению. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ФЕРМЕНТЫ… … Словарь иностранных слов русского языка
- (от лат. fermentum закваска) (энзимы) биологические катализаторы, присутствующие во всех живых клетках. Осуществляют превращения веществ в организме, направляя и регулируя тем самым его обмен веществ. По химической природе белки. Ферменты… … Большой Энциклопедический словарь
- (от латинского fermentum закваска), биологические катализаторы, присутствующие во всех живых клетках. Осуществляют превращения (обмен) веществ в организме. По химической природе белки. В многочисленных биохимических реакциях в клетке участвует… … Современная энциклопедия
Сущ., кол во синонимов: 2 биокатализаторы (1) энзимы (2) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
Ферменты. См. энзимы. (
История изучения
Термин фермент предложен в XVII веке химиком ван Гельмонтом при обсуждении механизмов пищеварения .
В кон. ХVIII - нач. XIX вв. уже было известно, что мясо переваривается желудочным соком , а крахмал превращается в сахар под действием слюны. Однако механизм этих явлений был неизвестен .
Классификация ферментов
По типу катализируемых реакций ферменты подразделяются на 6 классов согласно иерархической классификации ферментов (КФ , - Enzyme Comission code). Классификация была предложена Международным союзом биохимии и молекулярной биологии (International Union of Biochemistry and Molecular Biology). Каждый класс содержит подклассы, так что фермент описывается совокупностью четырёх чисел, разделённых точками. Например, пепсин имеет название ЕС 3.4.23.1. Первое число грубо описывает механизм реакции, катализируемой ферментом:
- КФ 1: Оксидоредуктазы , катализирующие окисление или восстановление. Пример: каталаза , алкогольдегидрогеназа .
- КФ 2: Трансферазы , катализирующие перенос химических групп с одной молекулы субстрата на другую. Среди трансфераз особо выделяют киназы , переносящие фосфатную группу, как правило, с молекулы АТФ .
- КФ 3: Гидролазы , катализирующие гидролиз химических связей. Пример: эстеразы , пепсин , трипсин , амилаза , липопротеинлипаза .
- КФ 4: Лиазы , катализирующие разрыв химических связей без гидролиза с образованием двойной связи в одном из продуктов.
- КФ 5: Изомеразы , катализирующие структурные или геометрические изменения в молекуле субстрата.
- КФ 6: Лигазы , катализирующие образование химических связей между субстратами за счёт гидролиза АТФ . Пример: ДНК-полимераза .
Кинетические исследования
Простейшим описанием кинетики односубстратных ферментативных реакций является уравнение Михаэлиса - Ментен (см. рис.). На сегодняшний момент описано несколько механизмов действия ферментов. Например, действие многих ферментов описывается схемой механизма «пинг-понг».
В 1972-1973 г.г. была создана первая квантово-механическая модель ферментативного катализа (авторы М. В. Волькенштейн , Р. Р. Догонадзе, З. Д. Урушадзе и др.) .
Структура и механизм действия ферментов
Активность ферментов определяется их трёхмерной структурой .
Как и все белки, ферменты синтезируются в виде линейной цепочки аминокислот , которая сворачивается определённым образом. Каждая последовательность аминокислот сворачивается особым образом, и получающаяся молекула (белковая глобула) обладает уникальными свойствами. Несколько белковых цепей могут объединяться в белковый комплекс. Третичная структура белков разрушается при нагревании или воздействии некоторых химических веществ.
Активный центр ферментов
В активном центре условно выделяют :
- каталитический центр - непосредственно химически взаимодействующий с субстратом;
- связывающий центр (контактная или «якорная» площадка) - обеспечивающий специфическое сродство к субстрату и формирование комплекса фермент-субстрат.
Чтобы катализировать реакцию, фермент должен связаться с одним или несколькими субстратами. Белковая цепь фермента сворачивается таким образом, что на поверхности глобулы образуется щель, или впадина, где связываются субстраты. Эта область называется сайтом связывания субстрата. Обычно он совпадает с активным центром фермента или находится вблизи него. Некоторые ферменты содержат также сайты связывания кофакторов или ионов металлов.
Фермент, соединяясь с субстратом:
- очищает субстрат от водяной «шубы»
- располагает реагирующие молекулы субстратов в пространстве нужным для протекания реакции образом
- подготавливает к реакции (например, поляризует) молекулы субстратов.
Обычно присоединение фермента к субстрату происходит за счет ионных или водородных связей, редко - за счет ковалентных. В конце реакции её продукт (или продукты) отделяются от фермента.
В результате фермент снижает энергию активации реакции. Это происходит потому, что в присутствии фермента реакция идет по другому пути (фактически происходит другая реакция), например:
В отсутствие фермента:
- А+В = АВ
В присутствии фермента:
- А+Ф = АФ
- АФ+В = АВФ
- АВФ = АВ+Ф
где А, В - субстраты, АВ - продукт реакции, Ф - фермент.
Ферменты не могут самостоятельно обеспечивать энергией эндергонические реакции (для протекания которых требуется энергия). Поэтому ферменты, осуществляющие такие реакции, сопрягают их с экзергоническими реакциями, идущими с выделением большего количества энергии. Например, реакции синтеза биополимеров часто сопрягаются с реакцией гидролиза АТФ.
Для активных центров некоторых ферментов характерно явление кооперативности .
Специфичность
Ферменты обычно проявляют высокую специфичность по отношению к своим субстратам (субстратная специфичность). Это достигается частичной комплементарностью формы, распределения зарядов и гидрофобных областей на молекуле субстрата и в центре связывания субстрата на ферменте. Ферменты обычно демонстрируют также высокий уровень стереоспецифичности (образуют в качестве продукта только один из возможных стереоизомеров или используют в качестве субстрата только один стереоизомер), региоселективности (образуют или разрывают химическую связь только в одном из возможных положений субстрата) и хемоселективности (катализируют только одну химическую реакцию из нескольких возможных для данных условий). Несмотря на общий высокий уровень специфичности, степень субстратной и реакционной специфичности ферментов может быть различной. Например, эндопептидаза трипсин разрывает пептидную связь только после аргинина или лизина , если за ними не следует пролин, а пепсин гораздо менее специфичен и может разрывать пептидную связь, следующую за многими аминокислотами.
Модель «ключ-замок»
Гипотеза Кошланда об индуцированном соответствии
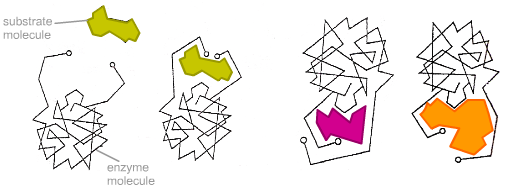
Более реалистичная ситуация в случае индуцированного соответствия. Неправильные субстраты - слишком большие или слишком маленькие - не подходят к активному центру
В 1890 г. Эмиль Фишер предположил, что специфичность ферментов определяется точным соответствием формы фермента и субстрата . Такое предположение называется моделью «ключ-замок». Фермент соединяется с субстратом с образованием короткоживущего фермент-субстратного комплекса. Однако, хотя эта модель объясняет высокую специфичность ферментов, она не объясняет явления стабилизации переходного состояния, которое наблюдается на практике.
Модель индуцированного соответствия
В 1958 г. Дениел Кошланд предложил модификацию модели «ключ-замок» . Ферменты, в основном, - не жесткие, а гибкие молекулы. Активный центр фермента может изменить конформацию после связывания субстрата. Боковые группы аминокислот активного центра принимают такое положение, которое позволяет ферменту выполнить свою каталитическую функцию. В некоторых случаях молекула субстрата также меняет конформацию после связывания в активном центре. В отличие от модели «ключ-замок», модель индуцированного соответствия объясняет не только специфичность ферментов, но и стабилизацию переходного состояния. Эта модель получила название «рука-перчатка».
Модификации
Многие ферменты после синтеза белковой цепи претерпевают модификации, без которых фермент не проявляет свою активность в полной мере. Такие модификации называются посттрансляционными модификациями (процессингом). Один из самых распространенных типов модификации - присоединение химических групп к боковым остаткам полипептидной цепи. Например, присоединение остатка фосфорной кислоты называется фосфорилированием, оно катализируется ферментом киназой . Многие ферменты эукариот гликозилированы, то есть модифицированы олигомерами углеводной природы.
Ещё один распространенный тип посттранляционных модификаций - расщепление полипептидной цепи. Например, химотрипсин (протеаза , участвующая в пищеварении), получается при выщеплении полипептидного участка из химотрипсиногена. Химотрипсиноген является неактивным предшественником химотрипсина и синтезируется в поджелудочной железе . Неактивная форма транспортируется в желудок , где превращается в химотрипсин. Такой механизм необходим для того, чтобы избежать расщепления поджелудочной железы и других тканей до поступления фермента в желудок. Неактивный предшественник фермента называют также «зимогеном».
Кофакторы ферментов
Некоторые ферменты выполняют каталитическую функцию сами по себе, безо всяких дополнительных компонентов. Однако есть ферменты, которым для осуществления катализа необходимы компоненты небелковой природы. Кофакторы могут быть как неорганическими молекулами (ионы металлов, железо-серные кластеры и др.), так и органическими (например, флавин или гем). Органические кофакторы, прочно связанные с ферментом, называют также простетическими группами. Кофакторы органической природы, способные отделяться от фермента, называют коферментами.
Фермент, который требует наличия кофактора для проявления каталитической активности, но не связан с ним, называется апо-фермент. Апо-фермент в комплексе с кофактором носит название холо-фермента. Большинство кофакторов связано с ферментом нековалентными, но довольно прочными взаимодействиями. Есть и такие простетические группы, которые связаны с ферментом ковалентно, например, тиаминпирофосфат в пируватдегидрогеназе.
Регуляция работы ферментов
У некоторых ферментов есть сайты связывания малых молекул, они могут быть субстратами или продуктами метаболического пути, в который входит фермент. Они уменьшают или увеличивают активность фермента, что создает возможность для обратной связи.
Ингибирование конечным продуктом
Метаболический путь - цепочка последовательных ферментативных реакций. Часто конечный продукт метаболического пути является ингибитором фермента, ускоряющего первую из реакций данного метаболического пути. Если конечного продукта слишком много, то он действует как ингибитор для самого первого фермента, а если после этого конечного продукта стало слишком мало, то первый фермент опять активируется. Таким образом, ингибирование конечным продуктом по принципу отрицательной обратной связи - важный способ поддержания гомеостаза (относительного постоянства условий внутренней среды организма).
Влияние условий среды на активность ферментов
Активность ферментов зависит от условий в клетке или организме - давления, кислотности среды, температуры, концентрации растворённых солей (ионной силы раствора) и др.
Множественные формы ферментов
Множественные формы ферментов можно разделить на две категории:
- Изоферменты
- Собственно множественные формы (истинные)
Изоферменты - это ферменты, синтез которых кодируется разными генами, у них разная первичная структура и разные свойства, но они катализируют одну и ту же реакцию. Виды изоферментов:
- Органные - ферменты гликолиза в печени и мышцах.
- Клеточные - малатдегидрогеназа цитоплазматическая и митохондриальная (ферменты разные, но катализируют одну и ту же реакцию).
- Гибридные - ферменты с четвертичной структурой, образуются в результате нековалентного связывания отдельных субъединиц (лактатдегидрогеназа - 4 субъединицы 2 типов).
- Мутантные - образуются в результате единичной мутации гена.
- Аллоферменты - кодируются разными аллелями одного и того же гена.
Собственно множественные формы (истинные) - это ферменты, синтез которых кодируется одним и тем же аллелем одного и того же гена, у них одинаковая первичная структура и свойства, но после синтеза на рибосомах они подвергаются модификации и становятся разными, хотя и катализируют одну и ту же реакцию.
Изоферменты разные на генетическом уровне и отличаются от первичной последовательности, а истинные множественные формы становятся разными на посттрансляционном уровне.
Медицинское значение
Связь между ферментами и наследственными болезнями обмена веществ была впервые установлена А. Гэрродом в 1910-е гг. Гэррод назвал заболевания, связанные с дефектами ферментов, «врожденными ошибками метаболизма».
Если происходит мутация в гене , кодирующем определенный фермент, может измениться аминокислотная последовательность фермента. При этом в результате большинства мутаций его каталитическая активность снижается или полностью пропадает. Если организм получает два таких мутантных гена (по одному от каждого из родителей), в организме перестает идти химическая реакция, которую катализирует данный фермент. Например, появление альбиносов связано с прекращением выработки фермента тирозиназы, отвечающего за одну из стадий синтеза темного пигмента меланина. Фенилкетонурия связана с пониженной или отсутствующей активностью фермента фенилаланин-4-гидроксилазы в печени.
В настоящее время известны сотни наследственных заболеваний, связанные с дефектами ферментов. Разработаны методы лечения и профилактики многих из таких болезней.
Практическое использование
Ферменты широко используются в народном хозяйстве - пищевой, текстильной промышленности, в фармакологии и медицине. Большинство лекарств влияют на течение ферментативных процессов в организме, запуская или приостанавливая те или иные реакции.
Ещё шире область использования ферментов в научных исследованиях и в медицине.
Примечания
Литература
Смотреть что такое "Ферменты" в других словарях:
ФЕРМЕНТЫ - (син. энзимы; франц. диастазы), биол. агенты, катализирующие большинство хим. реакций, лежащих в основе жизнедеятельности клетки и организма. Ряд характерных свойств термолябильность, специфичность действия, высокая каталитическая эффективность,… … Большая медицинская энциклопедия
- (от лат. fermentum брожение, закваска), энзимы, биокатализаторы, специфич. белки, присутствующие во всех живых клетках и играющие роль биол. катализаторов. Через их посредство реализуется генетич. информация и осуществляются все процессы обмена… … Биологический энциклопедический словарь
- (лат. Fermentum закваска, от fervere быть горячим). Органические вещества, производящие брожение других органических тел, не подвергаясь сами гниению. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ФЕРМЕНТЫ… … Словарь иностранных слов русского языка
- (от лат. fermentum закваска) (энзимы) биологические катализаторы, присутствующие во всех живых клетках. Осуществляют превращения веществ в организме, направляя и регулируя тем самым его обмен веществ. По химической природе белки. Ферменты… … Большой Энциклопедический словарь
- (от латинского fermentum закваска), биологические катализаторы, присутствующие во всех живых клетках. Осуществляют превращения (обмен) веществ в организме. По химической природе белки. В многочисленных биохимических реакциях в клетке участвует… … Современная энциклопедия
Сущ., кол во синонимов: 2 биокатализаторы (1) энзимы (2) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
Ферменты. См. энзимы. (
Введение
1. Ферменты
1.1 Термин «ферменты», биологическая роль ферментов
1.2 Особенности строения простых и сложных ферментов. Преимущества перед химическими катализаторами
1.3 Методы выделение ферментов
1.4 Классификация иноменклатура ферментов по типу катализируемой реакции
1.5 Область применения
2. Биокатализ
2.1 Принцип действия ферментов
2.2 Факторы, влияющие на реакции ферментации
3. Особенности биомиметики
Заключение
Список использованных источников
фермент катализатор реакция
Введение
Я выбрала тему «Ферменты. Биокатализ. Возможности биомиметики», потому что в последнее время в качестве лекарственных средств стали широко применять препараты, оказывающие направленное влияние на ферментные процессы организма. Как известно в нашем организме действует много ферментов, которые способствуют осуществлению обменных процессов (дыхание, пищеварение, мышечное сокращение, фотосинтез), которые и определяют сам процесс жизни. Поэтому препараты стали широко применяться при лечении заболеваний, сопровождающихся гнойно-некротическими процессами, при тромбозах и тромбоэмболиях, нарушениях процессов пищеварения. Ферментные препараты стали находить также применение при лечении онкологических заболеваний.
Ферменты играют немаловажную роль и в проведении многих технологических процессов. Ферменты высокого качества позволяют улучшить технологию, сократить затраты и даже получить новые продукты.
В настоящее время ферменты применяются более чем в 25 отраслях промышленности: это и пищевая промышленность, и фармацевтическая, целлюлозно-бумажная, лёгкая, а так же в сельском хозяйстве.
Целью моего реферата является: подробное исследование понятий фермента и ферментативного катализа (биокатализа).
В этой связи мне стало интересно узнать историю появления первых ферментов, особенности строения, их свойства, классификацию, принцип действия, методы выделения ферментов.
1. Ферменты
1.1 Термин «ферменты», биологическая роль ферментов
В течение всей своей истории существования человек пользовался ферментами, зачастую не подразумевая об этом.
Термин фермент предложен в XVII веке химиком Ван Гельмонтом при обсуждении механизмов пищеварения. В кон. ХVIII - нач. XIX вв. уже было известно, что мясо переваривается желудочным соком, а крахмал превращается в сахар под действием слюны. Однако механизм этих явлений был неизвестен. В XIX в. Луи Пастер, изучая превращение углеводов в этиловый спирт под действием дрожжей, пришел к выводу, что этот процесс (брожение) катализируется некой жизненной силой, находящейся в дрожжевых клетках. Термин энзим (от греч. ἐ ν- - в- и ζύμη - дрожжи, закваска) был предложен в 1876 году.
Первый кристаллический фермент (уреаза) выделен американским биохимиком Д. Самнером в 1926 г.
Итак, что же такое ферменты? Ферменты (от лат. fermentum - брожение, закваска) или энзимы - органические вещества белковой природы, которые синтезируются в клетках и во много раз ускоряют протекающие в них реакции, не подвергаясь при этом химическим превращениям.
На сегодняшний день известно свыше 3000 ферментов. Все они обладают рядом специфических свойств, отличающих их от неорганических катализаторов. Только в человеческом организме ежесекундно происходят тысячи ферментативных реакций. Ферменты играют важнейшую роль во всех процессах жизнедеятельности, направляя и регулируя обмен веществ организма.
Нужно также отметить, что вся живая природа существует исключительно благодаря биокатализу. Недаром великий русский физиолог, нобелевский лауреат И.П. Павлов назвал ферменты носителями жизни.
1.2 Особенности строения простых и сложных ферментов. Преимущества перед химическими катализаторами
По строению ферменты могут быть однокомпонентными, простыми белками, и двухкомпонентными, сложными белками. Во втором случае в составе фермента обнаруживается не только белковый компонент – апофермент (apoenzyme ), но и добавочная группа небелковой природы – кофермент (coenzyme) . Последние вещества, в отличие от белкового компонента фермента (апофермента), имеют сравнительно небольшую молекулярную массу и, как правило, термостабильны.
Химическая природа важнейших коферментов была выяснена в 30-е годы нашего столетия благодаря трудам О. Варбурга, Р. Куна, П. Каррера и др. Оказалось, что роль коферментов в двухкомпонентных ферментах играют большинство витаминов (Е, К, Q, В1, В2, В6 В12, С, Н и др.) или соединений, построенных с участием витаминов, именно поэтому они должны поступать в организм с пищей. Многие ферменты с большой молекулярной массой проявляют каталитическую активность только в присутствии специфических низкомолекулярных веществ, называемых коферментами (или кофакторами).
Характерной особенностью двухкомпонентных ферментов является то, что ни белковая часть, ни добавочная группа в отдельности не обладают заметной каталитической активностью. Только их комплекс проявляет ферментативные свойства. При этом белок резко повышает каталитическую активность добавочной группы, присущую ей в свободном состоянии в очень малой степени; добавочная же группа стабилизирует белковую часть и делает ее менее уязвимой к денатурирующим агентам.
Однокомпонентные ферменты представляют собой простые белки. У однокомпонентных ферментов, не имеющих добавочной группы, которая могла бы входить в непосредственный контакт с преобразуемым соединением. Эту функцию выполняет часть белковой молекулы, называемая каталитическим центром. Предполагают, что каталитический центр однокомпонентного фермента представляет собой уникальное сочетание нескольких аминокислотных остатков, располагающихся в определенной части белковой молекулы. Аминокислотные остатки, образующие каталитический центр однокомпонентного фермента, расположены в различных точках единой полипептидной цепи. Поэтому каталитический центр возникает в тот момент, когда белковая молекула приобретает присущую ей третичную структуру. Следовательно, изменение третичной структуры фермента под влиянием тех или иных факторов может привести к деформации каталитического центра и изменению ферментативной активности.
Кроме каталитического центра, образованного сочетанием аминокислотных радикалов или присоединением кофермента, у ферментов различают еще два центра: субстратный и аллостерический. Под субстратным центром понимают участок молекулы фермента, ответственный за присоединение вещества (субстрата), подвергающегося ферментативному превращению. Часто этот участок называют “якорной площадкой” фермента, где, как судно на якорь, становится субстрат. Понятие о каталитическом и субстратном центре не следует абсолютизировать. В реальных ферментах субстратный центр может совпадать (или перекрываться) с каталитическим центром. Более того, каталитический центр может окончательно формироваться в момент присоединения субстрата. Поэтому часто говорят об активном центре фермента, представляющем сочетание первого и второго.
Аллостерический центр представляет собой участок молекулы фермента, в результате присоединения к которому определенного низкомолекулярного (а иногда - и высокомолекулярного) вещества изменяется третичная структура белковой молекулы. Вследствие этого изменяется конфигурация активного центра, сопровождающаяся либо увеличением, либо снижением каталитической активности фермента.
Ферменты как биологические катализаторы имеют ряд особенностей, которые отличаются их от катализаторов неорганической природы:
ферментативные реакции протекают в физиологически нормальных для живого организма условиях и не требуют жестких условий - повышенной температуры, высокой кислотности среды, избыточного давления;
ферменты как катализаторы строго специфичны, они катализируют только определённые биохимические реакции, действуя лишь на определённый субстрат;
ферментативные реакции в живых организмах идут последовательно, таким образом, что субстратом для каждого последующего фермента является конечный продукт предшествующий ему ферментативной реакции;
скорость ферментативных реакций высока, но она зависит от определённых факторов. Ускоряют реакцию в 10 8 -10 20 раз. Ферментативные реакции идут со 100%-ным выходом и не дают побочным продуктов. Для выражения каталитической активности согласно рекомендациям Международного биохимического союза используется катал. Катал (кат) – это каталитическая активность, способная осуществить реакцию со скоростью, равной 1 моль в секунду;
все ферменты являются белками. Молекулярная масса ферментов колеблется в широких пределах от 12*10 3 до 10*10 6 Да.
1.3 Методы выделения ферментов
Процесс выделения какого-либо белка начинается с переведения белков ткани в раствор. Для этого ткань (материал), из которой получают фермент, тщательно измельчают в гомогенизаторе в присутствии буферного раствора. Для лучшего разрушения клеток к материалу добавляют кварцевый песок, если материал растирают в ступке. В результате получают кашицу - гомогенат. Если не проводилось предварительное фракционирование органоидов клетки, гомогенат содержит обрывки клеток, ядра, хлоропласты и другие органоиды клеток, растворимые пигменты и белки.
При выделении ферментов из тканей живых организмов, в том числе растительных, необходимо соблюдать условия, не вызывающие денатурацию белка. Все работы проводят при пониженной температуре (4 0 С) и при оптимальных для данного фермента значениях pH среды буферного раствора.
После перевода ферментов из ткани в растворенное состояние гомогенат подвергают центрифугированию для отделения нерастворимой части материала, а затем в отдельных фракциях экстрата-центрифугата выделяют следуемые ферменты.
Так как все ферменты являются белками, то для получения очищенных препаратов ферментов применяются те же способы выделения, что и при работе с белками.
Введение
1. Ферменты
1.1 Термин «ферменты», биологическая роль ферментов
1.2 Особенности строения простых и сложных ферментов. Преимущества перед химическими катализаторами
1.3 Методы выделение ферментов
1.4 Классификация иноменклатура ферментов по типу катализируемой реакции
1.5 Область применения
2. Биокатализ
2.1 Принцип действия ферментов
2.2 Факторы, влияющие на реакции ферментации
3. Особенности биомиметики
Заключение
Список использованных источников
фермент катализатор реакция
Введение
Я выбрала тему «Ферменты. Биокатализ. Возможности биомиметики», потому что в последнее время в качестве лекарственных средств стали широко применять препараты, оказывающие направленное влияние на ферментные процессы организма. Как известно в нашем организме действует много ферментов, которые способствуют осуществлению обменных процессов (дыхание, пищеварение, мышечное сокращение, фотосинтез), которые и определяют сам процесс жизни. Поэтому препараты стали широко применяться при лечении заболеваний, сопровождающихся гнойно-некротическими процессами, при тромбозах и тромбоэмболиях, нарушениях процессов пищеварения. Ферментные препараты стали находить также применение при лечении онкологических заболеваний.
Ферменты играют немаловажную роль и в проведении многих технологических процессов. Ферменты высокого качества позволяют улучшить технологию, сократить затраты и даже получить новые продукты.
В настоящее время ферменты применяются более чем в 25 отраслях промышленности: это и пищевая промышленность, и фармацевтическая, целлюлозно-бумажная, лёгкая, а так же в сельском хозяйстве.
Целью моего реферата является: подробное исследование понятий фермента и ферментативного катализа (биокатализа).
В этой связи мне стало интересно узнать историю появления первых ферментов, особенности строения, их свойства, классификацию, принцип действия, методы выделения ферментов.
1. Ферменты
1.1 Термин «ферменты», биологическая роль ферментов
В течение всей своей истории существования человек пользовался ферментами, зачастую не подразумевая об этом.
Термин фермент предложен в XVII веке химиком Ван Гельмонтом при обсуждении механизмов пищеварения. В кон. ХVIII - нач. XIX вв. уже было известно, что мясо переваривается желудочным соком, а крахмал превращается в сахар под действием слюны. Однако механизм этих явлений был неизвестен. В XIX в. Луи Пастер, изучая превращение углеводов в этиловый спирт под действием дрожжей, пришел к выводу, что этот процесс (брожение) катализируется некой жизненной силой, находящейся в дрожжевых клетках. Термин энзим (от греч. ἐν- - в- и ζύμη - дрожжи, закваска) был предложен в 1876 году.
Первый кристаллический фермент (уреаза) выделен американским биохимиком Д. Самнером в 1926 г.
Итак, что же такое ферменты? Ферменты (от лат. fermentum - брожение, закваска) или энзимы - органические вещества белковой природы, которые синтезируются в клетках и во много раз ускоряют протекающие в них реакции, не подвергаясь при этом химическим превращениям.
На сегодняшний день известно свыше 3000 ферментов. Все они обладают рядом специфических свойств, отличающих их от неорганических катализаторов. Только в человеческом организме ежесекундно происходят тысячи ферментативных реакций. Ферменты играют важнейшую роль во всех процессах жизнедеятельности, направляя и регулируя обмен веществ организма.
Нужно также отметить, что вся живая природа существует исключительно благодаря биокатализу. Недаром великий русский физиолог, нобелевский лауреат И.П. Павлов назвал ферменты носителями жизни.
1.2 Особенности строения простых и сложных ферментов. Преимущества перед химическими катализаторами
По строению ферменты могут быть однокомпонентными, простыми белками, и двухкомпонентными, сложными белками. Во втором случае в составе фермента обнаруживается не только белковый компонент – апофермент (apoenzyme), но и добавочная группа небелковой природы – кофермент (coenzyme). Последние вещества, в отличие от белкового компонента фермента (апофермента), имеют сравнительно небольшую молекулярную массу и, как правило, термостабильны.
Химическая природа важнейших коферментов была выяснена в 30-е годы нашего столетия благодаря трудам О. Варбурга, Р. Куна, П. Каррера и др. Оказалось, что роль коферментов в двухкомпонентных ферментах играют большинство витаминов (Е, К, Q, В1, В2, В6 В12, С, Н и др.) или соединений, построенных с участием витаминов, именно поэтому они должны поступать в организм с пищей. Многие ферменты с большой молекулярной массой проявляют каталитическую активность только в присутствии специфических низкомолекулярных веществ, называемых коферментами (или кофакторами).
Характерной особенностью двухкомпонентных ферментов является то, что ни белковая часть, ни добавочная группа в отдельности не обладают заметной каталитической активностью. Только их комплекс проявляет ферментативные свойства. При этом белок резко повышает каталитическую активность добавочной группы, присущую ей в свободном состоянии в очень малой степени; добавочная же группа стабилизирует белковую часть и делает ее менее уязвимой к денатурирующим агентам.
Однокомпонентные ферменты представляют собой простые белки.У однокомпонентных ферментов, не имеющих добавочной группы, которая могла бы входить в непосредственный контакт с преобразуемым соединением. Эту функцию выполняет часть белковой молекулы, называемая каталитическим центром. Предполагают, что каталитический центр однокомпонентного фермента представляет собой уникальное сочетание нескольких аминокислотных остатков, располагающихся в определенной части белковой молекулы. Аминокислотные остатки, образующие каталитический центр однокомпонентного фермента, расположены в различных точках единой полипептидной цепи. Поэтому каталитический центр возникает в тот момент, когда белковая молекула приобретает присущую ей третичную структуру. Следовательно, изменение третичной структуры фермента под влиянием тех или иных факторов может привести к деформации каталитического центра и изменению ферментативной активности.
Кроме каталитического центра, образованного сочетанием аминокислотных радикалов или присоединением кофермента, у ферментов различают еще два центра: субстратный и аллостерический. Под субстратным центром понимают участок молекулы фермента, ответственный за присоединение вещества (субстрата), подвергающегося ферментативному превращению. Часто этот участок называют “якорной площадкой” фермента, где, как судно на якорь, становится субстрат. Понятие о каталитическом и субстратном центре не следует абсолютизировать. В реальных ферментах субстратный центр может совпадать (или перекрываться) с каталитическим центром. Более того, каталитический центр может окончательно формироваться в момент присоединения субстрата. Поэтому часто говорят об активном центре фермента, представляющем сочетание первого и второго.
Аллостерический центр представляет собой участок молекулы фермента, в результате присоединения к которому определенного низкомолекулярного (а иногда - и высокомолекулярного) вещества изменяется третичная структура белковой молекулы. Вследствие этого изменяется конфигурация активного центра, сопровождающаяся либо увеличением, либо снижением каталитической активности фермента.
Ферменты как биологические катализаторы имеют ряд особенностей, которые отличаются их от катализаторов неорганической природы:
· ферментативные реакции протекают в физиологически нормальных для живого организма условиях и не требуют жестких условий - повышенной температуры, высокой кислотности среды, избыточного давления;
· ферменты как катализаторы строго специфичны, они катализируют только определённые биохимические реакции, действуя лишь на определённый субстрат;
· ферментативные реакции в живых организмах идут последовательно, таким образом, что субстратом для каждого последующего фермента является конечный продукт предшествующий ему ферментативной реакции;
· скорость ферментативных реакций высока, но она зависит от определённых факторов. Ускоряют реакцию в 10 8 -10 20 раз. Ферментативные реакции идут со 100%-ным выходом и не дают побочным продуктов. Для выражения каталитической активности согласно рекомендациям Международного биохимического союза используется катал. Катал (кат) – это каталитическая активность, способная осуществить реакцию со скоростью, равной 1 моль в секунду;
· все ферменты являются белками. Молекулярная масса ферментов колеблется в широких пределах от 12*10 3 до 10*10 6 Да.
1.3 Методы выделения ферментов
Процесс выделения какого-либо белка начинается с переведения белков ткани в раствор. Для этого ткань (материал), из которой получают фермент, тщательно измельчают в гомогенизаторе в присутствии буферного раствора. Для лучшего разрушения клеток к материалу добавляют кварцевый песок, если материал растирают в ступке. В результате получают кашицу - гомогенат. Если не проводилось предварительное фракционирование органоидов клетки, гомогенат содержит обрывки клеток, ядра, хлоропласты и другие органоиды клеток, растворимые пигменты и белки.
При выделении ферментов из тканей живых организмов, в том числе растительных, необходимо соблюдать условия, не вызывающие денатурацию белка. Все работы проводят при пониженной температуре (4 0 С) и при оптимальных для данного фермента значениях pH среды буферного раствора.
После перевода ферментов из ткани в растворенное состояние гомогенат подвергают центрифугированию для отделения нерастворимой части материала, а затем в отдельных фракциях экстрата-центрифугата выделяют следуемые ферменты.
Так как все ферменты являются белками, то для получения очищенных препаратов ферментов применяются те же способы выделения, что и при работе с белками.
Методы выделения:
· осаждение белка органическими растворителями;
· высаливание;
· метод электрофореза;
· метод ионообменной хроматографии;
· метод центрифугирования;
· метод гельфильтрации;
· метод аффинной хроматографии, или метод хроматографии по сродству;
· избирательная денатурация.
1.4 Классификация и номенклатура ферментов по типу катализируемой реакции
Классификация и номенклатура ферментов основана на типе реакции, которую они катализируют, так как катализируемая реакция – это тот специфический признак, по которому один фермент отличается от другого.
В 1961 г. специальной комиссией Международного биохимического союза была предложена систематическая номенклатура ферментов. Ферменты были подразделены на 6 групп или классов в соответствии с общим типом реакции, которую они катализируют: оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы, лигазы.
Каждый фермент при этом получил систематическое название, точно описывающее катализируемую им реакцию. Однако поскольку многие из этих систематических названий оказались очень длинными и сложными, каждому ферменту было также присвоено и тривиальное, рабочее название, предназначенное для повседневного употребления. В большинстве случаев оно состоит из названия вещества, на которое действует фермент, указания на тип катализируемой реакции и окончания –аза.
Международная комиссия по ферментам разработала систему присвоения кодовых чисел (шифров) индивидуальным ферментам. Шифр каждого фермента содержит четыре числа, разделенные точками. Он составляется по следующему принципу:
А. Первое число показывает, к какому классу принадлежит данный фермент.
Б. Второе число, которое присваивается ферменту по классификации, обозначает подкласс. У оксидоредуктаз оно указывает на природу той группы в молекуле донора, которая подвергается окислению (1- обозначает спиртовую группу –CH-OH; 2-альдегидную или кетонную группу и т.д.); у трансфераз – природу транспортируемой группы; у гидролаз - тип гидролизуемой связи; у лиаз – тип связи, подвергающийся разрыву; у изомераз – тип катализируемой реакции изомеризации; у лигаз – тип вновь образуемой связи.В. третье число обозначает подподкласс. У оксидоредуктаз оно указывает для каждой группы доноров тип участвующего акцептора (1 обозначает кофермент NAD + или NASP + ; 2- цитохром; 3- молекулярный кислород и т.д.); у трансфераз третье число обозначает тип транспортируемой группы; у гидролаз это число уточняет тип гидролизуемой связи, а у лиаз – тип отщепляемой группы; у изомераз оно уточняет характер превращения субстрата, а у лигаз – природу образующего соединения.
Г. Четвёртое число обозначает порядковый номер ферменты в данном подклассе.
Шифровая классификация имеет очень важное преимущество – она позволяет исключить необходимость при включении в список вновь открытых ферментов менять номера всех последующих. Новый фермент может быть помещен в конце соответствующего подкласса без нарушения всей остальной нумерации.
Ферменты нашли широкое применение в таких отраслях промышленности, как хлебопечение, пивоварение, виноделие, чайное, кожевенное и меховое производства, сыроварение, натуральных соков, кофе, кулинария (для обработки мяса) и т.д. В последние годы ферменты стали применять в тонкой химической индустрии для осуществления таких реакций органической химии, как окисление, восстановление, дезаминирование, декарбоксилирование, дегидратация, конденсация, а также для разделения и выделения изомеров аминокислот L-ряда (при химическом синтезе образуются рацемические смеси L- и D-изомеров), которые используют в промышленности, сельском хозяйстве, медицине. Овладение тонкими механизмами действия ферментов, несомненно, предоставит неограниченные возможности получения в огромных количествах и с большой скоростью полезных веществ в лабораторных условиях почти со 100% выходом.
Ферменты используются в производстве моющих средств и бумаги, а также в технологических процессах по производству кожи и текстилей, фармацевтической промышленности (фестал, мезимфорте). В настоящее время стало возможным их применение в кормах животных.
Используемые в пищевой промышленности ферменты имеют широкий спектр применения, включающий функции синтеза и разложения (деградации). При выборе фермента для конкретного пищевого процесса следует принимать во внимание его источник и биохимические характеристики, что важно при сертификации.
Подобно другим пищевым добавкам использование ферментов в пищевых продуктах нормируется законом.
2. Биокатализ
Биокатализ (ферментативный катализ), ускорение химических реакций под влиянием ферментов. В основе жизнедеятельности лежат многочисленные химические реакции расщепления питательных веществ, синтеза необходимых организму химических соединений и трансформации их энергии в энергию физиологических процессов (работа мышц, почек, нервная деятельность и т.п.). Все эти реакции не могли бы происходить с необходимой для живых организмов скоростью, если бы в ходе эволюции не возникли механизмы их ускорения с помощью биокатализа.
2.1 Принцип действия ферментов
Вещество, подвергающееся превращению в присутствии фермента, называют субстратом. Субстрат присоединяется к ферменту, который ускоряет разрыв одних химических связей в его молекуле и создание других; образующийся в результате продукт отсоединяется от фермента.
Ферменты не подвергаются износу во время реакции. Они высвобождаются по завершению реакции и сразу же готовы начать следующую реакцию. Теоретически это может продолжаться бесконечно, по крайней мере, до тех пор, пока они не израсходуют весь субстрат. На практике вследствие их восприимчивости и органического состава, продолжительность существования ферментов ограничена.
По образному выражению, употребляемому в биохимической литературе, фермент подходит к субстрату, как «ключ к замку». Это правило было сформулировано Э. Фишером в 1894 г. исходя из того, что специфичность действия фермента предопределяется строгим соответствием геометрической структуры субстрата и активного центра фермента. Фермент соединяется с субстратом с образованием короткоживущего фермент-субстратного комплекса (образования промежуточного комплекса). Однако, хотя эта модель объясняет высокую специфичность ферментов, она не объясняет явления стабилизации переходного состояния, которое наблюдается на практике. В 50-е годы нашего столетия это статическое представление было заменено гипотезой Д. Кошланда об индуцированном соответствии субстрата и фермента. Сущность ее сводится к тому, что пространственное соответствие структуры субстрата и активного центра фермента создается в момент их взаимодействия друг с другом, что может быть выряжено формулой “перчатка-рука”. Ферменты, в основном, - не жесткие, а гибкие молекулы. Активный центр фермента может изменить конформацию после связывания субстрата. Боковые группы аминокислот активного центра принимают такое положение, которое позволяет ферменту выполнить свою каталитическую функцию. В некоторых случаях молекула субстрата также меняет конформацию после связывания в активном центре. В отличие от модели «ключ-замок», модель индуцированного соответствия объясняет не только специфичность ферментов, но и стабилизацию переходного состояния.
Но в процессе всё большего развития науки гипотеза Кошланда постепенно вытесняется гипотезой топохимического соответствия. Сохраняя основные положения гипотезы взаимоиндуцированной настройки субстрата и фермента, она фиксирует внимание на том, что специфичность действия ферментов объясняется в первую очередь узнаванием той части субстрата, которая не изменяется при катализе. Между этой частью субстрата и субстратным центром фермента возникают многочисленные точечные гидрофобные взаимодействия и водородные связи.
2.2 Факторы, влияющие на реакции фермента
На активность ферментов, а следовательно и на скорость реакций ферментативного катализа оказывают влияние различные факторы: :
· Концентрация и доступность субстрата . При постоянном количестве фермента скорость возрастает с увеличением концентрации субстрата. Эта реакция подчинена закону действующих масс и рассматривается в свете теории Михаэлиса – Ментона.
· Концентрация фермента . Концентрация ферментов всегда относительно невелика. Скорость любого ферментативного процесса в значительной степени зависит от концентрации фермента. Для большинства пищевых применений скорость реакций пропорциональна концентрации ферментов. Исключение составляют те случаи, когда реакции доводят до очень низких уровней субстрата.
· Температура реакции . До некоторого значения температуры (в среднем до 5О°С) каталитическая активность растет, причем на каждые 10°С примерно в 2 раза повышается скорость преобразования субстрата. В общем для ферментов животного происхождения он лежит между 40 и 50°С, а растительного - между 50 и 60°С. Самой оптимальной температурой является 37 o С, при которой в живом организме процессы протекают быстро, сберегая большое количество энергии. Однако есть ферменты с более высоким температурным оптимумом, например, у папаина оптимум находится при 8О°С. В то же время у каталазы оптимальная температура действия находится между 0 и -10°С.
· рН реакции . Для каждого фермента характерна определённая область значения рН, при которых фермент проявляет максимальную активность. Однако наилучшими условиями их функционирования являются близкое к нейтральному значение величины рН. В резко кислой или резко щелочной среде хорошо работают лишь некоторые ферменты. Влияние рН среды на действия ферментов основано на том, что происходит изменение заряда различных групп белка в активном центре фермента, вызывающее существенное изменение конформации полипептидной цепи.
· Продолжительность процесса . Для реакции ферментативного катализа первого порядка скорость реакции со временем уменьшается, так как уменьшается доступность субстрата. Такие реакции ферментативного катализа требуют достаточно много времени для её завершения.
· Наличие ингибиторов или активаторов . Химические вещества, способные оказывать вредное воздействие на реакцию ферментации, получили названия «ингибиторы». В качестве таких веществ могут выступать металлы (медь, железо, кальций) или соединения из субстратов. Некоторые вещества способны активировать или стабилизировать ферменты. Присутствие в реакционной среде некоторых ионов может активировать образование активного субстрат ферментного комплекса, и в этом случае скорость ферментативной реакции будет увеличивается. Такие вещества получили название активаторов.
3. Особенности биомиметики
Знания, получаемые людьми из природы, используются в современном мире повсюду, начиная от строительства и кончая медициной. Сегодня эти знания уже составили новую область науки: биомиметику. Этот термин, впервые ввел американский писатель-натуралист Джанин Бениус.
Биомиметика - область химии, которая моделирует процессы, происходящие в живой природе. Открытия в области биомиметических систем готовят революционный переворот в области синтеза новых материалов. Различают:
· биологическую, изучающую процессы, происходящие в биологических системах;
· теоретическую, строящей математические модели этих процессов;
· техническую, применяющую модели теоретической биомиметики для решения инженерных задач.
В Институте проблем химической физики РАН в Черноголовке уже найдены биомиметические подходы к ферментативной фиксации азота, анаэробного окислениюя алканов (метана в метанол) и фотоокислению воды с получением кислорода (именно это делают растения в процессе фотосинтеза).
Лакокрасочное изделие Lotosan выпускаемое в Германии отличается высокой стойкостью к загрязнениям. Идея была почерпнута у цветков лотоса, растущих в болотистых районах, и, несмотря на это, сохраняющих свою белизну. Оказалось – дело в микроскопических шипах, покрывающих поверхность цветка. Они не дают частицам задерживаться на лепестках и позволяют дождевой воде легко их смывать. В настоящее время разработчики бьются над создания легких, эластичных и прочных(в 5 раз прочнее стали) материалов на основе паутины. Идеология биомиметики прочно заняла свое место в различных дисциплинах - инженерном деле, химической технологии, нанотехнологии и многих других. Учёные попытаются найти химические аналоги ферментов и на их основе создать новые промышленные процессы. И это процесс со временем будет только набирать силу.
Заключение
В данной работе рассмотрено одно из биологически активных веществ, а именно - ферменты. Ферменты являются биологическим катализатором белковой природы, ускоряющим химические реакции в живых организмов и вне их. Ферменты обладают уникальными свойствами, которые отличают их от обычных органических катализаторов. Это, прежде всего, необычно высокая каталитическая активность. Другое важнейшее свойство ферментов - это избирательность их действия.
Важным свойством ферментов, которое необходимо учитывать при их практическом пользовании, является стабильность, т.е. их способность сохранять каталитическую активность.
Благодаря высокой специфичности ферментов в организме не воцаряется хаос: каждый фермент выполняет строго отведённые ему функции, не влияя на течение многих десятков и сотен других реакций, происходящих в его окружении. Роль ферментов в жизнедеятельности организмов велика.
Будущее ферментов очень интересно. Технология обнаружения и производства новых ферментов развивается с большой скоростью. Прежде применение и производство ферментов развивалось большей частью за счет попыток и ошибок. Так как детали, влияющие на химию и действие ферментов, были известны плохо, то в препаратах использовались смеси наиболее универсальных ферментов. Благодаря новым исследованиям при производстве сбываемой продукции возможно использование более специфичных ферментов.
Сегодня развивающиеся технологии с каждым днем раскрывают все новые чудеса сотворения жизни, и "биомиметика" как наука избирает примерами превосходные системы в организмах живых существ, создавая по их образу и подобию изобретения для пользы и блага людей. Учёные попытаются найти химические аналоги ферментов и на их основе создать новые промышленные процессы.
Список литературы
1. http://www.krugosvet.ru/articles/03/1000310/1000310a1.htm
2. Габриелян О.С, Маскаев Ф.Н., Пономарев С.Ю, Теренин В.И. Учебник химия 10 класс. - М., 2005.
3. Нечаев А.П., Кочеткова А.А, Зайцев А.Н. Пищевые добавки.- М., 2001.
4. Биохимия растительного сырья/ Под ред. Щербакова В.Г. М., 1999.
5. http://www.gazeta.ru/science/2007/10/15_a_2241957.shtml?incut2
6. http://www.cleandex.ru/articles/2008/07/07/biomimetic-1
Приложение 1
Таблица 1
| Классы ферментов | Катализируемая реакция | Примеры ферментов или их групп (даны тривиальные названия) |
| Оксидоредуктазы | Перенос атомов водорода или электронов от одного вещества к другому | Дегидрогеназа, оксидаза |
| Трансферазы | Перенос определённой группы атомов - метильной, ацильной, фосфатной или аминогруппы – от одного вещества к другому | Трансаминаза, киназа |
| Гидролазы | Реакции гидролиза | Липаза, амилаза, пептидаза |
| Лиазы | Негидролитическое присоединение к субстрату | Декарбоксилаза, фумараза, альдолаза |
| Изомеразы | Внутримолекулярная перестройка | Изомераза, мутаза |
| Лигазы | Соединение двух молекул в результате образования новых связей С-С, С-N, С-О или С-S, сопряженное с распадом АТФ | Синтетаза |
Приложение 2
Некоторые примеры использования ферментов в промышленности
Таблица 2
| Фермент | Промышленность | Использование | |
| Амилазы (расщепляют крахмал) | пивоваренная | Осахаривание содержащегося в солоде крахмала | |
| текстильная | Удаление крахмала, наносимого на нити во время шлихтования | ||
хлебопекарная |
Крахмал Глюкоза. Дрожжевые клетки, сбраживая глюкозу, образуют углекислый газ, пузырьки которого разрыхляют тесто и придают хлебу пористую структуру. Хлеб лучше подрумянивается и дольше не черствеет | ||
Протеазы (расщепляют |
папаин | пивоваренная | Этапы процесса пивоварения, регулирующие качество пены |
| мясная | Умягчение мяса. Этот фермент довольно устойчив к повышению температуры и при нагревании мяса какое-то время продолжает действовать. Потом он, конечно, инактивируется | ||
| фармацевтическая | Добавки к зубным пастам для удаления зубного налёта | ||
| фицин | фотография | Смывание желатина с использованной плёнки для того, чтобы извлечь находящееся в нём серебро | |
| пепсин | пищевая | Производство «готовых» каш | |
| фармацевтическая | Препараты, способствующие пищеварению (в дополнение к обычному действию пепсина в желудке) | ||
| трипсин | пищевая | Производство продуктов для детского питания | |
| реннин | сыроделие | Свертывание молока (получение сгустка казеина) | |
|
риальные протеазы |
Стирка белья | Стиральные порошки с ферментными добавками | |
| кожевенная | Отделение волоса – способ, при котором не повреждаются ни волос, ни шкура | ||
| текстильная | Извлечение шерсти из обрывков овечьих шкур | ||
Давно выяснено, что все ферменты являются белками и обладают всеми свойствами белков. Поэтому подобно белкам ферменты делятся на простые и сложные.
Простые ферменты состоят только из аминокислот – например, пепсин , трипсин , лизоцим .
Сложные ферменты (холоферменты) имеют в своем составе белковую часть, состоящую из аминокислот – апофермент , и небелковую часть – кофактор . Кофактор, в свою очередь, может называться коферментом или простетической группой. Примером могут быть сукцинатдегидрогеназа (содержит ФАД) (в цикле трикарбоновых кислот), аминотрансферазы (содержат пиридоксальфосфат), пероксидаза (содержит гем).
Для осуществления катализа необходим полноценный комплекс апобелка и кофактора, по отдельности катализ они осуществить не могут. Кофактор входит в состав активного центра, участвует в связывании субстрата или в его превращении.
Как многие белки, ферменты могут быть мономерами , т.е. состоят из одной субъединицы, и полимерами , состоящими из нескольких субъединиц.
Структурно-функциональная организация ферментов
В составе фермента выделяют области, выполняющие различную функцию:
1. Активный центр – комбинация аминокислотных остатков (обычно 12-16), обеспечивающая непосредственное связывание с молекулой субстрата и осуществляющая катализ. Аминокислотные радикалы в активном центре могут находиться в любом сочетании, при этом рядом располагаются аминокислоты, значительно удаленные друг от друга в линейной цепи. В активном центре выделяют два участка:
- якорный (контактный, связывающий) – отвечает за связывание и ориентацию субстрата в активном центре,
- каталитический – непосредственно отвечает за осуществление реакции.
Схема строения ферментов
У ферментов, имеющих в своем составе несколько мономеров, может быть несколько активных центров по числу субъединиц. Также две и более субъединицы могут формировать один активный центр.
У сложных ферментов в активном центре обязательно расположены функциональные группы кофактора.
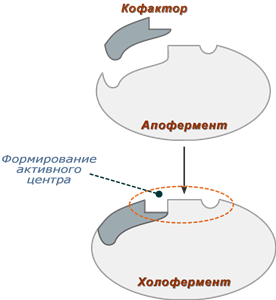
Схема формирования сложного фермента
2. Аллостерический центр (allos – чужой) – центр регуляции активности фермента, который пространственно отделен от активного центра и имеется не у всех ферментов. Связывание с аллостерическим центром какой-либо молекулы (называемой активатором или ингибитором, а также эффектором, модулятором, регулятором) вызывает изменение конфигурации белка-фермента и, как следствие, скорости ферментативной реакции.
Аллостерические ферменты являются полимерными белками, активный и регуляторный центры находятся в разных субъединицах.

Схема строения аллостерического фермента
В качестве такого регулятора может выступать продукт данной или одной из последующих реакций, субстрат реакции или иное вещество (см "Регуляция активности ферментов ").
Изоферменты
Изоферменты – это молекулярные формы одного и того же фермента, возникшие в результате небольших генетических различий в первичной структуре фермента. Различные изоферменты определяют скорость и направление реакции благодаря разному сродству к субстрату.
Например, димерный фермент креатинкиназа (КК) представлен тремя изоферментными формами, составленными из двух типов субъединиц: M (англ. muscle – мышца) и B (англ. brain – мозг). Креатинкиназа-1 (КК-1) состоит из субъединиц типа B и локализуется в головном мозге, креатинкиназа-2 (КК-2) – по одной М- и В-субъединице, активна в миокарде, креатинкиназа-3 (КК-3) содержит две М-субъединицы, специфична для скелетной мышцы.
Также существует пять изоферментов лактатдегидрогеназы (роль ЛДГ) – фермента, участвующего в обмене глюкозы. Отличия между ними заключаются в разном соотношении субъединиц Н (англ. heart – сердце) и М (англ. muscle – мышца). Лактатдегидрогеназы типов 1 (Н 4) и 2 (H 3 M 1) присутствуют в тканях с аэробным обменом (миокард, мозг, корковый слой почек), обладают высоким сродством к молочной кислоте (лактату) и превращают его в пируват. ЛДГ-4 (H 1 M 3) и ЛДГ-5 (М 4) находятся в тканях, склонных к анаэробному обмену (печень, скелетные мышцы, кожа, мозговой слой почек), обладают низким сродством к лактату и катализируют превращение пирувата в лактат. В тканях с промежуточным типом обмена (селезенка, поджелудочная железа, надпочечники, лимфатические узлы) преобладает ЛДГ-3 (H 2 M 2).
