Laktik asidin kimyasal özellikleri. Laktik asit kimyasal ve fiziksel özellikleri laktik asit kimyasal referans kitabı
Laktik asit (laktat)- a-hidroksipropiyonik (2-hidroksipropanoik) asit.
- t pl 25-26 °C optik olarak aktif (+)- veya (-)-form.
- t pl 18 °C rasemik form.
- Kimyasal formül: CH3CH(OH)COOH
- Rasemik formül: C3H6O3

Laktik asit ne zaman oluşur laktik asit fermantasyonuşarap ve biranın fermantasyonu sırasında özellikle ekşi sütteki şekerler. Hem kimya hem de gıda endüstrisinde koruyucu olarak kullanılır. İnsan vücudunda glikozun parçalanmasından laktik asit (laktat) oluşur.
Peki laktik asit ve laktat arasında bir fark var mı? HAYIR. İÇİNDE organik Kimya biyokimyada genellikle laktik asit olarak adlandırılır - laktat.
Laktat, muhtemelen en fazla sayıda farklı efsaneyi çevreler, çoğu hangisi doğru değil. Ve Rusça'da laktat hakkında yeterince güvenilir materyal olmasına rağmen, çok sayıda amatör sporcu (ve bazı profesyoneller) inatla geçen yüzyılın mitlerine inanmaya ve bunları tekrar etmeye devam ediyor.
Laktat hakkındaki temel gerçekleri kısaca ve özlü bir şekilde özetleyelim.
Laktat her zaman vücutta enerji üretimi sırasında oluşur.
Enerjinin hücrelere girmesinin ana yolu glikozun parçalanmasıdır. Glikoz molekülü, glikoliz adı verilen bir süreçte piruvat üretmek için bir dizi 10 ardışık reaksiyona girer. Ayrıca, piruvatın bir kısmı kısmen oksitlenir ve karbondioksit ve suya dönüştürülür. Diğer kısım ise laktat dehidrojenaz enziminin kontrolünde laktata çevrilir.
Bu reaksiyon tersine çevrilebilir.

Laktatın bir kısmı enerji sentezi için kullanılır.
Toplam laktatın yüzde 15 ila 20'si glukoneojenez sırasında glikojene dönüştürülür.
Laktat evrensel bir enerji taşıyıcısıdır.
koşullarda yüksek üretim anaerobik modda enerji, laktat, artan asitlik nedeniyle enerji dönüşümünü gerçekleştirmenin imkansız olduğu yerlerden enerjiye dönüştürülebileceği yerlere (kalp, solunum kasları, yavaş kasılan kas lifleri, diğer) bir enerji taşıyıcısıdır. kas grupları).
Laktat seviyelerindeki bir artış, oksijen eksikliğinden kaynaklanmaz.
Hayvan çalışmaları, izole kastaki hücre içi oksijen eksikliğinin, maksimal egzersiz sırasında bile mitokondriyal solunum zinciri aktivitesinde herhangi bir sınırlama göstermediğini göstermektedir. Kaslarda her zaman yeterli oksijenimiz olacak.
Laktat, anaerobik glikoliz yükünün bir göstergesidir.
Glikoliz sırasında glikoz metabolizmasının son ürünü olan piruvat her oluştuğunda, laktat oluşur. Anaerobik ve aerobik egzersizdeki enerji dönüşüm oranları farklı olduğu için laktat birikir.
İşin yoğunluğu ne kadar yüksek olursa, o kadar fazla laktat üretilir.
Kandaki laktat seviyesi egzersizin yoğunluğu ile yakından ilişkilidir. Anaerobik ve aerobik egzersizde enerji dönüşüm hızındaki farklılık nedeniyle laktat birikir. Anaerobik enerji metabolizmasında enerji dönüşüm hızı aerobik metabolizmadan daha hızlıdır.
Laktat asit oluşturmaz, ona eşlik eder.
Enerji üreterek, aynı anda asitlik de üretiyoruz. Vücudumuzdaki enerji reaksiyonları, elektronların enerji taşıyıcıları olarak katılımıyla gerçekleşir. Glikoliz ürünleri laktat ve hidrojen protonu H+'dır. Bir çözeltideki hidrojen iyonlarının (H+) aktivitesinin (konsantrasyon) ölçüsü, onun asitliğini ifade eder.
Laktat, reaksiyonu gerçekleştirmek için yalnızca geçici olarak asidik bir maddeyi (H +) alır ve ardından onu nötr bir ortama geri döndürür.
Laktatın %90'ı vücut tarafından antrenmandan sonraki ilk bir saat içinde kullanılır.
Vücuttaki laktatın %60'ı tamamen CO2 ve suya oksitlenir. Yaklaşık %20'si glukoneogenez sürecinde glikojene dönüştürülür, bir kısmı yeni amino asit oluşumu için kullanılır. Laktatın sadece küçük bir kısmı (%5'ten az) ter ve idrarla atılır.

Kan laktatı sistematik olarak kaslardaki laktatın varlığını yansıtmaz.
Kas ve kandaki laktat konsantrasyonu karşılaştırmaları, efor %75-80 VO2max'ı aşarsa, kaslardaki laktat konsantrasyonunun (uyluğun ön yüzeyindeki kasların biyopsisi) kandakinden daha yüksek olduğunu göstermektedir. Orta şiddette egzersizin aksine, laktat konsantrasyonunun %30, %50, %70 VO2max olduğu atardamar kanı kaslardan daha yüksektir.
Laktat ağrı ve kas kramplarına neden olmaz.
Yoğun bir antrenmandan sonraki gün kas ağrısı, egzersizden sonra meydana gelen kas hasarı ve doku iltihabından kaynaklanır. Çoğu kas krampı, kaslardaki yorgunluğun başlamasıyla birlikte aşırı uyarılan kaslardaki sinir reseptörleri tarafından tetiklenir.
Cmtscience.com'dan (2016) uyarlanmıştır.
Laktik asit için katalog numarası: CAS 50-21-5
Laktik asidin tanımı:
Yoğurt kokusunu andıran hafif ekşi bir kokuya sahip, neredeyse şeffaf, hafif sarımsı higroskopik şuruplu sıvı. Suda, etanolde az çözünür - benzen, kloroform ve diğer halokarbonlarda. D ve L formunun çeşitli optik olarak aktif izomerleri vardır. D ve L'nin optik olarak aktif olmayan bir karışımının yanı sıra. İkincisi kimyasal sentezle ve aktif formlar bakteriyel olarak elde edilir. (enzimatik yöntem) İnsan vücudunda Kreps döngüsünde yer alan optik olarak aktif L formudur, bu nedenle katkı maddesi olarak kullanılması önerilir (Laktik asit, E270), diğer endüstrilerde oynamaz özel bir rol
Dünya çapındaki Laktik asit adı Rusya'da kök salmadı, ancak laktat tuzlarının adı her yerde bulunur, kalsiyum laktattan çok daha sık olarak kalsiyum laktatı keseriz.
%80 laktik asit için spesifikasyon.
Kaynama noktası (%100 çözelti) 122 °C (115 mm Hg)
Özgül ağırlık (20 °C) 1,22
Suda çözünürlük Tamamen çözünür
Yoğunluk (20°C'de) 1,18-1,20 g/ml
Ağır metaller, %0,001'den fazla değil
Demir içeriği, %0,001'den fazla değil
Arsenik içeriği, %0.0001'den fazla değil
Klorür içeriği, %0,002'den fazla değil (aslında %0,0015)
Sülfat içeriği, %0,01'den fazla değil (aslında %0,004)
Kalsinasyondan sonra kalıntı, en fazla %0,1 (aslında %0,06)
Üretici firma:Çin
Paketleme: variller 25 kg veya küpler 1200 kg
Laktik asidin ana fiziksel özellikleri:
Erime noktası: 17°C Optik olarak aktif olmayan (rasematik) için,
25-26 °C optik olarak aktif + veya - form
(erime sıcaklıklarındaki farklılıklar, daha pahalı optik olarak aktif formların daha ucuz aktif olmayan formlardan niteliksel ve hızlı bir şekilde ayırt edilmesini mümkün kılar !!)
Bağıl yoğunluk (su = 1): 1.2
Suda çözünürlük: karışabilir
Moleküler ağırlık: 90.08 g/mol
Parlama noktası: 110°C c.c.
Ayrılma katsayısı oktanol/su, lg Pow olarak: -0,6
Patlama ve yangın tehlikesi:
Yanmayı destekler normal koşullar. kendiliğinden yanma olası değildirAçık alevlerin sigara içmesine izin vermeyin.
Yangın söndürme: toz, alkole dayanıklı köpük, su spreyi,
karbon dioksit.
Kimyasal stabilite: Normal sıcaklık ve basınçlarda kararlıdır.
Kaçınılması Gereken Koşullar: Toz oluşumu, aşırı ısı.
Diğer malzemelerle uyumsuzluk: Güçlü oksitleyici maddeler, mineral asitler.
Tehlikeli atık: Azot oksitler, karbonmonoksit, karbondioksit, buharlar.
siyanür.
Tehlikeli polimerizasyon:İşaretlenmemiş.
İnsanlar için tehlike:
Vücuda giriş yolları: Madde, aerosolün solunması ve yutulması yoluyla vücuda emilebilir.
MPC'yi aşan konsantrasyonlara kısa süreli maruz kalma durumunda: Bu madde cildi tahriş eder ve hava yolları ve ayrıca aşındırıcı
gözler üzerinde eylem. Yutulması halinde aşındırıcı etki.
Göz teması halinde: Kırmızılık. Ağrı. Şiddetli derin yanıklar. Gözlük-maske veya
koruyucu maske Önce durulayın büyük miktar birkaç kişi için su
dakika (kaldır kontak lens zor değilse), o zaman bir doktora götürün.
Çalışma alanı standartları:
TLV (maksimum eşik konsantrasyonu, ABD) belirlenmemiştir.
kanserojenlik: ACGIH, IARC, NTP veya CA Prop 65 tarafından listelenmemiştir.
epidemiyoloji: Bilgi yok.
Tetrajenite: Bilgi yok.
üreme etkileri: Bilgi yok.
mutajenite: bilgi yok
nörotoksisite: Bilgi yok.
Hayvan deneyleri şunları göstermiştir:
LD50/LC50:
Draize testi, tavşan, gözler: 100 mg Şiddetli;
Draize testi, tavşan, cilt: 500 mg/24H Hafif;
Soluma, sıçan: LC50 = >26 mg/m(cc)/lH;
Oral, fare: LD50 = 1940 mg/kg;
Oral, sıçan: LD50 = 1700 mg/kg;
Deri, tavşan: LD50 = >10 gm/kg;
Dikkat. Küçük miktarlarda ve laktik asit konsantrasyonlarında, maddenin konsantresi hakkında bilgiler, mevcut olanlara göre verilir. şu an veriler zararsızdır!
Laktik asit(2-hidroksipropiyonik asit) CH3CH(OH)COOH, molekül ağırlığı 90.1; renksiz. Bilinenler L(+)-laktik asit, D(-)-laktik (et-laktik) asit ve rasemik laktik asit fermantasyon laktik asittir. D,L- ve D-laktik asit için erime noktası 18 °C ve 53 °C'ye karşılık gelir; t.kip. karşılık 85°C/1 mmHg ve 103°C/2 mm Hg; D-laktik asit için [α] D 20 -2,26 (konsantrasyon %1,24 inç. D,L-laktik asit D için) H 0 dizi - 682,45 kJ/mol; D H 0 ul 11.35 kJ/mol; D H test 110,95 kJ/mol (25°C), 65,73 kJ/mol (150°C). L-laktik asit D için H 0 yanma - 1344,8 kJ/mol; D H 0 dizi -694,54 kJ/mol; D H 0 pl 16.87 kJ/mol.
Laktik asidin yüksek higroskopikliği nedeniyle, genellikle konsantre sulu çözeltileri kullanılır - şuruplu, renksiz, kokusuz. İçin sulu çözeltiler laktik asit D 20 4 1,0959 (40%), 1,1883 (80%), 1,2246 (100%); nD 25 1,3718 (%37,3), 1,4244 (%88,6); h 3,09 ve 28,5 MPa. s (25 0 C) karşılık. %45,48 ve %85,32 çözümleri için; g 46.0. 1 M çözelti için 10 -3 N/m (25°C); e22 (17°C). Laktik asit, içinde zayıf bir şekilde ve diğer halokarbonlarda çözünür; R ka 3.862 (25°C); Sulu çözeltilerin pH'ı 1.23 (%37.3), 0.2 (%84.0).
Laktik asit akrilik aside dehidre edilir, HBr ile ısıtıldığında 2-bromopropiyonik asit oluşturur, Ca-tuzu PCl5 veya SOCl 2-2-kloropropiyonil klorür ile reaksiyona girdiğinde. Mineral asitlerin mevcudiyetinde, laktik asidin kendi kendine esterlenmesi, lineer poliesterlerin yanı sıra formül I'in oluşumuyla gerçekleşir. Laktik asit ile etkileştiğinde hidroksi asitler RCH2CH(OH)COOH oluşur ve laktik asit alkollerle etkileştiğinde esterler oluşur. Laktik asidin tuzları ve esterlerine laktatlar denir (tabloya bakın).
laktik asit, laktik asidin bir sonucu olarak oluşur (süt ekşime, lahana turşusu, sebze turşusu, peynir olgunlaştırma, silolama yemi sırasında); D-laktik asit, hayvanların, bitkilerin ve ayrıca mikroorganizmaların dokularında bulunur.
Endüstride laktik asit, 2-kloropropiyonik asitten elde edilir ve bunun (100°C) veya laktonitril CH3CH(OH)CN (100°C, H2SO4) müteakip esterlerinin oluşumu, izolasyonu ve hidrolizi yapılır. hangi ürüne yol açar Yüksek kalite. Laktik asit üretmenin diğer yöntemleri bilinmektedir: propilenin nitrojen oksitlerle (15-20 °C) oksidasyonu, ardından H2S04 ile muamele, CH3CHO'nun CO ile etkileşimi (200 °C, 20 MPa).
BAZI LAKTATLARIN ÖZELLİKLERİ
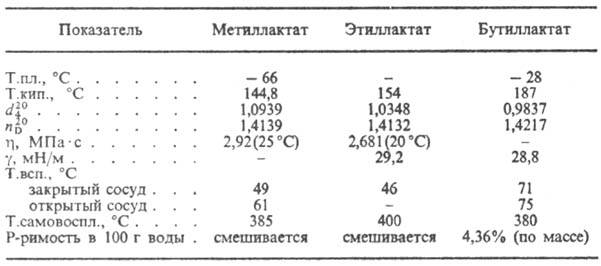
Laktik asit, gıda endüstrisinde, leke boyamada, deri endüstrisinde, fermantasyon atölyelerinde bakteri yok edici bir madde olarak, elde etmek için kullanılır. ilaçlar, plastikleştiriciler. Etil ve bütil laktatlar, selüloz eterler, kurutma yağı, sebze yağları; bütil laktat - ayrıca bazı sentetik polimerler için bir çözücü olarak.
Dünya laktik asit üretimi 40 bin tondur (1983).
Aydınlatılmış.: Holten C.H., Laktik asit. özellikler ve kimya. Laktik asit ve türevleri, Weisheim, 1971. Yu A. Treger.
Makale başlığındaki ilk harfi seçin:
hidroksi asitler (alkol asitleri), karboksile bağlı radikalde bir, iki veya daha fazla hidroksil grubu içeren karboksilik asitlerin türevleridir.
Karboksil gruplarının sayısına bağlı olarak, hidroksi asitler monobazik, dibazik vb. olarak ayrılır; toplam hidroksil grubu sayısına bağlı olarak, hidroksi asitler mono- veya polihidrik olarak ayrılır.
Radikalin doğasına göre, hidroksi asitler doymuş ve doymamış, asiklik, siklik veya aromatiktir.
Aşağıdaki izomerizm türleri hidroksi asitlerde meydana gelir:
yapısal(radikal zincir izomerizmi, karboksil ve hidroksilin karşılıklı pozisyonunun izomerizmi);
optik(ayna) asimetrik karbon atomlarının varlığından dolayı.
Hidroksi asitlerin adları, asidin adına "hidroksi" veya "dioksi" vb. Eklenerek verilir. Önemsiz terminoloji de yaygın olarak kullanılmaktadır.
HO–CH 2 –COOH
glikolik (oksiasetik)
süt ürünleri (α-hidroksipropiyonik)


α-hidroksibütirik β-hidroksibütirik
(2-hidroksibütanoik) (3-hidroksibütanik)
fiziki ozellikleri. Düşük hidroksi asitler çoğunlukla kalın, şuruplu maddelerdir. Hidroksi asitler su ile her oranda karışabilir ve moleküler ağırlık arttıkça çözünürlük azalır.
Kimyasal özellikler.
1. Asit özellikleri- hidroksi asitler, karboksile özgü tüm reaksiyonları verir: tuzların, esterlerin, amidlerin, asit halojenürlerin vb. oluşumu. Hidroksi asitler, karşılık gelen karboksilik asitlerden (hidroksil grubunun etkisi) daha güçlü elektrolitlerdir.

2. Alkol özellikleri - hidroksil grubunun hidrojen ikame reaksiyonları, basit oluşumu ve esterler, -OH'nin halojen için ikamesi, molekül içi dehidrasyon, oksidasyon.
kloroasetik glikolik glioksal
asit asit asit
a) HO–CH 2 –COOH + CH3 OHNO–CH 2 –CO–O–CH3 + H20
glikolik asit ve metil alkol esteri
b) HO–CH 2 –COOH + 2CH 3 ONCH 3 –O–CH 2 –COOCH 3 + 2H 2 O
glikolik metil metil eter
asit alkol metoksiasetik asit
(tam yayın)
3. Hidroksi asitlerin ısıtmaya oranı - ısıtıldığında, a-hidroksi asitler suyu ayırarak iki a-hidroksi asit molekülünün kimliği olarak oluşturulmuş bir siklik ester oluşturur:

a-hidroksipropionik asit laktit
β-hidroksi asitler aynı koşullar altında doymamış asitlerin oluşumu ile kolayca su kaybederler.
NO–CH 2 –CH 2 –COOH  CH 2 \u003d CH - COOH
CH 2 \u003d CH - COOH
β-hidroksipropiyonik akrilik asit
γ-hidroksi asitler ayrıca molekül içi esterlerin - laktonların oluşumuyla bir su molekülünü kaybedebilir.

NO–CH 2 –CH 2 –CH 2 –COOH
γ-hidroksibütirik asit
γ-bütirolakton
Bazı hidroksi asitler doğal ürünlerden elde edilir. Yani laktik asit, şekerli maddelerin laktik asit fermantasyonu ile elde edilir. Sentetik üretim yöntemleri aşağıdaki reaksiyonlara dayanmaktadır:
1) Cl–CH2 –COOH + HOH  HO–CH2-COOH;
HO–CH2-COOH;
monokloroasetik glikolik
asit asit
2) CH 2 \u003d CH - COOH + HOH  NO-CH2-CH2-COOH.
NO-CH2-CH2-COOH.
akrilik asit β-hidroksipropiyonik asit
hidroksi asitlerin temsilcileri.
glikolik (hidroksiasetik) asit, olgunlaşmamış meyvelerde, pancar suyunda, şalgamda ve diğer bitkilerde bulunan kristalli bir maddedir. Endüstride oksalik asidin indirgenmesiyle elde edilir. Boyama (patiska baskı) için kullanılır.
Laktik asit (a-hidroksipropiyonik) - kalın bir sıvı veya düşük erime noktalı kristal kütle. Laktik asit, laktik asit bakterilerinin etkisi altında şekerlerin laktik asit fermantasyonu sürecinde oluşur. Fermente süt ürünleri, lahana turşusu, silajda bulunur. Mordan boyamada, deri üretiminde, tıpta kullanılır.
Et-laktik asit, hayvanların kas sularında ve et özlerinde bulunur.
iki atomlu gliserik asit bitki ve hayvanların yaşam süreçlerine katılır.

Askorbik asit (C vitamini) - taze meyvelerde, limonlarda, siyah kuş üzümünde bulunan kristalli bir madde, taze sebzeler- lahana, fasulye. Sentetik olarak, C vitamini polihidrik alkol sorbitolün oksidasyonu ile elde edilir.
 α-askorbik asit
α-askorbik asit
Askorbik asit, özellikle ısıtıldığında atmosferik oksijen tarafından kolayca ayrışır.
asiklik iki-ve tribazik hidroksi asitler.
Elma (hidroksisüksinik) asit (HOOS-CHOH-CH2-COOH), suda yüksek oranda çözünür olan kristalli bir maddedir; tıpta kullanılır, olgunlaşmamış üvez, kızamık, ravent, üzüm suyu, şarapta bulunur.
Şarap (tartarik, dioksisüksinik) asit (HOOC–*CHOH–*CHOH–COOH) 2 asimetrik karbon atomuna sahiptir ve bu nedenle 4 optik izomere sahiptir. Suda az çözünen ve çökelen asidik potasyum tuzları oluşturur. Şarapta (tartar) tuz kristalleri görülebilir. Karışık potasyum-sodyum tuzuna Rochelle tuzu denir. Tartarik asit tuzlarına tartrat denir.
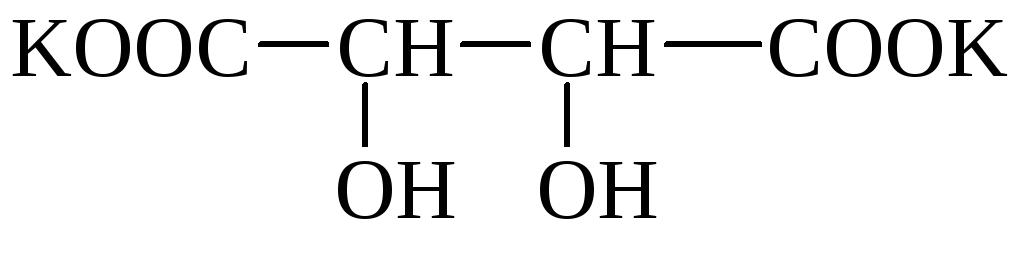

tartar, rochelle tuzu
Tartarik asit bitkilerde (üvez, üzüm vb.) yaygın olarak bulunur.
limon asidi
 turunçgillerde bulunur. Endüstride limon meyvelerinden ladin iğnelerinin işlenmesi sırasında şekerlerin küf mantarları tarafından oksidasyonu ile elde edilir.
turunçgillerde bulunur. Endüstride limon meyvelerinden ladin iğnelerinin işlenmesi sırasında şekerlerin küf mantarları tarafından oksidasyonu ile elde edilir.
Sitrik asit, metabolizmada yer alan biyolojik olarak önemli bir bileşiktir. İlaç, gıda, tekstil sanayinde boyalara katkı maddesi olarak kullanılır.
Siklik monobazik polihidrik hidroksi asitler, safra asitlerinin ve diğer fizyolojik açıdan önemli bileşiklerin bir parçasıdır; örneğin, oksin bitki büyümesini arttırır.
Aromatik hidroksi asitler yan zincirde hidroksil içeren fenolik asitler ve aromatik yağ asitleri olmak üzere ikiye ayrılır.


o-hidroksibenzoik mandelik asit
(salisilik asit
Salisilik asit bazı bitkilerde serbest formda (nergis) bulunur, ancak daha çok ester formunda bulunur. Endüstride, sodyum fenolatı karbondioksit ile ısıtmak suretiyle elde edilir. Dezenfektan olarak ve boya sentezinde kullanılır. Salisilik asidin birçok türevi ilaç olarak kullanılmaktadır (aspirin, salol).


aspirin salol (fenil eter
(asetilsalisilik asit) salisilik asit)
gallik asit (3,4,5-trioksibenzoik).

Çay yaprakları, meşe kabuğu, nar ağacında bulunur. Sanayide tanenin seyreltik asitlerle kaynatılmasıyla elde edilir. Mürekkep yapımında, fotoğrafçılıkta, tıpta antiseptik olarak kullanılır. Gallik asit ve türevleri, birçok kişi için koruyucu olarak yaygın şekilde kullanılmaktadır. Gıda Ürünleri(yağlar, yüksek dereceli sabunlar, süt ürünleri), tannik özelliklere sahiptir ve deri imalatında ve leke boyamada özel bir öneme sahiptir.
mandelik asit amigdalin, hardal, mürver vb.'de bulunan aromatik yağ asitlerini (C6H5-CH(OH)-COOH) ifade eder.
Tanenler genellikle polihidrik fenollerin türevleridir. Bitkilerin bir parçasıdırlar ve kabuk, odun, yaprak, kök, meyve veya büyüme (gals) özlerinden elde edilirler.
Tanenler en önemli tanenlerdir. Bu farklı karışımı kimyasal bileşikler başlıca gallik ve digallik asitlerin esterleri ve glikoz veya polihidrik alkoller.

Dg-digallik asit

m-digallik asit
Tanen, fenollerin ve esterlerin özelliklerini sergiler. Bir demir klorür çözeltisi ile siyah kompleks bir bileşik oluşturur. Tanenler, tabaklama özleri, pamuklu kumaşları boyamak için mordanlar, tıpta büzücüler (bakterisidal, hemostatik özelliklere sahiptirler) ve koruyucular olarak yaygın şekilde kullanılırlar.
Lipitler, çoğu makromoleküler yağ asitleri ve polihidrik alkollerin esterleri olan organik maddeleri içerir - bunlar yağlar, fosfatidler, mumlar, steroidler, makromoleküler yağ asitleri vb.
Lipitler esas olarak bitki tohumlarında, yemiş çekirdeklerinde ve hayvan organizmalarında - yağ ve sinir dokularında, özellikle hayvanların ve insanların beyninde bulunur.
Doğal yağlar, trihidrik alkol gliserol esterlerinin ve daha yüksek karboksilik asitlerin karışımlarıdır, örn. bu asitlerin gliserid karışımları.
HAKKINDA  Yağ için genel formül:
Yağ için genel formül:
burada R I R II R III, çift sayıda karbon atomuna sahip normal bir yapıya sahip daha yüksek yağ asitlerinin hidrokarbon radikalleridir. Yağlar hem doymuş hem de doymamış asit kalıntıları içerebilir.
Doymuş asitler:
C 15 H 31 COOH– palmitik;
C17H35COOH - stearik;
C 3 H 7 COOH - yağ (tereyağı içinde bulunur), vb.
Doymamış asitler:
C17H33COOH - oleik;
C17H31COOH - linoleik;
C 17 H 29 COOH - linolenik, vb.
Hayvansal ve bitkisel kaynaklı doğal kaynaklardan yağ alın.
Fiziki ozellikleri yağlar asidiktir. Ağırlıklı olarak doymuş asit kalıntıları içeren yağlar, katı veya merhem benzeri maddelerdir (koyun eti, sığır yağı vb.) Ağırlıklı olarak doymamış asit kalıntıları içeren yağlar, oda sıcaklığında sıvı kıvamına sahiptir ve sıvı yağ olarak adlandırılır. Yağlar suda çözünmez, ancak organik çözücülerde iyi çözünür: eter, benzen, kloroform vb.
Kimyasal özellikler. Tüm esterler gibi yağlar da hidrolize uğrar. Hidroliz asidik, nötr veya alkali bir ortamda ilerleyebilir.
1. Asit hidrolizi.

