Sodyum hidroksit kimyası. Sodyum hidroksit elde etmek için kimyasal yöntemler
Giriş .
Sodyum hidroksit veya kostik soda (NaOH), klor, hidroklorik asit HC1 ve hidrojen şu anda endüstride bir sodyum klorür çözeltisinin elektrolizi ile üretilmektedir.
Kostik soda veya sodyum hidroksit - güçlü bir alkali, yaygın olarak kostik soda olarak adlandırılır, sabun yapımında, alüminyum metal üretimi için bir ara ürün olan alümina üretiminde, boya ve vernikte, petrol arıtma endüstrilerinde, üretimde kullanılır. suni ipek, organik sentez endüstrisinde ve ulusal ekonominin diğer sektörlerinde.
Klor, hidrojen klorür, hidroklorik asit ve kostik soda ile çalışırken, güvenlik kurallarına kesinlikle uymalısınız: klorun solunması keskin bir öksürüğe ve boğulmaya, mukoza zarının iltihaplanmasına neden olur. solunum sistemi, pulmoner ödem ve daha sonra akciğerlerde enflamatuar odakların oluşumu.
Hidrojen klorür, havada düşük seviyelerde bile olsa, burun ve gırtlakta tahrişe, göğüste karıncalanmaya, ses kısıklığına ve boğulmaya neden olur. -de kronik zehirlenme küçük konsantrasyonları özellikle minesi hızla tahrip olan dişleri etkiler.
Hidroklorik asit zehirlenmesi çok benzer İle klor zehirlenmesi
Sodyum hidroksit üretmek için kimyasal yöntemler.
İle kimyasal yöntemler sodyum hidroksit üretimi kalkerli ve ferritiktir.
Sodyum hidroksit üretmek için kireç yöntemi, yaklaşık 80 ° C sıcaklıkta bir soda çözeltisinin kireç sütü ile etkileşiminden oluşur. Bu işleme kostikleme denir; reaksiyon ile tanımlanır
Na 2 C0 3 + Ca (OH) 2 \u003d 2NaOH + CaC0 3 (1)
çözüm-uzlaşma
Reaksiyon (1)'e göre, bir sodyum hidroksit çözeltisi ve bir kalsiyum karbonat çökeltisi elde edilir. Kalsiyum karbonat, yaklaşık %92 NaOH içeren erimiş bir ürün elde etmek üzere buharlaştırılan çözeltiden ayrılır. Erimiş NaOH, katılaştığı demir varillere dökülür.
Ferritik yöntem iki reaksiyonla tanımlanır:
Na 2 C0 3 + Fe 2 0 3 = Na 2 0 Fe 2 0 3 + C0 2 (2)
sodyum ferrit
Na 2 0 Fe 2 0 3 -f H2 0 \u003d 2 NaOH + Fe 2 O 3 (3)
solüsyon çökeltisi
reaksiyon (2), soda külünün demir oksit ile 1100-1200°C sıcaklıkta sinterlenmesi sürecini göstermektedir. Bu durumda benek - ferrit sodyum oluşur ve karbondioksit açığa çıkar. Daha sonra kek, reaksiyon (3)'e göre su ile işlenir (süzülür); bir sodyum hidroksit çözeltisi ve bir Fe203 çökeltisi elde edilir, bu çözeltiyi çözeltiden ayırdıktan sonra işleme geri döndürülür. Çözelti yaklaşık 400 g/l NaOH içerir. Yaklaşık %92 NaOH içeren bir ürün elde etmek için buharlaştırılır.
Kimyasal Yöntemler Sodyum hidroksit üretiminin önemli dezavantajları vardır: büyük miktarda yakıt tüketilir, elde edilen kostik soda safsızlıklarla kirlenir, aparatın bakımı zahmetlidir, vb. Şu anda, bu yöntemler neredeyse tamamen elektrokimyasal üretim yöntemiyle değiştirilmiştir. .
Elektroliz kavramı ve elektrokimyasal süreçler.
Elektrokimyasal süreçler, sulu çözeltilerde meydana gelen kimyasal süreçler veya bir sabitin etkisi altında erir. elektrik akımı.
Tuz çözeltileri ve eriyikleri, elektrolit adı verilen asit ve alkali çözeltileri, elektrik akımının iyonlar tarafından aktarıldığı ikinci türden iletkenlerdir. (Metaller gibi birinci tür iletkenlerde akım elektronlar tarafından taşınır.) Elektrolitten bir elektrik akımı geçtiğinde, elektrotlarda iyonlar boşalır ve karşılık gelen maddeler salınır. Bu işleme elektroliz denir. Elektrolizin gerçekleştirildiği cihaza elektrolizör veya elektrolitik banyo denir.
Elektroliz, bir dizi kimyasal ürün - klor, hidrojen, oksijen, alkaliler, vb. elde etmek için kullanılır. Elektrolizin ürettiğine dikkat edilmelidir. kimyasal ürünler bazı durumlarda kimyasal üretim yöntemleriyle elde edilemeyen yüksek derecede saflık.
Elektrokimyasal işlemlerin dezavantajları, elektroliz sırasında elde edilen ürünlerin maliyetini artıran yüksek enerji tüketimini içerir. Bu bağlamda, elektrokimyasal işlemlerin sadece ucuz elektrik enerjisi temelinde yapılması tavsiye edilir.
Sodyum hidroksit üretimi için hammadde.
Sodyum hidroksit, klor, hidrojen üretimi için bir çözelti kullanılır. sofra tuzu Elektrolize tabi tutulan sofra tuzu doğada yer altı birikintileri şeklinde oluşur. Kaya tuzu, göl ve deniz sularında ve doğal tuzlu sular veya çözeltiler halinde. Kaya tuzu yatakları Donbass, Urallar, Sibirya, Transkafkasya ve diğer bölgelerde bulunur. Ülkemizde tuz ve bazı göller bakımından zengindir.
Yaz aylarında göllerin yüzeyinden su buharlaşır ve sofra tuzu kristaller halinde dökülür. Bu tuza kendi kendine ekim denir. Deniz suyu 35 g/l'ye kadar sodyum klorür içerir. Suyun yoğun buharlaşmasının meydana geldiği sıcak iklime sahip yerlerde, kristalleştiği konsantre sodyum klorür çözeltileri oluşur. Dünyanın bağırsaklarında, tuz katmanlarında, NaCl'yi çözen ve sondaj deliklerinden yüzeye çıkan yeraltı tuzlu sularını oluşturan yeraltı suları akar.
Tuz çözeltileri, elde edilme şekli ne olursa olsun kalsiyum ve magnezyum tuzlarının safsızlıklarını içerirler ve elektroliz atölyelerine gönderilmeden önce bu tuzlardan arındırılırlar. Saflaştırma gereklidir çünkü elektroliz işlemi sırasında, elektrolizin normal seyrini bozan, az çözünür kalsiyum ve magnezyum hidroksitler oluşabilir.
Tuzlu suların temizlenmesi, bir soda ve kireç sütü çözeltisi ile gerçekleştirilir. Kimyasal saflaştırmaya ek olarak, çözeltiler sedimantasyon ve filtrasyon yoluyla mekanik safsızlıklardan arındırılır.
Adi tuz çözeltilerinin elektrolizi, katı demir (çelik) katodlu ve diyaframlı banyolarda ve sıvı cıva katotlu banyolarda gerçekleştirilir. Her durumda, modern büyük klor tesislerinin ekipmanı için kullanılan endüstriyel elektrolizörler, yüksek üretkenliğe, basit tasarıma sahip olmalı, kompakt olmalı, güvenilir ve istikrarlı bir şekilde çalışmalıdır.
Çelik katot ve grafit anotlu banyolarda sodyum klorür çözeltilerinin elektrolizi .
Tek bir cihazda (elektrolizör) sodyum hidroksit, klor ve hidrojen elde edilmesini mümkün kılar. Sulu bir sodyum klorür çözeltisinden doğru elektrik akımı geçerken, klor salınımı beklenebilir:
2CI - - 2.Þ С1 2 (a)
yanı sıra oksijen:
20N - - 2.Þ 1/2O 2 + H 2 O (b)
H 2 0-2eÞ1 / 2О 2 + 2H +
OH - - iyonlarının deşarjının normal elektrot potansiyeli + 0.41'dir. içinde, ve klor iyonlarının deşarjının normal elektrot potansiyeli + 1,36'dır. içinde. Nötr doymuş bir sodyum klorür çözeltisinde, hidroksil iyonlarının konsantrasyonu yaklaşık 1 10 - 7'dir. g-eq/l. 25°C'de, hidroksit iyonlarının deşarjı için denge potansiyeli
Deşarjın denge potansiyeli, 4.6'lık bir çözeltide NaCI konsantrasyonunda klorür iyonları g-eq/l eşittir
Bu nedenle, küçük bir aşırı gerilime sahip anotta önce oksijen boşaltılmalıdır.
Bununla birlikte, grafit anotlarda, oksijen aşırı gerilimi, klor aşırı geriliminden çok daha yüksektir ve bu nedenle, reaksiyon (a)'ya göre gaz halindeki klor salınımı ile esas olarak C1 - iyonlarını boşaltırlar.
Denge potansiyelinin değerindeki bir azalma nedeniyle çözeltideki NaCl konsantrasyonundaki artışla klor salınımı kolaylaştırılır. 310-315 içeren konsantre sodyum klorür solüsyonlarının kullanılmasının sebeplerinden biri de budur. g/l.
Alkali bir çözeltideki katotta, su molekülleri denkleme göre boşaltılır.
H 2 0 + e \u003d H + OH - (c)
Rekombinasyondan sonra hidrojen atomları moleküler hidrojen formunda salınır.
2H Þ H 2 (d)
Katı bir katot üzerindeki sulu çözeltilerden sodyum iyonlarının deşarjı, hidrojene kıyasla daha yüksek deşarj potansiyelleri nedeniyle imkansızdır. Bu nedenle çözeltide kalan hidroksit iyonları, sodyum iyonları ile alkali bir çözelti oluşturur.
NaCl'nin ayrışma süreci, aşağıdaki reaksiyonlarla bu şekilde ifade edilebilir:
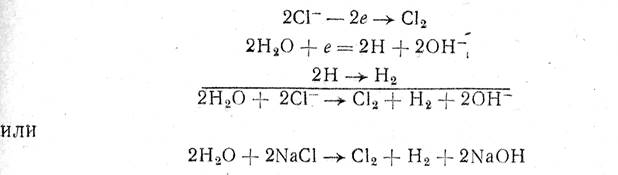
yani anotta klor oluşur ve katotta hidrojen ve sodyum hidroksit oluşur.
Elektroliz sırasında, açıklanan ana işlemlerle birlikte, biri denklem (b) ile açıklanan yan işlemler de meydana gelebilir. Ayrıca anotta salınan klor, elektrolit içinde kısmen çözülür ve reaksiyonla hidrolize edilir.
Alkalinin (OH - iyonları) anoda difüzyonu veya katot ve anot ürünlerinin yer değiştirmesi durumunda, hipokloröz ve hidroklorik asit hipoklorit ve sodyum klorür oluşturmak üzere alkali ile nötralize edilmiştir:
NOS1 + NaOH \u003d NaOCl + H2 0
HC1 + NaOH \u003d NaCl + H2 0
Anot üzerindeki ClO- iyonları kolayca ClO3-'e oksitlenir. Bu nedenle, elektroliz sırasında yan işlemler nedeniyle hipoklorit, sodyum klorür ve sodyum klorat üretilecek, bu da akım veriminin ve enerji verimliliğinin düşmesine neden olacaktır. Alkali bir ortamda, anotta oksijen salınımı kolaylaşır ve bu da elektroliz performansını kötüleştirir.
Sızıntıyı azaltmak için ters tepkiler, katot ve anot ürünlerinin karışmasını önleyecek koşullar oluşturulmalıdır. Bunlar, katot ve anot boşluklarının bir diyaframla ayrılmasını ve elektrolitin diyaframdan OH - iyonlarının anoda hareketinin tersi yönde süzülmesini içerir. Bu tür diyaframlara filtre diyaframları denir ve asbestten yapılır.
Klor çözünürlüğünün azalması nedeniyle elektrolitteki elektroliz sıcaklığında ve NaCl konsantrasyonundaki bir artış ve ayrıca katolitteki NaOH konsantrasyonundaki bir azalma, yan işlemlerin olasılığını azaltır.
Elektroliz sıcaklığındaki bir artış sadece akım verimini değil aynı zamanda elektrolitin elektriksel iletkenliğini de arttırır, böylece banyodaki voltajı azaltır. Böylece, sıcaklıktaki bir artış elektrik enerjisi tüketimini azaltır ve bu nedenle genellikle sodyum klorür çözeltilerinin elektrolizi 70-80 ° C'de gerçekleştirilir.
Filtreleme diyaframlı endüstriyel elektrolizörler, endüstride yaygın olarak kullanılmaktadır. Böyle bir banyonun şeması Şek. 1 Banyo çelik delikli (delikli) bir katoda ve bir grafit anoda sahiptir. Asbest kartondan yapılmış bir filtre diyaframı katoda sıkıca tutturulmuştur.
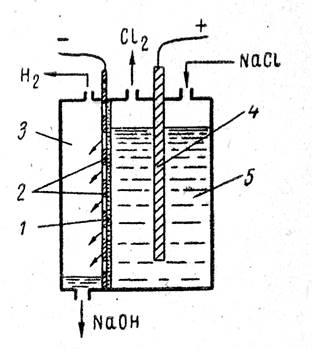 Sodyum klorür çözeltisi anot boşluğuna beslenir, diyaframdan süzülür ve katoda ulaşır. Elektrolit filtrasyon hızı, sözde diyafram sızıntısı ile karakterize edilir. v
(cm 3 /saat) ve diyaframın enine kesit alanına bağlıdır F
(bkz. 1), elektrolit kolonunun hidrostatik basıncı h
,
diyafram kalınlığı b (santimetre) ve elektrolit viskozitesi μ.
Sodyum klorür çözeltisi anot boşluğuna beslenir, diyaframdan süzülür ve katoda ulaşır. Elektrolit filtrasyon hızı, sözde diyafram sızıntısı ile karakterize edilir. v
(cm 3 /saat) ve diyaframın enine kesit alanına bağlıdır F
(bkz. 1), elektrolit kolonunun hidrostatik basıncı h
,
diyafram kalınlığı b (santimetre) ve elektrolit viskozitesi μ.
Doğru elektrik akımının geçişi ile anotta klor oluşur ve katodun deliklerinden geçerek katot boşluğuna akan ve banyodan çıkan katotta hidrojen ve alkali oluşur.
Filtreleme diyaframlı bir banyonun şeması:
1- diyafram; 2 - çelik katot;
3 - katot alanı;
4 - anot; 5 - anot alanı
Banyolarda sofra tuzunun tamamen ayrışması yoktur ve
sabit bir alkali ve ayrışmamış sofra tuzu konsantrasyonu kurulur.
Banyodan akan elektrolitik likör 110-120 içerir. g/l NaOH ve 180-170 g/l NaCl.
Endüstriyel elektrolizörler, yükü artırarak elde edilen daha yüksek bir üretkenliğe sahip olmalıdır. Çok gelişmiş bir yüzeye sahip katotların kullanılması, 50.000'e kadar yük ile kompakt elektrolizörler oluşturmayı mümkün kılar. a. Bu durumda diyafram, vakum kullanılarak hidroklorik-alkali çözeltilerdeki bir asbest lifi süspansiyonundan emilir veya katot yüzeyinde "biriktirilir".

Pirinç. 2. Diyaframlı banyo:
1- beton taban; 2 - çelik katot; 3 - beton kapak; 4 - tuzlu su tedarik borusu; 5 - klorun çıkarılması için boru; 6 - grafit anotlar; 7 - hidrojeni çıkarmak için bağlantı; 8 - elektrolitik likörü boşaltmak için tüp; 9 - İletken bakır
çekirdek
Birikmiş diyafram banyosuna bir örnek, Tip S Hooker banyosudur, şek. 2. Bu küvet üç ana bölümden oluşur - beton taban, çelik katot ve beton kaplama. Alt kısım, grafit anotların alt uçlarının kurşun ve akım sağlamaya yarayan bir bakır çubukla doldurulduğu dikdörtgen bir oluk şeklindedir. Anotlar grafit plakalardır. Katot, içine bir dizi yassı çelik ağ cebin monte edildiği çelik bir çerçevedir. Ceplerin yerleşimi ve genişlikleri öyledir ki katot banyonun dibine takıldığında cepler tam olarak anotların arasına yerleşir.
Tuzlu su temini ve klorun çıkarılması için banyonun kapağında açıklıklar vardır. Elektrolizör, çevreye ısı transferinden kaynaklanan enerji kayıplarını azaltan ısı yalıtımına sahiptir.
Cıvalı katot ve grafit anotlu banyolarda sodyum klorür çözeltilerinin elektrolizi.
Diyaframlı banyolara göre daha konsantre ürün alma şansı verir.
NaCl çözeltisinden sabit bir elektrik akımı geçtiğinde, grafit anotta C1 iyonlarının bir deşarjı meydana gelir ve bunu gaz halindeki klorin salınımı izler.
2C1 - - 2. Y C1 2
Bir cıva katodunda, büyük bir aşırı gerilim ile hidrojen oluşumu meydana gelir. Bir demir katot üzerinde nötr bir çözeltiden hidrojen çıkışı potansiyeli 0,415 ise içinde, o zaman bir cıva katodunda 1,7 - 1,85'tir içinde. Sodyum, fazla cıva içinde çözünen sodyum amalgam NaHgn oluşumu nedeniyle büyük bir depolarizasyon etkisi ile cıva üzerinde salınır. Bu nedenle, cıva katodu üzerindeki sodyum deşarjının potansiyeli denge durumundan yani 1,2 V'tan daha düşük, denge potansiyeli ise 2,71'dir. içinde. Böylece, cıva katodunda aşağıdaki işlemler gerçekleşir:
Na + + eÞ Na
Na+ n H g= NaHg n
ve neredeyse hiç hidrojen salmaz.
Sodyum amalgam özel bir aparat içinde ayrışır - reaksiyona göre su ile bir ayrıştırıcı
NaHg n + H 2 0 = NaOH + 1/2H 2 + nHg
Cıva katodlu bir banyoda elektroliz, ortalama olarak 4.3-4.4 voltajda ilerler. içinde.
Şematik diyagramı Şek. 3, iki bölümden oluşur: bir elektrolizör ve bir ayrıştırıcı.
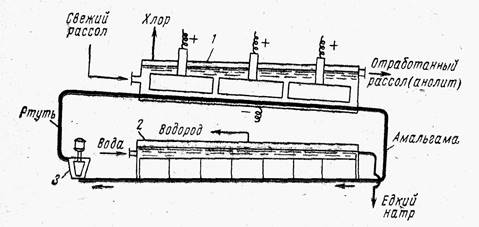 Elektrolizör ve ayrıştırıcı yapısal olarak ayrılabilir ve bir boru hattıyla birbirleriyle iletişim kurabilir veya ortak bir mahfazaya yerleştirilebilir.
Elektrolizör ve ayrıştırıcı yapısal olarak ayrılabilir ve bir boru hattıyla birbirleriyle iletişim kurabilir veya ortak bir mahfazaya yerleştirilebilir.
Her durumda, hücre, grafit anotların sabitlendiği, üstü bir kapakla kapatılmış, dikdörtgen kesitli uzun bir kutudur. Pirinç. 3. Cıva katodlu banyo şeması:
1- elektrolizör; 2 - ayrıştırıcı; 3 - pompa
Banyonun hafif eğimli tabanına bir katot veriyolu bağlanır ve üzerinde sürekli olarak ince bir cıva tabakası hareket eder. Böylece banyonun tabanı katottur. Elektrolizör konsantre (310-315) ile beslenir. g/l) elektroliz sürecinde sofra tuzundan 260-270 konsantrasyona kadar tüketilen sodyum klorür çözeltisi g/l, banyodan çıkarılır, vakum altında kloru giderilir ve basınçlı hava ile üflenir, tuza doyurulur, safsızlıklardan arındırılır (şemada gösterilmemiştir) ve tekrar elektrolize aktarılır. Ortaya çıkan klor, banyonun kapağından çıkarılır.
Elektroliz sırasında cıva hücrenin tabanı boyunca hareket ettiğinde, cıva içinde çözünen ve hücreden ayrıştırıcıya ayrılan sodyum amalgam elde edilir. Ayrıştırıcılar olabilir çeşitli tasarımlar- Yatay ve dikey. Yatay ayrıştırıcılar, bir kapakla kapatılmış dikdörtgen bir oluktur. Su, ayrıştırıcıya girer ve ortaya çıkan ürünler - hidrojen ve alkali - ondan çıkarılır. Ayrıştırıcının tabanı hafif bir eğime sahiptir, bu nedenle cıva alt kısımda hareket eder, ayrıştırıcıdan ve asansörler tarafından çıkarılır. çeşitli tipler elektrolizöre aktarılır.
Cıva katodlu bir banyo, cıva katodunun yatay yerleşimi nedeniyle geniş alanlar kaplar. Dikey birleştirilmiş disklerin katot görevi gördüğü banyolar vardır. Bu banyolar kompakttır, ancak tasarım ve kullanım açısından karmaşıktır.
İki tür banyonun ana performans göstergelerinin karşılaştırılması, cıva katotlu banyolardaki yüksek voltaj nedeniyle enerji tüketiminin diyafram banyolarından daha yüksek olduğunu göstermektedir. Ek olarak, cıva katot banyolarının çalıştırılması diyafram banyolarına göre daha zordur, kurulumlarının sermaye maliyetleri daha yüksektir ve cıva banyoları bulunan atölyelerde çalışma koşulları, diyafram banyolarının kurulu olduğu dükkanlara göre daha zordur.
Cıva banyolarında sofra tuzu içermeyen konsantre sıvılar elde edilebilmesi, cıva banyolarının önemli bir avantajıdır. Bu temelde, saf alkalinin gerekli olduğu tüm durumlarda (örneğin, viskon elyaf üretimi için), cıva katotlu banyolar tercih edilmelidir. Saf kostik için artan talep nedeniyle, cıva katodlu banyolarda elektroliz yaygınlaştı.
Elektroliz ile çözelti halinde elde edilen alkali, buharlaştırıcılarda konsantrasyona tabi tutulur. Diyafram banyolarından gelen alkali 130-140'a kadar içerir g/l NaOH ve 180-170 g/l NaCl. Sofra tuzunun çözünürlüğü, çözeltideki NaOH konsantrasyonu arttıkça azalır. Böylece %50 (769 g/l) NaOH, 20°C'de NaCl'nin çözünürlüğü 13.9'dur. g/l. Sonuç olarak, diyaframlı banyolarda elde edilen elektrolitik likörlerin buharlaştırılması sırasında, çözeltinin konsantrasyonu ile birlikte, elektrolize geri döndürülen sodyum klorür kristalleşmesi meydana gelir. Pratik olarak buharlaşma ve eritme işleminden sonra %92-94 NaOH, %2-3 NaCl içeren bir alkali elde edilir.
Çözüm.
Böylece, sodyum hidroksit şu anda elektroliz ile üretilmektedir. sulu çözelti sodyum klorit. Bu durumda, her birinin kendi avantajları ve dezavantajları olan iki tip elektrolizör kullanılır. Ancak her iki durumda da, sodyum hidroksit elde etme işlemine, hem insanlar hem de insanlar için tehlikeli maddeler olan gaz halindeki yan ürünlerin üretimi eşlik eder. çevre. Bu nedenle, bu üretimde özel güvenlik önlemlerine uymak gerekir.
Edebiyat.
1. Genel kimyasal teknoloji. Ed. IP Muhlenov. Üniversitelerin kimyasal-teknolojik uzmanlıkları için ders kitabı. M.: Yüksek okul.
2. Furmer I.E., Zaitsev V.N. Genel kimyasal teknoloji. - M.: Yüksekokul, 1978.
Buluş ile ilgili kimyasal endüstri sabun, boya, kağıt hamuru ve diğer endüstrilerin üretiminde kullanılabilir. Yöntem, CaO, CaC03 ve Na2C03 içeren soda külü üretim atığının 1000-1100°C sıcaklıkta kavrulmasıyla CaO·Na20 eriyiği elde edilmesini, ardından elde edilen sodyum hidroksitin süzdürülmesini ve buharlaştırılmasını içerir. Liç aşamasında elde edilen kalsiyum hidroksit, eriyiğin elde edilmesi aşamasında açığa çıkan karbondioksit ile karbonizasyona tabi tutulur. Önerilen yöntem, hedef üründeki sodyum hidroksit konsantrasyonunu artırmayı ve soda külü üretiminden kaynaklanan atıkları bertaraf etmeyi mümkün kılar. 3 wp f-ly, 1 hasta, 1 sekme.
Buluş kimya endüstrisine, özellikle sabun, boya, selüloz ve diğer endüstrilerin üretiminde yaygın olarak kullanılan sodyum hidroksit üretme teknolojisine ilişkindir.
Okul ders kitaplarından bile, örneğin aşağıdaki reaksiyonlara göre kostik soda elde etme yöntemleri bilinmektedir:
Na+HOH=NaOH+½H 2
[G. Remy. İnorganik kimya dersi. T.İ, Yabancı Edebiyat Yayınevi, M., 1963].
Kostik soda, sulu sodyum klorür çözeltilerinin elektrolizi veya kimyasal yöntemlerle elde edilir.
Sulu sodyum klorür çözeltilerinin elektrolizi sırasında alkali oluşur: anotta klorin ve katotta hidrojenin salınması, katot boşluğundaki OH iyonlarının konsantrasyonunda bir artışa yol açar. Endüstride, kostik soda ve klor elde etmek için iki tip banyo kullanılır: katı elektrotlar ve anottan katota hareket eden akan bir elektrolit (cıva katot) [Kısa kimyasal ansiklopedi. Ed. " Sovyet Ansiklopedisi”, v.3, M., 1964, s.376-377].
"Soda ürünleri teknolojisi" kitabında açıklanan kostik soda elde etme yöntemine göre [S.V. Belenky, S.M. Round, S.K. Sekovanny - Ed. "Kimya", M., 1972, s. 205-258] Diyafram banyolarında elektroliz sonucu katı katot, elektrolitik alkali, klor ve hidrojen elde edilir. Elektroliz atölyesindeki sürecin teknolojik şeması aynı edebi kaynakta 250-253. sayfalarda verilmektedir. Elektroliz atölyesinde elde edilen ve 110-135 g/l sodyum hidroksit ve 170-190 g/l ayrışmamış sodyum klorür içeren elektrolitik alkali, %42-50'ye kadar ticari sodyum hidroksitin kullanıldığı buharlaştırma atölyesine pompalanır. konsantre.
Cıva olarak kullanılan katı bir katot ile elektroliz yöntemiyle sodyum hidroksit üretimi birçok ülkede gerçekleştirilmektedir. endüstriyel Girişimcilik, özellikle Sterlitamak şehrinde "Kaustik" derneğinde.
Yukarıdaki yöntemin ana dezavantajı, bir cıva katodunun kullanılması ve ayrıca bir yan ürün olarak çevreye zarar vermeyen büyük miktarda klorin salınmasıdır.
Anolitin saflaştırılmış, konsantre, ısıtılmış bir sodyum klorür çözeltisi ile sürekli beslemesi ile anoliti ve katoliti ayıran bir filtre diyaframına sahip bir elektrolitik hücrede yükseltilmiş sıcaklıkta sulu bir sodyum klorür çözeltisinin elektrolizi yoluyla sodyum hidroksit üretmek için bilinen bir yöntem. 35-80 ° C, önce sodyum klorür çözeltisinin pH'ı 2-3'e eşit, 24-48 saat ve ardından pH 3.5-5.0'da.
Bilinen yöntemlerin dezavantajları aynı zamanda elde edilen sodyum hidroksitin nispeten düşük bir konsantrasyonunu içermelidir.
Sodyum hidroksit konsantrasyonunu artırmak için, ortak tuzun elektrolizini, elektrolitik alkalinin birinci aşamada %22-30'luk bir çözelti içinde sodyum hidroksit konsantrasyonuna buharlaştırılmasını, tuzun ayrılmasını içeren bir sodyum hidroksit üretme yöntemi önerilmiştir. kristaller ve ardından alkalinin buharlaştırılması, tuz ve sodyum sülfat kristalleri içeren sıyrılmış sodyum hidroksit çözeltisinin soğutulmuş bir çözelti ile karıştırılması, soğutulmuş çözeltinin bir kısmının tek sıyrılmış sodyum hidroksit çözeltisiyle karıştırılması için sağlanması, elde edilen hedef ürünün ayrılması.
Bilinen yöntemlerin dezavantajları, sodyum sülfat içeriği nedeniyle elde edilen sodyum hidroksitin düşük konsantrasyonunu ve saflığını da içermelidir.
Anot bölmesine sulu bir sodyum karbonat çözeltisi sağlayarak elektroliz dahil olmak üzere sulu sodyum hidroksit üretmek için geliştirilmiş bir yöntem bilinmektedir ve platin, platinleştirilmiş titanyum, platin oksitle kaplanmış titanyumun anot olarak kullanıldığı katot bölmesine su verilmektedir. .
Bu method ayrıca düşük konsantrasyonda sodyum hidroksit üretimi ile karakterize edilir ve ayrıca, bu yöntemin hazırlayıcı uygulamalarda kullanılmasına izin veren pahalı platin malzemelerinin kullanılması nedeniyle pahalıdır.
Kimyasal yöntemlerden, kostik soda üretimi için, 1000-1100 ° C sıcaklıkta demir oksit ile etkileşime girerek sodyum karbonatın kostikleştirilmesinden, ardından söndürmeden, elde edilen sodyum ferritin süzülmesinden oluşan ferritik bir yöntem bilinmektedir. su
[S.V. Belenky, S.M. Krugly, S.K. Sekovanny. Soda ürünleri teknolojisi. Ed. "Kimya", M., 1972, sayfa 285-287] veya 200-360 g/l NaOH içeren bir sodyum hidroksit çözeltisi.
Sodyum hidroksit üretmek için ferritik yöntemin dezavantajları arasında, sodyum ferritin yüksek kapasiteli ekipman gerektiren bir denge durumuna ayrışma süresi ve belirli bir zorluk arz eden kaynama işlemi nedeniyle işlemin ekonomik olmaması yer alır.
Kimyasal yöntemlerden, kostik soda üretimi için kireç yöntemi en yaygın olanıdır.
Yöntem, bir soda çözeltisinin sönmüş kireç veya kireç sütü ile etkileşiminin reaksiyonuna dayanır (kostikleştirme):
CaC03'ün zayıf çözünürlüğünden dolayı reaksiyonun dengesi NaOH oluşumuna doğru kayar. Bu şekilde işlenen soda kostik (yakıcı) hale gelir. Bu nedenle, bu şekilde elde edilen sodyum hidroksite kostik soda (genellikle %12-15) [NS Akhmetov. İnorganik kimya. M.: Lise, 1975, s. 591-592].
Kireç sütünün kostikleştirilmesi için kireç temini, CaO söndürme ısısının kullanılmasına izin verir. Ek olarak, kireç sütü ile gelen suyun prosesten çekilmesi nedeniyle daha konsantre bir sodyum hidroksit çözeltisi oluşur [IN Shokin, SA Krasheninnikov. soda teknolojisi. M.: Kimya, 1975, s.205].
Aynı kaynakta 218-220. sayfalarda bir açıklama verilmektedir. teknolojik şema yanmış kirecin bir soda çözeltisi ile etkileşimi dahil olmak üzere kireç yöntemiyle kostik soda üretimi.
Bu yöntemin ana dezavantajı, düşük konsantrasyon elde edilen sodyum hidroksit ve genellikle maliyetini artıran sodyum hidroksit konsantrasyonuyla ilişkili teknolojinin karmaşıklığı.
Soda külünün kireçle reaksiyona sokulması, ardından elde edilen likörlerin buharlaştırılması ve sodyum hidroksit çözeltisinin ayrılması yoluyla sodyum hidroksit üretmek için bilinen bir yöntem vardır.
Ayrıca, normal bir soda çözeltisinin kireç sütü ile üç aşamada reaksiyona sokulması, ardından birinci ve ikinci aşamalardaki arıtılmış sıvının buharlaştırılması ve çökeltilen tuzların, kostifikasyonun üçüncü aşamasının bir süspansiyonu ile karıştırılması yoluyla sodyum hidroksit üretme yöntemi de bilinmektedir. ve soda ve kostik sodanın çözeltiye geçişleri ile süspansiyonlardan süzüntü, ayrılması ve süzülmesi.
Bu yöntemin dezavantajı, düşük derecede soda ve kostik soda rejenerasyonunun (% 96.0-96.5) yanı sıra çöplüğe gönderilen yüksek sodyum sülfat içeriği ve sonuç olarak düşük bir hedef kostik soda konsantrasyonudur. .
Prototipe en yakın teknik çözüm, sodyum karbonatın kireçle etkileşimi, kirecin karbonizasyonu, elde edilen kalsiyum karbonatın ayrılması, sodyum hidroksit, sodyum hidroksit çözeltisinin buharlaştırılması dahil olmak üzere sodyum hidroksit üretme yöntemidir RU No. 2143398, IPC C 01 D 1/22, C 01 F 11 /18, 1995].
Bilinen yöntemin dezavantajları ana dezavantajı içerir - elde edilen sodyum hidroksitin küçük bir konsantrasyonu ve ayrıca pahalı hammaddelerin kullanılması nedeniyle elde edilen ürünlerin yüksek maliyeti.
Buluşun amacı, ucuz hammaddeler kullanılarak sodyum hidroksit üretimi, hedef üründeki sodyum hidroksit konsantrasyonunun arttırılması, soda külü üretim atıklarının geri dönüşümü için bir yöntem geliştirmektir.
Görev, daha önce CaO, CaCO 3 ve Na 2 CO 3 içeren soda külü üretim atığının kavrulmasıyla elde edilen CaO·Na 2 O eriyiğinin 1000-1100 °C sıcaklıkta liçine beslenmesi ve elde edilen likörün buharlaştırılması, sodyum hidroksit konsantrasyonu ağırlıkça %40'tan az olmayana kadar gerçekleştirilir ve süzme aşamasında elde edilen kalsiyum hidroksit, eriyik elde etme aşamasında salınan karbon dioksit ile karbonizasyona tabi tutulur. .
Geniş nitelikli kullanım alanı bulamayan soda külü üretim atıkları, kavurma için tedarik edilen ilk ürünler olarak kullanılır:
Kalsiyum karbonat - fırınlarda kireç taşının yakılmasından sonra küçük "altından atılan" (10-40 mm);
Kireç - fırınlardan sonra atık;
Standart olmayan sodyum karbonat (örneğin, "B" sınıfı)
İşlem şu şekilde gerçekleştirilir (çizim).
Soda külü üretiminden kaynaklanan atık - kalsiyum içeren atık - nepal - neredeyse sabit CaCO3 içeriği% 60-70, 10-40 mm parça boyutunda ve standart altı Na2C03 (örneğin , derece B) Na2C03 99, %2 içerikli ve CaO içeriği %60-80 olan fırınlardan sonra kireç - stokiyometrik bir oranda kutu 1-3'ten karıştırma ve granülasyon için bir granülatöre 4 beslenir.
Elde edilen granüller (granül boyutu 5-30 mm) daha sonra yakma fırınına (5) beslenir. Granüller, bir baca gazı akımında 1.5-2.0 saat boyunca 1000-1100°C sıcaklıkta ateşlenir.
Alınan eriyik CaO Na 2 Ö 80-95°C sıcaklıkta bir bilyeli değirmende 6 yıkanmak üzere gönderilir
Kalsiyum hidroksidin radyal çökeltici 7'de ayrılmasından sonra elde edilen sodyum hidroksit, buharlaştırma tesisine 8 buharlaştırılmak üzere beslenir. Hedef sodyum hidroksit, %40 konsantrasyonda elde edilir. Daha yüksek konsantrasyonda sodyum hidroksit elde etmek için aparat 9'da ek buharlaştırma gerçekleştirilir.
Ve çöktürücüden (7) izole edilen kalsiyum hidroksit, eriyiğin (I) kavrulması sonucu oluşan karbon dioksit ile etkileşime girerek karbonlaştırıcıya (10) beslenir, ardından elde edilen kalsiyum karbonat vakum filtresine (11) beslenir, ardından kurutmak için kurutucuya 12, ardından bitmiş ürün deposuna.
Yöntemin özü aşağıdaki örneklerle doğrulanmaktadır.
Bunker 1'den, 40 kg miktarında ağırlıkça %60 CaO içeriğine sahip fırınlarda pişirim sonrası kireç, bunker 3'ten soda külü marka " 100 kg miktarında ağırlıkça %99.2 Na2CO3 içeren B" granülasyon için granülatöre 4 beslenir. Daha sonra elde edilen eriyik, bilyeli değirmene 6 su verilerek gerçekleştirilen süzdürmeye beslenir. Süzme 90°C'lik bir sıcaklıkta gerçekleştirilir. Liçleme sonucunda %25 konsantrasyonda 300 kg sodyum hidroksit ve 111,6 kg miktarında kalsiyum hidroksit elde edilmektedir. Sodyum hidroksit buharlaşmaya yönlendirilir ve hedef sodyum hidroksit konsantrasyonu %40 elde edilir. Ve % 45 nem içeriğine sahip 111.6 kg miktarındaki kalsiyum hidroksit karbonlaştırıcıya 10 beslenir, burada karbon dioksit de pişirme fırınından 5 sonra verilir. Ortaya çıkan kalsiyum karbonat süspansiyonu vakum filtresine 11 beslenir ve sonra Kurutucuya 12. Ana madde içeriği %92 olan 150 kg kalsiyum karbonat.
Diğer örnekler tabloda sunulmuştur.
Yukarıdaki verilere dayanarak, sodyum hidroksit üretimi için önerilen yöntemin atıksız olduğu ve yüksek konsantrasyonda sodyum hidroksit elde edilmesine izin vereceği görülebilir. Ayrıca diş macunlarının yapımında tıpta kullanılabilen yüksek saflıkta kalsiyum karbonat elde edilir. Ayrıca önerilen yöntem, şu anda yeterince ustaca kullanılmayan soda külü üretiminden kaynaklanan atık ürünlerin bertaraf edilmesini mümkün kılacaktır.
| Masa | ||||||||||||
| Örnek No. | Başlangıç bileşenleri, ana madde başına 1:1:1 (mol) | Ateşleme sıcaklığı, °С | Liç aşaması | Park aşaması | karbonizasyon aşaması | |||||||
| kısa düştü | kireç - fırınlardan sonra | kalsiyum soda ("B" markası) | Şamandıra miktarı, kg | T-ra, °С | NaOH miktarı, kg | NaOH ile (elde edildi), % | T-ra, °С | C NaOH, (nihai), % | Ca (OH) 2 miktarı, kg | CaCO 3 miktarı, kg | ||
| 2 | 71,4 | 40 | 100 | 1000 | 186 | 80 | 322 | 25 | 80 | 40 | 111,6 | 150 |
| 3 | 80,4 | 45 | 100 | 1100 | 180 | 90 | 320 | 23 | 90 | 40 | 112,0 | 155 |
| 4 | 71,4 | 50 | 100 | 1050 | 184 | 95 | 323 | 20 | 85 | 40 | 111,6 | 155 |
| 5 | 70,0 | 50 | 150 | 1150 | Sinterleme oluşur ve eriyik boşaltılmaz | |||||||
| 6 | 71,4 | 40 | 100 | 950 | Eriyik oluşumu için yetersiz sıcaklık | |||||||
| 7 | 71,4 | 45 | 100 | 1050 | 186 | 90 | 321 | 25 | 85 | 40 | 112,1 | 154 |
1. Sodyum karbonatın kireçle etkileşimini içeren, ardından elde edilen karışımın süzülmesi, elde edilen likörün buharlaştırılması ve hedef ürünün ve ayrıca elde edilen kalsiyum karbonatın izole edilmesi dahil olmak üzere sodyum hidroksit üretme yöntemi olup, özelliği CaO Na20 olmasıdır. daha önce elde edilen eriyik, CaO, CaCO3 ve Na2C03 içeren soda külü üretim atığının 1000-1100°C sıcaklıkta yakılmasıyla liçe beslenir ve elde edilen likör en az sodyum hidroksit konsantrasyonuna kadar buharlaştırılır. 40 wt.% ve elde edilen kalsiyum hidroksit, eriyiğin elde edilmesi aşamasında salınan karbon dioksit ile liç karbonizasyonu aşamasında liç işlemine tabi tutulur.
2. İstem l'e göre yöntem olup, özelliği, soda külü üretiminden kaynaklanan bir atık olarak kalsiyum karbonatın kavrulması aşamasında oluşan, CaCO ile 5-30 mm'lik bir fraksiyonda oluşan ince "nedopal" kullanılmasıdır. 3 içeriği %60-70, CaO içeriği %60-80 olan yakma fırınlarından sonra sönmemiş kireç ve Na2C03 içeriği en az %92 olan soda külü üretiminden kaynaklanan atıklar.
3. İstem 1 ve 2'ye göre yöntem olup, özelliği, bir CaO Na20 eriyiği elde etmek için, soda külü üretim atığının - "düşmemiş", sönmemiş kireç ve standart altı Na2C03- stokiyometrik bir şekilde önceden karıştırılmasıdır. oranında, 5-30 mm tane büyüklüğünde granüle edilir.
4. İstem 1 ve 2'ye göre yöntem olup, özelliği, CaO.Na20 eriyiğinin özütlenmesinin 80-95°C'lik bir sıcaklıkta su ile gerçekleştirilmesidir.
Sodyum hidroksit üretmeye yönelik kimyasal yöntemler, kalkerli ve ferritiktir.
Sodyum hidroksit üretmek için kimyasal yöntemlerin önemli dezavantajları vardır: çok fazla enerji taşıyıcısı tüketilir, elde edilen kostik soda, safsızlıklarla ağır şekilde kirlenir.
Günümüzde bu yöntemlerin yerini neredeyse tamamen elektrokimyasal üretim yöntemleri almıştır.
kireç yöntemi
Sodyum hidroksit üretmek için kireç yöntemi, yaklaşık 80 ° C sıcaklıkta bir soda çözeltisinin sönmüş kireç ile etkileşiminden oluşur. Bu işleme kostikleme denir; reaksiyondan geçer:
hayır 2 BÖYLE 3 + Ca(OH) 2 = 2NaOH + CaCO 3
Reaksiyon sonucunda bir sodyum hidroksit çözeltisi ve bir kalsiyum karbonat çökeltisi elde edilir. Kalsiyum karbonat, kütlenin yaklaşık %92'sini içeren erimiş bir ürün elde etmek üzere buharlaştırılan çözeltiden ayrılır. NaOH. NaOH eritildikten ve katılaştığı demir varillere döküldükten sonra.
ferrit yöntemi
Sodyum hidroksit üretmek için ferritik yöntem iki aşamadan oluşur:
hayır 2 BÖYLE 3 + Fe 2 Ö 3 = 2NaFeО 2 + CO 2
2NaFeО 2 +xH 2 O = 2NaOH + Fe 2 Ö 3 *xH 2 Ö
Reaksiyon 1, soda külünün demir oksit ile 1100-1200 °C sıcaklıkta sinterlenmesi işlemidir. Ayrıca sodyum zerresi oluşur ve karbondioksit açığa çıkar. Daha sonra kek, reaksiyon 2'ye göre su ile işlenir (süzülür); bir sodyum hidroksit çözeltisi ve bir Fe203 *xH20 çökeltisi elde edilir, bu çözeltiden ayrıldıktan sonra işleme geri döndürülür. Nihai alkali solüsyon yaklaşık 400 g/l NaOH içerir. Kütlenin yaklaşık %92'sini içeren bir ürün elde etmek için buharlaştırılır. NaOH ve daha sonra granül veya pul şeklinde katı bir ürün elde edin.
Sodyum hidroksit üretmek için elektrokimyasal yöntemler
Elektrokimyasal olarak sodyum hidroksit elde edilir halit çözeltilerinin elektrolizi(esas olarak sofra tuzu NaCl'den oluşan bir mineral) ve aynı anda hidrojen ve klor üretimi. Bu süreç özet formülle temsil edilebilir:
2NaCI + 2H 2 ±2e hakkında - → H 2 +Cl 2 + 2NaOH
Kostik alkali ve klor, üç elektrokimyasal yöntemle üretilir. Bunlardan ikisi katı katotlu elektroliz (diyafram ve membran yöntemleri), üçüncüsü sıvı cıvalı katotlu elektrolizdir (cıva yöntemi).
Klor ve kostik elde etmenin üç yöntemi de dünya üretim pratiğinde kullanılmaktadır ve membran elektrolizinin payında net bir artış eğilimi vardır.
7. Katalitik zehirlerden kükürt dioksitin saflaştırılması.
Gaz emisyonları, bu sanayi işletmelerinin bulunduğu yerlerdeki ekolojik durumu çok olumsuz etkilemekte ve ayrıca sıhhi ve hijyenik çalışma koşullarını kötüleştirmektedir. Agresif kütle emisyonları arasında nitrojen oksitler, hidrojen sülfür, kükürt dioksit, karbon dioksit ve diğer birçok gaz bulunur.
Örneğin ülkemizdeki nitrik asit, sülfürik asit ve diğer fabrikalar her yıl on milyonlarca metreküp güçlü ve tehlikeli bir zehir olan nitrojen oksitleri atmosfere salmaktadır. Bu nitrojen oksitlerden binlerce ton nitrik asit üretilebilir.
Eşit derecede önemli bir görev, gazların kükürt dioksitten arındırılmasıdır. Ülkemizde sadece kükürt dioksit şeklinde atmosfere salınan toplam kükürt miktarı yaklaşık 16 milyon tondur. . yıl içinde. Bu miktardaki kükürtten 40 milyon tona kadar sülfürik asit üretilebilir.
Kok fırını gazında, esas olarak hidrojen sülfit formunda önemli miktarda kükürt bulunur.
Fabrika borularından ve elektrik santrallerinden çıkan baca gazları ile her yıl birkaç milyar metreküp karbondioksit atmosfere salınır. Bu gaz verimli karbonlu gübreler üretmek için kullanılabilir.
Verilen örnekler, gaz emisyonları ile atmosfere ne kadar büyük malzeme değerlerinin salındığını göstermektedir.
Ancak bu emisyonlar şehirlerde ve işletmelerde havayı zehirleyerek daha ciddi zararlara neden oluyor: zehirli gazlar bitki örtüsünü yok ediyor, insan ve hayvan sağlığı üzerinde son derece zararlı etki yapıyor, metal yapıları yok ediyor ve ekipmanları aşındırıyor.
olmasına rağmen son yıllar yerli sanayi kuruluşları tam kapasite ile çalışmamaktadır, ancak zararlı emisyonlarla mücadele sorunu çok şiddetlidir. Ve gezegendeki genel ekolojik durumu dikkate alarak, egzoz gazlarını zararlı safsızlıklardan arındırmak için en acil ve en radikal önlemleri almak gerekiyor.
katalitik zehirler
temas zehirleri, katalizörlerin "zehirlenmesine" neden olan maddeler (Bkz. Katalizörler) (genellikle heterojen), yani katalitik aktivitelerini azaltmak veya katalitik aktiviteyi tamamen durdurmak. Heterojen katalizörlerin zehirlenmesi, bir zehirin veya onun kimyasal dönüşüm ürününün katalizör yüzeyine adsorpsiyonu sonucu oluşur. Zehirlenme geri döndürülebilir veya geri döndürülemez olabilir. Böylece, amonyak sentezinin bir demir katalizörü üzerindeki reaksiyonunda, oksijen ve bileşikleri Fe'yi geri dönüşümlü olarak zehirler; bu durumda saf bir N2 + H2 karışımına maruz kaldığında, katalizörün yüzeyi oksijenden arındırılır ve zehirlenme azalır. Kükürt bileşikleri Fe'yi geri dönüşümsüz olarak zehirler; saf bir karışımın etkisi, katalizörün aktivitesini eski haline getirmede başarısız olur. Zehirlenmeyi önlemek için katalizöre beslenen reaksiyon karışımı iyice saflaştırılır. En yaygın K. I. metal katalizörler, oksijen (H20, CO, CO2), kükürt (H2S, CS2, C2H2SH, vb.), Se, Te, N, P, As, Sb ve ayrıca içeren maddeleri içerir. doymamış hidrokarbonlar (C2H4 , C2H2) ve metal iyonları (Cu2+ , Sn2+ , Hg2+ , Fe2+ , Co2+ , Ni2+) olarak. Asit katalizörler genellikle baz safsızlıkları tarafından zehirlenirken, bazik katalizörler asit safsızlıkları tarafından zehirlenir.
8. Azotlu gazların elde edilmesi.
Ağartma işleminden sonra açığa çıkan nitrojen oksitler, su ve tuzlu su kondenserlerinde yoğunlaştırılır ve ham karışımın hazırlanmasında kullanılır. N 2 O 4'ün kaynama noktası 0,1 MPa basınçta 20,6 ° C olduğundan, bu koşullar altında gaz halindeki NO 2 tamamen yoğunlaşabilir (sıvı N 2 O 4 üzerinde 21,5 ° C'de N 2 O 4'ün doymuş buhar basıncı) 0,098 MPa'ya eşittir, yani atmosferik değerden daha az). Sıvı nitrojen oksitleri elde etmenin bir başka yolu, onları basınç altında ve düşük sıcaklıkta yoğunlaştırmaktır. NH3'ün atmosferik basınçta temas oksidasyonu sırasında nitrojen oksit konsantrasyonunun hacimce %11'den fazla olmadığını hatırlarsak, Kısmi basınçları 83,5 mm Hg'ye karşılık gelir. Yoğunlaşma sıcaklığında (–10 °C) sıvının üzerindeki nitrojen oksitlerin basıncı (buhar basıncı) 152 mm Hg'dir. Bu, yoğuşma basıncını artırmadan bu gazlardan sıvı nitrojen oksitlerin elde edilemeyeceği anlamına gelir, bu nedenle -10 ° C sıcaklıkta böyle bir nitröz gazdan nitrojen oksitlerin yoğuşması 0,327 MPa basınçta başlar. 1,96 MPa'ya kadar basınç artışı ile yoğuşma derecesi keskin bir şekilde artar, basınçta daha fazla artış ile yoğuşma derecesi biraz değişir.
Azot gazının (yani NH3'ün dönüştürülmesinden sonra) sıvı nitrojen oksitlere işlenmesi etkisizdir, çünkü Р=2,94 MPa'da bile yoğuşma derecesi %68,3'tür.
Saf N 2 O 4'ün yoğuşma koşullarında soğutma -10 ° C'nin altında yapılmamalıdır, çünkü –10.8 °С'de N204 kristalleşir. NO, NO 2 , H20 safsızlıklarının varlığı kristalleşme sıcaklığını düşürür. Böylece N204 + %5 N203 bileşimine sahip bir karışım -15.8 ° C'de kristalleşir.
Ortaya çıkan sıvı nitrojen oksitler çelik tanklarda depolanır.
9. Basit ve çift süperfosfat elde edilmesi
"Süperfosfat" - Ca (H2P04) 2 * H20 ve CaS04 karışımı. En yaygın basit mineral fosforlu gübre. Süperfosfattaki fosfor esas olarak monokalsiyum fosfat ve serbest fosforik asit formunda bulunur. Gübre alçıtaşı ve diğer yabancı maddeleri (demir ve alüminyum fosfatlar, silis, flor bileşikleri, vb.) içerir. Basit süperfosfat, reaksiyona göre fosforitlerden sülfürik asit ile işlenerek elde edilir:
Sa 3 (RO 4 ) 2 + 2H 2 BÖYLE 4 = Sa(H 2 PO 4 ) 2 + 2CaSO 4 .
basit süperfosfat- neredeyse topaklanmayan, orta derecede dağılabilir gri toz; gübrede %14-19,5 P 2 O 5 bitkiler tarafından sindirilebilir. Basit süperfosfat üretiminin özü, suda ve toprak çözeltilerinde çözünmeyen doğal florapatitin çözünür bileşiklere, esas olarak Ca(H2P04)2 monokalsiyum fosfata dönüştürülmesidir. Ayrıştırma işlemi aşağıdaki özet denklemle temsil edilebilir:
2Ca 5 F (PO 4) 3 + 7H2S04 + 3H2O \u003d 3Ca (H2P04) 2 * H20] + 7 + 2HF; (1) ΔН= - 227,4 kJ.
Uygulamada, basit süperfosfat üretimi sırasında ayrışma iki aşamada ilerler. İlk aşamada apatitin yaklaşık %70'i sülfürik asit ile reaksiyona girer. Bu, fosforik asit ve kalsiyum sülfat hemihidrat üretir:
Ca 5 F (PO 4) 3 + 5H 2 SO 4 + 2.5H 2 O \u003d 5 (CaSO 4 * 0.5H 2 O) + 3H3PO 4 + HF (2)
Basit süperfosfat elde etmek için fonksiyonel şema, Şek. Ana süreçler ilk üç aşamada gerçekleşir: hammaddelerin karıştırılması, süperfosfat hamurunun oluşturulması ve katılaştırılması, süperfosfatın bir depoda olgunlaştırılması.
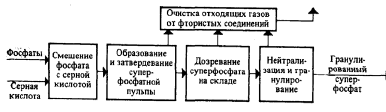
Pirinç. Basit süperfosfat üretiminin fonksiyonel diyagramı
Daha kaliteli bir ticari ürün elde etmek için süperfosfat olgunlaştıktan sonra katı katkı maddeleri (kireçtaşı, fosfat kayası vb.) ile nötralizasyona tabi tutulur ve granüle edilir.
Çift süperfosfat- konsantre fosfatlı gübre. Ana fosfor içeren bileşen, kalsiyum dihidroortofosfat monohidrat Ca (H 2PO 4) 2 H 2 O'dur. Genellikle diğer kalsiyum ve magnezyum fosfatları da içerir. Basit fosfata kıyasla balast - CaSO 4 içermez. Çift süperfosfatın ana avantajı az miktarda safradır, yani nakliye maliyetlerini, depolama maliyetlerini, paketleme maliyetlerini azaltır.
Çift süperfosfat, sülfürik asit H2S04'ün doğal fosfatlar üzerindeki etkisiyle üretilir. Rusya'da, akış yöntemi esas olarak kullanılır: hammaddelerin ayrışması, ardından elde edilen hamurun bir tamburlu granülatör-kurutucuda granülasyonu ve kurutulması. Yüzeyden ticari çift süperfosfat, standart bir ürün elde etmek için tebeşir veya NH3 ile nötralize edilir. Belirli bir miktarda çift süperfosfat hazne şeklinde üretilir. Fosfor içeren bileşenler temel olarak basit süperfosfattaki ile aynıdır, ancak daha fazla ve CaSO4 içeriği %3-5'tir. 135-140 °C'nin üzerinde ısıtıldığında, çift süperfosfat ayrışmaya ve kristalleşme suyunda erimeye başlar, soğuduktan sonra gözenekli ve kırılgan hale gelir. 280-320 °C'de ortofosfatlar, sindirilebilir ve kısmen suda çözünür formlarda olan meta-, piro- ve polifosfatlara dönüşür. 980 °C'de erir ve soğuduktan sonra metafosfatların %60-70'inin sitratta çözünür olduğu camsı bir ürüne dönüşür. Çift Süperfosfat, %43-49 asimile edilebilir fosforik anhidrit (fosfor pentoksit) içerir P2O5 (%37-43 suda çözünür), %3,5-6,5 serbest fosforik asit H3PO4 (%2,5-4,6 R2O5) :
Ca 3 (PO 4) 2 + 2H 2 SO 4 \u003d Ca (H 2 PO 4) 2 + 2CaSO 4
Fosfor içeren ham maddelerin fosforik asit ile ayrıştırılması için de bir yöntem vardır:
Ca 5 (PO 4) 3 F + 7H 3 PO 4 \u003d 5Ca (H 2 PO 4) 2 + HF
Çift süperfosfat üretimi için teknolojik sürecin blok diyagramı: 1 - ezilmiş fosforit ve fosforik asidin karıştırılması; 2 - 1. aşamadaki fosforitin ayrışması; 3 - fosforit II aşamasının ayrışması; 4 - kağıt hamuru granülasyonu; 5 - fosfor içeren gazların tozdan arındırılması; 6 - kağıt hamuru granüllerinin kurutulması; 7 - baca gazlarının elde edilmesi (fırında); 8 - kuru ürünün taranması; 9 - büyük bir fraksiyonun öğütülmesi; 10 - ikinci ekranda ince ve orta (mal) fraksiyonların ayrılması; 11 - ezilmiş büyük fraksiyonun karıştırılması ve ince; 12 - kalıntı fosforik asidin amonizasyonu (nötralizasyonu); 13 - amonyak ve toz içeren gazların saflaştırılması; 14 - çift süperfosfatın nötralize ticari fraksiyonunun soğutulması;

10. Ekstraksiyon ortofosforik asit elde edilmesi
Ekstraktif fosforik asidin hazırlanması
EPA elde edilmeden hemen önce özel bir teknoloji kullanılarak fosfor elde edilir.
Şekil 1. Fosfor üretim şeması: 1 - hammadde bunkerleri; 2 - karıştırıcı; 3 - halka besleyici; 4 - şarj hunisi; 5 - elektrikli fırın; 6 - cüruf kepçesi; 7 - ferrofosfor potası; 8 - elektrostatik çöktürücü; 5 - kapasitör; 10 - sıvı fosforun toplanması; 11 - karter
Ekstraksiyon yöntemi (en saf fosforik asidin üretilmesini sağlar) ana aşamaları içerir: elemental fosforun fazla havada yanması (oksidasyonu), ortaya çıkan P4O10'un hidrasyonu ve emilmesi, fosforik asidin yoğunlaşması ve gaz fazından sisin yakalanması . P4O10 elde etmenin iki yolu vardır: P buharının oksidasyonu (endüstride nadiren kullanılır) ve sıvı P'nin damlacıklar veya filmler şeklinde oksidasyonu. P'nin endüstriyel koşullar altında oksidasyon derecesi, oksidasyon bölgesindeki sıcaklık, bileşenlerin difüzyonu ve diğer faktörler tarafından belirlenir. Termal fosforik asit üretimindeki ikinci aşama - P4O10 hidrasyonu - asit (su) ile absorpsiyon veya P4O10 buharının su buharı ile etkileşimi ile gerçekleştirilir. Hidrasyon (P4O10 + 6H2O4H3PO4), polifosforik asitlerin oluşum aşamalarından geçer. Ortaya çıkan ürünlerin bileşimi ve konsantrasyonu, su buharının sıcaklığına ve kısmi basıncına bağlıdır.
Her zaman ayrı bir aparat içinde gerçekleştirilen buğu toplama işlemi dışında, prosesin tüm aşamaları tek bir aparat içinde birleştirilir. Endüstride genellikle iki veya üç ana aparattan oluşan şemalar kullanılır. Gaz soğutma prensibine bağlı olarak, termal fosforik asit üretimi için üç yöntem vardır: evaporatif, sirkülasyon-evaporatif, ısı değiştirici-evaporatif.
Suyun veya seyreltik fosforik asidin buharlaştırılması sırasında ısının uzaklaştırılmasına dayalı buharlaştırmalı sistemler, donanım tasarımında en basit olanlardır. Bununla birlikte, nispeten büyük hacimli egzoz gazları nedeniyle, bu tür sistemlerin kullanılması yalnızca küçük ünite kapasiteli kurulumlarda tavsiye edilir.
Sirkülasyon-buharlaştırma sistemleri, P'yi yakma, gaz fazını sirküle eden asitle soğutma ve P4O10'u hidratlama aşamalarını tek bir cihazda birleştirmeyi mümkün kılar. Planın dezavantajı, büyük miktarda asidi soğutma ihtiyacıdır. Isı değişimi ve buharlaştırma sistemleri, iki ısı giderme yöntemini birleştirir: yanma ve soğutma kulelerinin duvarları yoluyla ve ayrıca gaz fazından suyu buharlaştırarak; sistemin önemli bir avantajı, pompalama ve soğutma ekipmanı ile asit sirkülasyon devrelerinin olmamasıdır.
Yerli işletmeler, sirkülasyon-evaporatif soğutma yöntemiyle (çift kule sistemi) teknolojik planlar yürütür. Planın ayırt edici özellikleri: gaz soğutma için ek bir kulenin varlığı, sirkülasyon devrelerinde verimli plakalı ısı eşanjörlerinin kullanılması; P sıvı P jetinin düzgün bir ince atomizasyonunu ve daha düşük oksitler oluşmadan tam yanmasını sağlayan P'yi yakmak için yüksek performanslı bir brülörün kullanılması.
Yılda 60 bin ton %100 H3PO4 kapasiteli tesisin teknolojik şeması şekil 2'de gösterilmektedir. 2. Erimiş sarı fosfor, sirküle eden asitle püskürtülen bir yanma kulesindeki bir nozül aracılığıyla 700 kPa'ya kadar bir basınçta ısıtılmış hava ile atomize edilir. Kulede ısıtılan asit, plakalı ısı eşanjörlerinde dolaşan su ile soğutulur. %73-75 H3PO4 içeren üretim asidi sirkülasyon devresinden depoya atılır. Ek olarak, yanma kulesinden gazların soğutulması ve asidin emilmesi, soğutma kulesinde (hidrasyon) gerçekleştirilir, bu da doğum sonrası, elektrostatik çökeltici üzerindeki sıcaklık yükünü azaltır ve etkili gaz saflaştırmasına katkıda bulunur. Hidrasyon kulesindeki ısının uzaklaştırılması, plakalı ısı eşanjörlerinde soğutulmuş %50 H3PO4 sirküle edilerek gerçekleştirilir. Hidrasyon kulesinden çıkan gazlar, plaka elektrostatik çökelticide H3PO4 sisinden temizlendikten sonra atmosfere salınır. 1 ton %100 H3PO4 için 320 kg P tüketilmektedir.

Pirinç. Şekil 2. Ekstraksiyon H3PO4 üretimi için sirkülasyon iki kule şeması: 1 - ekşi su toplayıcı; 2 - fosforun depolanması; 3.9 - sirkülasyon toplayıcıları; 4.10 - dalgıç pompalar; 5.11 - plakalı ısı eşanjörleri; 6 - yanma kulesi; 7 - fosfor nozulu; 8 - hidrasyon kulesi; 12 - elektrostatik çöktürücü; 13 - hayran.
11. Kükürt dioksitin sülfürik anhidrite oksidasyonu için katalizörler. temas kurmak
Sülfürik anhidrit, kükürt dioksitin atmosferik oksijen ile oksitlenmesiyle elde edilir:
2SO2 + O2 ↔ 2SO3,
Bu geri dönüşümlü bir reaksiyondur.
Demir oksit, vanadyum pentoksit ve özellikle ince taneli platinin kükürt dioksitin sülfürik anhidrite oksidasyon reaksiyonunu hızlandırdığı uzun zamandır gözlemlenmiştir. Bu maddeler, kükürt dioksitin oksidasyonu için katalizörlerdir. Bu nedenle, örneğin, 400 ° C'de, platinleştirilmiş asbest (yani, yüzeyinde ince ezilmiş platinin biriktiği asbest) varlığında, kükürt dioksitin neredeyse% 100'ü atmosferik oksijen tarafından sülfürik anhidrite oksitlenir. Devamı Yüksek sıcaklık Hızlandıkça sülfürik anhidrit çıkışı azalır ters tepki- sülfürik anhidritin kükürt dioksit ve oksijene ayrışmasının reaksiyonu. 1000°C'de sülfürik anhidrit neredeyse tamamen başlangıç malzemelerine ayrışır. Bu nedenle, sülfürik anhidrit sentezinin ana koşulları, katalizörlerin kullanılması ve çok yüksek olmayan belirli bir sıcaklığa kadar ısıtılmasıdır.
Sülfürik anhidrit sentezi ayrıca iki koşula daha uyulmasını gerektirir: kükürt dioksit, katalizörlerin hareketini engelleyen safsızlıklardan arındırılmalıdır; Nem sülfürik anhidrit verimini azalttığı için kükürt dioksit ve hava kurutulmalıdır.

