Tripsin yağları parçalar. Petrol ve gazın büyük ansiklopedisi
Tükürük, nişastanın hidrolizini son derece kuvvetli bir şekilde katalize eden ptyalin enzimini içerir. Asit hidrolizinin aksine, nişastanın ptyalin tarafından hidrolizi sadece maltoz disakkarit oluşumuna kadar ilerler.
Tükürük, nişastanın hidrolizini son derece kuvvetli bir şekilde katalize eden ptyalin (amilaz) enzimini içerir.
Enzim ptyalin (amilaz) etkisi altında, nişasta kısmen önce dekstrinlere ve daha sonra disakkarit maltoza dönüştürülür. İkinci tükürük enzimi maltaz, altozu iki glikoz molekülüne böler.
Tükürükteki en önemli enzim, nişastanın dekstrinlere ve kısmen de maltoza hidrolizini katalize eden tükürük amilazı olan ptyalin'dir. Bu parçalanma ürünlerinin glikoza son hidrolizi ince bağırsakta gerçekleşir.
1831'de Leike, ptyalin'in diyastatik aktiviteye sahip olduğunu keşfetti ve nihayet 1833'te A.
İnsan vücudunda nişasta, tükürükte bulunan ptyalin veya amilaz enzimi tarafından hidrolize edilir. Bu nedenle tükürük, yiyeceğin yemek borusundan geçişini kolaylaştırmak için sadece nemlendirmekle kalmaz, aynı zamanda önemli bir sindirim sıvısıdır.
Açıkçası, tükürük enzimi - ptyalin - etkisi altında nişasta, glikoza değil, bir disakkarit olan maltoza hidrolize edilir. Ancak özellikle maltoz, glikoz gibi bakır oksit hidratı geri kazandırdığı için öğrencilerin dikkatini bu ayrıntıya çekmeye gerek yoktur.
Aşağıdaki terimleri açıklayın: duodenum, sekretin, ptyalin, enterokinaz, zimojen, lipaz, rennin, steapsin, kimus, safra tuzları, tripsinojen, kolesistokinin.
Nişasta başlangıçta tükürük enzimi olan ptyaline maruz kalır, ancak nişasta hidrolizinin çoğu, nişastanın pankreas ve diğer oldukça aktif enzimlerin etkisiyle glikoza dönüştürüldüğü ince bağırsakta meydana gelir. Glikoz içeren bazı basit şekerler kan yoluyla karaciğere taşınır ve burada glikojenin bir parçası olarak birikirler. Şekerlerin diğer bir kısmı direkt olarak genel dolaşıma girer, burada enerji salınımı ile yakılır, yağlara dönüştürülür veya glikojen şeklinde kaslarda birikirler. Glikojen gerektiğinde salınabilir ve bir enerji kaynağı olarak hizmet eder. Karbonhidrat metabolizması insülin gibi bir hormon tarafından düzenlenir. Karbonhidratların CO2 ve H2O'ya dönüşüm mekanizmaları çok karmaşıktır ve bu kitapta ele alınmayacaktır.
Tükürüğün nötr bir reaksiyonu vardır ve bu, ptyalin ve maltozun optimal etkisine karşılık gelir. Hidroklorik asit içeren mide suyu, asidik bir ortamda aktivitelerini kaybettikleri için midede tükürüğün etkisini durdurur. Bununla birlikte, ptyalin ve maltoz enzimleri, yiyecek bolusu yalnızca yavaş yavaş safra suyu ile doyurulduğundan, midede bir süre daha hareket etmeye devam edebilir.
Maltoz, malt diastazının nişasta ve ayrıca tükürük ptyalin üzerindeki etkisiyle oluşur. Damıtma ve bira endüstrisinin bir ara ürünüdür.
Enzimatik hidroliz, bitkilerde ve amilaz adı verilen hayvan organizmalarında (malt diastasis, tükürük ptyalin, vb.) bulunan enzimlerin etkisi altında gerçekleşir. Bu enzimler 1-4 bağı kırar, ancak 1-6 bağı hidrolize etmez. Geri kalanı bir dizi ara oligosakkarit oluşturur.
Ezme sırasında nişastanın hidrolitik parçalanması (amiloliz) malt amiloz tarafından katalize edilir. Bunlara ek olarak malt, nişastanın bazı parçalanma ürünlerine saldıran amiloglukozidaz ve transferaz gruplarından çeşitli enzimler içerir; ancak, niceliksel oran açısından, ezme sırasında yalnızca ikincil öneme sahiptirler.
Ezerken, doğal substrat maltta bulunan nişastadır. Herhangi bir doğal nişasta gibi, tek değil kimyasal, ancak kaynağa bağlı olarak %20 ila %25 amiloz ve %75-80 amilopektin içeren bir karışım.
Amiloz molekülü, a-1,4 konumunda karşılıklı olarak glukozidik bağlarla bağlanan a-glukoz moleküllerinden oluşan uzun, dalsız, sarmal olarak katlanmış zincirler oluşturur. Glikoz moleküllerinin sayısı farklıdır ve 60 ila 600 arasında değişir. Amiloz suda çözünür ve iyot çözeltisi ile boyanır. Mavi renk. Meyer'e göre, amiloz, malt β-amilazın etkisiyle tamamen maltoza hidrolize olur.
Amilopektin molekülü kısa dallı zincirlerden oluşur. α-1,4 konumundaki bağların yanı sıra dallanmış yerlerde α-1,6 bağları da bulunur. Bir molekülde yaklaşık 3000 glikoz birimi vardır.McLeod'a göre arpa amilopektin bunları 24 ila 26 arasında içerirken malt sadece 17-18 içerir. Amilopektin suda ısıtılmadan çözünmez; ısıtıldığında bir macun oluşturur.
Malt, nişastayı maltoz ve dekstrinlere parçalayan iki amilaz içerir. Bunlardan biri, mavi rengin iyot çözeltisi ile hızla kaybolduğu, ancak nispeten az maltoz oluştuğu bir reaksiyonu katalize eder; bu amilaza dekstrinasyon veya a-amilaz (a-1,4-glukan-4-glukanohidrolaz, EC 3.2.1 L.) adı verilir. İkinci amilazın etkisi altında, iyot çözeltisi ile mavi renk yalnızca büyük miktarda maltoz oluştuğunda kaybolur; amilaz veya β-amilazı sakarifiye eder (β-1,4-glukanmaltohidrolaz, EC 3.2.1.2) *.
* (α ve β işaretleri, ortaya çıkan şekerin (α-maltoz veya β-maltoz) optik biçimine atıfta bulunur.)
α-amilaz dekstrinasyonu. Maltın tipik bir bileşenidir. α-Amilaz maltlama sırasında aktive olur, ancak Kneen bunu arpada ancak 1944'te keşfetti. α-1,4 glukozidik bağların parçalanmasını katalize eder. Nişastanın her iki bileşeninin molekülleri, yani amiloz ve amilopektin, içeride eşit olmayan bir şekilde kırılır; sadece terminal bağlar hidrolize olmaz. Çözeltinin viskozitesinde hızlı bir azalma (pürenin sıvılaşması) ile kendini gösteren incelme ve dekstrinizasyon meydana gelir. Nişasta hamurunun sıvılaştırılması malt α-amilazın işlevlerinden biridir. Başka bir sıvılaştırıcı enzimin (amilofosfataz) dahil olduğu fikri şu anda doğrulanmış olarak kabul edilmemektedir. α-amilazın yalnızca Hızlı düşüş geri yükleme kabiliyeti aynı zamanda çok yavaş artan nişasta macununun viskozitesi. Nişasta hamurunun (yani amilopektin çözeltisinin) α-amilaz etkisi altındaki mavi iyot reaksiyonu, kırmızı, kahverengi ve akroik bir noktada, yani düşük indirgeme kabiliyeti ile hızla değişir.
Doğal ortamlarda, yani malt ekstraktlarında ve pürelerde α-amilaz, 70 ° C'lik bir optimum sıcaklığa sahiptir; 80°C'de inaktive edilir. Optimum pH bölgesi, pH eğrisinde net bir maksimum ile 5 ile 6 arasındadır. S ile 9 arasındaki pH aralığında stabildir. aα-Amilaz hiperasiditeye karşı çok hassastır (aside dayanıksızdır); oksidasyon ile inaktive evet 0°C'de pH 3 veya 20°C'de pH 4.2-4.3'e kadar.
β-amilazı sakarifiye etmek. Arpada bulunur ve maltlama (çimlenme) sırasında hacmi büyük ölçüde artar. β-Amilaz, nişastanın maltoza parçalanmasını katalize etme konusunda yüksek bir yeteneğe sahiptir. Çözünmeyen doğal nişastayı ve hatta nişasta hamurunu sulandırmaz.
Dallanmamış amilaz zincirlerinden β-amilaz, ikincil a-1,4 glukozidik bağları, yani indirgeyici olmayan (aldehit olmayan) zincir uçlarından koparır. Maltoz yavaş yavaş ayrı zincirlerden birer birer molekül olarak ayrılır. Amilopektin bölünmesi de meydana gelir, ancak enzim dallı amilopektin molekülüne eşzamanlı olarak birkaç uzamsal zincirde, yani bölünmenin durduğu a-1,6 bağlarının bulunduğu dallanma bölgelerinde saldırır.
α-amilaz etkisi altında nişasta macununun viskozitesi yavaş yavaş azalırken, indirgeme yeteneği eşit olarak artar. İyot rengi maviden çok yavaş bir şekilde menekşe rengine, oradan da kırmızıya geçer ancak akroik noktaya hiç ulaşmaz.
Malt özütlerinde ve ezmelerde β-amilaz için optimum sıcaklık 60-65°C'dir; 75 °C'de inaktive edilir. Diğer verilere göre optimal pH bölgesi 4,5-5'tir - pH eğrisinde yumuşak bir maksimum ile 40-50°C'de 4,65.
α- ve β-amilazın genel etkisi. Normal maltlarda ve özel diastatik maltlarda bulunan amilaz (diastaz), β-amilazın kantitatif olarak α-amilaza göre baskın olduğu doğal bir α- ve β-amilaz karışımıdır.
Her iki amilazın eşzamanlı etkisi ile nişastanın hidrolizi, nişastadan çok daha derindir. bağımsız eylem bu enzimlerden biri ve bu durumda maltoz %75-80 elde edilir.
Amilozun ve amilopektinin uç gruplarının β-amilaz tarafından sakarifikasyonu zincirlerin sonundan başlar, α-amilaz ise zincirler içindeki substrat moleküllerine saldırır.
α-amilazın amiloz ve amilopektin üzerindeki etkisi ile maltoz ile birlikte daha düşük ve daha yüksek dekstrinler oluşur. β-amilazın amilopektin üzerindeki etkisiyle daha yüksek dekstrinler de oluşturulur. Dekstrinler bir tür eritrogranülozdur ve α-amilaz onları α-1,6 bağlarına ayırır, böylece β-amilazın etkisi için yeni merkezler oluşur. Böylece α-amilaz, β-amilazın aktivitesini arttırır. Ayrıca α-amilaz, β-amilazın amiloz üzerindeki etkisiyle oluşan heksoz tipi dekstrinlere saldırır.
Normal düz zincirli dekstrinler, her iki amilaz tarafından da şekerlenir. Aynı zamanda, β-amilaz, maltoz ve biraz maltotrioz ve ayrıca maltoz ve glikoza parçalanan a-amilaz - maltoz, glikoz ve maltotrioz verir. Dallanmış zincir dekstrinleri dallanma bölgelerine ayrılır. Bu durumda, daha düşük dekstrinler, bazen oligosakaritler, esas olarak trisakaritler ve izomaltoz oluşur. Enzimlerin daha fazla hidrolize etmediği bu tür dallı artık ürünlerin yaklaşık %25-30'u vardır ve bunlara nihai dekstrinler denir.
α- ve β-amilazın sıcaklık optimumundaki fark, pratikte her iki enzimin etkileşimini düzenlemek için kullanılır, çünkü doğru sıcaklık seçimi bir enzimin aktivitesini diğerinin zararına destekler.
Malt amiloglukosidazlar, örneğin α- ve β-glukosidaz, β-h-fruktosidaz, amilazlarla tam olarak aynı şekilde reaksiyona giren hidrolize edici enzimlerdir, ancak bunlar nişastayı hidrolize etmez, sadece bazı bölünme ürünlerini.
Transglukosidazlar daha çok hidrolize edilemeyen enzimlerdir, ancak katalize ettikleri reaksiyonların mekanizması hidrolazlarınkine benzer. Malt, transglukosidazlar, fosforile edici veya fosforilazlar ve örneğin siklodekstrinaz, amilomaltaz, vb. gibi fosforile etmeyen maddeler içerir. Bütün bu enzimler, şeker radikallerinin transferini katalize eder. Bunların teknolojik önemi ikincil öneme sahiptir.
Proteinleri parçalayan enzimler
Proteinlerin bölünmesi (proteoliz), ezme sırasında peptidazlar veya proteazlar (peptid hidrolazlar, EK 34) grubundan enzimler tarafından katalize edilir, hidrolize peptid bağları = CO = NH =. Endopeptidazlar veya proteinazlar (peptidohidrolaz peptidi, EC 3.44) ve ekzopeptidazlar veya peptidazlar (hidrolaz dipeptid, EC 3.4.3) olarak ikiye ayrılırlar.
Pürelerde, substratlar arpa protein maddesinin kalıntılarıdır, yani lökosin, edestin, hordein ve glutelin, maltlama sırasında kısmen değişmiş (örneğin, kurutma sırasında pıhtılaşmış) ve bunların parçalanma ürünleri, yani albümozlar, peptonlar ve polipeptitler.
Bazı proteinler serbest terminal amin grupları = NH2 ve karboksil grupları = COOH ile peptit bağlarıyla bağlı açık amino asit zincirleri oluşturur. Bunlara ek olarak, bir protein molekülünde diaminokarboksilik asitlerin amino grupları ve dikarboksilik asitlerin karboksil grupları bulunabilir. Bazı proteinler halka şeklinde kapalı peptit zincirlerine sahipken, terminal amin ve karboksil gruplarına sahip değildirler.
Arpa ve malt, endopeptidazlar (proteinazlar) grubundan bir enzim ve en az iki ekzopeptidaz (peptidazlar) içerir. Hidrolize edici etkileri birbirini tamamlayıcıdır.
Endopeptidaz (proteinaz). Gerçek bir proteinaz gibi, arpa ve malt endopeptidaz, proteinlerin iç peptid bağlarını hidrolize eder. Bu durumda, protein makromolekülleri daha küçük partiküllere, yani daha düşük moleküler ağırlığa sahip polipeptitlere bölünür. Tıpkı diğer proteinazlar gibi, arpa ve malt proteinazları da doğal proteinlere göre denatüre olanlar gibi değiştirilmiş proteinler üzerinde daha aktif olarak etki eder.
Arpa ve malt proteinazları özelliklerine göre bitkilerde çok yaygın olan papain tipi enzimlerdir. Optimum sıcaklıkları 50-60°C arasındadır, optimum pH, alt tabakaya bağlı olarak 4,6 ila 4,9 arasındadır. Proteinaz, yüksek sıcaklıklarda nispeten kararlıdır ve bu nedenle peptidazlardan farklıdır. İzoelektrik bölgede, yani pH 4.4 ila 4.6 arasında en kararlıdır. Kolbach'a göre, enzimin sulu bir ortamdaki aktivitesi, 30°C'de 1 saat sonra zaten azalmaktadır; 70°C'de 1 saat sonra tamamen yok edilir.
Malt proteinaz tarafından katalize edilen hidroliz kademeli olarak ilerler. Proteinler ve polipeptitler arasında, en önemlileri proteozlar, albümozlar vb. olarak da adlandırılan peptonlar olan birkaç ara ürün izole edilmiştir. daha yüksek ürünler proteinlerin tipik özelliklerine sahip kolloidal bölünmeler. Tanen ile asidik bir ortamda çökelirler, ancak biüre reaksiyonu sırasında (yani bir alkali protein çözeltisinde bakır sülfat ile reaksiyona girerler), içinde boyanırlar. pembe renk mor yerine. Kaynatıldığında peptonlar pıhtılaşmaz. Çözeltiler aktif bir yüzeye sahiptir, viskozdur ve çalkalandığında kolayca köpük oluşturur.
Malt proteinaz tarafından katalize edilen proteinlerin son bölünme derecesi polipeptitlerdir. Kolloidal özelliklere sahip sadece kısmen yüksek moleküler maddelerdir. Normal olarak polipeptitler, kolayca yayılabilen moleküler çözeltiler oluşturur. Kural olarak, proteinler gibi reaksiyona girmezler ve tanen tarafından çökeltilmezler. Polipeptitler, proteinazların etkisini tamamlayan peptidazlar için bir substrattır.
Ekzopeptidazlar (peptidazlar). Peptidaz kompleksi maltta iki enzim tarafından temsil edilir, ancak diğerlerine izin verilir.
Peptidazlar, ilk dipeptitler ve son olarak amino asitler ile peptitlerden terminal amino asit kalıntılarının ayrılmasını katalize eder. Peptidazlar, substrat spesifikliği ile karakterize edilir. Bunlar arasında sadece dipeptitleri hidrolize eden dipeptidazlar ve molekülde en az üç amino asit içeren daha yüksek peptitleri hidrolize eden polipeptidazlar bulunur. Peptidazlar grubunda, aktivitesi serbest bir amino grubunun varlığını belirleyen aminopolipeptidazlar ve serbest bir karboksil grubunun varlığını gerektiren karboksipeptidazlar vardır.
Tüm malt peptidazlar, pH 7 ve 8 arasındaki hafif alkali bölgede optimum pH'a ve yaklaşık 40°C'lik bir optimum sıcaklığa sahiptir. Proteolizin çimlenen arpada meydana geldiği pH 6'da, peptidazların aktivitesi belirgindir, pH 4.5-5.0'da (proteinazlar için optimum), peptidazlar inaktive edilir. AT sulu çözeltiler peptidazların aktivitesi 50°C'de bile azalır, 60°C'de peptidazlar hızla inaktive olur.
Fosforik asit esterlerini parçalayan enzimler
Ezerken büyük önem fosforik asit esterlerinin hidrolizini katalize eden enzimlere bağlanır.
Fosforik asidin ortadan kaldırılması, demleme ara ürünlerinin ve biranın asitliği ve tamponlama sistemi üzerindeki doğrudan etkisinden dolayı teknik olarak çok önemlidir.
Malt fosfoesterazların doğal substratı esterler maltta fitinin baskın olduğu fosforik asit. İnositolün hekzafosforik esteri olan fitik asidin kalsis ve magnezyum tuzlarının bir karışımıdır. Fosfatidlerde fosfor, gliserole bir ester olarak bağlanırken, nükleotidler, bir pirimidin veya pürin bazına bağlı bir riboz fosfor esteri içerir.
En önemli malt fosfoesteraz fitazdır (mezoinositol heksafosfat fosfohidrolaz, EC 3.1.3.8). O çok aktif. Fitinden, fitaz kademeli olarak fosforik asidi ayırır. Bu, sonunda inositol ve inorganik fosfat veren inositolün çeşitli fosfat esterlerini üretir. Fitaz ile birlikte sakarofosforilaz, nükleotid pirofosfataz, gliserofosfataz ve pirofosfataz da tarif edilmiştir.
Malt fosfatazların optimal pH'ı nispeten dar bir aralıktadır - 5 ila 5.5. İle yüksek sıcaklıklar farklı şekillerde duyarlıdırlar. 40-50°C'lik optimum sıcaklık aralığı, peptidazların (proteazlar) sıcaklık aralığına çok yakındır.
Proteinlerin parçalanması gastrointestinal sistem- bu, protein metabolizmasının bir parçasıdır, sindirim sisteminde gerçekleştirilen bir dizi kontrollü süreç, vücuda gıda ile giren proteinlerin kimyasal olarak işlenmesi, daha sonra kan ve lenf içine emilmeleri için.
Protein moleküllerinin parçalanması midede başlar. varlığı sayesinde hidroklorik asit proteinler şişer ve denatüre olur. Pepsinden etkilenirler. mide suyu, dışında öne çıkan aktif form pepsinojen ve hidroklorik asit ile aktive edilir.
Pepsinin etkisi altında protein, albümozlara ve peptonlara bölünür.
Albümoz ve peptonun daha fazla hidrolizi duodenumda meydana gelir.
Aktif olmayan formlar pankreastan duodenuma girer: tripsinojen, kimotripsinojen, polipeptidazlar.
Duodenum boşluğunda, tripsinojen enterokenaz etkisi altında aktif tripsine dönüştürülür, aktif tripsin oluşur, albümozları ve peptonları parçalar ve bunun bir kısmı kimotripsinojenlerin kimotripsine dönüştürülmesine harcanır.
Trinsinin etkisini tamamlar, küçük peptitler oluşur; hidrolizleri aminopolipeptidazlar ve karboksipolipeptidazlar tarafından katalize edilir.
Aynı zamanda dipeptidler, dipeptidazlar onlara etki eder ve duvarlar tarafından salgılanır. ince bağırsak. Amino asitler kan dolaşımına girer, kanla birlikte karaciğerden geçer, daha sonra vücutta dolaşır ve hücrelerde yeni protein moleküllerini sentezlemek için kullanılır.
Emilmeyenler, mikrobiyal enzimlerin etkisi altında toksik maddelerin oluştuğu kalın bağırsağa taşınır.
Sindirim önce midede, sonra ince bağırsağın lümeninde (kaviter sindirim) ve daha sonra paryetal sindirim - bağırsak epitelinin paryetal tabakasında gerçekleşir.
Ağız boşluğunda, yiyeceklerin mekanik olarak öğütülmesi meydana gelir. Midedeki yiyecek bolusu hidroklorik aside maruz kalırken, mide peptit hidrolazlarının - pepsin ve gastriksin - etkisi için yüzeyi şişer ve arttırır.
(Çoğunlukla sincaplar pankreas peptid hidrolazlarının (tripsin, kimotripsin, elastaz, karboksipeptidaz) ve bağırsakların (aminopeptidaz, dipeptidaz, tripeptidaz) etkisi altında bağırsakta sindirilir. Endopeptidazların (gastrik peptidazlar, tripsin, kimotripsin, elastaz) etkisi altında proteinler polipeptidlere ayrışır; ekzopeptidazların (karboksipeptidaz, aminopeptidaz, di- ve tripeptidazlar) etkisi altında polipeptitler amino asitlere ayrışır.
Çürüme sırasında amino asitlerin yok edilmesi 2 şekilde olabilir: 1) dekarboksilasyon; 2) yan zincir oksidasyonu.
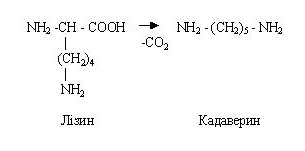
Amino asitler, karşılık gelen aminleri oluşturmak için dekarboksilatlanır. AT kalın bağırsak diaminomonokarboksilik amino asitler genellikle dekarboksillenir, örneğin ornitinin dekarboksilasyonu putresin üretir ve lizinin dekarboksilasyonu kadaverin - bilinmesi gereken reaksiyonları üretir.
Putresin ve kadaverin de cesetlerin ayrışması sırasında oluşur, bu nedenle başlangıçta kadavra zehirleri olarak adlandırıldılar. Daha sonra, bu maddelerin zehirli olmadığı ve önceden nötralizasyon olmadan atılabileceği ortaya çıktı. Bağırsakta, bu aminler idrarla atılan az miktarda oluşur.
Çürümenin ikinci yolu, amino asitlerin yan zincirinin oksidasyonudur. Bu şekilde, esas olarak siklik amino asitler - tirozin ve triptofan - çürür. Böylece, tir yan zincirinin oksidasyonu sırasında kresol ve fenol, tri yan zincirin oksidasyonu sırasında indol ve skatol oluşur. Bu bileşiklere bağırsak zehirleri denir.)
SİNDİRİM YOLUNDA PROTEİN SİNDİRİMİ. Besinlerin (proteinler, karbonhidratlar, lipitler) sindirimi, gıda ürünlerini oluşturan ilgili bileşiklerin hidroliz işlemidir, bitkisel kanalda meydana gelir ve özel membran mekanizmalarının etkisiyle basit biyomoleküllerin oluşumuna yol açar. taşınır, kan veya lenf içine emilir.
Proteinlerin sindirimi mide suyunun etkisi altında midede başlar. Mide mukozasının obkladovye hücreleri tarafından üretilen hidroklorik asit içerir. Daha sonraki bölünmesini kolaylaştıran proteini denatüre eder. Mide suyunun bileşimi asit fosfatları ve bazı organik asitleri içerir. Klorik asit, mide mukozasının ana hücreleri tarafından salgılanan proenzim pepsinojenin aktif proteolitik enzim pepsine dönüşümünü destekler.
Pepsin için hidrojen iyonlarının optimal konsantrasyonu, sindirim sırasında mide suyunun asitliğine karşılık gelen 1.5...2.5'tir. Ortamın pH'ında 6.0'a (bağırsakta) bir artış ile pepsin aktivitesini kaybeder. Pepsin, tek bileşenli enzimleri, yani protein enzimlerini ifade eder. Midede günde yaklaşık 2 g pepsin üretilir. Pepsinin midedeki katalitik aktivitesi çok yüksektir. Bozulmayı katalize eder peptid bağları aromatik ve dikarboksilik amino asitlerin amino gruplarından oluşan bir protein molekülünde. Pepsinin etkisinin bir sonucu olarak, çeşitli boyutlarda polipeptitler ve bireysel serbest amino asitler oluşur.
Pepsine ek olarak, mide suyu, optimal pH değerleri 3.5...4.5 aralığında olan proteolitik enzim gastriksin içerir. Gastriksin, midede besinlerin sindiriminin son aşamalarında devreye girer.
Rennet, kimozin, bebeklerin midesinde bulundu. Bu enzimin optimum etkisi pH 3.5...4.0'dır. Kalsiyum tuzlarının varlığında kimozinin etkisi altında, hidroliz sırasında süt kazeinojeni kazeine dönüşür ve süt pıhtılaşır.
Midede diğerlerinden daha kolay sindirilen albüminler ve hayvansal ve bitkisel kaynaklı globulinler; bağ dokusu proteinleri (kollajen ve elastin) zayıf bir şekilde bölünür ve keratin ve protamin hiç bölünmez.
Midede (kime) oluşan kısmen sindirilmiş yarı sıvı besin bileşikleri kütlesi periyodik olarak pilorik kapaktan içeri girer. on iki parmak bağırsağı. Sindirim kanalının bu kısmı, mideden gelen peptitler üzerinde etkili olan pankreastan proteolitik enzimler ve peptidazlar alır. Bu enzimlerin katalitik etkisi, bağırsak suyunda bulunan bikarbonatların oluşturduğu hafif alkali bir ortamda (pH 7.5 ... 8.0) meydana gelir. İnce bağırsakta görev yapan proteolitik enzimlerin çoğu, pankreasın ekzokrin hücrelerinde, duodenuma girdikten sonra aktive olan proenzimler (tripsinojen, kimotripsinojen, proelastaz, prokarboksipeptidaz A ve B) şeklinde sentezlenir. Mideden gelen proteinlerin ve peptitlerin hidrolizi hem ince bağırsağın boşluğunda hem de enterositlerin yüzeyinde meydana gelir - parietal veya membran sindirimi.
Pankreas suyu on iki parmak bağırsağına girer ve bağırsak suyuyla karışır. Bu karışım, proteinleri, albümoziyi ve peptonları küçük peptitlere ve ardından amino asitlere parçalayan proteolitik enzimler içerir. Proteolitik enzimler, tripsin, kimotripsin, karboksipeptidazlar, aminopeptidazlar ve büyük bir tri- ve dipeptidaz grubunu içerir.
Tripsin, pankreas suyunda proenzim tripsinojen formunda aktif olmayan bir formda bulunur. Bir enzimin etkisiyle aktive olur. bağırsak suyu- enterokinazlar. Aktivasyon süreci Ca2+ iyonlarını gerektirir. Tripsinojeni tripsine dönüştürme işlemi, enzimin peptid zincirinin N-terminalinden küçük bir peptidin ayrılmasıyla gerçekleştirilir.
Tripsin, hem midedeki sindirilmemiş proteinleri hem de yüksek moleküler ağırlıklı peptitleri hidrolize eder, esas olarak arginin ve lizin arasındaki peptit bağları üzerinde hareket eder. Tripsin için optimum pH 7.0...8.0'dır. Tripsin, nispeten sığ bir protein hidrolizi yapar, polipeptitler ve az miktarda serbest amino asit oluşturur.
Tripsin aktivitesi, bir dizi inhibitörün etkisi altında azaltılabilir. Bunlar, moleküler ağırlığı 9000 Da olan bazik peptitleri içerir. Pankreas, kan, akciğerler, soya fasulyesinde bulunurlar. İçeriğinde bulunan tripsin ve mukoproteinin aktivitesini azaltır. çiğ yumurta- avidin.
Kimotripsin pankreasın ikinci proteolitik enzimidir. Kimotripsinojen olarak inaktif formda da salgılanır. Tripsin etkisi altında, kimotripsinojen aktif bir enzim olan kimotripsin'e dönüştürülür. Kimotripsinin etkisi tripsininkine benzer. Her iki enzim için optimum pH yaklaşık olarak aynıdır; kimotripsin, aromatik amino asitler (tirozin, fenilalanin, triptofan) içeren proteinler ve polipeptitler üzerinde ve ayrıca tripsinden (metionin, lösin) etkilenmeyen peptit bağları üzerinde etkilidir.
Pepsin, tripsin ve kimotripsinin alt kısımlardaki proteinler üzerindeki etkisi sonucu oluşan peptitler ince bağırsak, daha fazla bölünmeye tabi tutulur. Bu işlem karboksipeptidazlar, aminopeptidazlar tarafından gerçekleştirilir. Bu enzimler metalloenzimler olarak sınıflandırılır. Enzim-substrat kompleksinin oluşumunda önemli bir rol oynayan iki değerli iyonlar: Mg2+, Mn2+, Co2+ tarafından aktive edilirler.
Amino ve karboksipeptidazların etki mekanizması, serbest bir amino veya karboksil grubuna sahip amino asitlerin terminal peptitlerinden ayrılmaya dayanır. Küçük peptitler temizlenmemiş ve üç ila dört amino asit kalıntısından oluşur, spesifik di- ve triaminopeptidazlar tarafından hidrolize edilir. Pankreas suyunda elastaz enzimi bulunur.
Elastaz, aynı zamanda, küçük amino asit kalıntıları - glisin, alanin, serin tarafından oluşturulan peptit bağlarını parçalayan geniş bir substrat spesifikliğine sahip bir endopeptidazdır.
Böylece, proteolitik enzimlerin proteinler üzerindeki ardışık etkisinin bir sonucu olarak, bağırsakta, bağırsak duvarından kana emilen serbest amino asitler oluşur.
Kalın bağırsakta toksik ürünlerin oluşumu, karaciğerde sülfürik ve glukuronik asitlerin yardımıyla nötralizasyonu.
İnce bağırsağın mukoza zarından kana emilmeyen amino asitler, kalın bağırsakta mikroorganizmalara maruz kalır. Aynı zamanda, mikroorganizmaların enzimleri amino asitleri parçalar ve bunları aminlere, yağ asitlerine, alkollere, fenollere ve genellikle vücut için toksik olan diğer maddelere dönüştürür. Bu süreç bazen bağırsakta protein çürümesi olarak adlandırılır. Amino asitlerin dekarboksilasyonuna dayanırken, biyolojik aminler amino asitlerden ortaya çıkar. Böylece, ornitin amino asidinden putresin oluşur:
Lisinden kadaverin oluşur:
Putresin ve kadaverin vücuttan fekal madde ile atılır. Bu bileşikler kan dolaşımına girdiklerinde, idrarla değişmeden atılırlar.
Kresol, tirozinden oluşur ve işlem daha da ileri giderse fenol:

Triptofan, skatole ve indole dönüştürülür:

Kükürt içeren amino asitlerin - sistin, sistein ve metionin - bağırsak mikroorganizmaları tarafından derin yok edilmesiyle, hidrojen sülfür (H2S), merkaptan (CH3SH) ve diğer kükürt içeren bileşikler oluşur.
Protein bozunma ürünleri venöz kana emilir, daha sonra karaciğere girer ve burada sülfürik veya glukuronik asit ile nötralize edilir.
Bu işlem aşağıdaki şemaya göre gerçekleştirilir:


İndol ve skatol ayrıca karaciğerde sülfürik ve glukuronik asitlerin katılımıyla nötralize edilir. Bununla birlikte, önceden oksitlenirler: skatole skatoksile, indolden indoksile ve çift asitler şeklinde idrarla vücuttan atılır.

Fenilalaninden oluşan benzoik asit gibi bazı toksik maddeler glisin yardımıyla karaciğerde nötralize edilir. Bu, idrarla atılan zararsız bir bileşik olan hipopurik asit üretir.

Karaciğerin kalın bağırsakta oluşan ve kana emilen toksik maddeleri nötralize etme imkanları sınırsız değildir. İşlevsel kabiliyetinde bir azalma ile (örneğin, önceki hastalıklar nedeniyle), önemli miktarda toksik madde alımı aşırı yük olabilir, daha sonra nötralize edilmemiş toksik maddelerin bir kısmı yayılır (büyük ölçüde). kan dolaşımı çemberi) vücutta zehirlenmeye neden olur. Hücrelerin erken yaşlanması ve ölümü gerçekleşir. Aynı zamanda, bir kişinin refahında bir bozulma olduğu not edilir, baş ağrıları tarafından işkence görür.
Toksik maddelerin vücut üzerindeki olumsuz etkilerini önlemek için rasyonel planlama yapmak gerekir. diyet. Sadece proteinleri değil, aynı zamanda yağları ve karbonhidratları, faydalı fermente süt ürünlerini de içermelidir, çünkü laktik asit bakterileri kolondaki paslandırıcı mikroorganizmaların ölümünü hızlandırmaya yardımcı olur. Diyet, bağırsağın motor aktivitesini artırarak toksinlerin (toksik maddeler dahil) vücuttan atılmasına katkıda bulunan bir pektin ve lif kaynağıdır.
Hücre içi protein metabolizması: deaminasyon, dekarboksilasyon, transaminasyon.
Proteinlerden bağırsaklarda oluşan amino asitlerin ana kısmı kana (% 95) ve küçük bir kısmı - lenf içine girer. Portal damar yoluyla, amino asitler karaciğere girer, burada çeşitli spesifik proteinlerin (albümin, globulinler, fibrinojen) biyosentezi için harcanırlar, diğer amino asitler kan dolaşımı tarafından tüm organlara ve dokulara taşınır, hücrelere taşınır. protein biyosentezi için kullanılırlar. Kullanılmayan amino asitler, metabolizmanın son ürünlerine oksitlenir.
Doku proteinlerinin parçalanma süreci, doku enzimleri - katepsin proteinazları tarafından katalize edilir.
Proteinlerde parçalanan ve sentezlenen amino asitlerin oranı farklıdır, bu nedenle serbest amino asitlerin bir kısmının başka amino asitlere dönüştürülmesi veya basit bileşiklere oksitlenmesi ve vücuttan atılması gerekir. Bu nedenle, vücutta amino asitlerin birbirine dönüştürülmesi, proteinlerin hidrolizi, amino asitlerin sentezi ve hücre dışı sıvıdan girişleri nedeniyle büyük ölçüde yenilenen hücre içi bir amino asit kaynağı vardır. Aynı zamanda, proteinlerin sentezi ve diğer reaksiyonlar (üre oluşumu, pürinler vb.) nedeniyle, serbest amino asitler hücre dışı sıvıdan sürekli olarak çıkarılır.
amino asitlerin deaminasyonu. Deaminasyonun özü, enzimlerin etkisi altında amino asitlerin amonyak ve nitrojen içermeyen bir kalıntıya (yağ asitleri, hidroksi asitler, keto asitler) parçalanmasıdır. Deaminasyon indirgeyici, hidrolitik, oksidatif ve molekül içi süreçler şeklinde olabilir. Son iki tip insanlarda ve hayvanlarda baskındır.
Oksidatif deaminasyon iki aşamaya ayrılır. İlk aşama enzimatiktir, kararsız bir ara ürün oluşumu ile sona erer - ikinci aşamada su varlığında kendiliğinden amonyak ve a-keto aside ayrışan imino asit. Bu süreci katalize eden enzimler, prostetik gruplar olarak ya NAD ya da FAD içerir.
İnsan vücudunda, glutamik asidin en aktif deaminasyonu, tüm dokuların hücrelerinin mitokondrilerinde bulunan glutamat dehidrojenaz enziminin etkisi altında gerçekleşir. Bu işlem sonucunda birçok metabolik süreçte yer alan -ketoglutarik asit oluşturur.
Amino asitlerin transaminasyonu (transaminasyonu). Transaminasyon için bir ön koşul, dikarboksilik amino asitlerin (glutamik ve aspartik), karşılık gelen keto asitleri biçiminde katılımıdır - -ketoglutarik ve oksalik asit, lizin, treonin ve arginin hariç tüm amino asitlerle etkileşime girebilir.
Reaminasyon sırasında, amino grubunun amino asitten keto aside doğrudan transferi vardır ve keto grupları - amino asitli keto asitler, amonyak salınmadan serbest bırakılır.
Bu süreç birkaç aşamada gerçekleşir. Genel olarak, reaksiyon şöyle görünür:

Reaksiyon, transferaz sınıfına ait enzimler tarafından katalize edilir, prostetik grupları, B6 vitamininin fosfor esteri olan fosforpiridoksaldır.
Transaminasyon süreci doğada yaygındır. Özelliği kolay tersinirliktir.
Transaminasyon reaksiyonları metabolizmada önemli bir rol oynar. Bunlar, amino asit alaninin glikoz parçalanma ürünlerinden oluşturulabildiği zaman, karşılık gelen keto asitlerinden birçok esansiyel amino asidin biyosentezi, amino asitlerin parçalanması, karbonhidrat ve amino asit metabolizması yollarının birleşmesi gibi önemli süreçlere bağlıdırlar. örneğin, piruvik asit ve bunun tersi.
Vidbudovne aminasyonu. Bu süreç deaming işleminin tersidir. Karşılık gelen amino asitlerin oluşumu ile amonyak keto asitlerin bağlanmasını sağlar.
Vidbudovne aminasyonu, glutamik veya aspartik asit oluşumu ile a-ketoglutarik veya oksalo-oküler asidin aminasyonunu sağlayan iyi işleyen bir enzim sistemi tarafından katalize edilir.

Amonyağı inorganik ve organik asitlerle nötralize ederken, amonyum tuzlarının oluşumu meydana gelir. Bu işlem böbreklerde gerçekleştirilir. Oluşan amonyum tuzları vücuttan idrar ve ter ile atılır.
amino asitlerin dekarboksilasyonu. Dekarboksilasyon işlemi, prostetik grubu piridoksal fosfat olan her amino aside özgü dekarboksilazlar tarafından katalize edilir. Bu enzimler liyaz sınıfına aittir. Amin oluşumu ile amino asitlerden CO2'nin çıkarılmasından oluşan dekarboksilasyon işlemi aşağıdaki şemada gösterilebilir:

Amino asitlerin dekarboksilasyon reaksiyonunun mekanizması genel teori piridoksal kataliz, enzimin aktif bölgesinde piridoksal fosfat-substrat kompleksinin oluşumuna indirgenir.
Bu şekilde triptofandan triptamin, hidroksitriptofandan serotonin oluşur. Histamin, amino asit histidinden oluşur. Dekarboksilasyon sırasında glutamik asitten -aminobütirik asit (GABA) oluşur.
Amino asitlerden oluşan aminler, vücut üzerinde güçlü bir biyolojik etkiye sahip oldukları için biyojenik aminler olarak adlandırılır.
Biyojenik aminler çok düşük konsantrasyonlarda fizyolojik etkiler gösterirler. Böylece, histaminin vücuda girmesi, kılcal damarların genişlemesine ve geçirgenliklerinde bir artışa, daralmaya yol açar. büyük gemiler, çeşitli organ ve dokuların düz kaslarının kasılması, midede hidroklorik asit salgısının artması. Ek olarak, histamin, sinir uyarımının iletilmesinde rol oynar.
Serotonin kan basıncını arttırır ve bronşları daraltır; küçük dozları merkezi sinir sisteminin aktivitesini engeller, büyük dozlarda bu maddenin uyarıcı bir etkisi vardır. Vücudun çeşitli dokularında, büyük miktarlarda histamin ve serotonin, bağlı, inaktif formdadır. Sadece serbest formda biyolojik etki gösterirler.
-aminobütirik asit (GABA) beyin dokusunda birikir ve merkezi sinir sisteminin inhibisyonunun nörohumoral inhibitörü-mediatörüdür.
Bu bileşiklerin yüksek konsantrasyonları vücudun normal işleyişi için bir tehdit oluşturabilir. Bununla birlikte, amin oksidaz, aminleri karşılık gelen aldehitlere parçalayan, daha sonra yağ asitlerine dönüştürülen ve nihai ürünlere ayrışan hayvan dokularında bulunur.
Amonyağın nötralizasyonu.

Amino asitlerin dokularda dönüşüm sürecinde, son metabolizma ürünleri oluşur - karbon monoksit, su ve amonyak. Su, vücut tarafından biyokimyasal süreçleri sağlamak için kullanılır. Karbon monoksit kısmen solunan hava ile vücuttan atılır, diğer kısmı sentez işlemlerinde (örneğin yağ asitleri, pürin bazlarının sentezinde vb.) kullanılır. Amino asitlerin deaminasyonu sonucu oluşan amonyak toksik bir maddedir, kanda ve diğer dokularda konsantrasyonunun artması özellikle vücut üzerinde olumsuz etki yapar. gergin sistem. Amonyağın toksisitesi, mitokondride -ketoglutarik asidin amino asit metabolizasyonunu teşvik etmesinden kaynaklanmaktadır. Bu, Krebs döngüsünden çıkarılmasına ve sonuç olarak doku solunumunda bir düşüşe ve asetil-CoA'dan aşırı keton cisimleri oluşumuna yol açar.
Evrim sürecinde, canlı organizmalar amonyağın toksik etkilerini nötralize etmek için çeşitli etkili mekanizmalar geliştirmiştir, bunların başlıcaları şunlardır: glutamin veya asparagin aminlerinin oluşumu, aminasyon, asit nötralizasyonu, üre sentezi.
Glutamin veya asparagin sentezi vücut için büyük önem taşır. Amonyağın doğrudan oluştuğu yerlerde (örneğin karaciğerde, beyinde) oluşur ve bu süreci katalize eden enzim olan glutamin sentetaz da ligas sınıfına ait olan orada bulunur. Amitlerin sentezi, enerjinin ATP formunda verilmesini, glutamik veya aspartik asitlerin varlığını, serbest amonyak ve uygun spesifik enzimleri gerektirir. Amit sentezi reaksiyonu, ATP'nin parçalanması ile ilişkilidir.

Böylece, bir amonyak molekülü sitrüline sabitlenir.

İkinci aşama. Bir amonyak molekülü daha α-ketoglutarik asit ile indirgeyici aminasyon yoluyla glutamik aside bağlanır. Glutamik asit, bir NH2 grubu formundaki sabit amonyak molekülünü aspartik aside dönüştürülen oksalo-ocial aside aktarır (transaminasyon işlemi):

Üçüncü sahne. Bu aşamada üre sentezi gerçekleştirilir. Aspartik asidin amino grubu ile etkileşime giren sitrülin, argininoburstinik asit (arginin süksinat) oluşturur.
Bu işlem, başka bir ATP molekülünün enerjisini kullanır.

Argininoburstynic asit, arginin ve fumarik aside bölünür. Fumarik asit, karbonhidrat metabolizmasına dahil edilir ve dehidrojenasyon yoluyla oksalik aside dönüşen malik aside dönüşür.

Oksalik asit, amonyağı kendisine bağlayabilir ve tekrar aspartik aside veya dekarboksilasyona uğrayarak pirüvik aside ve daha sonra çeşitli biyosentez reaksiyonlarında kullanılan veya CO2 ve H2O'ya oksitlenen koenzim A'ya dönüşebilir.
Arginazın etkisi altında oluşan arginin, hidrolitik olarak ornitin ve üreye ayrılır. Salınan ornitin yeni bir karbomoil fosfat molekülü ile tekrar reaksiyona girebilir ve süreç tekrar edecektir.
Azot dengesi durumunda, bir yetişkinin vücudunun 15 g azot tükettiği ve buna göre serbest bıraktığı tahmin edilmektedir; idrarda atılan nitrojen, üre yaklaşık% 85, kreatinin -% 5, amonyum tuzları - 3, ürik asit - 1 ve diğer formları - 6.

