الأس الهيدروجيني لحمض اللبنيك للمحاليل المائية. حمض اللاكتيك (2-هيدروكسي بروبيونيك أسيد)
حمض اللاكتيك(حمض 2-هيدروكسي بروبيونيك) CH 3 CH (OH) COOH ، الوزن الجزيئي 90.1 ؛ بلورات عديمة اللون. المعروف D (+) - حمض اللاكتيك ، D (-) - حمض اللاكتيك (اللحم اللبني) والراسيمي. - تخمير حمض اللاكتيك. بالنسبة إلى D و L- و D-M.k. نقطة الانصهار ، على التوالي ، 18 درجة مئوية و 53 درجة مئوية ؛ نقطة الغليان ، على التوالي ، 85 درجة مئوية / 1 ملم زئبق. و 103 درجة مئوية / 2 مم زئبق ؛ لـ D-M.k. [أ] D 20 -2.26 (تركيز 1.24٪ في الماء). بالنسبة إلى D ، L-M. K. DH 0 arr - 682.45 كيلوجول / مول ؛ DH 0 رر 11.35 كيلوجول / مول ؛ اختبار DH 110.95 كيلوجول / مول (25 درجة مئوية) ، 65.73 كيلوجول / مول (150 درجة مئوية). بالنسبة لـ L-M.k. DH 0 محترق - 1344.8 كيلوجول / مول ؛ DH 0 arr -694.54 كيلوجول / مول ؛ DH 0 رر 16.87 كيلوجول / مول.
بسبب الرطوبة العالية لحمض اللاكتيك. عادة ما تستخدم مكثفها. محاليل مائية ، شراب ، عديم اللون. سوائل عديمة الرائحة. للحصول على المحاليل المائية LACTIC ACID. د 20 4 1.0959 (40٪) ، 1.1883 (80٪) ، 1.2246 (100٪) ؛ ن د 25 1.3718 (37.3٪) ، 1.4244 (88.6٪) ؛ ح 3.09 و 28.5 ميجا باسكال. ق (25 0 ج) ، على التوالي ، لحلول 45.48 و 85.32٪ ؛ ز 46.0. 10 -3 N / م (25 درجة مئوية) لمحلول 1 م ؛ ه 22 (17 درجة مئوية). حمض اللاكتيك قابل للذوبان في الماء ، الإيثانول ، ضعيف في البنزين ، الكلوروفورم وغيرها من مركبات الكربون الهالوكربونية ؛ pKa 3.862 (25 درجة مئوية) ؛ الرقم الهيدروجيني للمحاليل المائية 1.23 (37.3٪) ، 0.2 (84.0٪).
حمض اللاكتيك الأكسدة. عادة مصحوبة بالتحلل. تحت تأثير HNO 3 أو O 2 الهواء في وجود Cu أو Fe ، يتم تكوين HCOOH و CH 3 COOH و (COOH) 2 و CH 3 CHO و CO 2 وحمض البيروفيك. استعادة حمض اللاكتيك. يؤدي HI إلى حمض البروبيونيك ، ويؤدي تقليل وجود Re black إلى البروبيلين غليكول.
م إلى حمض أكريليك ، عند تسخينه باستخدام HBr يشكل حمض 2-بروموبروبيونيك ، عندما يتفاعل ملح الكالسيوم مع PCl 5 أو SOCl 2 -2-chloropropionyl chloride. في وجود يحدث الأسترة الذاتية للأحماض المعدنية LACTIC ACID. مع تكوين اللاكتون للصيغة I ، وكذلك البوليستر الخطي. عند تفاعل حمض اللاكتيك. مع الكحوليات ، تتشكل أحماض الهيدروكسي RCH 2 CH (OH) COOH ، وعند تفاعل الأملاح LACTIC ACID. بالكحول والإيثرات. تسمى أملاح وإسترات حمض اللاكتيك اللاكتات (انظر الجدول).
م. تشكلت نتيجة لذلك تخمير حمض اللاكتيك(عند تحمض الحليب ، مخلل الملفوف ، تخليل الخضار ، الجبن الناضج ، العلف الناتج) ؛ D-M.k. توجد في أنسجة الحيوانات والنباتات وكذلك في الكائنات الحية الدقيقة.
في الصناعة ، يتم الحصول على LACTIC ACID بالتحلل المائي لحمض 2-chloropropionic وأملاحه (100 درجة مئوية) أو لاكتونيتريل CH 3 CH (OH) CN (100 درجة مئوية ، H 2 SO 4) متبوعًا بتكوين الإسترات ، والعزل والتحلل المائي الذي يؤدي إلى المنتج جودة عالية. هناك طرق أخرى للحصول على حمض اللاكتيك: أكسدة البروبيلين بأكاسيد النيتروجين (15-20 درجة مئوية) تليها المعالجة بـ H 2 SO 4 ، تفاعل CH 3 CHO مع CO (200 درجة مئوية ، 20 ميجا باسكال).
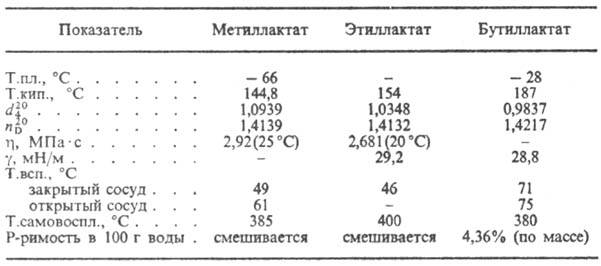
خصائص بعض اللاكتات
م. تستخدم في صناعة المواد الغذائية ، في صباغة البقع ، في صناعة الجلود ، في محلات التخمير كعامل مبيد للجراثيم ، للحصول على ليك. الأربعاء ، الملدنات. يتم استخدام لاكتات الإيثيل والبوتيل كمذيبات لإيثرات السليلوز وزيوت التجفيف والنمو. زيوت؛ لاكتات البوتيل - أيضًا كمذيب لبعض المواد التركيبية. البوليمرات.
حمض اللاكتيك الإنتاج العالمي. 40 ألف طن (1983).
موسوعة كيميائية. المجلد 3 >>
يتم تجميع التسمية المنطقية للإنزيمات عن طريق إضافة إلى الجذر اللاتيني لاسم الركيزة التي يعمل الإنزيم عليها ، أو إلى اسم العملية التي يحفزها الإنزيم ، النهاية "aza".
على سبيل المثال ، يسمى الإنزيم الذي يعمل على النشا (amylum) الأميليز. اليوريا (اليوريا) - اليوريا. الفينولات - الفينولاز ، إلخ.
بالإضافة إلى الاسم المنطقي ، تم الحفاظ على المصطلحات التي ظهرت سابقًا: البيبسين ، التربسين.
في عام 1961 ، جديد التصنيف الدولي، بناءً على نوع التفاعل المحفز.
حاليًا ، هناك حوالي 3000 إنزيم مختلف معروف. يتم تصنيفها حسب نوع عملها. هناك 6 أصناف من الإنزيمات:
1 .أوكسيدوروكتاز - الأكسدة والاختزال
الإنزيمات. تحفيز الأكسدة البيولوجية.
2.المحولات - تحفيز تفاعلات النقل المختلفة المجموعات الكيميائيةمن جزيء (مانح) إلى جزيء آخر (متقبل).
3. هيدروليسات - إجراء تحولات كيميائية للمواد بمشاركة جزيء الماء.
4. لياس - تشق مجموعة أو أخرى من الركائز بوسائل غير متحللة بالماء.
5. الايزوميراز - إجراء التحولات الأيزومرية للمركبات.
6. Ligases (التركيبات) - تحفيز التفاعلات التخليقية المصحوبة بإزالة حامض الفوسفوريك من ATP أو ثلاثي فوسفات آخر.
أنا صنف. أوكسيدوروكتازهي إنزيمات من تفاعلات الأكسدة والاختزال التي تكمن وراءها الأكسدة البيولوجية. يتم تجميع اسم الإنزيمات بالشكل التالي: اسم الركيزة (المتبرع) التي تنفصل منها ذرات الهيدروجين (الإلكترونات) ، واسم المستقبل الذي تنتقل إليه ذرات الهيدروجين وينتهي بالاسم "أوكسيدوروكتاز": على سبيل المثال ، اللاكتات: NAD-oxidoreductase.
يتم تمييز الفئات الفرعية التالية:
1) نازعات الهيدروجين الهوائية التي تنقل الإلكترونات وبروتونات الهيدروجين من ركيزة مؤكسدة إلى أكسجين:
H 2 S + O 2 S مؤكسد + H 2 O 2
كبريتيد الهيدروجين
وتشمل هذه إنزيمات أوكسيديز ؛
2) نازعات الهيدروجين اللاهوائية تنقل إلكترونات وبروتونات الهيدروجين من المؤكسد إلى ركيزة أخرى. وتشمل هذه نازعات الهيدروجين المعتمدة على البيريدين والفلافين. على سبيل المثال ، تحدث أكسدة حمض اللاكتيك تحت تأثير نازعة هيدروجين اللاكتات ، بينما يتم تقليل NAD إلى NADH 2:

حمض اللاكتيك حمض البيروفيك
تحدث أكسدة حمض السكسينيك تحت تأثير نازعة هيدروجين السكسينات ، بينما يتم تقليل FAD إلى FADH 2.

حمض السكسينيك حمض الفوماريك
3) ناقلات الإلكترون - ناقلات الإلكترون. وتشمل هذه إنزيمات السيتوكروم وأكسيدات السيتوكروم في السلسلة التنفسية للميتوكوندريا
4) البيروكسيداز والكتلاز. يحفز البيروكسيداز أكسدة الركيزة باستخدام بيروكسيد الهيدروجين. على سبيل المثال ، تحت تأثير البيروكسيداز ، يتأكسد كبريتيد الهيدروجين بمشاركة بيروكسيد الهيدروجين:
H 2 S + H 2 O 2 S يتأكسد + 2H 2 O
يحلل الكاتلاز في الحيوانات بيروكسيد الهيدروجين إلى ماء وأكسجين جزيئي:
2 س 2 س 2 2 س 2 س + س 2
الكاتلاز يحيد تأثير البيروكسيد وهو مصدر للأكسجين الجزيئي في الأنسجة.
الدرجة الثانية. المحولات- تحفز تفاعلات نقل الذرات ومجموعات الذرات ، وتشمل الفئات الفرعية التالية:
1) الأمينوفيراز هي إنزيمات تنقل المجموعات الأمينية من مادة إلى أخرى. الإنزيم المساعد هو أحد مشتقات فيتامين ب 6 (البيريدوكسين): على سبيل المثال ، يتبرع حمض الجلوتاميك بمجموعة أمينية إلى البيروفات ، ونتيجة لذلك ، يتم تصنيع الألانين وتشكيل حمض الكيتوجلوتاريك.

الجلوتامين بيروفات α - كيتوجلوتاريك ألانين
حمض
Pyridoxine ، الإنزيم الذي يقوم بهذا التفاعل ، يسمى 1-glutamyl: pyruvate aminotransferase أو ، وفقًا للتسمية القديمة ، aminoferase.
2) Acyltransferases - تسريع نقل الأسيل (بقايا حمض الكربوكسيل) إلى الأحماض الأمينية والكحولات والمركبات الأخرى. على سبيل المثال ، يتم تصنيع الأسيتيل كولين بمشاركة إنزيم الكولين أسيتيل ترانسفيراز:

3) فسفوتانسفيرازات - إنزيمات تسرع من تفاعل نقل بقايا حمض الفوسفوريك. المانح الأكثر شيوعًا لبقايا الفوسفات هو ATP. على سبيل المثال ، يعمل هيكسوكيناز على تسريع نقل بقايا حمض الفوسفوريك إلى الجلوكوز:

α-D- جلوكوز-6-فوسفات
4) Methylferases - الإنزيمات التي تنقل مجموعة الميثيل من مركب إلى آخر: على سبيل المثال ، في تخليق الكرياتين ، الميثيونين هو متبرع لمجموعة الميثيل.
5) Glucosyltransferases - ناقلات الجلوكوزيد
بقايا الطعام:
11 (C 6 H 12 O 6) + UDP - الجلوكوز (n + 1) (C 6 H 12 O 6) + UDP
وتشمل هذه المواد التركيبية الجليكوجين ، الجلوكوزيل ترانسفيراز ، فسفوريبوزيل ترانسفيراز ، إلخ.
6) Alkyltransferases - ناقلات بقايا الكحول. وتشمل هذه الكولين ترانسفيراز ، فوسفاتيل إيثانول أمين ترانسفيراز ، إلخ.
الدرجة الثالثة.هيدروليسات- كسر الروابط الجزيئية عن طريق إضافة عناصر من الماء:
R - R 1 + HOH R - H + R 1 - OH
وتشمل هذه الفئات الفرعية التالية:
1) استرات - إنزيمات تعمل على تحلل روابط الإستر وفقًا للمخطط:
R 1 -0-R 2 + HOH R 1 -H + R 2 -OH
على سبيل المثال ، phosphodiesterases - تحلل استرات الفوسفور:
دياسيل جلسرين 3 - حمض الفوسفوريك + HOH دياسيل جلسرين + H 3 PO 4.
تشمل هذه الفئة الفرعية: الفوسفاتاز (الحمضي ، القلوي) ، الجلوكوز -6-الجلوكوز-1-الفوسفاتاز ، RNase ، إلخ.
كربوكسي استيراز - روابط استر التحلل المائي:

تريستارين الجلسرين دهني
تشمل هذه الإنزيمات الليباز ، الليسيثيناز ، الإسترات البسيطة ، إلخ.
الكبريتات - تحلل استرات الكبريتات وفقًا للمخطط التالي:
حمض الفينول حامض الكبريتيك الفينول حامض الكبريتيك
2) Glycosidases - التحلل المائي للروابط الجليكوسيدية ، وتشمل α- و-amylases ، maltase ، lactase ، sucrase.
3) الببتيدات. هناك endopeptidases - بيبسين ، التربسين ، كيموتريبسين ؛ exopeptidases - aminopeptidase ، carboxypeptidase ، dipeptidases ، tripeptidases.
تحلل البيبتيديز السندات الببتيدمن خلال رد الفعل التالي:
![]()
ألانيلالانين ألانين
نتيجة للتحلل المائي ، يتم تكوين جزيئين من الألانين.
4) الأميدازات - الإنزيمات التي تحلل روابط الأميد لقواعد البيورين والبيريميدين ، أميدات الأحماض الأمينية و
أرجينين. أمثلة:
أ) Adenine + H 2 O hypoxanthine + NH 3
ديميناز البيورين

الجلوتامين الجلوتامين

أرجينين اليوريا أورنيثين
5) Polyphosphatases - تحلل روابط أنهيدريد الفوسفوريك:
ATP + H 2 O ADP + H 3 PO 4
تتضمن هذه المجموعة Na + و K + و Mg 2+ -ATPase وما إلى ذلك.
الدرجة الرابعة. Lyases هي إنزيمات تشق الروابط دون مشاركة الماء ، أثناء الانكسار اتصالات C-C، سندات C-N ، اتصالات C-O. وتشمل هذه إنزيمات الألدولاز ، ديكاربوكسيلاز وغيرها. على سبيل المثال ، يكسر Aldolase روابط C-C لهكسوز (1،6-diphosphofructose) لتشكيل مجموعتين من الفوسفوديوكسي أسيتون و phosphoglyceraldehyde:

فئة V. Isomerases: تحفيز الأيزومرة ، أي التحول الأيزومري للجزيئات ، مثل الجلوكوز إلى الفركتوز. تغير الطفرات موقع مجموعات أو ذرات مختلفة في الجزيء. وتشمل هذه: فسفوغليسيروموتاز ، فسفوغلوكوموتاز ، فسفوفركتوموتاز ، إلخ. على سبيل المثال ، يتم تحويل فوسفوديوكسي أسيتون بواسطة أيزوميراز إلى فسفوغليسيرالديهيد:

phosphodioxyacetone phosphoglyceraldehyde
الدرجة السادسة. Ligases (synthetases) هي إنزيمات تحفز ارتباط الجزيئات ببعضها البعض. علي سبيل المثال:
الأحماض الأمينية + الحمض الأميني tRNA aminoacyl-tRNA
وتشمل هذه الإنزيمات: بوليميرات الحمض النووي ، بوليميرات الحمض النووي الريبي ، والإنزيمات التي تحفز تخليق البروتين ، إلخ.
الكواشف:
حمض فثاليك
تقدم:
يتم وضع 0.1-0.2 جم من حمض أورثوفثاليك في أنبوب اختبار جاف ويتم تسخينه على شعلة مصباح كحول ، ممسكًا أنبوب الاختبار أفقيًا. يتشكل أنهيدريد فثاليك ، والذي يتصاعد ويتكثف مرة أخرى على الجدران الباردة لأنبوب الاختبار. يتم تبريد الأنبوب ، ثم يتم تسخين راسب أنهيدريد الفثاليك بعناية ، ويذوب بسهولة ويتدفق إلى أسفل الأنبوب.
تجربة رقم 56. الحصول على الفينول فثالين
الكواشف:
أنهيدريد الفثاليك
تقدم:
~ 0.2 جم من الفينول ، ~ 0.1 جم من أنهيدريد الفثاليك ، ~ 5 قطرات من حمض الكبريتيك المركز توضع في أنبوب اختبار جاف وتُسخن برفق على شعلة مصباح كحول. يذوب الخليط ، يتكثف الفينول مع أنهيدريد الفثاليك:

ثم يتم تبريد الأنبوب بالهواء. أضف نصف أنبوب اختبار من الماء إلى الخليط المبرد ورجه بقوة. يتم نقل المحلول الناتج إلى أنبوب اختبار آخر وتضاف بضع قطرات من المحلول القلوي. في البيئة القلوية ، يظهر لون أحمر قرمزي ، مما يشير إلى وجود الفينول فثالين في المحلول.
في بيئة قلوية ، تحدث أزمرة لإحدى نوى البنزين ، وتتشكل مجموعة كينويد ، مما يؤدي إلى ظهور اللون. عندما يتحمض المحلول ، يختفي اللون ؛ وعندما يضاف القلوي ، فإنه يظهر مرة أخرى. تُستخدم الخاصية المحددة للفينول فثالين في الكيمياء التحليلية كمؤشر (مؤشر) لتفاعل الوسط.
إذا أخذنا ريزورسينول (ثنائي هيدرو الفينول) بدلاً من الفينول ونجري التجربة بنفس الطريقة الموضحة أعلاه ، فسيتم تكوين الفلورسين. محلول الفلورسين في وسط قلوي له لون جميل ، أحمر في الضوء المنقول ، أخضر في الضوء المنعكس (التألق).
ثامنا. الهيدروكسيدات
تجربة رقم 57. كشف حمض اللاكتيك
الكواشف:
محلول 1٪ فينول
محلول 1٪ كلوريد الحديديك
حمض اللاكتيك
تقدم:
إلى حوالي 3 مل من محلول 1٪ من الفينول ، أضف بضع قطرات من محلول 1٪ من كلوريد الحديد (III). يتحول السائل إلى اللون الأرجواني الفاتح بسبب تكوين الفينولات الحديديك المعقدة. يتم إضافة بضع قطرات من حمض اللاكتيك إلى السائل الناتج ويتغير لون المحلول إلى الأصفر والأخضر بسبب تكوين لاكتات الحديد (CH 3 CH (OH) COO) 3 Fe.
تجربة رقم 58. تحلل حمض اللاكتيك عند تسخينه بحمض الكبريتيك المركز
الكواشف:
حمض اللاكتيك
حامض الكبريتيك المركز
تقدم:
يتم تسخين خليط من الأحجام المتساوية (~ 0.5 مل لكل منهما) من أحماض اللاكتيك والكبريتيك بعناية في أنبوب اختبار مع أنبوب مخرج الغاز. يشتعل أول أكسيد الكربون المنطلق (II) عند فتح أنبوب مخرج الغاز ، ويحترق بلهب مزرق.
- حمض ألفا هيدروكسي بروبيونيك (2-هيدروكسي بروبانويك) ، CH 3 CH (OH) COOH. حمض هيدروكسي كربوكسيلي أحادي القاعدة ؛ وسيط استقلابي مهم في الحيوانات والنباتات والكائنات الحية الدقيقة ؛ الحد من حمض أحادي الكربوكسيل من السلسلة اللا الحلقية

اكتشفه الكيميائي السويدي كارل شيل في عام 1780.
في عام 1807 ، عزل Jens Jakob Berzelius ملح الزنك لحمض اللبنيك من العضلات.
الوصف والخصائص
بلورات عديمة اللون ، قابلة للذوبان في الماء بسهولة ، الإيثانول ، ضعيفة - في البنزين ، الكلوروفورم. يوجد في شكلين نشطين بصريًا (-) - و (+) - ( ررر 25-26 درجة مئوية) وفي شكل راسيمي غير نشط (±) - شكل (ر ر 18 درجة مئوية).
تفاعلات

حمض اللاكتيك في الإنسان والحيوان
يتكون حمض اللاكتيك من انهيار الجلوكوز. يُشار إلى الجلوكوز أحيانًا باسم "سكر الدم" ، وهو المصدر الرئيسي للكربوهيدرات في أجسامنا. إنه الوقود الرئيسي للدماغ و الجهاز العصبيوكذلك العضلات أثناء التمرين. عندما يتم تكسير الجلوكوز ، تنتج الخلايا ATP (أدينوسين ثلاثي الفوسفات) ، والذي يوفر الطاقة لمعظم الناس تفاعلات كيميائيةفي الكائن الحي. يحدد مستوى ATP مدى سرعة ومدة انقباض عضلاتنا ومتى النشاط البدني. لا يتطلب إنتاج حمض اللاكتيك وجود الأكسجين ، ولهذا غالبًا ما يشار إلى هذه العملية باسم "التمثيل الغذائي اللاهوائي". يعتقد الكثير من الناس أن العضلات تنتج حمض اللاكتيك عندما لا تحصل على ما يكفي من الأكسجين من الدم. بعبارة أخرى ، أنت في حالة لاهوائية. ومع ذلك ، يدعي العلماء أن حمض اللاكتيك يتكون أيضًا في العضلات التي تتلقى ما يكفي من الأكسجين. تشير الزيادة في كمية حمض اللاكتيك في مجرى الدم فقط إلى أن مستوى تناوله يتجاوز مستوى الإزالة. لا يلعب الأكسجين دورًا مهمًا هنا. إن إنتاج ATP المعتمد على اللاكتات صغير جدًا ، ولكنه ذو معدل مرتفع. هذا الظرف يجعلها مثالية للاستخدام كوقود عندما تتجاوز الحمولة 50٪ من الحد الأقصى. أثناء الراحة والحمل دون الحد الأقصى (معتدل نوعًا ما ، عادةً ما يُفهم دون الحد الأقصى على أنه 90 ٪ من الحد الأقصى) ، يفضل الجسم تكسير الدهون للحصول على الطاقة. عند تحميل 50٪ من الحد الأقصى (حد الشدة لمعظم برامج التدريب) ، يتم إعادة بناء الجسم للاستهلاك التفضيلي للكربوهيدرات. كلما زادت الكربوهيدرات التي تستخدمها كوقود ، زادت المزيد من الإنتاجحمض اللاكتيك.
للسماح للجلوكوز بالمرور أغشية الخلاياإنها بحاجة إلى الأنسولين. يبلغ حجم جزيء حمض اللاكتيك نصف حجم جزيء الجلوكوز ، ولا يحتاج إلى دعم هرموني - يمر بسهولة عبر أغشية الخلايا بمفرده.
طلب.
يستخدم حمض اللاكتيك في صناعة المواد الغذائية ، في صباغة البقع ، في صناعة الجلود ، في محلات التخمير كعامل مبيد للجراثيم ، للحصول على الأدوية، الملدنات. تستخدم لاكتات الإيثيل والبوتيل كمذيبات لإيثرات السليلوز ، وزيت التجفيف ، الزيوت النباتية؛ لاكتات البوتيل - يستخدم أيضًا كمذيب لبعض البوليمرات الاصطناعية.
الإنتاج العالمي من حمض اللاكتيك - 40 ألف طن (1983).
 هاينريش أوتو ويلاند
هاينريش أوتو ويلاند
 أدولف يوهان فريدريش فيلهلم فون باير
أدولف يوهان فريدريش فيلهلم فون باير
 فريدريك بيرجيوس
فريدريك بيرجيوس  الخصائص العامةالمعادن. حدوثه في الطبيعة وانتشاره. طرق الحصول عليها وتنظيفها
الخصائص العامةالمعادن. حدوثه في الطبيعة وانتشاره. طرق الحصول عليها وتنظيفها
 الكروم كعنصر كيميائي
الكروم كعنصر كيميائي
صفحة 1
تؤدي أكسدة حمض اللاكتيك مع ثاني أكسيد الرصاص إلى إنتاج الأسيتالديهيد.
عندما يتأكسد حمض اللاكتيك بثاني كرومات البوتاسيوم في وجود حمض الكبريتيك ، يتشكل الأسيتالديهيد ، والذي يتم التقاطه بالتقطير باستخدام كاشف نيسلر. يشير لون الأخير فقط إلى احتمال وجود حمض اللاكتيك في العينة.
المهمة 10.7. تحدث أكسدة حمض اللاكتيك إلى حمض متعدد الدرجات (2-أوكسوبروبانويك) في الكائنات الحية كإحدى مراحل الذوبان البيولوجي للكربوهيدرات.
يمكن تصنيع حمض البيروفيك عن طريق أكسدة حمض اللاكتيك (انظر ثانية.
تُستخدم الطاقة المنبعثة أثناء أكسدة حمض اللاكتيك في العضلات لإعادة تخليق الجليكوجين.
مثال على هذا التفاعل هو أكسدة حمض اللاكتيك إلى حمض البيروفيك.
درسنا بالتفصيل تأثير حموضة الوسط وزيادة العامل المؤكسد أثناء أكسدة حمض اللاكتيك مع ثنائي كرومات البوتاسيوم.
إذا تم نقل العضلة المسمومة بمنتج نشاطها الحيوي إلى جو أكسجين ، فإن الصورة تتغير. تبدأ عمليتان: أكسدة حمض اللاكتيك ، مما يؤدي إلى إطلاق إضافي ومهم للغاية للطاقة ، وتخليق الجليكوجين. اتضح أن عمليات التحويل التدريجي للجليكوجين إلى جلوكوز ثم إلى حمض اللاكتيك يمكن عكسها في جميع مراحلها الأكثر أهمية. يمكن للآلة البيوكيميائية أن تعمل بشكل عكسي وتنتج المواد الخام مرة أخرى من المنتجات النهائية. ينتقل جزء من حمض اللاكتيك - المنتج النهائي لتحلل الجليكوجين (تحلل الجليكوجين) مرة أخرى إلى المادة الخام - الجليكوجين.
تعتمد الطريقة على قياس شدة لون المركب المتكون أثناء تفاعل سيتالديهيد ، والذي نشأ بسبب أكسدة حمض اللاكتيك مع باروكسيديفينيل.
على الرغم من أن السيتوكروم ب 2 يحفز تحلل الركائز الأخرى (a-hydroxy-n-butyrates ، a-hydroxy-m-caproates ، oc-hydroxyisocaproates) ، فإن تركيزها في الوسط البيولوجي أقل بعدة مرات من تركيز حمض اللاكتيك ، لذلك تأثير التداخل ضئيل بشكل مهم. عدد كبير من المستقلبات ذات الخصائص المختزلة ، على سبيل المثال حمض البوليك، الجلوتاثيون ، السيستين ، الأدرينالين ، فيتامين سي، p- ألانين ، تتأكسد إما [Fe (CN) 6] 3 ، أو على قطب بلاتيني ، ويضاف تيار الأكسدة الخاص بها إلى التيار المقابل لأكسدة حمض اللاكتيك. لذلك ، في وجود هذه المستقلبات ، من غير المرغوب فيه إجراء تحديد حمض اللاكتيك.
يوصف مثل هذا الجهاز من أجل التحديد الدقيق للثريونين باستخدام t-hydroxydiphenyl (انظر الفصل. تنتهي أكسدة حمض اللاكتيك إلى الأسيتالديهيد عند 50 حمامًا مائيًا لمدة 30 دقيقة. وخلال نفس الوقت ، يتم نفخ الأسيتالديهيد في 15 مل من HtaSCh القوي الذي يحتوي على فائض من n-oxydiphenyl. تم تنفيذ العملية بأكملها على النحو الموصوف في الفصل.
توضع الأنابيب التي تحتوي على المرشح في ماء مثلج وببطء ، قطرة قطرة ، أضف 1 مل من حامض الكبريتيك المركز. يجب اهتزاز أنابيب الاختبار برفق طوال الوقت والتأكد من عدم تسخين محتوياتها. لتسريع أكسدة حمض اللاكتيك ، يتم نقل كلا أنبوب الاختبار إلى حمام مغلي لمدة 4 دقائق ، ثم يتم تبريده بسرعة في ماء مثلج. بعد التبريد ، أضف 1-2 قطرات من محلول 0 1٪ من فيراترول لكل أنبوب ، ورجه برفق لعدة دقائق. في العينة التجريبية ، يتطور لون وردي فاتح ، حيث حدث تحلل السكر تحت تأثير إنزيمات الأنسجة العضلية. في العينة الضابطة ، كان اللون ورديًا قليلاً بسبب حمض اللاكتيك ، الذي كان موجودًا في لب العضلات قبل بدء التجربة.
أظهرت مجموعة لوريا أن ارتباط جزيئات بروتين كوليسين K و E1 بخلايا بكتيريا E-coli يترافق مع توقف تخليق الجزيئات الكبيرة: البروتينات والحمض النووي والحمض النووي الريبي والجليكوجين. النقل النشط لسكر الحليب (اللاكتوز) والجلوتامين ، أحماض أمينية مختلفةوأيونات البوتاسيوم والمغنيسيوم. في الوقت نفسه ، تستمر الخلية في تراكم الجلوكوز ، حيث يتم توفير النقل النشط مباشرة بواسطة طاقة أكسدة حمض اللاكتيك.
كما أنه أحد المنتجات الوسيطة في حمض اللاكتيك و التخمير الكحوليالكربوهيدرات. يمكن الحصول عليها عن طريق تفاعل كلوريد الأسيتيل مع سيانيد البوتاسيوم ، متبوعًا بالتحلل المائي للكيتونونتريل الناتج ، أو عن طريق أكسدة حمض اللاكتيك.
يتم التفاعل مع المرشحات في وجود حمض اللاكتيك. للقيام بذلك ، خذ 2 من أنابيب الاختبار النظيفة المرقمة: في أول - 10 قطرات من المرشح السيطرة العينة، في الثانية - 10 قطرات من عينة تجريبية ترشيح. يجب ألا ننسى أن ارتفاع درجة الحرارة يمكن أن يؤدي إلى تفحم حمض اللاكتيك. لتسريع أكسدة حمض اللاكتيك ، يتم نقل كلا أنبوب الاختبار إلى حمام مائي مغلي لمدة 4-5 دقائق ثم يتم تبريده بسرعة في ماء مثلج. أضف 3 قطرات من 0 2٪ محلول كحول من فيراترول أو جاياكول لكل أنبوب اختبار إلى السوائل المبردة.
