Как се получава млечна киселина? Млечна киселина (2-хидроксипропионова киселина). Голяма енциклопедия на нефта и газа
Рационалната номенклатура на ензимите се съставя, като към латинския корен на името на субстрата, върху който действа ензимът, или към името на процеса, катализиран от ензима, се добавя окончанието "аза".
Например, ензимът, който действа върху нишестето (амил), се нарича амилаза; урея (карбамид) - уреаза; феноли - фенолаза и др.
Енантиомерите по своята същност са трудни за идентифициране и разграничаване, тъй като техните физически и Химични свойствадо голяма степен идентични. За щастие, почти двестагодишното откритие на френския физик Жан-Батист Беат значително улесни тази задача. Това откритие показа, че десният и левият енантиомери на хирално съединение смущават равнинната поляризирана светлина по противоположни начини. Това смущение е уникално за хиралните молекули и се нарича оптична активност.
Плоскополяризираната светлина се създава чрез преминаване на обикновена светлина през поляризатор, който може да бъде толкова прост, колкото леща, взета от поляризатори. слънчеви очила. Такива устройства селективно предават само този компонент на светлинния лъч, който има вектори на електрическо и магнитно поле, осцилиращи в една и съща равнина. Равнината на поляризация може да се определи с инструмент, наречен поляриметър, както е показано на диаграмата по-долу.
В допълнение към рационалното наименование са запазени по-рано появили се термини: пепсин, трипсин.
През 1961 г. нов международна класификация, въз основа на вида на катализираната реакция.
В момента са известни около 3000 различни ензими. Те се класифицират според вида на тяхното действие. Има 6 класа ензими:
Монохроматичната светлина се поляризира от фиксиран поляризатор близо до източника на светлина. Държачът на кювета за проби е позициониран на една линия със светлинния лъч, последван от подвижен поляризатор и окуляр, през който може да се наблюдава интензитетът на светлината. В съвременните устройства електронен сензор за светлина заема мястото на човешкото око. При липса на проба, интензитетът на светлината в детектора е максимален, когато вторият поляризатор е поставен успоредно на първия поляризатор. Ако анализаторът се завърти на 90º спрямо оригиналната поляризационна равнина, цялата светлина ще бъде блокирана от достигане до детектора.
1 .Оксидоредуктаза – редокс
ензими; катализират биологичното окисление.
2.Трансферази - катализират реакции на трансфер на различни химични групиот една молекула (донор) към друга молекула (акцептор).
3. Хидролази - извършват химични трансформации на вещества с участието на водна молекула.
Химиците използват поляриметри, за да изследват ефектите на съединенията върху плоско поляризирана светлина. Пробите, състоящи се само от ахирални молекули, не влияят на поляризирания светлинен лъч. Въпреки това, ако се изследва един енантиомер, равнината на поляризация се върти или по посока на часовниковата стрелка, или обратно на часовниковата стрелка и анализаторът трябва да се завърти до подходящия подходящ ъгъл α, ако общият интензитет на светлината трябва да достигне детектора. На фигурата по-горе пробата завъртя равнината на поляризация по посока на часовниковата стрелка с 90º и анализаторът беше завъртян с тази стойност, за да се осигури максимално предаване на светлина.
4. Лиаза - отцепват една или друга група от субстратите по нехидролитичен път.
5. Изомерази - извършват изомерни трансформации на съединения.
6. Лигази (синтетази) - катализират реакции на синтез, придружени от елиминиране на фосфорна киселина от АТФ или друг трифосфат.
I клас. Оксидоредуктазаса ензими на редокс реакциите, които са в основата биологично окисление. Името на ензимите се съставя в следната форма: името на субстрата (донора), от който се отделят водородните атоми (електрони), името на акцептора, към който се прехвърлят водородните атоми и завършва с името "оксидоредуктаза": например лактат: NAD-оксидоредуктаза.
Наблюдаваните въртения на енантиомерите са противоположни по посока. Един енантиомер ще върти поляризирана светлина по посока на часовниковата стрелка, наречен дясновъртящ или, а партньорът му в огледален образ обратно на часовниковата стрелка, наречен лявовъртящ или. Ако проверите равни количества от всеки енантиомер, като използвате една и съща клетка за проба, тогава степента на въртене ще бъде същата, като едното от тях е положително, а другото отрицателно. За да сте абсолютно сигурни, че наблюдаваното въртене е положително или отрицателно, често е необходимо да се направи второ измерване, като се използва различно количество или концентрация на пробата.
Разграничават се следните подкласове:
1) аеробни дехидрогенази, които пренасят електрони и водородни протони от окислен субстрат към кислород:
H 2 S + O 2 S окислен + H 2 O 2
водороден сулфид
те включват ензими оксидаза;
2) анаеробните дехидрогенази пренасят водородни електрони и протони от окисления към друг субстрат. Те включват пиридин-зависими и флавин-зависими дехидрогенази. Например, окисляването на млечната киселина се извършва под действието на лактат дехидрогеназа, докато NAD се редуцира до NADH 2:
На илюстрацията по-горе, например, α може да бъде -90º или 270º, а не 90º. Ако концентрацията на пробата се намали с 10%, тогава положителното завъртане ще се промени на 81º, а отрицателното завъртане ще се промени на -81º, и правилното α ще бъде уникално определено. Тъй като не винаги е възможно да се получат или използват проби с еднакъв размер, наблюдаваното въртене обикновено се коригира, за да се компенсират промените в броя на пробите и дължината на клетката.
Съединенията, които въртят равнината на поляризираната светлина, се наричат оптически активни. Всеки енантиомер на стереоизомерна двойка е оптически активен и има еднакво, но противоположно въртене. Специфичните ротации са полезни с това, че са експериментално определени константи, които характеризират и идентифицират чистите енантиомери. Например, обсъжданите по-рано енантиомери на млечна киселина и карвон, обсъдени по-рано, имат следните специфични ротации.

млечна киселина пирогроздена киселина
Окисляването на янтарната киселина се извършва под действието на сукцинат дехидрогеназа, докато FAD се редуцира до FADH 2.

янтарна киселина фумарова киселина
Такива смеси се наричат рацемати или рацемични модификации и се обозначават. Когато хиралните съединения са създадени от ахирални съединения, продуктите са рацемични, освен ако един енантиомер на хиралния ко-реагент или катализатор не участва в реакцията.
Хирална органични съединенияизолирани от живи организми обикновено са оптически активни, което показва преобладаването на един от енантиомерите. Това е резултат от действието на хиралните катализатори, които наричаме ензими, и отразява присъщата хирална природа на самия живот. Хиралните синтетични съединения, от друга страна, обикновено са рацемати, освен ако не са получени от енантиомерно чисти изходни материали.
3) електронни транспортази - преносители на електрони. Те включват цитохромни ензими, цитохромоксидази на митохондриалната дихателна верига
4) пероксидаза и каталаза. Пероксидазата катализира окисляването на субстрата с водороден пероксид. Например, под действието на пероксидаза, сероводородът се окислява с участието на водороден пероксид:
H 2 S + H 2 O 2 S окислен + 2H 2 O
Има два начина за промяна на състоянието на хиралната материя. Рацематът може да бъде разделен на неговите съставни енантиомери. Този процес се нарича резолюция. Чистият енантиомер може да се превърне в неговия рацемат. Този процес се нарича рацемизация. „Оптична чистота“ е сравнение на оптичното въртене на чиста проба с неизвестна стереохимия в сравнение с оптичното въртене на чист енантиомерен образец. Изразява се в проценти. Ако пробата върти само равнинно поляризирана светлина наполовина от очакваното, оптичната чистота е 50%.
Каталазата при животните разгражда водородния пероксид до вода и молекулярен кислород:
2H 2 O 2 2H 2 O + O 2
Каталазата неутрализира действието на пероксида и е източник на молекулярен кислород в тъканите.
II клас. Трансферази- катализират реакциите на пренос на атоми и групи от атоми, включват следните подкласове:
Въпреки това, ако знаем специфичното въртене за хирална молекула, можем лесно да изчислим съотношението на енантиомерите, присъстващи в смес от два енантиомера, като функция на измерената оптична активност. Когато една смес съдържа повече от един енантиомер от останалите, химиците често използват концепцията за енантиомерен излишък, за да определят количествено разликата. Енантиомерният излишък може да се изрази като.
Разделяне на хирални съединения
Изразено чрез оптично въртене. Хиралните молекули често се маркират според знака на тяхното специфично въртене, като в -карвон и -карвон, или -карвон за рацемична смес. Както беше отбелязано по-рано, хиралните съединения, синтезирани от ахирални изходни материали и реагенти, обикновено са рацемични. Разделянето на рацематите на техните съставни енантиомери е процес, наречен разделяне. Тъй като енантиомерите имат същото физични свойства, като разтворимост и точка на топене, разделянето е изключително трудно.
1) Аминоферазите са ензими, които пренасят аминогрупи от едно вещество в друго. Коензимът е производно на витамин В6 (пиридоксин): например глутаминовата киселина дарява аминогрупа на пируват, в резултат на което се синтезира аланин и се образува а-кетоглутарова киселина.

От друга страна, диастереомерите имат различни физични свойства и този факт се използва за постигане на разделяне на рацемати. Реакцията на рацемат с енантиомерно чист хирален реагент дава смес от диастереомери, които могат да бъдат разделени. Например, ако рацемична смес от хирален алкохол реагира с енантиомерно чиста карбоксилна киселина, резултатът е смес от диастереомери: в този случай, тъй като се използва чистият енантиомер на киселината, продуктът е смес от диастереомерни и диастереомерни естери, които теоретично могат да бъдат разделени от техните различни физични свойства.
глутамин пируват α - кетоглутаров аланин
киселина киселина
Пиридоксинът, ензимът, който осъществява тази реакция, се нарича 1-глутамил:пируват аминотрансфераза или, според старата номенклатура, аминофераза.
2) Ацилтрансферази - ускоряват прехвърлянето на ацили (остатъци от карбоксилна киселина) към аминокиселини, алкохоли и други съединения. Например, синтезът на ацетилхолин се осъществява с участието на ензима холин ацетилтрансфераза:
Последваща хидролиза на всеки отделен естерще даде "разрешени" алкохоли. Използваните в този метод са известни като. Етикети за тип артикул Тази страница няма етикети. . Характеристика различни материалие извършено с помощта на спектроскопия, термичен анализ и микроскопия чрез определяне на техните молекулни тегла и техните механични свойства.
Тестове за импланти, биосъвместимост и клетъчен растеж бяха проведени при зайци и оценени макроскопски и хистологични изследвания. Характеризирането на тези материали беше извършено с помощта на спектроскопия, термичен анализ, микроскопия, определяне на молекулното тегло и техните механични свойства. Тъканният растеж и биосъвместимостта са изследвани чрез имплантиране на материали в зайци, последвано от макроскопска и хистологична оценка.

3) Фосфотрансферази - ензими, които ускоряват реакцията на прехвърляне на остатък от фосфорна киселина. Най-честият донор на фосфатни остатъци е АТФ. Например, хексокиназата ускорява прехвърлянето на остатък от фосфорна киселина към глюкоза:

Оттогава са разработени много приложения на тези материали: влакна, шини, уплътнения, инженерни полимери, импланти, конци, контактни лещи, матрици за тъканни култури и други. Поради своята издръжливост и ниска плътност те заемат голям обем, ставайки екологичен проблемкогато се изхвърля. Алтернативи за смекчаване на въздействието върху околен святбяха рециклиране, изгаряне и производство на биоразградими полимери.
Има европейски, американски и японски стандарти, които определят тези условия, които варират от един континент на друг. От известно време е установено, че полимерните матрици могат да стимулират регенерацията на тъкани със специфични размери и форми, което води например до развитието на съдови присадки, получени от ендотелни клетки и разширен политетрафлуоретилен, хрущял, направен от хондроцити и киселини. полимлечна и полигликолова, чернодробни приложения от хепатоцити и полигликолова киселина и чревни тръби от полигликолова киселина и ентероцити.
α-D-глюкоза глюкозо-6-фосфат
4) Метилферази - ензими, които пренасят метилова група от едно съединение в друго: например при синтеза на креатин метионинът е донор на метилова група.
5) Глюкозилтрансферази - носители на глюкозидни
остатъци:
11 (C 6 H 12 O 6) + UDP - глюкоза (n + 1) (C 6 H 12 O 6) + UDP
те включват гликоген синтази, глюкозилтрансферази, фосфорибозилтрансферази и др.
Полимлечната киселина се извлича от млечна киселина, естествен ферментационен продукт от възобновяеми източници. Полимеризацията на млечната киселина може да се контролира, за да се получат различни молекулни тегла и различни степеникристалност чрез подходящ избор на реакционни параметри като температура, налягане, време на реакция и избор на катализатор. От своя страна степента на кристалност и физико-механичните свойства на продукта зависят от молекулното тегло и избрания изомер за полимеризация.
6) Алкилтрансферази - носители на алкохолни остатъци. Те включват холин трансфераза, фосфатилдиетаноламин трансфераза и др.
III клас.Хидролази- прекъсване на вътрешномолекулни връзки чрез добавяне на елементи от вода:
R - R 1 + HOH R - H + R 1 - OH
Те включват следните подкласове:
1) Естерази - ензими, които хидролизират естерни връзки по схемата:
Поведение на устройството в реални условияУпотребата и биосъвместимостта на материала бяха оценени с помощта на процедура за имплантиране в заешки бутчета в съответствие с протоколите за етика на животните. По този начин се контролира внезапното изпаряване на млечната киселина и се предотвратява нейното разграждане. Реакционният продукт се разтваря в ацетон и се утаява в дестилирана вода при енергично разбъркване. След това се възстановява чрез вакуумна филтрация и се съхранява в ексикатор за 24 часа, за да се отстрани напълно влагата.
Бяха получени седем проби и подложени на характеризиране, хидролитично разграждане и имплантиране в експериментални субекти. Полимерните проби се въвеждат във фосфатен буферен разтвор с рН около 7 и се използва пещ за симулиране на телесната температура, при която пробите се инкубират. Бяха извършени изчисления на загуба на тегло, набъбване и промяна на pH, за да се оцени устойчивостта на хидролитично разграждане на пробите.
R 1 -0-R 2 + HOH R 1 -H + R 2 -OH
Например фосфодиестерази - хидролизират фосфорни естери:
Диацилглицерол 3-фосфорна киселина + HOH диацилглицерол + H 3 PO 4.
Този подклас включва: фосфатази (киселинни, алкални), глюкозо-6-глюкоза-1-фосфатаза, РНКаза и др.
Карбоксиестерази - хидролизират естерни връзки:

тристеарин глицерин стеарин
Тези ензими включват липази, лецитинази, прости естерази и др.
Сулфоестерази - хидролизират сулфатни естери по следната схема:
фенол сярна киселина фенол сярна киселина
2) Гликозидази - хидролизират гликозидни връзки, те включват α- и β-амилази, малтаза, лактаза, сукраза.
3) Пептидази. Има ендопептидази - пепсин, трипсин, хемотрипсин; екзопептидази - аминопептидаза, карбоксипептидаза, дипептидаза, трипептидаза.
Пептидазите се хидролизират пептидни връзкичрез следната реакция:
![]()
аланилаланин аланин
В резултат на хидролизата се образуват две молекули аланин.
4) Амидази - ензими, които хидролизират амидни връзки на пуринови и пиримидинови бази, амиди на аминокиселини и
аргинин. Примери:
А) Аденин + Н2О хипоксантин + NH3
пурин деаминаза

глутамин глутамин

аргинин урея орнитин
5) Полифосфатази - хидролизират връзките на фосфорния анхидрид:
ATP + H 2 O ADP + H 3 PO 4
Тази група включва Na +, K +, Mg 2+ -АТФаза и др.
IV клас. Лиазите са ензими, които разцепват връзките без участието на вода, като същевременно разрушават С-С връзките, C-N връзки, C-O връзки. Те включват ензимите алдолаза, декарбоксилаза и др. Например, алдолазата разрушава С-С връзките на хексозата (1,6-дифосфофруктоза), за да образува две триози, фосфодиоксиацетон и фосфоглицералдехид:

V клас. Изомерази: катализират изомеризацията, изомерната трансформация на молекули, като глюкоза във фруктоза. Мутазите променят местоположението на различни групи или атоми в една молекула. Те включват: фосфоглицеромутаза, фосфоглюкомутаза, фосфофруктомутаза и др. Например фосфодиоксиацетонът се превръща от изомераза във фосфоглицералдехид:

фосфодиоксиацетон фосфоглицералдехид
VI клас. Лигазите (синтетазите) са ензими, които катализират прикрепването на молекулите една към друга. Например:
Аминокиселина + тРНК аминоацил-тРНК
Те включват ензими: ДНК полимерази, РНК полимерази, ензими, които катализират протеиновия синтез и др.
Млечна киселина (2-хидроксипропионова киселина)
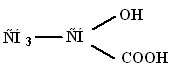
Молекулна маса 90,1; безцветни кристали. известен D(+)-млечна киселина, Д(-)- млечна (месно-млечна) киселина и рацемична млечна киселина - млечнокисела ферментация. За D,L-и д- млечни киселини - температура на топенесъответно 18 °С и 53 °С; температура на кипенесъответно 85 ° C / 1 mm Hg. и 103 °C/2mm Hg; за д- специфично за млечната киселина оптично въртене за натриева D-линия при температура 20˚С: [α] D 20-2,26 (концентрация 1,24% във вода). За Д,Л-млечна киселина ∆H 0 образование- 682,45 kJ/mol; ∆H 0 топене 11,35 kJ/mol; ∆H 0 изпарение 110,95 kJ/mol (25°C), 65,73 kJ/mol (150°C). За Л-млечна киселина ∆H 0 изгаряне- 1344,8 kJ/mol; ∆H 0 образуване-694,54 kJ/mol; ∆H 0 топене 16,87 kJ/mol.
Поради високата хигроскопичност на млечната киселина обикновено се използват нейни концентрирани водни разтвори - сиропообразни, безцветни течности без мирис. За водни разтвориплътност на млечна киселина g / cm 3 при температура 20˚С d4 20 1.0959 (40%), 1.1883 (80%), 1.2246 (100%); специфично оптично въртене за D-линията на натрий при температура 25˚С: [α] D 25 1.3718 (37.3%), 1.4244 (88.6%); h 3,09 и 28,5 mPa s (при 25 ˚С), съответно за 45,48 и 85,32% разтвори; ж 46.0.10 -3 N/m (25°C) за 1 М разтвор; д 22 (17°С). Млечната киселина е разтворима във вода, етанол, слабо - в бензен, хлороформ и други халогенови въглеводороди; pK a 3,862 (при 25°С); pH на водни разтвори 1,23 (37,3%), 0,2 (84,0%).
Окисляването на млечната киселина обикновено е придружено от разлагане. Под действието на HNO 3 или O 2 въздух в присъствието на Cu или Fe се образуват HCOOH, CH 3 COOH, (COOH) 2, CH 3 CHO, CO 2 и пирогроздена киселина. Редукцията на млечна киселина с HI води до пропионова киселина, а редукция в присъствието на Re черно води до пропилей гликол.
Млечната киселина се дехидратира до акрилова киселина, при нагряване с HBr образува 2-бромопропионова киселина, когато Ca-солта реагира с PCl 5 или SOCl 2 -2-хлоропропионил хлорид. В присъствието на минерални киселини настъпва самоестерификация на млечната киселина с образуването на лактон, както и линейни полиестери. При взаимодействие на млечна киселина с алкохоли се образуват хидрокси киселини RCH 2 CH (OH) COOH, а при взаимодействие на соли на млечна киселина с алкохоли се образуват естери. Солите и естерите на млечната киселина се наричат лактати.
В резултат се получава млечна киселина млечнокисела ферментация(при подкисване на мляко, кисело зеле, мариноване на зеленчуци, зреене на сирене, силажиране на фураж); дМлечната киселина се намира в тъканите на животни, растения, а също и в микроорганизми.
В промишлеността млечната киселина се получава чрез хидролиза на 2-хлоропропионова киселина и нейните соли (100 ° C) или лактонитрил CH 3 CH (OH) CN (100 ° C, H 2 SO 4), последвано от образуването на естери, изолирането и чиято хидролиза води до продукта Високо качество. Известни са и други методи за получаване на млечна киселина: окисление на пропилен с азотни оксиди (15-20°C), последвано от обработка с H2SO4, взаимодействие на CH3CHO с CO (200°C, 20 MPa).
Млечната киселина се използва в хранително-вкусовата промишленост, при боядисване на петна, в кожарската промишленост, в цеховете за ферментация като бактерицидно средство, за получаване на лекарства, пластификатори. Етил и бутил лактати се използват като разтворители за целулозни етери, изсушаващо масло, растителни масла; бутил лактат - използва се и като разтворител за някои синтетични полимери.
