рН на млечна киселина на водни разтвори. Млечна киселина (2-хидроксипропионова киселина)
МЛЕЧНА КИСЕЛИНА(2-хидроксипропионова киселина) CH3CH(OH)COOH, молекулно тегло 90.1; безцветни кристали. Известни D(+)-млечна киселина, D(-)-млечна (месно-млечна) киселина и рацемична. LACTIC ACID.-млечнокисела ферментация. За Д,Л- и Д-М.к. точка на топене съответно 18 °C и 53 °C; точка на кипене, съответно 85 ° C / 1 mm Hg. и 103°C/2mm Hg; за Д-М.к. [a] D 20 -2,26 (концентрация 1,24% във вода). За D,L-M. K. DH 0 arr - 682,45 kJ / mol; DH 0 pl 11,35 kJ/mol; DH тест 110,95 kJ/mol (25°C), 65,73 kJ/mol (150°C). За Л-М.к. DH 0 изгорял - 1344,8 kJ/mol; DH 0 arr -694,54 kJ/mol; DH 0 pl 16,87 kJ/mol.
Поради високата хигроскопичност на МЛЕЧНАТА КИСЕЛИНА. обикновено използвайте неговия концентратор. водни разтвори, сироповидни, безцветни. течности без мирис. За водни разтвори МЛЕЧНА КИСЕЛИНА. d 20 4 1.0959 (40%), 1.1883 (80%), 1.2246 (100%); n D 25 1.3718 (37.3%), 1.4244 (88.6%); h 3,09 и 28,5 MPa. s (25°С), съответно, за 45,48 и 85,32% разтвори; g 46.0. 10 -3 N/m (25°C) за 1 М разтвор; е 22 (17°С). МЛЕЧНА КИСЕЛИНА разтворим във вода, етанол, слабо разтворим в бензен, хлороформ и други халокарбони; рКа 3.862 (25°С); pH на водни разтвори 1,23 (37,3%), 0,2 (84,0%).
Окисляване МЛЕЧНА КИСЕЛИНА. обикновено се придружава от разлагане. Под действието на HNO 3 или O 2 въздух в присъствието на Cu или Fe се образуват HCOOH, CH 3 COOH, (COOH) 2, CH 3 CHO, CO 2 и пирогроздена киселина. Възстановяване МЛЕЧНА КИСЕЛИНА. HI води до пропионова киселина, а редуцирането в присъствието на Re черно води до пропилей гликол.
М. до дехидратира до акрилова киселина, при нагряване с HBr образува 2-бромопропионова киселина, когато Ca-солта реагира с PCl 5 или SOCl 2 -2-хлоропропионил хлорид. В присъствието минерални киселини настъпва самоестерификация МЛЕЧНА КИСЕЛИНА. с образуването на лактона с формула I, както и линейни полиестери. При взаимодействие МЛЕЧНА КИСЕЛИНА. с алкохоли се образуват хидрокси киселини RCH 2 CH(OH)COOH, а при взаимодействие на соли МЛЕЧНА КИСЕЛИНА. с алкохоли и етери. Солите и естерите на МЛЕЧНАТА КИСЕЛИНА се наричат лактати (виж таблицата).
М.к. образувани в резултат млечнокисела ферментация(при подкисване на мляко, кисело зеле, мариноване на зеленчуци, зреене на сирене, силажиране на фураж); Д-М.к. открити в тъкани на животни, растения, както и в микроорганизми.
В промишлеността МЛЕЧНАТА КИСЕЛИНА се получава чрез хидролиза на 2-хлоропропионова киселина и нейните соли (100 ° C) или лактонитрил CH 3 CH (OH) CN (100 ° C, H 2 SO 4), последвано от образуването на естери, изолирането и чиято хидролиза води до продукт Високо качество. Има и други методи за получаване на МЛЕЧНА КИСЕЛИНА: окисление на пропилей с азотни оксиди (15-20 ° C), последвано от обработка с H 2 SO 4, взаимодействие на CH 3 CHO с CO (200 ° C, 20 MPa).
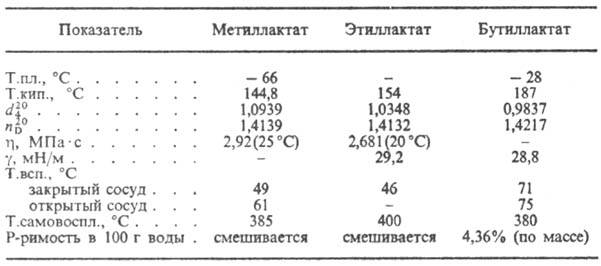
СВОЙСТВА НА НЯКОИ ЛАКТАТИ
М.к. използва се в хранително-вкусовата промишленост, при боядисване на петна, в кожарската промишленост, в цеховете за ферментация като бактерицидно средство, за получаване на лек. Ср, пластификатори. Етил и бутил лактати се използват като разтворители за целулозни етери, изсушаващи масла и растат. масла; бутил лактат - също и като разтворител за някои синтетични. полимери.
Световно производство МЛЕЧНА КИСЕЛИНА. 40 хиляди тона (1983 г.).
Химическа енциклопедия. Том 3 >>
Рационалната номенклатура на ензимите се съставя, като към латинския корен на името на субстрата, върху който действа ензимът, или към името на процеса, катализиран от ензима, се добавя окончанието "аза".
Например, ензимът, който действа върху нишестето (амил), се нарича амилаза; урея (карбамид) - уреаза; феноли - фенолаза и др.
В допълнение към рационалното наименование са запазени по-рано появили се термини: пепсин, трипсин.
През 1961 г. нов международна класификация, въз основа на вида на катализираната реакция.
В момента са известни около 3000 различни ензими. Те се класифицират според вида на тяхното действие. Има 6 класа ензими:
1 .Оксидоредуктаза – редокс
ензими; катализират биологичното окисление.
2.Трансферази - катализират реакции на трансфер на различни химични групиот една молекула (донор) към друга молекула (акцептор).
3. Хидролази - извършват химични трансформации на вещества с участието на водна молекула.
4. Лиаза - отцепват една или друга група от субстратите по нехидролитичен път.
5. Изомерази - извършват изомерни трансформации на съединения.
6. Лигази (синтетази) - катализират реакции на синтез, придружени от елиминиране на фосфорна киселина от АТФ или друг трифосфат.
I клас. Оксидоредуктазаса ензими на редокс реакциите, които са в основата биологично окисление. Името на ензимите се съставя в следната форма: името на субстрата (донора), от който се отделят водородните атоми (електрони), името на акцептора, към който се прехвърлят водородните атоми и завършва с името "оксидоредуктаза": например лактат: NAD-оксидоредуктаза.
Разграничават се следните подкласове:
1) аеробни дехидрогенази, които пренасят електрони и водородни протони от окислен субстрат към кислород:
H 2 S + O 2 S окислен + H 2 O 2
водороден сулфид
те включват ензими оксидаза;
2) анаеробните дехидрогенази пренасят електрони и протони на водород от окисления към друг субстрат. Те включват пиридин-зависими и флавин-зависими дехидрогенази. Например, окисляването на млечната киселина се извършва под действието на лактат дехидрогеназа, докато NAD се редуцира до NADH 2:

млечна киселина пирогроздена киселина
Окисляването на янтарната киселина се извършва под действието на сукцинат дехидрогеназа, докато FAD се редуцира до FADH 2.

янтарна киселина фумарова киселина
3) електронни транспортази - преносители на електрони. Те включват цитохромни ензими, цитохромоксидази на митохондриалната дихателна верига
4) пероксидаза и каталаза. Пероксидазата катализира окисляването на субстрата с водороден пероксид. Например, под действието на пероксидаза, сероводородът се окислява с участието на водороден пероксид:
H 2 S + H 2 O 2 S окислен + 2H 2 O
Каталазата при животните разгражда водородния пероксид до вода и молекулярен кислород:
2H 2 O 2 2H 2 O + O 2
Каталазата неутрализира действието на пероксида и е източник на молекулярен кислород в тъканите.
II клас. Трансферази- катализират реакциите на пренос на атоми и групи от атоми, включват следните подкласове:
1) Аминоферазите са ензими, които пренасят аминогрупи от едно вещество в друго. Коензимът е производно на витамин В6 (пиридоксин): например глутаминовата киселина дарява аминогрупа на пируват, в резултат на което се синтезира аланин и се образува а-кетоглутарова киселина.

глутамин пируват α - кетоглутаров аланин
киселина киселина
Пиридоксинът, ензимът, който осъществява тази реакция, се нарича 1-глутамил:пируват аминотрансфераза или, според старата номенклатура, аминофераза.
2) Ацилтрансферази - ускоряват прехвърлянето на ацили (остатъци от карбоксилна киселина) към аминокиселини, алкохоли и други съединения. Например, синтезът на ацетилхолин се осъществява с участието на ензима холин ацетилтрансфераза:

3) Фосфотрансферази - ензими, които ускоряват реакцията на прехвърляне на остатък от фосфорна киселина. Най-честият донор на фосфатни остатъци е АТФ. Например, хексокиназата ускорява прехвърлянето на остатък от фосфорна киселина към глюкоза:

α-D-глюкоза глюкозо-6-фосфат
4) Метилферази - ензими, които пренасят метилова група от едно съединение в друго: например при синтеза на креатин метионинът е донор на метилова група.
5) Глюкозилтрансферази - носители на глюкозидни
остатъци:
11 (C 6 H 12 O 6) + UDP - глюкоза (n + 1) (C 6 H 12 O 6) + UDP
те включват гликоген синтази, глюкозилтрансферази, фосфорибозилтрансферази и др.
6) Алкилтрансферази - носители на алкохолни остатъци. Те включват холин трансфераза, фосфатилдиетаноламин трансфераза и др.
III клас.Хидролази- прекъсване на вътрешномолекулни връзки чрез добавяне на елементи от вода:
R - R 1 + HOH R - H + R 1 - OH
Те включват следните подкласове:
1) Естерази - ензими, които хидролизират естерни връзки по схемата:
R 1 -0-R 2 + HOH R 1 -H + R 2 -OH
Например фосфодиестерази - хидролизират фосфорни естери:
Диацилглицерол 3-фосфорна киселина + HOH диацилглицерол + H 3 PO 4.
Този подклас включва: фосфатази (киселинни, алкални), глюкозо-6-глюкоза-1-фосфатаза, РНКаза и др.
Карбоксиестерази - хидролизират естерни връзки:

тристеарин глицерин стеарин
Тези ензими включват липази, лецитинази, прости естерази и др.
Сулфоестерази - хидролизират сулфатни естери по следната схема:
фенол сярна киселина фенол сярна киселина
2) Гликозидази - хидролизират гликозидни връзки, те включват α- и β-амилази, малтаза, лактаза, сукраза.
3) Пептидази. Има ендопептидази - пепсин, трипсин, хемотрипсин; екзопептидази - аминопептидаза, карбоксипептидаза, дипептидаза, трипептидаза.
Пептидазите се хидролизират пептидни връзкичрез следната реакция:
![]()
аланилаланин аланин
В резултат на хидролизата се образуват две молекули аланин.
4) Амидази - ензими, които хидролизират амидни връзки на пуринови и пиримидинови бази, амиди на аминокиселини и
аргинин. Примери:
А) Аденин + Н2О хипоксантин + NH3
пурин деаминаза

глутамин глутамин

аргинин урея орнитин
5) Полифосфатази - хидролизират връзките на фосфорния анхидрид:
ATP + H 2 O ADP + H 3 PO 4
Тази група включва Na +, K +, Mg 2+ -АТФаза и др.
IV клас. Лиазите са ензими, които разцепват връзките без участието на вода, като същевременно се разрушават C-C връзки, C-N връзки, C-O връзки. Те включват ензимите алдолаза, декарбоксилаза и др. Например, алдолазата разрушава С-С връзките на хексозата (1,6-дифосфофруктоза), за да образува две триози, фосфодиоксиацетон и фосфоглицералдехид:

V клас. Изомерази: катализират изомеризацията, изомерната трансформация на молекули, като глюкоза във фруктоза. Мутазите променят местоположението на различни групи или атоми в една молекула. Те включват: фосфоглицеромутаза, фосфоглюкомутаза, фосфофруктомутаза и др. Например фосфодиоксиацетонът се превръща от изомераза във фосфоглицералдехид:

фосфодиоксиацетон фосфоглицералдехид
VI клас. Лигазите (синтетазите) са ензими, които катализират прикрепването на молекулите една към друга. Например:
Аминокиселина + тРНК аминоацил-тРНК
Те включват ензими: ДНК полимерази, РНК полимерази, ензими, които катализират протеиновия синтез и др.
Реактиви:
Фталова киселина
Напредък:
~0,1-0,2 g ортофталова киселина се поставя в суха епруветка и се нагрява на пламъка на спиртна лампа, като епруветката се държи хоризонтално. Образува се фталов анхидрид, който сублимира и отново кондензира върху студените стени на епруветката. Тръбата се охлажда, след което утайката от фталов анхидрид се нагрява внимателно, лесно се топи и се стича на дъното на епруветката.
Опит No56. Получаване на фенолфталеин
Реактиви:
Фталов анхидрид
Напредък:
~ 0,2 g фенол, ~ 0,1 g фталов анхидрид, ~ 5 капки концентрирана сярна киселина се поставят в суха епруветка и леко се нагряват на пламъка на спиртна лампа. Сместа се топи, фенолът се кондензира с фталов анхидрид:

След това тръбата се охлажда на въздух. Добавете половин епруветка вода към охладената смес и разклатете енергично. Полученият разтвор се прехвърля в друга епруветка и се добавят няколко капки алкален разтвор. В алкална среда се появява пурпурночервен цвят, което показва наличието на фенолфталеин в разтвора.
В алкална среда настъпва изомеризация на едно от бензеновите ядра, образува се хиноидна група, която причинява появата на цвят. Когато разтворът се подкисли, цветът изчезва, когато се добави алкал, той се появява отново. Посоченото свойство на фенолфталеина се използва в аналитичната химия като индикатор (индикатор) на реакцията на средата.
Ако вместо фенол вземем резорцинол (дихидричен фенол) и проведем експеримента по същия начин, както е описано по-горе, тогава се образува флуоресцеин. Разтвор на флуоресцеин в алкална среда има красив цвят, червен в пропусната светлина, зелен в отразена светлина (флуоресценция).
VIII. ХИДРОКСИКИСЕЛИНИ
Опит No57. Откриване на млечна киселина
Реактиви:
Разтвор на 1% фенол
Разтвор на 1% железен хлорид
Млечна киселина
Напредък:
Към ~3 ml от 1% разтвор на фенол, добавете няколко капки от 1% разтвор на железен (III) хлорид. Течността става ярко лилава поради образуването на сложни железни фенолати. Към получената течност се добавят няколко капки млечна киселина и цветът на разтвора се променя на зелено-жълт поради образуването на железен лактат (CH 3 CH (OH) COO) 3 Fe.
Опит No58. Разлагане на млечна киселина при нагряване с концентрирана сярна киселина
Реактиви:
Млечна киселина
концентрирана сярна киселина
Напредък:
Смес от равни обеми (~0,5 ml всеки) млечна и сярна киселина се нагрява внимателно в епруветка с тръба за изпускане на газ. Освободеният въглероден окис (II) се запалва в отвора на изходната тръба за газ, той гори със синкав пламък.
- α-хидроксипропионова (2-хидроксипропанова) киселина, CH3CH(OH)COOH. Едноосновна хидроксикарбоксилна киселина; важен метаболитен междинен продукт при животни, растения и микроорганизми; ограничаваща монокарбоксилна киселина от ацикличната серия

Открит е от шведския химик Карл Шееле през 1780 г.
През 1807 г. Йенс Якоб Берцелиус изолира цинковата сол на млечната киселина от мускулите.
Описание и свойства
Безцветни кристали, лесно разтворими във вода, етанол, слабо - в бензен, хлороформ. Съществува в две оптически активни (-)- и (+)-форми ( т pl 25-26 °C) и под формата на неактивна рацемична (±)-форма (t pl 18 °C).
Реакции

Млечна киселина при хора и животни
Млечната киселина се образува от разграждането на глюкозата. Понякога наричана "кръвна захар", глюкозата е основният източник на въглехидрати за нашето тяло. Това е основното гориво за мозъка и нервна система, както и за мускулите по време на тренировка. Когато глюкозата се разгражда, клетките произвеждат АТФ (аденозин трифосфат), който осигурява енергия за повечето химична реакцияв организма. Нивото на АТФ определя колко бързо и за колко дълго нашите мускули могат да се съкращават кога физическа дейност. Производството на млечна киселина не изисква наличието на кислород, поради което този процес често се нарича "анаеробен метаболизъм". Много хора вярват, че мускулите произвеждат млечна киселина, когато не получават достатъчно кислород от кръвта. С други думи, вие сте в анаеробно състояние. Учените обаче твърдят, че млечната киселина се образува и в мускулите, които получават достатъчно кислород. Увеличаването на количеството млечна киселина в кръвния поток показва само, че нивото на нейния прием надвишава нивото на отстраняване. Кислородът тук не играе съществена роля. Лактат-зависимото производство на АТФ е много малко, но има висока скорост. Това обстоятелство го прави идеален за използване като гориво, когато натоварването надвишава 50% от максимума. По време на почивка и субмаксимално (по-скоро умерено, под максимално обикновено се разбира 90% от максималното) натоварване, тялото предпочита да разгражда мазнините за енергия. При натоварвания от 50% от максимума (прагът на интензивност за повечето тренировъчни програми), тялото се преустройва за преференциална консумация на въглехидрати. Колкото повече въглехидрати използвате като гориво, толкова повече повече производствомлечна киселина.
За да позволи на глюкозата да премине клетъчни мембраниИма нужда от инсулин. Молекулата на млечната киселина е наполовина по-малка от молекулата на глюкозата и не се нуждае от хормонална подкрепа - тя лесно преминава през клетъчните мембрани сама.
Приложение.
Млечната киселина се използва в хранително-вкусовата промишленост, при боядисване на петна, в кожарската промишленост, в цеховете за ферментация като бактерицидно средство, за получаване на лекарства, пластификатори. Етил и бутил лактати се използват като разтворители за целулозни етери, изсушаващо масло, растителни масла; бутил лактат - използва се и като разтворител за някои синтетични полимери.
Световно производство на млечна киселина – 40 хил. тона (1983 г.).
 Хайнрих Ото Виланд
Хайнрих Ото Виланд
 Адолф Йохан Фридрих Вилхелм фон Байер
Адолф Йохан Фридрих Вилхелм фон Байер
 Фридрих Бергиус
Фридрих Бергиус  основни характеристикиметали. Срещане в природата и разпространение. Методи за получаване и почистване
основни характеристикиметали. Срещане в природата и разпространение. Методи за получаване и почистване
 Хромът като химичен елемент
Хромът като химичен елемент
Страница 1
Окисляването на млечна киселина с оловен диоксид води до производството на ацеталдехид.
Когато млечната киселина се окислява с калиев дихромат в присъствието на сярна киселина, се образува ацеталдехид, който се улавя чрез дестилация с реактив на Неслер. Цветът на последния показва само възможното наличие на млечна киселина в пробата.
Задача 10.7. Окисляването на млечната киселина до полиградна (2-оксопропанова) киселина се среща в живите организми като един от етапите на биологичното размразяване на въглехидратите.
Пирогроздена киселина може да се синтезира чрез окисление на млечна киселина (виж раздел.
Енергията, освободена по време на окислението на млечната киселина, се използва в мускула за ресинтеза на гликоген.
Пример за тази реакция е окислението на млечна киселина до пирогроздена киселина.
Изследвахме подробно влиянието на киселинността на средата и излишъка на окислителя по време на окисляването на млечна киселина с калиев бихромат.
Ако мускулът, отровен от продукта на собствената си жизнена дейност, се прехвърли в кислородна атмосфера, тогава картината се променя. Започват два процеса: окисление на млечна киселина, което води до допълнително и много значително освобождаване на енергия и синтез на гликоген. Оказва се, че процесите на постепенно превръщане на гликогена в глюкоза и след това в млечна киселина са обратими във всичките им най-важни етапи. Биохимичната машина може да работи обратно и отново да създава суровини от крайните продукти. Част от млечната киселина - крайният продукт на гликогенолизата (разграждането на гликогена) отново преминава към суровината - гликоген.
Методът се основава на измерване на интензитета на цвета на съединението, образувано по време на реакцията на цеталдехид, възникнал поради окисляването на млечна киселина с параоксидифенил.
Въпреки че цитохром b2 катализира разграждането на други субстрати (a-хидрокси-n-бутирати, a-хидрокси-m-капроати, oc-хидроксиизокапроати), тяхната концентрация в биологичната среда е с няколко порядъка по-ниска от концентрацията на млечна киселина, така че смущаващият ефект е пренебрежимо малък. Голям брой метаболити с редуциращи свойства, напр пикочна киселина, глутатион, цистеин, адреналин, витамин Ц, p-аланин, се окисляват или [Fe (CN) 6 ] 3, или върху платинов електрод, и техният окислителен ток се добавя към тока, съответстващ на окислението на млечната киселина. Следователно, в присъствието на тези метаболити, не е желателно да се извършва определяне на млечна киселина.
Такъв апарат е описан за микроопределяне на треонин с помощта на t-хидроксидифенил (вижте глава. Окисляването на млечна киселина до ацеталдехид завършва при 50°С на водна баня за 30 минути. През същото време ацеталдехидът се вдухва в 15 ml силен HtaSCh, съдържащ излишък Цялата операция, проведена, както е описано в гл.
Епруветките с филтрата се поставят в ледена вода и бавно, капка по капка, се добавя 1 ml концентрирана сярна киселина. Епруветките трябва да се разклащат внимателно през цялото време и да се гарантира, че съдържанието им не се нагрява. За да се ускори окисляването на млечната киселина, двете епруветки се прехвърлят в кипяща баня за 4 минути и след това бързо се охлаждат в ледена вода. След охлаждане добавете 1 - 2 капки от 0,1% разтвор на вератрол към всяка епруветка, разклатете леко няколко минути. В експерименталната проба се развива ярко розов цвят, тъй като гликолизата е настъпила под въздействието на ензими на мускулната тъкан. В контролната проба цветът е леко розов поради млечната киселина, която присъства в мускулната пулпа преди началото на експеримента.
Групата на Лурия показа, че прикрепването на протеиновите молекули на колицин К и Е1 към клетките на бактерията E-coli е придружено от спиране на синтеза на макромолекули: протеини, ДНК, РНК и гликоген. Активният транспорт на млечна захар (лактоза), глутамин, различни аминокиселинии калиеви и магнезиеви йони. В същото време клетката продължава да натрупва глюкоза, чийто активен транспорт се осигурява директно от енергията на окислението на млечната киселина.
Освен това е един от междинните продукти в млечната киселина и алкохолна ферментациявъглехидрати. Може да се получи чрез взаимодействие на ацетилхлорид с калиев цианид, последвано от хидролиза на получения кетонитрил или чрез окисление на млечна киселина.
Реакцията се провежда с филтратите в присъствието на млечна киселина. За да направите това, вземете 2 чисти номерирани епруветки: в първата - 10 капки от филтрата контролна проба, във втория - 10 капки от филтрата на опитната проба. Не трябва да забравяме, че силното прегряване може да доведе до овъгляване на млечна киселина. За да се ускори окисляването на млечната киселина, двете епруветки се прехвърлят във вряща водна баня за 4-5 минути и след това бързо се охлаждат в ледена вода. Добавете 3 капки 0,2% алкохолен разтвор на вератрол или гваякол към всяка епруветка към охладените течности.
