ما هي خصائص الانزيمات. التنظيم الهيكلي والوظيفي للأنزيمات. تنظيم نشاط الانزيم. تحديد نشاط البول الأميليز
الانزيمات
إنزيمات-ov. رر(وحدة إنزيم ، -أ ؛ م.). [من خط العرض. خميرة - خميرة] بيول ، تشيم.محفزات بروتينية محددة موجودة في جميع الخلايا الحية التي تنظم التمثيل الغذائي وبالتالي تلعب دورًا مهمًا في جميع عمليات الحياة ؛ الانزيمات. انزيم التخمير. F. المتعفنة. F. الأكسدة. يعتمد نشاط الإنزيمات على تناول الفيتامينات. دراسة خصائص الانزيمات الفردية.
◁ الأنزيمية ، ال ، ال. بيول ، تشيم. رد فعل و. سموم F.الأنزيمية ، ال ، ال. المواد F- عشر. دراسة العمليات الأنزيمية.
الانزيمات(من lat. fermentum - leaven) (إنزيمات) ، محفزات بيولوجية موجودة في جميع الخلايا الحية. القيام بتحويل المواد في الجسم وتوجيه وتنظيم عملية الأيض. بواسطة الطبيعة الكيميائية- البروتينات. تمتلك الإنزيمات نشاطًا مثاليًا عند بعض قيم الأس الهيدروجيني ، وغالبًا ما يكون وجود الإنزيمات المساعدة والعوامل المساعدة اللازمة ، وغياب المثبطات. كل نوع من الإنزيمات يحفز تحول مواد معينة (ركائز) ، وأحيانًا مادة واحدة فقط. لذلك ، العديد من السيرة الذاتية تفاعلات كيميائيةينفذ في الخلايا رقم ضخمإنزيمات مختلفة. تنقسم جميع الإنزيمات إلى 6 فئات: أوكسيدوروكتازات ، ترانسالات ، هيدروليسات ، لياز ، إيزوميراز ، ليجاسيس. تم عزل العديد من الإنزيمات من الخلايا الحية وتم الحصول عليها في شكل بلوري (لأول مرة في عام 1926). تستخدم مستحضرات الإنزيم في الطب والأغذية والصناعات الخفيفة. يدرس إنزيمات الإنزيمات.
إنزيماتENZYMES (من اللاتينية "fermentum" - التخمير ، الخميرة) ، إنزيمات ، بروتينات معينة تزيد من معدل التفاعلات الكيميائية في خلايا جميع الكائنات الحية. بطبيعتها الكيميائية - البروتينات التي لها نشاط أمثل عند درجة حموضة معينة ، ووجود الإنزيمات المساعدة والعوامل المساعدة اللازمة وغياب المثبطات. تسمى الإنزيمات أيضًا بالمحفزات الحيوية عن طريق القياس مع المحفزات. (سم.المحفزات)في الكيمياء. كل نوع من الإنزيمات يحفز تحول مواد معينة (ركائز) ، وأحيانًا مادة واحدة فقط في اتجاه واحد. لذلك ، يتم إجراء العديد من التفاعلات الكيميائية الحيوية في الخلايا بواسطة عدد كبير من الإنزيمات المختلفة. مقسمة إلى 6 فئات: أكسدة الأكسدة ، ترانسالات ، هيدروليسات (سم.الهيدرولات)، lyases (سم. LIASE)، ايزوميراز (سم.الأيزوميرات)و ligases (سم.إنزيمات دمج الجزيئات). تم عزل العديد من الإنزيمات من الخلايا الحية وتم الحصول عليها في شكل بلوري (لأول مرة في عام 1926).
دور الانزيمات في الجسم
تشارك الإنزيمات في تنفيذ جميع عمليات التمثيل الغذائي ، في تنفيذ المعلومات الجينية. الهضم والاستيعاب العناصر الغذائيةتخليق وانهيار البروتينات (سم.البروتينات (مركبات عضوية)), احماض نووية (سم.احماض نووية)، سمين (سم.الدهون)والكربوهيدرات (سم.الكربوهيدرات)والمركبات الأخرى في الخلايا والأنسجة لجميع الكائنات الحية - كل هذه العمليات مستحيلة بدون مشاركة الإنزيمات. يتم توفير أي مظهر من مظاهر وظائف الكائن الحي - التنفس ، وتقلص العضلات ، والنشاط العصبي النفسي ، والتكاثر ، وما إلى ذلك - من خلال عمل الإنزيمات. يتم تحديد الخصائص الفردية للخلايا التي تؤدي وظائف معينة إلى حد كبير من خلال مجموعة فريدة من الإنزيمات ، والتي يكون إنتاجها مبرمجًا وراثيًا. يمكن أن يؤدي عدم وجود إنزيم واحد أو عيب فيه إلى عواقب سلبية خطيرة على الجسم.
الخصائص التحفيزية للإنزيمات
الإنزيمات هي الأكثر نشاطًا بين جميع المحفزات المعروفة. تستمر معظم التفاعلات في الخلية أسرع بملايين ومليارات المرات مما لو استمرت في غياب الإنزيمات. على سبيل المثال ، جزيء واحد من إنزيم الكاتلاز (سم.كاتاليس)إنه قادر على تحويل ما يصل إلى 10 آلاف جزيء من بيروكسيد الهيدروجين ، السامة للخلايا ، التي تشكلت أثناء أكسدة المركبات المختلفة ، إلى ماء وأكسجين في ثانية. تعود الخصائص التحفيزية للإنزيمات إلى قدرتها على تقليل طاقة التنشيط بشكل كبير للمركبات التي تدخل في التفاعل ، أي في وجود الإنزيمات ، يلزم طاقة أقل "لبدء" هذا التفاعل.
تاريخ اكتشاف الانزيمات
العمليات التي تتم بمشاركة الإنزيمات معروفة للإنسان منذ العصور القديمة ، لأن تحضير الخبز والجبن والنبيذ والخل يعتمد على العمليات الأنزيمية. ولكن فقط في عام 1833 ، ولأول مرة ، تم عزل مادة فعالة من إنبات حبوب الشعير ، والتي تحول النشا إلى سكر وسميت دياستاز (الآن يسمى هذا الإنزيم الأميليز). (سم.أميلاس)). في نهاية القرن التاسع عشر ثبت أن العصير الذي يتم الحصول عليه عن طريق فرك خلايا الخميرة يحتوي على خليط معقد من الإنزيمات التي تضمن العملية. التخمير الكحولي. منذ ذلك الوقت ، بدأت دراسة مكثفة للأنزيمات - هيكلها وآلية عملها. منذ أن تم الكشف عن دور التحفيز الحيوي في دراسة التخمير ، فقد ارتبطت بهذه العملية عمليتان تم تأسيسهما منذ القرن التاسع عشر. الأسماء هي "إنزيم" (مترجم من اليونانية "من الخميرة") و "إنزيم". صحيح أن المرادف الأخير يستخدم فقط في الأدب الروسي ، بالرغم من ذلك الاتجاه العلمي، تشارك في دراسة الإنزيمات والعمليات بمشاركتها ، يُطلق عليها تقليديًا علم الإنزيمات. في النصف الأول من القرن العشرين وجد أن الإنزيمات هي بروتينات بطبيعتها الكيميائية ، وفي النصف الثاني من القرن ، بالنسبة لمئات الإنزيمات ، تم تحديد تسلسل بقايا الأحماض الأمينية بالفعل ، وتم إنشاء الهيكل المكاني. في عام 1969 ، تم إجراء التركيب الكيميائي لإنزيم الريبونوكلياز لأول مرة. لقد تم إحراز تقدم هائل في فهم آلية عمل الإنزيمات.
موقع الإنزيمات في الجسم
في الخلية ، توجد بعض الإنزيمات في السيتوبلازم ، ولكن في الغالب ترتبط الإنزيمات ببعض الهياكل الخلوية ، حيث تُظهر عملها. في النواة ، على سبيل المثال ، هناك إنزيمات مسؤولة عن التكاثر - تخليق الحمض النووي (سم.أحماض ديوكسيريبونيكليك)(DNA polymerase) ، لنسخه - تكوين RNA (سم.أحماض الريبونوكليك)(بوليميراز الحمض النووي الريبي). في الميتوكوندريا ، توجد إنزيمات مسؤولة عن تراكم الطاقة ، في الجسيمات الحالة - معظم الإنزيمات المتحللة بالماء التي تشارك في تكسير الأحماض النووية والبروتينات.
شروط عمل الانزيمات
تستمر جميع التفاعلات التي تتضمن الإنزيمات بشكل رئيسي في وسط محايد ، قلوي قليلاً أو حمضي قليلاً. ومع ذلك ، يظهر الحد الأقصى لنشاط كل إنزيم فردي عند قيم الأس الهيدروجيني المحددة بدقة. بالنسبة لعمل معظم إنزيمات الحيوانات ذوات الدم الحار ، فإن درجة الحرارة الأكثر ملاءمة هي 37-40 درجة مئوية في النباتات عند درجات حرارة أقل من 0 درجة مئوية ، لا يتوقف عمل الإنزيمات تمامًا ، على الرغم من انخفاض النشاط الحيوي للنباتات بشكل حاد. العمليات الأنزيمية ، كقاعدة عامة ، لا يمكن أن تستمر في درجات حرارة أعلى من 70 درجة مئوية ، لأن الإنزيمات ، مثل جميع البروتينات ، تخضع للتمسخ الحراري (التدمير الهيكلي).
أحجام الإنزيمات وبنيتها
الوزن الجزيئي للأنزيمات ، مثل جميع البروتينات الأخرى ، يقع في حدود 10 آلاف - 1 مليون (ولكن يمكن أن يكون أكثر). قد تتكون من واحد أو أكثر من سلاسل عديد الببتيد وقد تكون بروتينات معقدة. يتضمن تكوين الأخير ، جنبًا إلى جنب مع مكون البروتين (apoenzyme) ، مركبات منخفضة الوزن الجزيئي - أنزيمات مساعدة (عوامل مساعدة ، أنزيمات مساعدة) ، بما في ذلك أيونات المعادن والنيوكليوتيدات والفيتامينات ومشتقاتها. تتشكل بعض الإنزيمات في شكل سلائف غير نشطة (proenzymes) وتصبح نشطة بعد تغييرات معينة في بنية الجزيء ، على سبيل المثال ، بعد انقسام جزء صغير منه. وتشمل هذه الانزيمات الهاضمةالتربسين (سم.تريبسين)وكيموتربسين (سم.كيموتربسين)، والتي يتم تصنيعها بواسطة خلايا البنكرياس في شكل سلائف غير نشطة (التربسينوجين والكيموتريبسينوجين) وتكتسب نشاطًا في الأمعاء الدقيقةكجزء من عصارة البنكرياس. تشكل العديد من الإنزيمات ما يسمى بمجمعات الإنزيم. مثل هذه المجمعات ، على سبيل المثال ، مدمجة في أغشية الخلايا أو عضيات الخلية وتشارك في نقل المواد.
ترتبط المادة (الركيزة) التي تخضع للتحول بموقع معين من الإنزيم ، قبل المركز النشط ، والذي يتكون من سلاسل جانبية من الأحماض الأمينية ، والتي غالبًا ما توجد في أقسام من سلسلة البولي ببتيد البعيدة بشكل كبير عن بعضها البعض. على سبيل المثال ، يتكون المركز النشط لجزيء كيموتربسين بواسطة بقايا الهيستيدين (سم.الهيستيدين)، تقع في سلسلة البولي ببتيد في الموضع 57 ، سيرين (سم.سيرين)في الموضع 195 وحمض الأسبارتيك في الموضع 102 (هناك 245 من الأحماض الأمينية في جزيء كيموتربسين). وبالتالي ، فإن التركيب المعقد لسلسلة البولي ببتيد في جزيء البروتين - يوفر الإنزيم فرصة للعديد من السلاسل الجانبية للأحماض الأمينية لتكون في مكان محدد بدقة وعلى مسافة معينة من بعضها البعض. الإنزيمات المساعدة هي أيضًا جزء من المركز النشط (لا يحتوي جزء البروتين والمكون غير البروتيني بشكل منفصل على نشاط إنزيمي ويكتسبان خصائص الإنزيم فقط عند دمجهما معًا).
مسار العمليات التي تنطوي على الإنزيمات
تتميز معظم الإنزيمات بخصوصية عالية (انتقائية) للعمل ، عندما يتم تحويل كل مادة متفاعلة (ركيزة) إلى منتج تفاعل بواسطة إنزيم خاص. في هذه الحالة ، يمكن أن يقتصر عمل الإنزيم بشكل صارم على ركيزة واحدة. على سبيل المثال ، إنزيم اليورياز (سم.اليوريا)، التي تشارك في تكسير اليوريا إلى الأمونيا وثاني أكسيد الكربون ، لا تتفاعل مع ميثيل يوريا ، وهو مشابه في الهيكل. تعمل العديد من الإنزيمات على العديد من المركبات ذات الصلة من الناحية الهيكلية أو على نوع واحد من الروابط الكيميائية (على سبيل المثال ، إنزيم الفوسفاتيز الذي يشق رابطة فسفودايستر (سم.فوسفاتيز)).
يقوم الإنزيم بعمله من خلال تكوين مركب الركيزة الإنزيمية ، والذي يتحلل بعد ذلك لتشكيل المنتجات رد فعل إنزيميوإطلاق الإنزيم. نتيجة لتشكيل مجمع الركيزة الإنزيمية ، تغير الركيزة تكوينها ؛ في هذه الحالة ، تضعف الرابطة الإنزيمية الكيميائية التي يتم تحويلها ويستمر التفاعل بإنفاق طاقة ابتدائي أقل ، وبالتالي بمعدل أعلى بكثير. مقياس معدل التفاعل الأنزيمي هو مقدار الركيزة التي خضعت للتحول لكل وحدة زمنية ، أو كمية المنتج المتكون. يمكن للعديد من التفاعلات الأنزيمية ، اعتمادًا على تركيز الركيزة ومنتج التفاعل في الوسط ، أن تستمر بشكل مباشر وفي غير إتجاه(الفائض من الركيزة يغير رد الفعل تجاه تكوين المنتج ، بينما مع التراكم المفرط لهذا الأخير ، سيحدث تخليق الركيزة). هذا يعني أن التفاعلات الأنزيمية يمكن أن تكون قابلة للعكس. على سبيل المثال ، الأنهيدراز الكربوني (سم.مطهر كربوني)يقوم الدم بتحويل ثاني أكسيد الكربون القادم من الأنسجة إلى حمض الكربونيك (H 2 CO 3) ، وفي الرئتين على العكس من ذلك ، فإنه يحفز تحويل حمض الكربونيك إلى ماء وثاني أكسيد الكربون ، والذي يتم إزالته أثناء الزفير. ومع ذلك ، يجب أن نتذكر أن الإنزيمات ، مثل المحفزات الأخرى ، لا يمكنها تحويل التوازن الديناميكي الحراري للتفاعل الكيميائي ، ولكنها تسرع بشكل كبير فقط في تحقيق هذا التوازن.
تسمية أسماء الإنزيمات
عند تسمية إنزيم ca ، يؤخذ اسم الركيزة كأساس وتضاف اللاحقة "aza". لذلك ، على وجه الخصوص ، ظهرت البروتينات - الإنزيمات التي تكسر البروتينات (البروتينات) ، الليباز (تكسر الدهون ، أو الدهون) ، إلخ. تلقت بعض الإنزيمات أسماء خاصة (تافهة) ، على سبيل المثال ، الإنزيمات الهاضمة - البيبسين (سم.بيبسين)، كيموتربسين (سم.كيموتربسين)و التربسين (سم.تريبسين).
في خلايا الجسم ، تحدث عدة آلاف من التفاعلات الأيضية المختلفة ، وبالتالي يوجد العديد من الإنزيمات. من أجل إدخال هذا التنوع في النظام ، تم اعتماد اتفاقية دولية بشأن تصنيف الإنزيمات. وفقًا لهذا النظام ، تم تقسيم جميع الإنزيمات ، اعتمادًا على نوع التفاعلات التي تحفزها ، إلى ست فئات رئيسية ، يتضمن كل منها عددًا من الفئات الفرعية. بالإضافة إلى ذلك ، تلقى كل إنزيم رقمًا رمزيًا مكونًا من أربعة أرقام (تشفير) واسمًا يشير إلى التفاعل الذي يحفزه هذا الإنزيم. الإنزيمات التي تحفز نفس التفاعل في الكائنات الحية أنواع مختلفة، قد تختلف اختلافًا كبيرًا عن بعضها البعض في بنية البروتين الخاصة بهم ، ولكن في التسمية لديهم اسم شائع ورقم كود واحد.
الأمراض المصاحبة لضعف إنتاج الإنزيمات
يؤدي غياب أو نقص نشاط أي إنزيم (غالبًا ما يكون نشاطًا مفرطًا) لدى البشر إلى تطور أمراض (اعتلالات إنزيمية) أو موت الكائن الحي. وبالتالي ، فإن مرض وراثي للأطفال - الجالاكتوز في الدم (يؤدي إلى التأخر العقلي) - يتطور بسبب انتهاك تخليق الإنزيم المسؤول عن تحويل الجالاكتوز (سم.الجالاكتوز)إلى جلوكوز سهل الهضم (سم.الجلوكوز). سبب مرض وراثي آخر - بيلة الفينيل كيتون ، مصحوبًا باضطراب نشاط عقلى، هو فقدان خلايا الكبد للقدرة على تخليق إنزيم يحفز تحويل الحمض الأميني فينيل ألانين (سم.فينيل ألانين)للتيروزين (سم.التيروزين). يستخدم تحديد نشاط العديد من الإنزيمات في الدم والبول والنخاع الشوكي وسوائل الجسم المنوية وغيرها من سوائل الجسم لتشخيص عدد من الأمراض. بمساعدة هذا التحليل لمصل الدم ، من الممكن الكشف عن مرحلة مبكرةاحتشاء عضلة القلب، التهاب الكبد الفيروسيوالتهاب البنكرياس والتهاب الكلية وأمراض أخرى.
استخدام الإنسان للإنزيمات
نظرًا لأن الإنزيمات تحتفظ بخصائصها خارج الجسم ، يتم استخدامها بنجاح في مختلف الصناعات. على سبيل المثال ، إنزيم البابايا المحلل للبروتين (من عصير البابايا (سم.بابايا)) - في التخمير ، لتليين اللحوم ؛ البيبسين - في إنتاج الحبوب "الجاهزة" وكدواء ؛ التربسين - في إنتاج منتجات أغذية الأطفال ؛ رينين (منفحة من معدة العجل) - في صناعة الجبن. يستخدم الكاتلاز على نطاق واسع في صناعات الأغذية والمطاط ، ويستخدم السليولاز والبكتيداز ، اللذان يعملان على تكسير السكريات ، لتصفية عصائر الفاكهة. الإنزيمات ضرورية عند إنشاء بنية البروتينات والأحماض النووية والسكريات ، في الهندسة الوراثية ، وما إلى ذلك بمساعدة الإنزيمات ، يتم الحصول على الأدوية والمركبات الكيميائية المعقدة.
تم اكتشاف قدرة بعض أشكال الأحماض النووية الريبية (الريبوزيمات) على تحفيز التفاعلات الفردية ، أي العمل كأنزيمات. ربما ، أثناء تطور العالم العضوي ، عملت الريبوزيمات كمحفزات حيوية قبل أن يتم نقل الوظيفة الأنزيمية إلى بروتينات تتكيف بشكل أفضل لأداء هذه المهمة.
- (من التخمير اللاتيني ، العجين المخمر) ، الإنزيمات ، المحفزات الحيوية ، محددة. البروتينات الموجودة في جميع الخلايا الحية وتلعب دور البيول. المحفزات. من خلالهم ، تتحقق الجينات. يتم تنفيذ المعلومات وجميع عمليات التبادل ... ... القاموس الموسوعي البيولوجي
- (لات. خميرة الخميرة ، من حار إلى حار). المواد العضوية التي تخمر الأجسام العضوية الأخرى دون أن تتعفن نفسها. قاموس كلمات اجنبيةالمدرجة في اللغة الروسية. Chudinov A.N. ، 1910. ENZYMES ... ... قاموس الكلمات الأجنبية للغة الروسية
- (من خميرة لاتينية) (إنزيمات) محفزات بيولوجية موجودة في جميع الخلايا الحية. القيام بتحويل المواد في الجسم وتوجيه وتنظيم عملية الأيض. الطبيعة الكيميائية للبروتينات. الإنزيمات ... ... كبير قاموس موسوعي
- (من الخميرة اللاتينية المخمرة) ، المحفزات البيولوجية الموجودة في جميع الخلايا الحية. إجراء التحولات (التمثيل الغذائي) للمواد في الجسم. الطبيعة الكيميائية للبروتينات. يشارك في العديد من التفاعلات البيوكيميائية في الخلية ... ... الموسوعة الحديثة
موجود ، عدد المرادفات: 2 محفز حيوي (1) إنزيمات (2) قاموس مرادف أيسيس. في. تريشين. 2013 ... قاموس مرادف
الانزيمات. انظر الانزيمات. (
تاريخ الدراسة
شرط إنزيماقترحه الكيميائي فان هيلمونت في القرن السابع عشر عند مناقشة آليات الهضم.
في يخدع. الثامن عشر - في وقت مبكر. القرن ال 19 كان معروفًا بالفعل أن اللحوم تُهضم عن طريق العصارة المعدية ، ويتحول النشا إلى سكر بفعل اللعاب. ومع ذلك ، كانت آلية هذه الظواهر غير معروفة.
تصنيف الانزيم
وفقًا لنوع التفاعلات المحفزة ، يتم تقسيم الإنزيمات إلى 6 فئات وفقًا للتصنيف الهرمي للإنزيمات (KF ، - كود تكوين الإنزيم). تم اقتراح تصنيف الاتحاد الدوليالكيمياء الحيوية والبيولوجيا الجزيئية (الاتحاد الدولي للكيمياء الحيوية والبيولوجيا الجزيئية). تحتوي كل فئة على فئات فرعية ، لذلك يتم وصف الإنزيم بمجموعة من أربعة أرقام مفصولة بالنقاط. على سبيل المثال ، يحمل اسم البيبسين EC 3.4.23.1. يصف الرقم الأول تقريبًا آلية التفاعل المحفز بواسطة الإنزيم:
- ك 1: أوكسيدوروكتازالتي تحفز الأكسدة أو الاختزال. مثال: الكاتلاز والكحول ديهيدروجينيز.
- ك 2: المحولات، مما يحفز النقل المجموعات الكيميائيةمن جزيء ركيزة إلى آخر. من بين الانتقالات ، تتميز الكينازات بشكل خاص ، حيث تنقل مجموعة الفوسفات ، كقاعدة عامة ، من جزيء ATP.
- ك 3: هيدروليساتالتي تحفز التحلل المائي روابط كيميائية. مثال: إستراتس ، بيبسين ، تريبسين ، أميليز ، ليباز بروتين شحمي.
- ك 4: لياس، مما يحفز تكسير الروابط الكيميائية دون التحلل المائي مع تكوين رابطة مزدوجة في أحد المنتجات.
- ك 5: الايزوميراز، والتي تحفز التغييرات الهيكلية أو الهندسية في جزيء الركيزة.
- ك 6: إنزيمات دمج الجزيئات، تحفيز تكوين روابط كيميائية بين الركائز بسبب التحلل المائي ATP. مثال: بوليميراز الحمض النووي.
البحث الحركي
أبسط وصف حركيةالتفاعلات الأنزيمية أحادية الركيزة هي معادلة ميكايليس-مينتين (انظر الشكل). حتى الآن ، تم وصف العديد من آليات عمل الإنزيم. على سبيل المثال ، يتم وصف عمل العديد من الإنزيمات بواسطة مخطط آلية "بينج بونج".
في 1972-1973. تم إنشاء أول نموذج ميكانيكي كمي للحفز الإنزيمي (المؤلفون M.V. Volkenshtein ، R.R.
هيكل وآلية عمل الإنزيمات
يتم تحديد نشاط الإنزيمات من خلال هيكلها ثلاثي الأبعاد.
مثل جميع البروتينات ، يتم تصنيع الإنزيمات كسلسلة خطية من الأحماض الأمينية التي تطوى بطريقة معينة. يتم طي كل تسلسل من الأحماض الأمينية بطريقة معينة ، ويكون للجزيء الناتج (بروتين الكريات) خصائص فريدة من نوعها. يمكن دمج العديد من سلاسل البروتين في مركب بروتيني. يتم تدمير البنية الثلاثية للبروتينات عند تسخينها أو تعرضها لمواد كيميائية معينة.
الموقع النشط للإنزيمات
في المركز النشط التخصيص المشروط:
- مركز تحفيزي - يتفاعل كيميائياً بشكل مباشر مع الركيزة ؛
- مركز الربط (موقع التلامس أو "المرساة") - يوفر تقاربًا محددًا للركيزة وتشكيل مركب الركيزة الإنزيمية.
لتحفيز التفاعل ، يجب أن يرتبط الإنزيم بواحدة أو أكثر من الركائز. يتم طي سلسلة بروتين الإنزيم بطريقة تتشكل فجوة ، أو انخفاض ، على سطح الكريات ، حيث ترتبط الركائز. تسمى هذه المنطقة موقع ربط الركيزة. عادة ما يتزامن مع الموقع النشط للإنزيم أو يقع بالقرب منه. تحتوي بعض الإنزيمات أيضًا على مواقع ربط للعوامل المساعدة أو أيونات المعادن.
يرتبط الإنزيم بالركيزة:
- ينظف الركيزة من الماء "معطف الفرو"
- يرتب جزيئات الركيزة المتفاعلة في الفضاء بالطريقة اللازمة لمواصلة التفاعل
- يستعد للتفاعل (على سبيل المثال ، يستقطب) جزيئات الركيزة.
عادةً ما يحدث ارتباط الإنزيم بركيزة بسبب الروابط الأيونية أو الهيدروجينية ، ونادرًا ما يكون ذلك بسبب الروابط التساهمية. في نهاية التفاعل ، يتم فصل منتجه (أو منتجاته) عن الإنزيم.
نتيجة لذلك ، يقلل الإنزيم من طاقة تنشيط التفاعل. هذا لأنه في وجود الإنزيم ، يأخذ التفاعل مسارًا مختلفًا (في الواقع ، يحدث تفاعل مختلف) ، على سبيل المثال:
في حالة عدم وجود إنزيم:
- أ + ب = أب
في وجود انزيم:
- A + F = AF
- AF + V = AVF
- AVF \ u003d AV + F
حيث A ، B - ركائز ، AB - منتج تفاعل ، F - إنزيم.
لا تستطيع الإنزيمات توفير الطاقة للتفاعلات العصبية (التي تتطلب طاقة) من تلقاء نفسها. لذلك ، فإن الإنزيمات التي تنفذ مثل هذه التفاعلات تقرنها بتفاعلات طاردة للطاقة تتقدم مع إطلاق المزيد من الطاقة. على سبيل المثال ، غالبًا ما تقترن تفاعلات تخليق البوليمر الحيوي مع تفاعل التحلل المائي ATP.
تتميز المراكز النشطة لبعض الإنزيمات بظاهرة التعاون.
النوعية
عادة ما تظهر الإنزيمات خصوصية عالية لركائزها (خصوصية الركيزة). يتم تحقيق ذلك من خلال التكامل الجزئي للشكل وتوزيع الشحنة والمناطق الكارهة للماء على جزيء الركيزة وفي موقع ربط الركيزة على الإنزيم. تظهر الإنزيمات عادة أيضًا مستوى عالالخصوصية الفراغية (تشكل كمنتج واحدًا فقط من الأيزومرات الفراغية المحتملة أو تستخدم فقط أيسومر فراغي واحد كركيزة) ، انتقائية رجعية (تشكل أو تكسر رابطة كيميائية في واحد فقط من المواضع المحتملة للركيزة) والانتقائية الكيميائية (تحفز فقط تفاعل كيميائي واحد خارج من عدة حالات ممكنة لظروف معينة). على الرغم من المستوى العام العالي للخصوصية ، يمكن أن تختلف درجة الركيزة وخصوصية تفاعل الإنزيمات. على سبيل المثال ، فإن endopeptidase trypsin يكسر رابطة الببتيد فقط بعد الأرجينين أو الليسين ، ما لم يكن متبوعًا بالبرولين ، ويكون البيبسين أقل تحديدًا ويمكن أن يكسر رابطة الببتيد بعد العديد من الأحماض الأمينية.
نموذج مفتاح القفل
تخمين كوشلاند الملائم المستحث
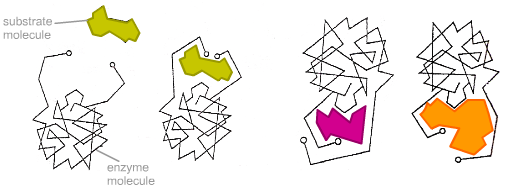
الموقف الأكثر واقعية في حالة المطابقة المستحثة. ركائز غير صحيحة - كبيرة جدًا أو صغيرة جدًا - لا تناسب الموقع النشط
في عام 1890 ، اقترح إميل فيشر أن خصوصية الإنزيمات يتم تحديدها من خلال التطابق الدقيق بين شكل الإنزيم والركيزة. يسمى هذا الافتراض نموذج القفل والمفتاح. يرتبط الإنزيم بالركيزة ليشكل مركب ركيزة إنزيم قصير العمر. ومع ذلك ، على الرغم من أن هذا النموذج يشرح الخصوصية العالية للإنزيمات ، إلا أنه لا يفسر ظاهرة استقرار الحالة الانتقالية التي لوحظت في الممارسة.
نموذج ملائم مستحث
في عام 1958 ، اقترح دانيال كوشلاند تعديل نموذج قفل المفاتيح. الإنزيمات بشكل عام ليست جامدة ، لكنها جزيئات مرنة. يمكن أن يغير الموقع النشط للإنزيم الشكل بعد ربط الركيزة. تتخذ المجموعات الجانبية للأحماض الأمينية للموقع النشط موقعًا يسمح للإنزيم بأداء وظيفته التحفيزية. في بعض الحالات ، يغير جزيء الركيزة أيضًا الشكل بعد الارتباط بالموقع النشط. على عكس نموذج قفل المفاتيح ، لا يشرح نموذج الملاءمة المستحث خصوصية الإنزيمات فحسب ، بل يشرح أيضًا استقرار حالة الانتقال. هذا النموذج كان يسمى "قفاز اليد".
التعديلات
تخضع العديد من الإنزيمات لتعديلات بعد تخليق سلسلة البروتين ، والتي بدونها لا يظهر الإنزيم نشاطه إلى أقصى حد. تسمى هذه التعديلات التعديلات اللاحقة للترجمة (المعالجة). أحد أكثر أنواع التعديل شيوعًا هو إضافة مجموعات كيميائية إلى المخلفات الجانبية لسلسلة البولي ببتيد. على سبيل المثال ، تسمى إضافة بقايا حمض الفوسفوريك الفسفرة ويتم تحفيزها بواسطة إنزيم كيناز. العديد من إنزيمات حقيقية النواة جليكوزيلاتي ، أي معدلة بأوليجومرات الكربوهيدرات.
نوع آخر شائع من التعديلات اللاحقة للترجمة هو انقسام سلسلة البولي ببتيد. على سبيل المثال ، يتم الحصول على الكيموتريبسين (بروتياز يشارك في الهضم) عن طريق شق منطقة بولي ببتيد من كيموتربسينوجين. Chymotrypsinogen هو سلائف غير نشطة للكيموتريبسين ويتم تصنيعه في البنكرياس. يتم نقل الشكل غير النشط إلى المعدة حيث يتم تحويله إلى كيموتربسين. هذه الآلية ضرورية لتجنب انقسام البنكرياس والأنسجة الأخرى قبل دخول الإنزيم إلى المعدة. يُشار أيضًا إلى سلائف إنزيم غير نشط باسم "زيموجين".
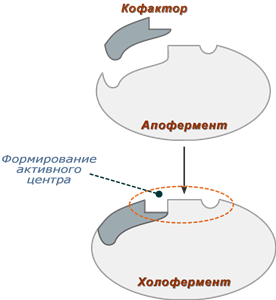
العوامل المساعدة للإنزيم
تؤدي بعض الإنزيمات الوظيفة التحفيزية من تلقاء نفسها ، دون أي مكونات إضافية. ومع ذلك ، هناك إنزيمات تتطلب مكونات غير بروتينية للتحفيز. يمكن أن تكون العوامل المساعدة إما جزيئات غير عضوية (أيونات المعادن ، ومجموعات الحديد والكبريت ، وما إلى ذلك) أو عضوية (على سبيل المثال ، الفلافين أو الهيم). تسمى العوامل المساعدة العضوية التي ترتبط ارتباطًا وثيقًا بالإنزيم أيضًا بالمجموعات الاصطناعية. تسمى العوامل المساعدة العضوية التي يمكن فصلها عن الإنزيم بالإنزيمات المساعدة.
يُطلق على الإنزيم الذي يتطلب عاملًا مساعدًا لعرض نشاط تحفيزي ، ولكنه غير مرتبط به ، إنزيم apo-enzyme. يسمى إنزيم apo-en-in-in-a-cofactor بـ holo-enzyme. ترتبط معظم العوامل المساعدة بالإنزيم عن طريق تفاعلات غير تساهمية ولكنها قوية إلى حد ما. هناك أيضًا مجموعات صناعية مرتبطة تساهميًا بالإنزيم ، مثل ثيامين بيروفوسفات في بيروفات ديهيدروجينيز.
تنظيم الانزيم
تحتوي بعض الإنزيمات على مواقع ربط جزيئات صغيرة وقد تكون ركائز أو منتجات من المسار الأيضي الذي يدخله الإنزيم. إنها تقلل أو تزيد من نشاط الإنزيم ، مما يخلق فرصة للتغذية الراجعة.
تثبيط المنتج النهائي
المسار الأيضي - سلسلة من التفاعلات الأنزيمية المتتالية. غالبًا ما يكون المنتج النهائي للمسار الأيضي مثبطًا للإنزيم الذي يسرع أول التفاعلات في هذا المسار الأيضي. إذا كان المنتج النهائي كبيرًا جدًا ، فإنه يعمل كمثبط للإنزيم الأول ، وإذا أصبح المنتج النهائي بعد ذلك صغيرًا جدًا ، يتم تنشيط الإنزيم الأول مرة أخرى. وبالتالي ، فإن تثبيط المنتج النهائي وفقًا لمبدأ التغذية الراجعة السلبية هو وسيلة مهمة للحفاظ على التوازن (الثبات النسبي لظروف البيئة الداخلية للجسم).
تأثير الظروف البيئية على نشاط الإنزيم
يعتمد نشاط الإنزيمات على الظروف في الخلية أو الكائن الحي - الضغط ، حموضة البيئة ، درجة الحرارة ، تركيز الأملاح الذائبة (القوة الأيونية للمحلول) ، إلخ.
أشكال متعددة من الإنزيمات
يمكن تقسيم الأشكال المتعددة من الإنزيمات إلى فئتين:
- الإنزيمات
- صيغ الجمع الصحيحة (صحيح)
الإنزيمات- هذه إنزيمات ، يتم ترميز تركيبها بواسطة جينات مختلفة ، ولها هياكل أولية مختلفة وخصائص مختلفة ، لكنها تحفز نفس التفاعل. أنواع الإنزيمات المتشابهة:
- عضوي - إنزيمات تحلل السكر في الكبد والعضلات.
- الخلوية - السيتوبلازمية والميتوكوندريا نازعة الهيدروجين (الإنزيمات مختلفة ، لكنها تحفز نفس التفاعل).
- هجين - تتشكل الإنزيمات ذات البنية الرباعية نتيجة الارتباط غير التساهمي للوحدات الفرعية الفردية (اللاكتات ديهيدروجينيز - 4 وحدات فرعية من نوعين).
- متحولة - تتشكل نتيجة طفرة واحدة في الجين.
- Alloenzymes - مشفر بواسطة أليلات مختلفة من نفس الجين.
صيغ الجمع الصحيحة(صحيح) هي الإنزيمات التي يتم ترميز تركيبها بنفس الأليل لنفس الجين ، ولها نفس البنية الأساسية والخصائص ، ولكن بعد التوليف على الريبوسومات تخضع للتعديل وتصبح مختلفة ، على الرغم من أنها تحفز نفس التفاعل.
تختلف الإنزيمات الإنزيمية على المستوى الجيني وتختلف عن التسلسل الأساسي ، وتصبح الأشكال المتعددة الحقيقية مختلفة في مستوى ما بعد الترجمة.
الأهمية الطبية
تم إنشاء الصلة بين الإنزيمات والأمراض الأيضية الوراثية لأول مرة A. Garrodomفي عام 1910 ووصف جارود الأمراض المرتبطة بعيوب الإنزيم بأنها "أخطاء فطرية في التمثيل الغذائي".
إذا حدثت طفرة في الجين الذي يشفر إنزيمًا معينًا ، فقد يتغير تسلسل الحمض الأميني للإنزيم. في الوقت نفسه ، نتيجة لمعظم الطفرات ، يتناقص نشاطها التحفيزي أو يختفي تمامًا. إذا تلقى الكائن الحي اثنين من هذه الجينات الطافرة (واحد من كل والد) ، فإن التفاعل الكيميائي المحفز بواسطة هذا الإنزيم يتوقف عن الحدوث في الجسم. على سبيل المثال ، يرتبط ظهور ألبينو بوقف إنتاج إنزيم التيروزيناز ، المسؤول عن إحدى مراحل تخليق صبغة الميلانين الداكنة. يرتبط Phenylketonuria بنقص أو غياب نشاط إنزيم phenylalanine-4-hydroxylase في الكبد.
حاليًا ، عُرفت مئات الأمراض الوراثية المرتبطة بعيوب الإنزيم. تم تطوير طرق العلاج والوقاية من العديد من هذه الأمراض.
الاستخدام العملي
تستخدم الإنزيمات على نطاق واسع في الاقتصاد الوطني - الغذاء ، صناعة النسيج، في علم الصيدلة والطب. تؤثر معظم الأدوية على مسار العمليات الأنزيمية في الجسم ، حيث تبدأ أو توقف تفاعلات معينة.
مجال أوسع لتطبيق الإنزيمات فيه بحث علميوفي الطب.
ملحوظات
الأدب
شاهد ما هي "الإنزيمات" في القواميس الأخرى:
إنزيمات- (إنزيمات متزامنة ؛ دياستاز فرنسي) ، بيول. العوامل التي تحفز معظم الكيماويات. ردود الفعل التي تكمن وراء النشاط الحيوي للخلية والكائن الحي. عدد من الخصائص المميزة هي القابلية للحرارة ، وخصوصية العمل ، والكفاءة التحفيزية العالية ، ... ... كبير الموسوعة الطبية
- (من التخمير اللاتيني ، العجين المخمر) ، الإنزيمات ، المحفزات الحيوية ، محددة. البروتينات الموجودة في جميع الخلايا الحية وتلعب دور البيول. المحفزات. من خلالهم ، تتحقق الجينات. يتم تنفيذ المعلومات وجميع عمليات التبادل ... ... القاموس الموسوعي البيولوجي
- (لات. خميرة الخميرة ، من حار إلى حار). المواد العضوية التي تخمر الأجسام العضوية الأخرى دون أن تتعفن نفسها. قاموس الكلمات الأجنبية المدرجة في اللغة الروسية. Chudinov A.N. ، 1910. ENZYMES ... ... قاموس الكلمات الأجنبية للغة الروسية
- (من خميرة لاتينية) (إنزيمات) محفزات بيولوجية موجودة في جميع الخلايا الحية. القيام بتحويل المواد في الجسم وتوجيه وتنظيم عملية الأيض. الطبيعة الكيميائية للبروتينات. الإنزيمات ... ... قاموس موسوعي كبير
- (من الخميرة اللاتينية المخمرة) ، المحفزات البيولوجية الموجودة في جميع الخلايا الحية. إجراء التحولات (التمثيل الغذائي) للمواد في الجسم. الطبيعة الكيميائية للبروتينات. يشارك في العديد من التفاعلات البيوكيميائية في الخلية ... ... الموسوعة الحديثة
موجود ، عدد المرادفات: 2 محفز حيوي (1) إنزيمات (2) قاموس مرادف أيسيس. في. تريشين. 2013 ... قاموس مرادف
الانزيمات. انظر الانزيمات. (
مقدمة
1. الإنزيمات
1.1 مصطلح "الإنزيمات" ، دور بيولوجيالانزيمات
1.2 السمات الهيكلية للأنزيمات البسيطة والمعقدة. مزايا على المحفزات الكيميائية
1.3 طرق عزل الإنزيم
1.4 تصنيف تسمية الإنزيمات حسب نوع التفاعل المحفز
1.5 النطاق
2. التحفيز الحيوي
2.1 كيف تعمل الإنزيمات
2.2 العوامل المؤثرة على تفاعلات التخمير
3. ميزات المحاكاة الحيوية
خاتمة
قائمة المصادر المستخدمة
تفاعل محفز الإنزيم
مقدمة
اخترت موضوع "الانزيمات. التحفيز الحيوي. إمكانيات المحاكاة الحيوية "، لأن مؤخرًا الأدويةبدأ استخدام الأدوية التي لها تأثير مباشر على العمليات الأنزيمية في الجسم على نطاق واسع. كما تعلم ، يوجد في أجسامنا العديد من الإنزيمات التي تساهم في تنفيذ عمليات التمثيل الغذائي (التنفس ، الهضم ، تقلص العضلات ، التمثيل الضوئي) ، والتي تحدد عملية الحياة ذاتها. لذلك ، أصبحت الأدوية مستخدمة على نطاق واسع في علاج الأمراض المصحوبة بعمليات نخرية قيحية ، وتخثر وانصمام خثاري ، واضطرابات في الجهاز الهضمي. بدأت مستحضرات الإنزيم أيضًا في العثور على تطبيقات في علاج أمراض الأورام.
تلعب الإنزيمات دورًا مهمًا في العديد من العمليات التكنولوجية. تسمح لك الإنزيمات عالية الجودة بتحسين التكنولوجيا وخفض التكاليف وحتى الحصول على منتجات جديدة.
حاليًا ، تُستخدم الإنزيمات في أكثر من 25 صناعة: صناعة الأغذية ، والأدوية ، ولب الورق والورق ، والصناعات الخفيفة ، وكذلك في الزراعة.
الغرض من الملخص الخاص بي هو: دراسة تفصيلية لمفاهيم الإنزيم والحفز الأنزيمي (التحفيز الحيوي).
في هذا الصدد ، أصبح من المثير للاهتمام بالنسبة لي معرفة تاريخ ظهور الإنزيمات الأولى ، والسمات الهيكلية ، وخصائصها ، والتصنيف ، ومبدأ العمل ، وطرق عزل الإنزيمات.
1. الإنزيمات
1.1 مصطلح "الإنزيمات" الدور البيولوجي للإنزيمات
طوال تاريخ وجوده ، استخدم الإنسان الإنزيمات ، غالبًا بدون معنى.
شرط إنزيماقترحه الكيميائي فان هيلمونت في القرن السابع عشر عند مناقشة آليات الهضم. في يخدع. الثامن عشر - في وقت مبكر. القرن ال 19 كان من المعروف بالفعل أن اللحوم مهضومة عصير المعدةوالنشا يتحول إلى سكر عن طريق اللعاب. ومع ذلك ، كانت آلية هذه الظواهر غير معروفة. في القرن 19 لويس باستور ، بدراسة تحول الكربوهيدرات إلى الإيثانولتحت تأثير الخميرة ، توصل إلى استنتاج مفاده أن هذه العملية (التخمير) يتم تحفيزها بواسطة نوع من القوة الحيوية الموجودة في خلايا الخميرة. شرط إنزيم(من اليونانية ἐ ν- - في - و ζύμη - الخميرة ، العجين المخمر) في عام 1876.
تم عزل أول إنزيم بلوري (يورياز) بواسطة عالم الكيمياء الحيوية الأمريكي د.سومنر في عام 1926.
إذن ما هي الإنزيمات؟ الإنزيمات (من التخمير اللاتيني - التخمير ، العجين المخمر) أو الإنزيمات - المواد العضويةطبيعة البروتين ، التي يتم تصنيعها في الخلايا وتؤدي في كثير من الأحيان إلى تسريع التفاعلات التي تحدث فيها ، دون الخضوع لتحولات كيميائية.
حتى الآن ، هناك أكثر من 3000 إنزيم معروف. كل منهم لديه عدد من الخصائص المحددة التي تميزها عن المحفزات غير العضوية. فقط في جسم الانسانتحدث آلاف التفاعلات الأنزيمية كل ثانية. تلعب الإنزيمات دورًا مهمًا في جميع عمليات الحياة ، وتوجيه وتنظيم عملية التمثيل الغذائي في الجسم.
وتجدر الإشارة أيضا إلى أن كل شيء الطبيعة الحيةموجود فقط من خلال التحفيز الحيوي. لا عجب أن الفيزيولوجي الروسي العظيم ، حائز على جائزة نوبلا. دعا بافلوف الإنزيمات ناقلات الحياة.
1.2 السمات الهيكلية للأنزيمات البسيطة والمعقدة. مزايا على المحفزات الكيميائية
حسب التركيب ، يمكن أن تكون الإنزيمات عبارة عن بروتينات بسيطة مكونة من مكون واحد وبروتينات معقدة مكونة من مكونين. في الحالة الثانية ، لا يحتوي الإنزيم على مكون البروتين فقط ، وهو الإنزيم ( أبوينزيم), ولكن أيضًا مجموعة إضافية من الطبيعة غير البروتينية - إنزيم (مساعد الانزيم). المواد الأخيرة ، على عكس مكون البروتين في الإنزيم (أبوينزيم) ، لها وزن جزيئي صغير نسبيًا ، وكقاعدة عامة ، قابلة للحرارة.
تم توضيح الطبيعة الكيميائية لأهم الإنزيمات المساعدة في الثلاثينيات من القرن الحالي بفضل أعمال O. Warburg و R. Kuhn و P. Carrera وغيرهم. واتضح أن دور الإنزيمات المساعدة في الإنزيمات المكونة من عنصرين يتم لعبها تحتوي على معظم الفيتامينات (E ، K ، Q ، B1 ، B2 ، B6 B12 ، C ، H ، وما إلى ذلك) أو المركبات المبنية بمشاركة الفيتامينات ، ولهذا السبب يجب تناولها مع الطعام. تظهر العديد من الإنزيمات ذات الوزن الجزيئي الكبير نشاطًا تحفيزيًا فقط في وجود مواد معينة منخفضة الوزن الجزيئي تسمى الإنزيمات المساعدة (أو العوامل المساعدة).
السمة المميزة للإنزيمات المكونة من عنصرين هي أنه لا جزء البروتين ولا المجموعة الإضافية بشكل فردي لهما نشاط تحفيزي ملحوظ. فقط معقداتها تظهر خصائص أنزيمية. في الوقت نفسه ، يزيد البروتين بشكل حاد من النشاط التحفيزي للمجموعة الإضافية المتأصلة فيه في الحالة الحرة إلى حد ضئيل ؛ تقوم المجموعة الإضافية بتثبيت جزء البروتين وتجعله أقل عرضة لعوامل تغيير الطبيعة.
الإنزيمات أحادية المكون هي بروتينات بسيطة. بالنسبة للإنزيمات أحادية المكون التي لا تحتوي على مجموعة إضافية يمكن أن تتلامس مباشرة مع المركب المحول. يتم تنفيذ هذه الوظيفة بواسطة جزء من جزيء البروتين يسمى مركز التحفيز. من المفترض أن المركز التحفيزي للإنزيم أحادي المكون هو مزيج فريد من العديد من بقايا الأحماض الأمينية الموجودة في جزء معين من جزيء البروتين. توجد بقايا الأحماض الأمينية التي تشكل المركز التحفيزي لأنزيم مكون واحد في نقاط مختلفة في سلسلة بولي ببتيد واحدة. لذلك ، ينشأ المركز التحفيزي في اللحظة التي يكتسب فيها جزيء البروتين هيكله الثلاثي المتأصل. وبالتالي ، فإن التغيير في البنية الثلاثية للإنزيم تحت تأثير عوامل معينة يمكن أن يؤدي إلى تشوه مركز الحفاز وتغيير في النشاط الأنزيمي.
بالإضافة إلى المركز التحفيزي الذي يتكون من مزيج من جذور الأحماض الأمينية أو إضافة أنزيم ، يتم تمييز مركزين آخرين في الإنزيمات: الركيزة والتمايز. يُفهم تحت مركز الركيزة قسم جزيء الإنزيم المسؤول عن ارتباط مادة (ركيزة) تخضع للتحول الأنزيمي. غالبًا ما يُطلق على هذا الموقع اسم "منطقة التثبيت" للإنزيم ، حيث تصبح الركيزة ، مثل السفينة عند المرساة. لا ينبغي اعتبار مفهوم المركز الحفاز والركيزة مطلقًا. في الإنزيمات الحقيقية ، قد يتطابق موقع الركيزة مع (أو يتداخل مع) الموقع الحفاز. علاوة على ذلك ، يمكن تشكيل المركز الحفاز أخيرًا في وقت ربط الركيزة. لذلك ، غالبًا ما يتحدثون عن المركز النشط للإنزيم ، وهو مزيج من الأول والثاني.
المركز الخيفي هو جزء من جزيء الإنزيم ، نتيجة للتعلق الذي يغير به وزن جزيئي منخفض معين (وأحيانًا وزن جزيئي مرتفع) البنية الثلاثية لجزيء البروتين. نتيجة لذلك ، يتغير تكوين المركز النشط ، مصحوبًا بزيادة أو نقصان في النشاط التحفيزي للإنزيم.
تحتوي الإنزيمات كمحفزات بيولوجية على عدد من الميزات التي تختلف عن المحفزات غير العضوية:
تستمر التفاعلات الأنزيمية في ظل ظروف طبيعية فسيولوجية لكائن حي ولا تتطلب ظروفًا قاسية - درجة حرارة مرتفعة ، حموضة عالية للوسط ، ضغط مفرط ؛
إن الإنزيمات كمحفزات محددة بدقة ، فهي تحفز فقط تفاعلات كيميائية حيوية معينة ، تعمل فقط على ركيزة معينة ؛
تستمر التفاعلات الأنزيمية في الكائنات الحية بالتتابع ، بحيث تكون الركيزة لكل إنزيم لاحق هي المنتج النهائي للتفاعل الأنزيمي الذي يسبقه ؛
معدل التفاعلات الأنزيمية مرتفع ولكنه يعتمد على عوامل معينة. تسريع التفاعل بمقدار 10 8-10 20 مرة. تأتي التفاعلات الأنزيمية مع مردود 100٪ ولا تعطي منتجات ثانوية. يستخدم الكتال للتعبير عن النشاط التحفيزي وفقًا لتوصيات الاتحاد البيوكيميائي الدولي. كاتال (قطة) هو نشاط تحفيزي قادر على تنفيذ تفاعل بمعدل 1 مول في الثانية ؛
جميع الإنزيمات عبارة عن بروتينات. يختلف الوزن الجزيئي للأنزيمات بشكل كبير من 12 * 10 3 إلى 10 * 10 6 Da.
1.3 طرق عزل الانزيم
تبدأ عملية عزل البروتين بنقل بروتينات الأنسجة إلى محلول. للقيام بذلك ، يتم طحن الأنسجة (المادة) التي يتم الحصول على الإنزيم منها بعناية في الخالط في وجود محلول عازل. لتدمير الخلايا بشكل أفضل ، تتم إضافة رمل الكوارتز إلى المادة إذا كانت المادة مطحونة في ملاط. نتيجة لذلك ، يتم الحصول على ملاط - متجانس. إذا لم يتم إجراء تجزئة أولية لعضيات الخلية ، فإن المتجانس يحتوي على شظايا من الخلايا والنوى والبلاستيدات الخضراء وعضيات الخلية الأخرى والأصباغ والبروتينات القابلة للذوبان.
عند عزل الإنزيمات من أنسجة الكائنات الحية ، بما في ذلك النباتات ، من الضروري ملاحظة الظروف التي لا تسبب تمسخ البروتين. يتم تنفيذ جميع الأعمال عند درجة حرارة منخفضة (4 0 درجة مئوية) وعند قيم الأس الهيدروجيني لمحلول العازلة الأمثل لهذا الإنزيم.
بعد نقل الإنزيمات من النسيج إلى الحالة المذابة ، يخضع المجانسة للطرد المركزي لفصل الجزء غير القابل للذوبان من المادة ، ثم يتم عزل الإنزيمات التالية في أجزاء منفصلة من المستخلص - الطرد المركزي.
نظرًا لأن جميع الإنزيمات عبارة عن بروتينات ، يتم استخدام نفس طرق العزل للحصول على مستحضرات إنزيم منقى كما هو الحال عند العمل مع البروتينات.
مقدمة
1. الإنزيمات
1.1 مصطلح "الإنزيمات" الدور البيولوجي للإنزيمات
1.2 السمات الهيكلية للأنزيمات البسيطة والمعقدة. مزايا على المحفزات الكيميائية
1.3 طرق عزل الانزيم
1.4 تصنيف تسمية الإنزيمات حسب نوع التفاعل المحفز
1.5 النطاق
2. التحفيز الحيوي
2.1 كيف تعمل الإنزيمات
2.2 العوامل المؤثرة على تفاعلات التخمير
3. ميزات المحاكاة الحيوية
خاتمة
قائمة المصادر المستخدمة
تفاعل محفز الإنزيم
مقدمة
اخترت موضوع "الانزيمات. التحفيز الحيوي. إمكانيات المحاكاة الحيوية ، لأن الأدوية التي لها تأثير مباشر على العمليات الأنزيمية في الجسم أصبحت مؤخرًا تستخدم على نطاق واسع كأدوية. كما تعلم ، يوجد في أجسامنا العديد من الإنزيمات التي تساهم في تنفيذ عمليات التمثيل الغذائي (التنفس ، الهضم ، تقلص العضلات ، التمثيل الضوئي) ، والتي تحدد عملية الحياة ذاتها. لذلك ، أصبحت الأدوية مستخدمة على نطاق واسع في علاج الأمراض المصحوبة بعمليات نخرية قيحية ، وتخثر وانصمام خثاري ، واضطرابات في الجهاز الهضمي. بدأت مستحضرات الإنزيم أيضًا في العثور على تطبيقات في علاج أمراض الأورام.
تلعب الإنزيمات دورًا مهمًا في العديد من العمليات التكنولوجية. تسمح لك الإنزيمات عالية الجودة بتحسين التكنولوجيا وخفض التكاليف وحتى الحصول على منتجات جديدة.
حاليًا ، تُستخدم الإنزيمات في أكثر من 25 صناعة: صناعة الأغذية ، والأدوية ، ولب الورق والورق ، والصناعات الخفيفة ، وكذلك في الزراعة.
الغرض من الملخص الخاص بي هو: دراسة تفصيلية لمفاهيم الإنزيم والحفز الأنزيمي (التحفيز الحيوي).
في هذا الصدد ، أصبح من المثير للاهتمام بالنسبة لي معرفة تاريخ ظهور الإنزيمات الأولى ، والسمات الهيكلية ، وخصائصها ، والتصنيف ، ومبدأ العمل ، وطرق عزل الإنزيمات.
1. الإنزيمات
1.1 مصطلح "الإنزيمات" الدور البيولوجي للإنزيمات
طوال تاريخ وجوده ، استخدم الإنسان الإنزيمات ، غالبًا بدون معنى.
شرط إنزيماقترحه الكيميائي فان هيلمونت في القرن السابع عشر عند مناقشة آليات الهضم. في يخدع. الثامن عشر - في وقت مبكر. القرن ال 19 كان معروفًا بالفعل أن اللحوم تُهضم عن طريق العصارة المعدية ، ويتحول النشا إلى سكر بفعل اللعاب. ومع ذلك ، كانت آلية هذه الظواهر غير معروفة. في القرن 19 توصل لويس باستور ، الذي درس تحويل الكربوهيدرات إلى كحول إيثيلي تحت تأثير الخميرة ، إلى استنتاج مفاده أن هذه العملية (التخمير) يتم تحفيزها بواسطة عامل معين. قوة الحياةوجدت في خلايا الخميرة. شرط إنزيم(من اليونانية ἐν- - في- و ζύμη - الخميرة ، العجين المخمر) في عام 1876.
تم عزل أول إنزيم بلوري (يورياز) بواسطة عالم الكيمياء الحيوية الأمريكي د.سومنر في عام 1926.
إذن ما هي الإنزيمات؟ الإنزيمات (من التخمير - التخمير ، العجين المخمر) أو الإنزيمات هي مواد عضوية ذات طبيعة بروتينية يتم تصنيعها في الخلايا وتسرع في كثير من الأحيان التفاعلات التي تحدث فيها دون الخضوع لتحولات كيميائية.
حتى الآن ، هناك أكثر من 3000 إنزيم معروف. كل منهم لديه عدد من الخصائص المحددة التي تميزها عن المحفزات غير العضوية. في جسم الإنسان وحده ، تحدث آلاف التفاعلات الأنزيمية كل ثانية. تلعب الإنزيمات دورًا مهمًا في جميع عمليات الحياة ، وتوجيه وتنظيم عملية التمثيل الغذائي في الجسم.
وتجدر الإشارة أيضًا إلى أن الحياة البرية موجودة فقط بسبب التحفيز الحيوي. لا عجب في أن الفيزيولوجي الروسي العظيم ، الحائز على جائزة نوبل آي. دعا بافلوف الإنزيمات ناقلات الحياة.
1.2 السمات الهيكلية للأنزيمات البسيطة والمعقدة. مزايا على المحفزات الكيميائية
حسب التركيب ، يمكن أن تكون الإنزيمات عبارة عن بروتينات بسيطة مكونة من مكون واحد وبروتينات معقدة مكونة من مكونين. في الحالة الثانية ، ليس فقط مكون البروتين ، إنزيم (apoenzyme ), ولكن أيضًا مجموعة إضافية من الطبيعة غير البروتينية - أنزيم (أنزيم) . المواد الأخيرة ، على عكس مكون البروتينالإنزيم (apoenzyme) ، له وزن جزيئي صغير نسبيًا ، وكقاعدة عامة ، قابل للحرارة.
تم توضيح الطبيعة الكيميائية لأهم الإنزيمات المساعدة في الثلاثينيات من القرن الحالي بفضل أعمال O. Warburg و R. Kuhn و P. Carrera وغيرهم. واتضح أن دور الإنزيمات المساعدة في الإنزيمات المكونة من عنصرين يتم لعبها تحتوي على معظم الفيتامينات (E ، K ، Q ، B1 ، B2 ، B6 B12 ، C ، H ، وما إلى ذلك) أو المركبات المبنية بمشاركة الفيتامينات ، ولهذا السبب يجب تناولها مع الطعام. تظهر العديد من الإنزيمات ذات الوزن الجزيئي الكبير نشاطًا تحفيزيًا فقط في وجود مواد معينة منخفضة الوزن الجزيئي تسمى الإنزيمات المساعدة (أو العوامل المساعدة).
السمة المميزة للإنزيمات المكونة من عنصرين هي أنه لا جزء البروتين ولا المجموعة الإضافية بشكل فردي لهما نشاط تحفيزي ملحوظ. فقط معقداتها تظهر خصائص أنزيمية. في الوقت نفسه ، يزيد البروتين بشكل حاد من النشاط التحفيزي للمجموعة الإضافية المتأصلة فيه في الحالة الحرة إلى حد ضئيل ؛ تقوم المجموعة الإضافية بتثبيت جزء البروتين وتجعله أقل عرضة لعوامل تغيير الطبيعة.
إن الإنزيمات ذات المكون الواحد عبارة عن بروتينات بسيطة ، ولا تحتوي الإنزيمات ذات المكون الواحد على مجموعة إضافية يمكن أن تتلامس مباشرة مع المركب المحول. يتم تنفيذ هذه الوظيفة بواسطة جزء من جزيء البروتين يسمى مركز التحفيز. من المفترض أن المركز التحفيزي للإنزيم أحادي المكون هو مزيج فريد من العديد من بقايا الأحماض الأمينية الموجودة في جزء معين من جزيء البروتين. توجد بقايا الأحماض الأمينية التي تشكل المركز التحفيزي لأنزيم مكون واحد في نقاط مختلفة في سلسلة بولي ببتيد واحدة. لذلك ، ينشأ المركز التحفيزي في اللحظة التي يكتسب فيها جزيء البروتين هيكله الثلاثي المتأصل. وبالتالي ، فإن التغيير في البنية الثلاثية للإنزيم تحت تأثير عوامل معينة يمكن أن يؤدي إلى تشوه مركز الحفاز وتغيير في النشاط الأنزيمي.
بالإضافة إلى المركز التحفيزي الذي يتكون من مزيج من جذور الأحماض الأمينية أو إضافة أنزيم ، يتم تمييز مركزين آخرين في الإنزيمات: الركيزة والتمايز. يُفهم تحت مركز الركيزة قسم جزيء الإنزيم المسؤول عن ارتباط مادة (ركيزة) تخضع للتحول الأنزيمي. غالبًا ما يُطلق على هذا الموقع اسم "منطقة التثبيت" للإنزيم ، حيث تصبح الركيزة ، مثل السفينة عند المرساة. لا ينبغي اعتبار مفهوم المركز الحفاز والركيزة مطلقًا. في الإنزيمات الحقيقية ، قد يتطابق موقع الركيزة مع (أو يتداخل مع) الموقع الحفاز. علاوة على ذلك ، يمكن تشكيل المركز الحفاز أخيرًا في وقت ربط الركيزة. لذلك ، غالبًا ما يتحدثون عن المركز النشط للإنزيم ، وهو مزيج من الأول والثاني.
المركز الخيفي هو جزء من جزيء الإنزيم ، نتيجة للتعلق الذي يغير به وزن جزيئي منخفض معين (وأحيانًا وزن جزيئي مرتفع) البنية الثلاثية لجزيء البروتين. نتيجة لذلك ، يتغير تكوين المركز النشط ، مصحوبًا بزيادة أو نقصان في النشاط التحفيزي للإنزيم.
تحتوي الإنزيمات كمحفزات بيولوجية على عدد من الميزات التي تختلف عن المحفزات غير العضوية:
تستمر التفاعلات الأنزيمية في ظل ظروف طبيعية فسيولوجية لكائن حي ولا تتطلب ظروفًا قاسية - درجة حرارة مرتفعة ، حموضة عالية للوسط ، ضغط زائد ؛
إن الإنزيمات كمحفزات محددة بدقة ، فهي تحفز فقط تفاعلات كيميائية حيوية معينة ، تعمل فقط على ركيزة معينة ؛
تستمر التفاعلات الأنزيمية في الكائنات الحية بالتتابع ، بحيث تكون الركيزة لكل إنزيم لاحق هي المنتج النهائي للتفاعل الأنزيمي الذي يسبقه ؛
معدل التفاعلات الأنزيمية مرتفع ، لكنه يعتمد على عوامل معينة. تسريع التفاعل بمقدار 10 8-10 20 مرة. تأتي التفاعلات الأنزيمية مع مردود 100٪ ولا تعطي منتجات ثانوية. يستخدم الكتال للتعبير عن النشاط التحفيزي وفقًا لتوصيات الاتحاد البيوكيميائي الدولي. كاتال (قطة) هو نشاط تحفيزي قادر على تنفيذ تفاعل بمعدل 1 مول في الثانية ؛
جميع الإنزيمات عبارة عن بروتينات. يختلف الوزن الجزيئي للأنزيمات بشكل كبير من 12 * 10 3 إلى 10 * 10 6 Da.
1.3 طرق عزل الانزيم
تبدأ عملية عزل البروتين بنقل بروتينات الأنسجة إلى محلول. للقيام بذلك ، يتم طحن الأنسجة (المادة) التي يتم الحصول على الإنزيم منها بعناية في الخالط في وجود محلول عازل. لتدمير الخلايا بشكل أفضل ، تتم إضافة رمل الكوارتز إلى المادة إذا كانت المادة مطحونة في ملاط. نتيجة لذلك ، يتم الحصول على ملاط - متجانس. إذا لم يتم إجراء تجزئة أولية لعضيات الخلية ، فإن المتجانس يحتوي على شظايا من الخلايا والنوى والبلاستيدات الخضراء وعضيات الخلية الأخرى والأصباغ والبروتينات القابلة للذوبان.
عند عزل الإنزيمات من أنسجة الكائنات الحية ، بما في ذلك النباتات ، من الضروري ملاحظة الظروف التي لا تسبب تمسخ البروتين. يتم تنفيذ جميع الأعمال عند درجة حرارة منخفضة (4 0 درجة مئوية) وعند قيم الأس الهيدروجيني لمحلول العازلة الأمثل لهذا الإنزيم.
بعد نقل الإنزيمات من النسيج إلى الحالة المذابة ، يخضع المجانسة للطرد المركزي لفصل الجزء غير القابل للذوبان من المادة ، ثم يتم عزل الإنزيمات التالية في أجزاء منفصلة من المستخلص - الطرد المركزي.
نظرًا لأن جميع الإنزيمات عبارة عن بروتينات ، يتم استخدام نفس طرق العزل للحصول على مستحضرات إنزيم منقى كما هو الحال عند العمل مع البروتينات.
طرق الاختيار:
ترسيب البروتين بالمذيبات العضوية ؛
يملح؛
طريقة الرحلان الكهربائي.
طريقة كروماتوغرافيا التبادل الأيوني ؛
طريقة الطرد المركزي
طريقة الترشيح الهلامي
طريقة كروماتوغرافيا التقارب ، أو طريقة كروماتوغرافيا التقارب ؛
تمسخ انتقائي.
1.4 تصنيف وتسمية الإنزيمات حسب نوع التفاعل المحفز
يعتمد تصنيف وتسمية الإنزيمات على نوع التفاعل الذي تحفزه ، لأن التفاعل المحفز هو السمة المحددة التي يختلف بواسطتها إنزيم عن الآخر.
في عام 1961 ، اقترحت لجنة خاصة من الاتحاد الدولي للكيمياء الحيوية تسمية منهجية للأنزيمات. تم تقسيم الإنزيمات إلى 6 مجموعات أو فئات وفقًا لـ النوع الشائعالتفاعلات التي تحفزها: الأكسدة ، الناقلات ، الإنزيمات المائية ، اللياز ، الأيزوميراز ، الليجاسيس.
ثم يتم إعطاء كل إنزيم اسمًا منهجيًا يصف بدقة التفاعل الذي يحفزه. ومع ذلك ، نظرًا لأن العديد من هذه الأسماء المنهجية اتضح أنها طويلة جدًا ومعقدة ، فقد تم أيضًا تعيين اسم عملي تافه لكل إنزيم مخصص للاستخدام اليومي. في معظم الحالات ، يتكون من اسم المادة التي يعمل عليها الإنزيم ، وبيان نوع التفاعل المحفز ، والنهاية -aza.
طورت لجنة الإنزيم الدولية نظامًا لتخصيص أرقام الكود (الأصفار) للأنزيمات الفردية. يحتوي رمز كل إنزيم على أربعة أرقام مفصولة بنقاط. يتم تجميعها وفقًا للمبدأ التالي:
الرقم الأول يشير إلى الفئة التي ينتمي إليها الإنزيم.
ب- الرقم الثاني المخصص لإنزيم حسب التصنيف يعين الفئة الفرعية. بالنسبة للأكسدة المؤكسدة ، فإنه يشير إلى طبيعة المجموعة في الجزيء المانح الذي يخضع للأكسدة (1- يشير إلى مجموعة الكحول -CH-OH ؛ 2-ألدهيد أو مجموعة كيتون ، إلخ) ؛ بالنسبة للنقل ، طبيعة المجموعة المنقولة ؛ في hydrolase ، نوع الرابطة القابلة للتحلل بالماء ؛ في lyases ، نوع السندات التي تمر بالتمزق ؛ بالنسبة للأيزوميرات ، نوع تفاعل الأزمرة المحفز ؛ بالنسبة للليغازات ، نوع الرابطة المشكلة حديثًا.ب. الرقم الثالث يشير إلى الفئة الفرعية. بالنسبة للأكسدة المؤكسدة ، فإنه يشير لكل مجموعة من المتبرعين إلى نوع المستقبِل المعني (1 يشير إلى أنزيم NAD + أو NASP + ؛ 2- السيتوكروم ؛ 3- الأكسجين الجزيئي ، إلخ) ؛ في حالة النقل ، يشير الرقم الثالث إلى نوع المجموعة التي يتم نقلها ؛ في hydrolase ، يحدد هذا الرقم نوع الرابطة القابلة للتحلل بالماء ، بينما في lyases ، نوع المجموعة المراد قطعها ؛ بالنسبة للأيزوميرات ، فإنه يحدد طبيعة تحول الركيزة ، وبالنسبة للليغازات ، فإنه يحدد طبيعة مركب التشكيل.
د. يشير الرقم الرابع إلى الرقم التسلسلي للأنزيمات في هذه الفئة الفرعية.
يتميز تصنيف التشفير بميزة مهمة جدًا - فهو يلغي الحاجة إلى تغيير أعداد جميع الإنزيمات اللاحقة عند تضمين الإنزيمات المكتشفة حديثًا في القائمة. يمكن وضع الإنزيم الجديد في نهاية الفئة الفرعية المقابلة دون الإخلال ببقية الترقيم.
تستخدم الإنزيمات على نطاق واسع في صناعات مثل الخبز ، والتخمير ، وصناعة النبيذ ، والشاي ، وإنتاج الجلود والفراء ، وصنع الجبن ، والعصائر الطبيعية ، والقهوة ، والطهي (لتجهيز اللحوم) ، إلخ. في السنوات الاخيرةبدأ استخدام الإنزيمات في الصناعة الكيميائية الدقيقة لإجراء مثل هذه التفاعلات الكيمياء العضوية، مثل الأكسدة ، والاختزال ، ونزع الأمين ، ونزع الكربوكسيل ، والجفاف ، والتكثيف ، وكذلك لفصل وعزل أيزومرات الأحماض الأمينية من السلسلة L (أثناء التخليق الكيميائي ، تتشكل الخلائط الراسيمية للأيزومرات L و D) ، والتي هي تستخدم في الصناعة والزراعة والطب. إن إتقان الآليات الدقيقة لعمل الإنزيم سيوفر بلا شك إمكانيات غير محدودة للحصول على مواد مفيدة بكميات كبيرة وبنسبة عالية في ظروف المختبر مع عائد 100٪ تقريبًا.
تستخدم الإنزيمات في صناعة المنظفات والورق وكذلك في العمليات التكنولوجيةلإنتاج الجلود والمنسوجات ، صناعة الأدوية (المهرجانات ، mezimforte). الآن أصبح من الممكن استخدامها في علف الحيوانات.
الانزيمات المستخدمة في الصناعات الغذائية مدى واسعالتطبيقات ، بما في ذلك وظائف التوليف والتحلل (التدهور). عند اختيار إنزيم لعملية غذائية معينة ، يجب مراعاة مصدره وخصائصه البيوكيميائية ، وهو أمر مهم للحصول على الشهادة.
مثل المضافات الغذائية الأخرى ، ينظم القانون استخدام الإنزيمات في الأطعمة.
2. التحفيز الحيوي
التحفيز الحيوي (التحفيز الأنزيمي) ، تسريع التفاعلات الكيميائية تحت تأثير الإنزيمات. يعتمد نشاط الحياة على العديد من التفاعلات الكيميائية لتقسيم العناصر الغذائية والتوليف ضروري للجسم مركبات كيميائيةوتحويل طاقتهم إلى طاقة العمليات الفسيولوجية (عمل العضلات والكلى ، نشاط عصبيوما إلى ذلك وهلم جرا.). كل هذه التفاعلات لا يمكن أن تحدث بالمعدل اللازم للكائنات الحية ، إذا لم تنشأ آليات تسريعها بمساعدة التحفيز الحيوي أثناء التطور.
2.1 كيف تعمل الإنزيمات
تسمى المادة التي تخضع للتحول في وجود إنزيم الركيزة. تنضم الركيزة إلى الإنزيم ، مما يسرع من تكسير بعض الروابط الكيميائية في جزيءه وتكوين روابط كيميائية أخرى ؛ يتم فصل المنتج الناتج عن الإنزيم.
لا تخضع الإنزيمات للتآكل أثناء التفاعل. يتم إطلاقها عند اكتمال التفاعل وتكون جاهزة على الفور لبدء التفاعل التالي. من الناحية النظرية ، يمكن أن يستمر هذا إلى أجل غير مسمى ، على الأقل حتى يستهلكوا كل الركيزة. في الممارسة العملية ، نظرًا لقابليتها للتأثر والتركيب العضوي ، فإن عمر الإنزيمات محدود.
وفقًا للتعبير المجازي المستخدم في الأدبيات البيوكيميائية ، يقترب الإنزيم من الركيزة مثل "مفتاح القفل". صاغ E. Fischer هذه القاعدة في عام 1894 على أساس أن خصوصية عمل الإنزيم يتم تحديدها مسبقًا من خلال التوافق الصارم بين البنية الهندسية للركيزة والمركز النشط للإنزيم. يرتبط الإنزيم بالركيزة ليشكل مركب ركيزة إنزيم قصير العمر (تكوين مركب وسيط). ومع ذلك ، على الرغم من أن هذا النموذج يشرح الخصوصية العالية للإنزيمات ، إلا أنه لا يفسر ظاهرة استقرار الحالة الانتقالية التي لوحظت في الممارسة. في الخمسينيات من القرن الماضي ، تم استبدال هذه النظرة الثابتة بفرضية د.كوشلاند حول المطابقة المستحثة للركيزة والإنزيم. يتلخص جوهرها في حقيقة أن التوافق المكاني بين بنية الركيزة والمركز النشط للإنزيم يتم إنشاؤه في لحظة تفاعلهما مع بعضهما البعض ، والذي يمكن التعبير عنه بواسطة صيغة "يد القفاز". الإنزيمات بشكل عام ليست جامدة ، لكنها جزيئات مرنة. يمكن أن يغير الموقع النشط للإنزيم الشكل بعد ربط الركيزة. تتخذ المجموعات الجانبية للأحماض الأمينية للموقع النشط موقعًا يسمح للإنزيم بأداء وظيفته التحفيزية. في بعض الحالات ، يغير جزيء الركيزة أيضًا الشكل بعد الارتباط بالموقع النشط. على عكس نموذج قفل المفاتيح ، لا يشرح نموذج الملاءمة المستحث خصوصية الإنزيمات فحسب ، بل يشرح أيضًا استقرار حالة الانتقال.
ولكن في عملية التطور المتزايد للعلم ، يتم استبدال فرضية كوشلاند تدريجياً بفرضية التطابق الكيميائي الطبقي. مع الاحتفاظ بالأحكام الرئيسية لفرضية الضبط الناجم بشكل متبادل للركيزة والإنزيم ، فإنه يلفت الانتباه إلى حقيقة أن خصوصية عمل الإنزيمات ترجع في المقام الأول إلى التعرف على هذا الجزء من الركيزة الذي لا يتغير أثناء التحفيز. . تنشأ العديد من التفاعلات الكارهة للماء والروابط الهيدروجينية بين هذا الجزء من الركيزة ومركز الركيزة للإنزيم.
2.2 العوامل المؤثرة على تفاعلات الإنزيم
يتأثر نشاط الإنزيمات ، وبالتالي معدل تفاعلات التحفيز الإنزيمي ، بعدة عوامل:
· تركيز الركيزة وتوافرها. عند وجود كمية ثابتة من الإنزيم ، يزداد المعدل مع زيادة تركيز الركيزة. يخضع رد الفعل هذا لقانون العمل الجماعي ويُنظر إليه في ضوء نظرية ميكايليس-مينتون.
· تركيز الانزيم. دائمًا ما يكون تركيز الإنزيمات منخفضًا نسبيًا. معدل أي عملية إنزيمية يعتمد بشكل كبير على تركيز الإنزيم. بالنسبة لمعظم تطبيقات الطعاممعدل التفاعلات يتناسب مع تركيز الانزيمات. الاستثناء هو تلك الحالات عندما يتم عرض ردود الفعل على غاية مستويات منخفضةالمادة المتفاعلة.
· درجة حرارة التفاعل. حتى درجة حرارة معينة (تصل إلى 50 درجة مئوية في المتوسط) ، يزداد النشاط التحفيزي ، ولكل 10 درجات مئوية ، يزداد معدل تحويل الركيزة بحوالي ضعفين. بشكل عام ، بالنسبة للإنزيمات من أصل حيواني ، يتراوح بين 40 و 50 درجة مئوية ، ومن أصل نباتي بين 50 و 60 درجة مئوية. درجة الحرارة المثلى هي 37 درجة مئوية ، حيث تستمر العمليات في الكائن الحي بسرعة ، مما يوفر كمية كبيرة من الطاقة. ومع ذلك ، هناك إنزيمات ذات درجة حرارة أعلى مثلى ، على سبيل المثال ، يحتوي غراء على درجة حرارة مثالية عند 80 درجة مئوية. في الوقت نفسه ، يحتوي الكاتلاز على درجة حرارة مثالية للعمل بين 0 و -10 درجة مئوية.
· رد فعل الرقم الهيدروجيني. يحتوي كل إنزيم على نطاق محدد من قيم الأس الهيدروجيني حيث يُظهر الإنزيم أقصى نشاط. لكن أفضل الظروفعملها قريب من قيم الأس الهيدروجيني المحايدة. في بيئة حمضية أو قلوية حادة ، فقط بعض الإنزيمات تعمل بشكل جيد. يعتمد تأثير الرقم الهيدروجيني للوسط على تصرفات الإنزيمات على حقيقة أن هناك تغييرًا في شحنة مجموعات البروتين المختلفة في المركز النشط للإنزيم ، مما يتسبب في حدوث تغيير كبير في تشكيل سلسلة البولي ببتيد.
· مدة العملية. بالنسبة لتفاعل تحفيز إنزيمي من الدرجة الأولى ، ينخفض معدل التفاعل بمرور الوقت مع تناقص توافر الركيزة. تستغرق تفاعلات الحفز الإنزيمي وقتًا طويلاً حتى تكتمل.
· وجود مثبطات أو منشطات. كيماويات قادرة على التسبب تأثير ضارعلى تفاعل التخمير تسمى "مثبطات". يمكن للمعادن (النحاس والحديد والكالسيوم) أو مركبات الركائز أن تعمل كمواد كهذه. بعض المواد قادرة على تنشيط أو استقرار الإنزيمات. يمكن أن يؤدي وجود أيونات معينة في وسط التفاعل إلى تنشيط تكوين الركيزة النشطة لمركب الإنزيم ، وفي هذه الحالة سيزداد معدل التفاعل الإنزيمي. تسمى هذه المواد المنشطات.
3. ميزات المحاكاة الحيوية
تُستخدم المعرفة التي حصل عليها الناس من الطبيعة في العالم الحديث في كل مكان ، من البناء إلى الطب. اليوم ، شكلت هذه المعرفة بالفعل مجالًا جديدًا للعلم: المحاكاة الحيوية. تم تقديم هذا المصطلح لأول مرة من قبل عالمة الطبيعة الأمريكية جانين بينيوس.
المحاكاة الحيوية هي مجال الكيمياء الذي يمثل العمليات التي تحدث في الحياة البرية. تعد الاكتشافات في مجال أنظمة المحاكاة الحيوية ثورة في مجال تخليق المواد الجديدة. يميز:
بيولوجية ، ودراسة العمليات التي تحدث في الأنظمة البيولوجية;
· النماذج الرياضية النظرية والبنائية لهذه العمليات.
· التقنية التطبيقية لنماذج المحاكاة الحيوية النظرية لحل المشكلات الهندسية.
وجد معهد مشاكل الفيزياء الكيميائية التابع لأكاديمية العلوم الروسية في تشيرنوغولوفكا بالفعل طرقًا للمحاكاة الحيوية لتثبيت النيتروجين الأنزيمي ، والأكسدة اللاهوائية للألكانات (الميثان إلى الميثانول) ، والأكسدة الضوئية للماء لإنتاج الأكسجين (وهذا ما تفعله النباتات أثناء عملية التمثيل الضوئي. ).
منتج طلاء Lotosan المصنوع في ألمانيا مقاوم للغاية للأوساخ. الفكرة مأخوذة من أزهار اللوتس التي تنمو في مناطق المستنقعات ، ورغم ذلك تحافظ على بياضها. اتضح أن الأمر كان في المسامير المجهرية التي تغطي سطح الزهرة. إنها تمنع الجزيئات من البقاء على البتلات وتسمح لمياه الأمطار بغسلها بسهولة. حاليًا ، يكافح المطورون لإنشاء مواد قائمة على الويب خفيفة ومرنة وقوية (أقوى بخمس مرات من الفولاذ). لقد احتلت أيديولوجية المحاكاة الحيوية مكانها بحزم في مختلف التخصصات - الهندسة والتكنولوجيا الكيميائية وتكنولوجيا النانو والعديد من المجالات الأخرى. سيحاول العلماء إيجاد نظائر كيميائية للإنزيمات وإنشاء عمليات صناعية جديدة تعتمد عليها. وستكتسب هذه العملية قوة دفع بمرور الوقت فقط.
خاتمة
في هذه الورقة واحدة من البيولوجية المواد الفعالةوهي الإنزيمات. الانزيمات محفز بيولوجيطبيعة البروتين ، تسريع التفاعلات الكيميائية في الكائنات الحية وخارجها. تتمتع الإنزيمات بخصائص فريدة تميزها عن المحفزات العضوية التقليدية. هذا ، أولاً وقبل كل شيء ، نشاط تحفيزي مرتفع بشكل غير عادي. خاصية أخرى مهمة للإنزيمات هي انتقائية عملها.
من الخصائص المهمة للإنزيمات ، والتي يجب أخذها في الاعتبار عند استخدامها العملي ، الاستقرار ، أي قدرتهم على الحفاظ على النشاط التحفيزي.
نظرًا للخصوصية العالية للإنزيمات ، لا تسود الفوضى في الجسم: يؤدي كل إنزيم وظائف محددة بدقة دون التأثير على مسار العديد من عشرات ومئات التفاعلات الأخرى التي تحدث في بيئته. دور الإنزيمات في حياة الكائنات عظيم.
مستقبل الانزيمات مثير جدا للاهتمام. تتقدم تقنية اكتشاف وإنتاج إنزيمات جديدة بوتيرة سريعة. قبل تطوير استخدام وإنتاج الإنزيمات بالنسبة للجزء الاكبرمن خلال التجربة والخطأ. نظرًا لأن التفاصيل التي تؤثر على كيمياء وعمل الإنزيمات لم تكن معروفة جيدًا ، فقد تم استخدام مخاليط من الإنزيمات الأكثر تنوعًا في المستحضرات. بفضل البحث الجديد ، يمكن استخدام إنزيمات أكثر تحديدًا في إنتاج المنتجات المسوقة.
اليوم ، يكشف تطوير التقنيات كل يوم عن المزيد والمزيد من العجائب الجديدة لخلق الحياة ، و "المحاكاة الحيوية" كعلم يختار أنظمة ممتازة في كائنات الكائنات الحية كأمثلة ، وخلق الاختراعات في صورتها وشبهها لصالح وفائدة الناس. سيحاول العلماء إيجاد نظائر كيميائية للإنزيمات وإنشاء عمليات صناعية جديدة تعتمد عليها.
فهرس
1. http://www.krugosvet.ru/articles/03/1000310/1000310a1.htm
2. Gabrielyan O.S.، Maskaev F.N.، Ponomarev S.Yu.، Terenin V.I. كتاب كيمياء للصف العاشر. - م ، 2005.
3. Nechaev A.P.، Kochetkova A.A.، Zaitsev A.N. المضافات الغذائية - M. ، 2001.
4. الكيمياء الحيوية للمواد النباتية / إد. Shcherbakova V.G. م ، 1999.
5. http://www.gazeta.ru/science/2007/10/15_a_2241957.shtml؟incut2
6. http://www.cleandex.ru/articles/2008/07/07/biomimetic-1
المرفق 1
الجدول 1
| فئات الإنزيم | رد فعل محفز | أمثلة على الإنزيمات أو مجموعاتها (تم ذكر أسماء تافهة) |
| أوكسيدوروكتاز | نقل ذرات الهيدروجين أو الإلكترونات من مادة إلى أخرى | ديهيدروجينيز ، أوكسيديز |
| المحولات | نقل مجموعة معينة من الذرات - ميثيل ، أسيل ، فوسفات أو مجموعة أمينية - من مادة إلى أخرى | ترانساميناز ، كيناز |
| هيدروليسات | تفاعلات التحلل المائي | الليباز ، الأميليز ، الببتيداز |
| لياس | إضافة غير مائية إلى ركيزة | ديكاربوكسيلاز ، فوماراس ، ألدولاز |
| الايزوميراز | إعادة ترتيب الجزيئات | إيزوميراز ، موتيز |
| إنزيمات دمج الجزيئات | اتصال جزيئين نتيجة تكوين جزيئات جديدة اتصالات C-Cأو C-N أو C-O أو C-S المرتبطة بتفكك ATP | مركب |
الملحق 2
بعض الأمثلة على استخدام الإنزيمات في الصناعة
الجدول 2
| إنزيم | صناعة | إستعمال | |
| الأميليز (يكسر النشا) | مصنع الجعة | تسكر النشا الموجود في الشعير | |
| الغزل والنسيج | إزالة النشا المطبق على الخيوط أثناء التحجيم | ||
مخبز |
النشا الجلوكوز. تشكل خلايا الخميرة ، الجلوكوز المخمر ، ثاني أكسيد الكربون ، حيث تعمل الفقاعات على فك العجين وتعطي الخبز بنية مسامية. يتحول لون الخبز إلى اللون البني بشكل أفضل ويبقى ثابتًا لفترة أطول | ||
البروتياز (ينقسم |
غراء | مصنع الجعة | مراحل عملية التخمير التي تنظم جودة الرغوة |
| لحمة | تطرية اللحوم. هذا الإنزيم مقاوم تمامًا لارتفاع درجة الحرارة ويستمر في العمل لبعض الوقت عند تسخين اللحم. ثم ، بالطبع ، يتم تعطيله | ||
| الأدوية | إضافات معجون الأسنان لإزالة البلاك | ||
| فيسين | صورة | غسل الجيلاتين من الغشاء المستخدم لاستخراج الفضة الموجودة فيه | |
| بيبسين | طعام | إنتاج الحبوب "الجاهزة" | |
| الأدوية | مساعدات الجهاز الهضمي (بالإضافة إلى التأثير الطبيعي للبيبسين في المعدة) | ||
| التربسين | طعام | تصنيع منتجات أغذية الأطفال | |
| رينين | صناعة الجبنة | تخثر الحليب (الحصول على جلطة من الكازين) | |
|
حقيقي البروتياز |
مغسلة | منظفات الغسيل مع إضافات الإنزيم | |
| جلد | فصل الشعر - طريقة لا يتلف فيها الشعر ولا الجلد | ||
| الغزل والنسيج | استخلاص الصوف من قصاصات جلود الغنم | ||
لقد وجد منذ فترة طويلة أن جميع الإنزيمات عبارة عن بروتينات ولها جميع خصائص البروتينات. لذلك ، مثل البروتينات ، تنقسم الإنزيمات إلى بسيطة ومعقدة.
إنزيمات بسيطةتتكون من أحماض أمينية فقط ، على سبيل المثال ، بيبسين , التربسين , الليزوزيم.
إنزيمات معقدة(holoenzymes) في تركيبها جزء بروتيني ، يتكون من أحماض أمينية - أبوينزيم ، وجزء غير بروتيني - عامل مساعد. العامل المساعد ، بدوره ، قد يشار إليه على أنه أنزيم أو مجموعة صناعية. قد يكون على سبيل المثال نازعة هيدروجين السكسينات(يحتوي على FAD) (في دورة حمض الكربوكسيل) ، aminotransferases(تحتوي على فوسفات البيريدوكسال) ، بيروكسيداز(يحتوي على الهيم).
لتنفيذ التحفيز ، يلزم وجود مجمع كامل من البروتينات والعامل المساعد ؛ لا يمكن التحفيز بشكل منفصل. العامل المساعد هو جزء من المركز النشط ، ويشارك في ربط الركيزة أو في تحولها.
مثل العديد من البروتينات ، يمكن أن تكون الإنزيمات مونومرات، أي. تتكون من وحدة فرعية واحدة ، و البوليمراتتتكون من عدة وحدات فرعية.
التنظيم الهيكلي والوظيفي للأنزيمات
في تكوين الإنزيم ، يتم تمييز المناطق التي تؤدي وظائف مختلفة:
1. المركز النشط - مزيج من بقايا الأحماض الأمينية (عادة 12-16) ، يوفر الارتباط المباشر لجزيء الركيزة والحفز. يمكن أن تكون جذور الأحماض الأمينية في المركز النشط في أي مجموعة ، بينما توجد الأحماض الأمينية في مكان قريب ، والتي تكون بعيدة بشكل كبير عن بعضها البعض في السلسلة الخطية. يوجد قسمان في المركز النشط:
- مِرسَاة(جهة اتصال ، ربط) - مسؤولة عن ربط وتوجيه الركيزة في المركز النشط ،
- المحفز- مسؤول بشكل مباشر عن تنفيذ رد الفعل.
رسم تخطيطي لبنية الانزيمات
قد تحتوي الإنزيمات التي تحتوي على عدة مونومرات في تركيبها على عدة مراكز نشطة وفقًا لعدد الوحدات الفرعية. أيضًا ، يمكن أن تشكل وحدتان فرعيتان أو أكثر موقعًا نشطًا واحدًا.
في الإنزيمات المعقدة ، توجد المجموعات الوظيفية للعامل المساعد بالضرورة في المركز النشط.
مخطط تكوين انزيم معقد
2. مركز خيفي (allos- أجنبي) - مركز تنظيم نشاط الإنزيم ، والذي يتم فصله مكانيًا عن المركز النشط ولا يتوفر لجميع الإنزيمات. يؤدي الارتباط بالمركز الخيفي للجزيء (يسمى المنشط أو المثبط ، بالإضافة إلى المستجيب ، والمعدِّل ، والمنظم) إلى حدوث تغيير في تكوين بروتين الإنزيم ، ونتيجة لذلك ، معدل التفاعل الإنزيمي.
إنزيمات Allosteric هي بروتينات بوليمرية ، وتقع المراكز النشطة والتنظيمية في وحدات فرعية مختلفة.

مخطط هيكل إنزيم خيفي
يمكن لمنتج هذا أو أحد التفاعلات اللاحقة ، ركيزة التفاعل ، أو مادة أخرى أن تعمل كمنظم (انظر "تنظيم نشاط الإنزيم").
الإنزيمات
إنزيمات الإنزيم هي أشكال جزيئية من نفس الإنزيم ناتجة عن اختلافات جينية صغيرة في التركيب الأساسي للإنزيم. تحدد نظائر الإنزيمات المختلفة معدل واتجاه التفاعل بسبب الصلات المختلفة للركيزة.
على سبيل المثال ، يتم تمثيل إنزيم الكرياتين كيناز ثنائي القطب (CK) بثلاثة أشكال إيزوزيم ، تتكون من نوعين من الوحدات الفرعية: M (eng. عضلة- عضلة) وباء (م. مخ- مخ). يتكون الكرياتين كيناز 1 (CK-1) من وحدات فرعية من النوع B ومترجمة في الدماغ ، ويحتوي الكرياتين كيناز 2 (CK-2) على وحدة فرعية واحدة M و B لكل منهما ، وهي نشطة في عضلة القلب ، ووحدتان فرعيتان M خاص بالعضلات الهيكلية.
هناك أيضًا خمسة إنزيمات متشابهة نازعة هيدروجين اللاكتات(دور LDH) - إنزيم يشارك في استقلاب الجلوكوز. الاختلافات بينهما في النسبة المختلفة للوحدات الفرعية H (eng. قلب- قلب) و م (م. عضلة- عضلة). أنواع نازعة هيدروجين اللاكتات 1 (H 4) و 2 (H 3 M 1) موجودة في الأنسجة مع الهوائيةالأيض (عضلة القلب ، الدماغ ، الطبقة القشرية من الكلى) ، لها انجذاب كبير لحمض اللاكتيك (اللاكتات) وتحويله إلى البيروفات. تم العثور على LDH-4 (H 1 M 3) و LDH-5 (M 4) في الأنسجة المعرضة اللاهوائيةالتمثيل الغذائي (الكبد ، العضلات الهيكلية ، الجلد ، النخاع الكلوي) ، له ألفة منخفضة للاكتات ويحفز تحويل البيروفات إلى اللاكتات. في الأقمشة ذات متوسطنوع التمثيل الغذائي (الطحال والبنكرياس والغدد الكظرية ، الغدد الليمفاوية) يهيمن عليها LDH-3 (H 2 M 2).
