Što je karakteristično za enzime. Strukturna i funkcionalna organizacija enzima. Regulacija aktivnosti enzima. Određivanje aktivnosti amilaze u urinu
Enzimi
ENZIMI-ov; pl.(jedinica enzim, -a; m.). [od lat. fermentum - kvasac] Biol., Chem. Specifični proteinski katalizatori prisutni u svim živim stanicama koji reguliraju metabolizam i stoga imaju važnu ulogu u svim životnim procesima; enzima. fermentacijski enzim. F. truljenje. F. oksidacija. Aktivnost enzima ovisi o unosu vitamina. Proučavanje svojstava pojedinih enzima.
◁ Enzimski, th, th. Biol., Chem. f-ta reakcija. F otrovi. Enzimski, th, th. F-te tvari. Proučavanje enzimskih procesa.
enzima(od lat. fermentum - kvasac) (enzimi), biološki katalizatori prisutni u svim živim stanicama. Provesti transformaciju tvari u tijelu, usmjeravajući i regulirajući time njegov metabolizam. Po kemijske prirode- bjelančevine. Enzimi imaju optimalnu aktivnost pri određenim pH vrijednostima, često prisutnost potrebnih koenzima i kofaktora, te odsutnost inhibitora. Svaki tip enzima katalizira pretvorbu određenih tvari (supstrata), ponekad samo jedne tvari. Stoga su brojne bio kemijske reakcije obavlja u stanicama ogroman broj razni enzimi. Svi enzimi se dijele u 6 klasa: oksidoreduktaze, transferaze, hidrolaze, liaze, izomeraze i ligaze. Mnogi enzimi izolirani su iz živih stanica i dobiveni u kristalnom obliku (prvi put 1926.). Enzimski pripravci koriste se u medicini, prehrambenoj i lakoj industriji. Bavi se proučavanjem enzimologije enzima.
ENZIMIENZIMI (od latinskog "fermentum" - vrenje, kvasac), enzimi, specifične bjelančevine koje povećavaju brzinu kemijskih reakcija u stanicama svih živih organizama. Po kemijskoj prirodi - proteini koji imaju optimalnu aktivnost pri određenom pH, prisutnost potrebnih koenzima i kofaktora i odsutnost inhibitora. Enzimi se također nazivaju biokatalizatori po analogiji s katalizatorima. (cm. KATALIZATORI) u kemiji. Svaka vrsta enzima katalizira pretvorbu određenih tvari (supstrata), ponekad samo jedne tvari u jednom smjeru. Stoga se brojne biokemijske reakcije u stanicama odvijaju uz pomoć velikog broja različitih enzima. Dijele se u 6 klasa: oksidoreduktaze, transferaze, hidrolaze (cm. HIDROLAZE), liaze (cm. VEZA), izomeraze (cm. IZOMERAZE) i ligaze (cm. LIGASE). Mnogi enzimi izolirani su iz živih stanica i dobiveni u kristalnom obliku (prvi put 1926.).
Uloga enzima u organizmu
Enzimi sudjeluju u provedbi svih metaboličkih procesa, u provedbi genetske informacije. Probava i asimilacija hranjivim tvarima sinteza i razgradnja proteina (cm. PROTEINI (organski spojevi), nukleinske kiseline (cm. NUKLEINSKE KISELINE), mast (cm. MASTI), ugljikohidrati (cm. UGLJIKOHIDRATI) i drugi spojevi u stanicama i tkivima svih organizama – svi su ti procesi nemogući bez sudjelovanja enzima. Svaka manifestacija funkcija živog organizma - disanje, kontrakcija mišića, neuropsihička aktivnost, reprodukcija itd. - osigurava se djelovanjem enzima. Individualne karakteristike stanica koje obavljaju određene funkcije uvelike su određene jedinstvenim skupom enzima, čija je proizvodnja genetski programirana. Nedostatak čak i jednog enzima ili neki nedostatak u njemu može dovesti do ozbiljnih negativnih posljedica za tijelo.
Katalitička svojstva enzima
Enzimi su najaktivniji od svih poznatih katalizatora. Većina reakcija u stanici odvija se milijunima i milijardama puta brže nego da se odvijaju bez enzima. Na primjer, jedna molekula enzima katalaze (cm. KATALAZA) sposoban je pretvoriti do 10 tisuća molekula vodikovog peroksida, otrovnog za stanice, nastalog tijekom oksidacije raznih spojeva, u vodu i kisik u sekundi. Katalitička svojstva enzima rezultat su njihove sposobnosti da značajno smanje energiju aktivacije spojeva koji ulaze u reakciju, odnosno u prisutnosti enzima potrebno je manje energije za "pokretanje" ove reakcije.
Povijest otkrića enzima
Procesi koji se odvijaju uz sudjelovanje enzima poznati su čovjeku od davnina, jer se priprema kruha, sira, vina i octa temelji na enzimskim procesima. Ali tek 1833. godine prvi put je iz klijajućih zrna ječma izolirana aktivna tvar koja pretvara škrob u šećer i nazvana je dijastaza (sada se taj enzim zove amilaza (cm. AMILAZE)). Krajem 19.st dokazano je da sok dobiven trljanjem stanica kvasca sadrži složenu mješavinu enzima koji osiguravaju proces alkoholno vrenje. Od tada počinje intenzivno proučavanje enzima - njihove strukture i mehanizma djelovanja. Budući da je uloga biokatalize otkrivena u proučavanju fermentacije, s tim su se procesom povezivala dva procesa koja su uspostavljena još od 19. stoljeća. nazivi su "enzim" (u prijevodu s grčkog "od kvasca") i "enzim". Istina, posljednji sinonim koristi se samo u književnosti na ruskom jeziku, iako znanstveni smjer, koji se bavi proučavanjem enzima i procesa s njihovim sudjelovanjem, tradicionalno se naziva enzimologija. U prvoj polovici 20.st utvrđeno je da su enzimi po kemijskoj prirodi proteini, au drugoj polovici stoljeća za mnoge stotine enzima već je određen redoslijed aminokiselinskih ostataka i utvrđena prostorna struktura. Godine 1969. prvi put je izvedena kemijska sinteza enzima ribonukleaze. Ogroman napredak postignut je u razumijevanju mehanizma djelovanja enzima.
Položaj enzima u tijelu
U stanici se dio enzima nalazi u citoplazmi, no većinom su enzimi povezani s određenim staničnim strukturama, gdje ispoljavaju svoje djelovanje. U jezgri se, primjerice, nalaze enzimi odgovorni za replikaciju – sintezu DNA (cm. DEOKSIRIBONUKLEINSKE KISELINE)(DNA polimeraza), za njegovu transkripciju – stvaranje RNA (cm. RIBONUKLEINSKE KISELINE)(RNA polimeraza). U mitohondrijima postoje enzimi odgovorni za akumulaciju energije, u lizosomima - većina hidrolitičkih enzima uključenih u razgradnju nukleinskih kiselina i proteina.
Uvjeti za djelovanje enzima
Sve reakcije koje uključuju enzime odvijaju se uglavnom u neutralnom, blago alkalnom ili blago kiselom mediju. No, maksimalna aktivnost svakog pojedinog enzima javlja se kod strogo definiranih pH vrijednosti. Za djelovanje većine enzima toplokrvnih životinja najpovoljnija je temperatura 37-40 o C. Kod biljaka pri temperaturama nižim od 0 o C djelovanje enzima ne prestaje potpuno, iako životna aktivnost biljaka naglo opada. Enzimski procesi se u pravilu ne mogu odvijati na temperaturama iznad 70 o C, budući da su enzimi, kao i svi proteini, podložni toplinskoj denaturaciji (strukturnom razaranju).
Veličine enzima i njihova struktura
Molekularna težina enzima, kao i svih drugih proteina, leži u rasponu od 10 tisuća do 1 milijun (ali može biti i više). Mogu se sastojati od jednog ili više polipeptidnih lanaca i mogu biti složeni proteini. Sastav potonjeg, zajedno s proteinskom komponentom (apoenzim), uključuje spojeve niske molekularne težine - koenzime (kofaktore, koenzime), uključujući metalne ione, nukleotide, vitamine i njihove derivate. Neki enzimi nastaju u obliku neaktivnih prekursora (proenzima) i postaju aktivni nakon određenih promjena u strukturi molekule, na primjer, nakon što se od nje odcijepi mali fragment. To uključuje probavni enzimi tripsin (cm. TRIPSIN) i kimotripsin (cm. CHymotripsin), koje sintetiziraju stanice gušterače u obliku neaktivnih prekursora (tripsinogen i kimotripsinogen) i poprimaju aktivnost u tanko crijevo kao dio pankreasnog soka. Mnogi enzimi tvore takozvane enzimske komplekse. Takvi su kompleksi, na primjer, ugrađeni u stanične membrane ili stanične organele i uključeni su u transport tvari.
Tvar (supstrat) koja prolazi kroz transformaciju veže se na određeno mjesto enzima, prije aktivnog centra, koji se sastoji od bočnih lanaca aminokiselina, koji se često nalaze u dijelovima polipeptidnog lanca koji su značajno udaljeni jedan od drugog. Na primjer, aktivno središte molekule kimotripsina čine ostaci histidina (cm. HISTIDIN), smješten u polipeptidnom lancu na poziciji 57, serin (cm. SERIN) na poziciji 195 i asparaginsku kiselinu na poziciji 102 (u molekuli kimotripsina ima 245 aminokiselina). Dakle, složeno polaganje polipeptidnog lanca u proteinskoj molekuli - enzim daje mogućnost da nekoliko bočnih lanaca aminokiselina budu na strogo određenom mjestu i na određenoj udaljenosti jedan od drugog. Koenzimi su također dio aktivnog centra (proteinski dio i neproteinska komponenta odvojeno nemaju enzimsku aktivnost i poprimaju svojstva enzima tek kada se spoje zajedno).
Tijek procesa koji uključuju enzime
Većina enzima karakterizira visoka specifičnost (selektivnost) djelovanja, kada pretvorbu svakog reaktanta (supstrata) u produkt reakcije provodi poseban enzim. U tom slučaju djelovanje enzima može biti strogo ograničeno na jedan supstrat. Na primjer, enzim ureaza (cm. UREAZA), koji sudjeluje u razgradnji uree do amonijaka i ugljičnog dioksida, ne reagira na metilureu, koja je slične strukture. Mnogi enzimi djeluju na nekoliko strukturno povezanih spojeva ili na jednu vrstu kemijske veze (na primjer, enzim fosfataza koji cijepa fosfodiestersku vezu (cm. FOSFATAZE)).
Enzim ostvaruje svoje djelovanje stvaranjem kompleksa enzim-supstrat, koji se zatim razgrađuje u proizvode enzimska reakcija i oslobađanje enzima. Kao rezultat stvaranja kompleksa enzim-supstrat, supstrat mijenja svoju konfiguraciju; u ovom slučaju, enzimsko-kemijska veza koja se pretvara je oslabljena i reakcija se odvija s manjim početnim utroškom energije i, posljedično, puno većom brzinom. Mjera brzine enzimske reakcije je količina supstrata koji je prošao transformaciju po jedinici vremena, ili količina nastalog produkta. Mnoge enzimske reakcije, ovisno o koncentraciji supstrata i produkta reakcije u mediju, mogu teći izravno i obrnuti smjer(višak supstrata pomiče reakciju prema stvaranju produkta, dok će kod prekomjernog nakupljanja potonjeg doći do sinteze supstrata). To znači da enzimske reakcije mogu biti reverzibilne. Na primjer, karboanhidraza (cm. KARBOANHIDRAZA) krv pretvara ugljični dioksid koji dolazi iz tkiva u ugljičnu kiselinu (H 2 CO 3), au plućima, naprotiv, katalizira pretvorbu ugljične kiseline u vodu i ugljični dioksid, koji se uklanjaju tijekom izdisaja. Međutim, treba imati na umu da enzimi, poput drugih katalizatora, ne mogu pomaknuti termodinamičku ravnotežu kemijske reakcije, već samo značajno ubrzati postizanje te ravnoteže.
Nomenklatura naziva enzima
Pri imenovanju enzima ca za osnovu se uzima naziv supstrata i dodaje se nastavak "aza". Tako su se posebno pojavile proteinaze - enzimi koji razgrađuju proteine (bjelančevine), lipaze (razgrađuju lipide ili masti) itd. Neki enzimi dobili su posebna (trivijalna) imena, na primjer, probavni enzimi - pepsin (cm. PEPSIN), kimotripsin (cm. CHymotripsin) i tripsina (cm. TRIPSIN).
U stanicama tijela odvija se nekoliko tisuća različitih metaboličkih reakcija, a samim tim i enzima. Kako bi se takva raznolikost unijela u sustav, usvojen je međunarodni sporazum o klasifikaciji enzima. U skladu s tim sustavom, svi enzimi, ovisno o vrsti reakcija koje kataliziraju, podijeljeni su u šest glavnih klasa, od kojih svaka uključuje nekoliko podklasa. Osim toga, svaki je enzim dobio četveroznamenkasti kodni broj (šifru) i naziv koji označava reakciju koju taj enzim katalizira. Enzimi koji kataliziraju istu reakciju u organizmima različiti tipovi, mogu se međusobno značajno razlikovati po strukturi proteina, ali u nomenklaturi imaju zajedničko ime i jedan kodni broj.
Bolesti povezane s poremećenom proizvodnjom enzima
Nedostatak ili smanjena aktivnost bilo kojeg enzima (često prekomjerna aktivnost) kod čovjeka dovodi do razvoja bolesti (enzimopatije) ili smrti organizma. Dakle, nasljedna bolest djece - galaktozemija (dovodi do mentalna retardacija) - razvija se zbog kršenja sinteze enzima odgovornog za pretvorbu galaktoze (cm. GALAKTOZA) u lako probavljivu glukozu (cm. GLUKOZA). Uzrok druge nasljedne bolesti - fenilketonurija, popraćena poremećajem mentalna aktivnost, je gubitak sposobnosti stanica jetre da sintetiziraju enzim koji katalizira pretvorbu aminokiseline fenilalanin (cm. fenilalanin) na tirozin (cm. TIROZIN). Određivanje aktivnosti mnogih enzima u krvi, urinu, leđnoj moždini, sjemenoj i drugim tjelesnim tekućinama koristi se za dijagnosticiranje niza bolesti. Uz pomoć ove analize krvnog seruma moguće je otkriti na ranoj fazi infarkt miokarda, virusni hepatitis, pankreatitis, nefritis i druge bolesti.
Ljudska upotreba enzima
Budući da enzimi zadržavaju svoja svojstva izvan tijela, uspješno se koriste u raznim industrijama. Na primjer, proteolitički enzim papaje (iz soka papaje (cm. PAPAJA)) - u pivarstvu, za omekšavanje mesa; pepsin - u proizvodnji "gotovih" žitarica i kao lijek; tripsin - u proizvodnji proizvoda za dječju hranu; rennin (sirilo iz telećeg želuca) - u proizvodnji sira. Katalaza se široko koristi u industriji hrane i gume, a celulaza i pektidaza, koje razgrađuju polisaharide, koriste se za bistrenje voćnih sokova. Enzimi su nužni pri uspostavljanju strukture proteina, nukleinskih kiselina i polisaharida, u genetičkom inženjeringu itd. Uz pomoć enzima dobivaju se lijekovi i složeni kemijski spojevi.
Otkrivena je sposobnost nekih oblika ribonukleinskih kiselina (ribozima) da kataliziraju pojedine reakcije, odnosno da djeluju kao enzimi. Možda su tijekom evolucije organskog svijeta ribozimi služili kao biokatalizatori prije nego što je enzimska funkcija prenesena na proteine koji su bolje prilagođeni obavljanju ove zadaće.
- (od lat. fermentum vrenje, kiselo tijesto), enzimi, biokatalizatori, specifič. proteini prisutni u svim živim stanicama i igraju ulogu biol. katalizatori. Kroz njih se ostvaruje genetski. odvijaju se informacije i svi procesi razmjene ... ... Biološki enciklopedijski rječnik
- (lat. Fermentum kvasac, od fervere biti vruć). Organske tvari koje fermentiraju druga organska tijela, a da se same ne trule. Rječnik strane riječi uključen u ruski jezik. Chudinov A.N., 1910. ENZIMI ... ... Rječnik stranih riječi ruskog jezika
- (od lat. fermentum kvasac) (enzimi) biološki katalizatori prisutni u svim živim stanicama. Provesti transformaciju tvari u tijelu, usmjeravajući i regulirajući time njegov metabolizam. Kemijska priroda proteina. Enzimi ..... Velik enciklopedijski rječnik
- (od lat. fermentum kvasac), biološki katalizatori prisutni u svim živim stanicama. Provesti transformacije (metabolizam) tvari u tijelu. Kemijska priroda proteina. Sudjeluje u brojnim biokemijskim reakcijama u stanici ... ... Moderna enciklopedija
Post., broj sinonima: 2 biokatalizatori (1) enzimi (2) Rječnik sinonima ASIS. V.N. Trishin. 2013 ... Rječnik sinonima
Enzimi. Vidi enzimi. (
Povijest studija
Termin enzim predložio u 17. stoljeću kemičar van Helmont kada je raspravljao o mehanizmima probave.
U kon. XVIII - rano. 19. stoljeća već se znalo da se meso probavlja želučanim sokom, a škrob se pretvara u šećer djelovanjem sline. Međutim, mehanizam ovih pojava bio je nepoznat.
Klasifikacija enzima
Prema vrsti kataliziranih reakcija, enzimi se dijele u 6 klasa prema hijerarhijskoj klasifikaciji enzima (KF, - Enzyme Comission code). Predložena je klasifikacija Međunarodna unija biokemije i molekularne biologije (International Union of Biochemistry and Molecular Biology). Svaka klasa sadrži podklase, tako da je enzim opisan skupom od četiri broja odvojena točkama. Na primjer, pepsin ima naziv EC 3.4.23.1. Prvi broj ugrubo opisuje mehanizam reakcije koju katalizira enzim:
- CF 1: Oksidoreduktaza koji kataliziraju oksidaciju ili redukciju. Primjer: katalaza, alkohol dehidrogenaza.
- CF 2: Transferaze, koji kataliziraju prijenos kemijske skupine od jedne molekule supstrata do druge. Među transferazama posebno se ističu kinaze, koje prenose fosfatnu skupinu, u pravilu, iz molekule ATP.
- CF 3: Hidrolaze koji kataliziraju hidrolizu kemijske veze. Primjer: esteraze, pepsin, tripsin, amilaza, lipoprotein lipaza.
- CF 4: Liase, katalizirajući kidanje kemijskih veza bez hidrolize uz stvaranje dvostruke veze u jednom od proizvoda.
- CF 5: Izomeraze, koji kataliziraju strukturne ili geometrijske promjene u molekuli supstrata.
- CF 6: Ligaze, katalizirajući stvaranje kemijskih veza između supstrata uslijed hidrolize ATP-a. Primjer: DNA polimeraza.
Kinetička istraživanja
Najjednostavniji opis kinetika enzimatske reakcije s jednim supstratom je Michaelis-Mentenova jednadžba (vidi sliku). Do danas je opisano nekoliko mehanizama djelovanja enzima. Na primjer, djelovanje mnogih enzima opisano je shemom mehanizma "ping-pong".
Godine 1972-1973. stvoren je prvi kvantno-mehanički model enzimske katalize (autori M. V. Volkenshtein, R. R. Dogonadze, Z. D. Urushadze i dr.).
Struktura i mehanizam djelovanja enzima
Djelovanje enzima određeno je njihovom trodimenzionalnom strukturom.
Kao i svi proteini, enzimi se sintetiziraju kao linearni lanac aminokiselina koji se savija na specifičan način. Svaki slijed aminokiselina savija se na specifičan način, a rezultirajuća molekula (proteinska globula) ima jedinstvena svojstva. Nekoliko proteinskih lanaca može se spojiti u proteinski kompleks. Tercijarna struktura proteina uništava se zagrijavanjem ili izlaganjem određenim kemikalijama.
Aktivno mjesto enzima
U aktivnom centru uvjetno dodijelite:
- katalitički centar - izravno kemijski komunicira sa supstratom;
- vezni centar (kontaktno ili "sidrišno" mjesto) – osigurava specifični afinitet za supstrat i stvaranje kompleksa enzim-supstrat.
Da bi katalizirao reakciju, enzim se mora vezati na jedan ili više supstrata. Proteinski lanac enzima je presavijen na takav način da se na površini globule formira praznina, odnosno udubljenje, gdje se supstrati vežu. Ovo područje se naziva mjesto vezivanja supstrata. Obično se podudara s aktivnim mjestom enzima ili se nalazi blizu njega. Neki enzimi također sadrže vezna mjesta za kofaktore ili metalne ione.
Enzim se veže za supstrat:
- čisti podlogu od vodenog "krznenog kaputa"
- raspoređuje molekule supstrata koji reagiraju u prostoru na način potreban za odvijanje reakcije
- priprema za reakciju (primjerice, polarizira) molekule supstrata.
Obično se vezivanje enzima za supstrat događa zahvaljujući ionskim ili vodikovim vezama, rijetko zahvaljujući kovalentnim vezama. Na kraju reakcije, njezin produkt (ili produkti) se odvajaju od enzima.
Kao rezultat, enzim smanjuje aktivacijsku energiju reakcije. To je zato što u prisutnosti enzima reakcija ide drugim putem (zapravo, događa se drugačija reakcija), na primjer:
U nedostatku enzima:
- A+B = AB
U prisustvu enzima:
- A+F = AF
- AF+V = AVF
- AVF \u003d AV + F
gdje su A, B - supstrati, AB - produkt reakcije, F - enzim.
Enzimi ne mogu sami osigurati energiju za endergonske reakcije (koje zahtijevaju energiju). Stoga, enzimi koji provode takve reakcije spajaju ih s egzergonskim reakcijama koje se odvijaju s oslobađanjem više energije. Na primjer, reakcije sinteze biopolimera često su povezane s reakcijom hidrolize ATP-a.
Aktivni centri nekih enzima karakterizirani su fenomenom kooperativnosti.
Specifičnost
Enzimi obično pokazuju visoku specifičnost za svoje supstrate (supstratna specifičnost). To se postiže djelomičnom komplementarnošću oblika, raspodjele naboja i hidrofobnih područja na molekuli supstrata i na mjestu vezivanja supstrata na enzimu. Obično se pokazuju i enzimi visoka razina stereospecifičnost (tvore kao produkt samo jedan od mogućih stereoizomera ili koriste samo jedan stereoizomer kao supstrat), regioselektivnost (tvore ili prekidaju kemijsku vezu samo na jednom od mogućih položaja supstrata) i kemoselektivnost (kataliziraju samo jednu kemijsku reakciju od nekoliko mogućih za date uvjete). Unatoč općoj visokoj razini specifičnosti, stupanj supstratne i reakcijske specifičnosti enzima može biti različit. Na primjer, endopeptidaza tripsin samo prekida peptidnu vezu nakon arginina ili lizina, osim ako ih ne prati prolin, a pepsin je mnogo manje specifičan i može prekinuti peptidnu vezu nakon mnogih aminokiselina.
Model s ključem
Koshlandova inducirana pretpostavka o prilagodbi
Realnija situacija je u slučaju induciranog podudaranja. Neispravne podloge - prevelike ili premale - ne odgovaraju aktivnom mjestu
Godine 1890. Emil Fischer je predložio da je specifičnost enzima određena točnom korespondencijom između oblika enzima i supstrata. Ta se pretpostavka naziva modelom brave i ključa. Enzim se veže za supstrat stvarajući kratkotrajni kompleks enzim-supstrat. Međutim, iako ovaj model objašnjava visoku specifičnost enzima, on ne objašnjava fenomen stabilizacije prijelaznog stanja koji se uočava u praksi.
Inducirani fit model
Godine 1958. Daniel Koshland predložio je modifikaciju modela ključ-brava. Enzimi općenito nisu krute, već fleksibilne molekule. Aktivno mjesto enzima može promijeniti konformaciju nakon vezanja supstrata. Bočne skupine aminokiselina aktivnog mjesta zauzimaju položaj koji enzimu omogućuje obavljanje njegove katalitičke funkcije. U nekim slučajevima, molekula supstrata također mijenja konformaciju nakon vezanja na aktivno mjesto. Za razliku od modela ključ-brava, inducirani fit model objašnjava ne samo specifičnost enzima, već i stabilizaciju prijelaznog stanja. Ovaj model je nazvan "rukavica".
Izmjene
Mnogi enzimi nakon sinteze proteinskog lanca prolaze kroz modifikacije, bez kojih enzim ne pokazuje svoju aktivnost u punoj mjeri. Takve se modifikacije nazivaju posttranslacijske modifikacije (obrada). Jedna od najčešćih vrsta modifikacije je dodavanje kemijskih skupina na bočne ostatke polipeptidnog lanca. Na primjer, dodavanje ostatka fosforne kiseline naziva se fosforilacija i katalizira ga enzim kinaza. Mnogi eukariotski enzimi su glikozilirani, tj. modificirani oligomerima ugljikohidrata.
Drugi uobičajeni tip post-translacijskih modifikacija je cijepanje polipeptidnog lanca. Na primjer, kimotripsin (proteaza uključena u probavu) dobiva se cijepanjem polipeptidne regije iz kimotripsinogena. Kimotripsinogen je neaktivni prekursor kimotripsina i sintetizira se u gušterači. Neaktivni oblik se prenosi u želudac gdje se pretvara u kimotripsin. Ovaj mehanizam je neophodan kako bi se izbjeglo cijepanje gušterače i drugih tkiva prije nego što enzim uđe u želudac. Neaktivni prekursor enzima također se naziva "zimogen".
Enzimski kofaktori
Neki enzimi obavljaju katalitičku funkciju sami, bez dodatnih komponenti. Međutim, postoje enzimi koji za katalizu zahtijevaju neproteinske komponente. Kofaktori mogu biti ili anorganske molekule (metalni ioni, klasteri željezo-sumpor, itd.) ili organske (na primjer, flavin ili hem). Organski kofaktori koji su snažno povezani s enzimom nazivaju se i prostetičke skupine. Organski kofaktori koji se mogu odvojiti od enzima nazivaju se koenzimi.
Enzim koji zahtijeva kofaktor da bi pokazao katalitičku aktivnost, ali nije vezan za njega, naziva se apo-enzim. Apo-enzim u kombinaciji s kofaktorom naziva se holo-enzim. Većina kofaktora povezana je s enzimom nekovalentnim, ali prilično jakim interakcijama. Postoje i prostetske skupine koje su kovalentno povezane s enzimom, poput tiamin pirofosfata u piruvat dehidrogenazi.
Regulacija enzima
Neki enzimi imaju mjesta za vezivanje malih molekula i mogu biti supstrati ili proizvodi metaboličkog puta u koji enzim ulazi. Oni smanjuju ili povećavaju aktivnost enzima, što stvara priliku za povratnu informaciju.
Inhibicija krajnjeg proizvoda
Metabolički put – lanac uzastopnih enzimskih reakcija. Često je krajnji proizvod metaboličkog puta inhibitor enzima koji ubrzava prvu od reakcija u tom metaboličkom putu. Ako je krajnjeg produkta previše, tada djeluje kao inhibitor za prvi enzim, a ako nakon toga krajnjeg produkta postane premalo, tada se prvi enzim ponovno aktivira. Dakle, inhibicija krajnjim proizvodom prema principu negativne povratne sprege važan je način održavanja homeostaze (relativna konstantnost uvjeta unutarnje okoline tijela).
Utjecaj okolišnih uvjeta na aktivnost enzima
Djelovanje enzima ovisi o uvjetima u stanici ili organizmu - tlaku, kiselosti okoline, temperaturi, koncentraciji otopljenih soli (ionska jakost otopine) itd.
Višestruki oblici enzima
Višestruki oblici enzima mogu se podijeliti u dvije kategorije:
- Izoenzimi
- Pravilni oblici množine (true)
Izoenzimi- To su enzimi, čiju sintezu kodiraju različiti geni, imaju različite primarne strukture i različita svojstva, ali kataliziraju istu reakciju. Vrste izoenzima:
- Organski - enzimi glikolize u jetri i mišićima.
- Stanična - citoplazmatska i mitohondrijska malat dehidrogenaza (enzimi su različiti, ali kataliziraju istu reakciju).
- Hibridni - enzimi s kvarternom strukturom, nastaju kao rezultat nekovalentnog vezanja pojedinih podjedinica (laktat dehidrogenaza - 4 podjedinice 2 vrste).
- Mutant - nastaju kao rezultat jedne mutacije gena.
- Aloenzimi – kodirani različitim alelima istog gena.
Pravilni oblici množine(true) su enzimi čiju sintezu kodira isti alel istog gena, imaju istu primarnu strukturu i svojstva, ali nakon sinteze na ribosomima mijenjaju se i postaju drugačiji, iako kataliziraju istu reakciju.
Izoenzimi su različiti na genetskoj razini i razlikuju se od primarne sekvence, a pravi višestruki oblici postaju drugačiji na posttranslacijskoj razini.
medicinski značaj
Prvi put je utvrđena veza između enzima i nasljednih metaboličkih bolesti A. Garrodom 1910-ih godina Garrod je nazvao bolesti povezane s nedostacima enzima "urođenim greškama metabolizma".
Ako dođe do mutacije u genu koji kodira određeni enzim, sekvenca aminokiselina enzima može se promijeniti. Istodobno, kao rezultat većine mutacija, njegova katalitička aktivnost se smanjuje ili potpuno nestaje. Ako organizam primi dva od ovih mutiranih gena (po jedan od svakog roditelja), kemijska reakcija katalizirana tim enzimom prestaje se odvijati u tijelu. Na primjer, pojava albina povezana je s prestankom proizvodnje enzima tirozinaze, koji je odgovoran za jednu od faza u sintezi tamnog pigmenta melanina. Fenilketonurija je povezana sa smanjenom ili odsutnom aktivnošću enzima fenilalanin-4-hidroksilaze u jetri.
Trenutno su poznate stotine nasljednih bolesti povezanih s nedostacima enzima. Razvijene su metode za liječenje i prevenciju mnogih od ovih bolesti.
Praktična upotreba
Enzimi se široko koriste u nacionalnom gospodarstvu - hrani, tekstilna industrija, u farmakologiji i medicini. Većina lijekova utječe na tijek enzimskih procesa u tijelu, pokrećući ili zaustavljajući određene reakcije.
Još šire područje primjene enzima u znanstveno istraživanje i u medicini.
Bilješke
Književnost
Pogledajte što su "enzimi" u drugim rječnicima:
ENZIMI- (sin. enzimi; franc. dijastaza), biol. agensi koji kataliziraju većinu kem. reakcije koje su u osnovi vitalne aktivnosti stanice i organizma. Brojna karakteristična svojstva su termolabilnost, specifičnost djelovanja, visoka katalitička učinkovitost, ... ... Velik medicinska enciklopedija
- (od lat. fermentum vrenje, kiselo tijesto), enzimi, biokatalizatori, specifič. proteini prisutni u svim živim stanicama i igraju ulogu biol. katalizatori. Kroz njih se ostvaruje genetski. odvijaju se informacije i svi procesi razmjene ... ... Biološki enciklopedijski rječnik
- (lat. Fermentum kvasac, od fervere biti vruć). Organske tvari koje fermentiraju druga organska tijela, a da se same ne trule. Rječnik stranih riječi uključenih u ruski jezik. Chudinov A.N., 1910. ENZIMI ... ... Rječnik stranih riječi ruskog jezika
- (od lat. fermentum kvasac) (enzimi) biološki katalizatori prisutni u svim živim stanicama. Provesti transformaciju tvari u tijelu, usmjeravajući i regulirajući time njegov metabolizam. Kemijska priroda proteina. Enzimi ..... Veliki enciklopedijski rječnik
- (od lat. fermentum kvasac), biološki katalizatori prisutni u svim živim stanicama. Provesti transformacije (metabolizam) tvari u tijelu. Kemijska priroda proteina. Sudjeluje u brojnim biokemijskim reakcijama u stanici ... ... Moderna enciklopedija
Post., broj sinonima: 2 biokatalizatori (1) enzimi (2) Rječnik sinonima ASIS. V.N. Trishin. 2013 ... Rječnik sinonima
Enzimi. Vidi enzimi. (
Uvod
1. Enzimi
1.1 Pojam "enzimi", biološku ulogu enzima
1.2. Strukturne značajke jednostavnih i složenih enzima. Prednosti u odnosu na kemijske katalizatore
1.3 Metode izolacije enzima
1.4 Klasifikacija nomenklature enzima prema tipu katalizirane reakcije
1.5 Opseg
2. Biokataliza
2.1 Kako enzimi rade
2.2 Čimbenici koji utječu na reakcije fermentacije
3. Značajke biomimetike
Zaključak
Popis korištenih izvora
enzim katalizator reakcija
Uvod
Izabrala sam temu „Enzimi. Biokataliza. Mogućnosti biomimetike”, jer nedavno kao lijekovi počeo široko koristiti lijekove koji imaju usmjereni učinak na enzimske procese tijela. Kao što znate, u našem tijelu postoje mnogi enzimi koji doprinose provedbi metaboličkih procesa (disanje, probava, kontrakcija mišića, fotosinteza), koji određuju sam proces života. Stoga su lijekovi postali naširoko korišteni u liječenju bolesti popraćenih gnojno-nekrotičnim procesima, trombozom i tromboembolijom te probavnim poremećajima. Enzimski pripravci također su počeli nalaziti primjenu u liječenju onkoloških bolesti.
Enzimi imaju važnu ulogu u mnogim tehnološkim procesima. Visokokvalitetni enzimi omogućuju vam da poboljšate tehnologiju, smanjite troškove i čak dobijete nove proizvode.
Trenutno se enzimi koriste u više od 25 industrija: prehrambena, farmaceutska, celulozno-papirna, laka industrija, kao iu poljoprivredi.
Svrha mog sažetka je: detaljno proučavanje pojmova enzima i enzimske katalize (biokatalize).
U tom smislu, postalo mi je zanimljivo naučiti povijest pojave prvih enzima, strukturne značajke, njihova svojstva, klasifikaciju, princip djelovanja, metode za izolaciju enzima.
1. Enzimi
1.1 Pojam "enzimi", biološka uloga enzima
Čovjek je kroz svoju povijest postojanja koristio enzime, često nenamjerno.
Termin enzim predložio u 17. stoljeću kemičar Van Helmont kada je raspravljao o mehanizmima probave. U kon. XVIII - rano. 19. stoljeća već se znalo da se meso probavlja želučana kiselina a škrob se slinom pretvara u šećer. Međutim, mehanizam ovih pojava bio je nepoznat. U 19. stoljeću Louis Pasteur, proučavajući pretvorbu ugljikohidrata u etanol pod utjecajem kvasca, došli do zaključka da je ovaj proces (fermentacija) kataliziran nekom vrstom vitalne sile koja se nalazi u stanicama kvasca. Termin enzim(od grčkog ἐ ν- - u- i ζύμη - kvasac, kiselo tijesto) predložen je 1876. godine.
Prvi kristalni enzim (ureazu) izolirao je američki biokemičar D. Sumner 1926. godine.
Dakle, što su enzimi? Enzimi (od lat. fermentum - vrenje, kiselo tijesto) ili enzimi - organska tvar proteinske prirode, koji se sintetiziraju u stanicama i mnogo puta ubrzavaju reakcije koje se odvijaju u njima, bez podvrgavanja kemijskim transformacijama.
Do danas je poznato preko 3000 enzima. Svi oni imaju niz specifičnih svojstava koja ih razlikuju od anorganskih katalizatora. Samo u ljudsko tijelo Tisuće enzimskih reakcija odvija se svake sekunde. Enzimi imaju važnu ulogu u svim životnim procesima, usmjeravajući i regulirajući tjelesni metabolizam.
Također treba napomenuti da svi Živa priroda postoji isključivo putem biokatalize. Nije ni čudo što je veliki ruski fiziolog, nobelovac I.P. Pavlov je enzime nazvao nositeljima života.
1.2. Strukturne značajke jednostavnih i složenih enzima. Prednosti u odnosu na kemijske katalizatore
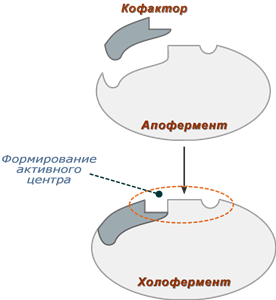
Po strukturi enzimi mogu biti jednokomponentni, jednostavni proteini i dvokomponentni, složeni proteini. U drugom slučaju, enzim ne sadrži samo proteinsku komponentu, apoenzim ( apoenzim), ali i dodatnu skupinu neproteinske prirode – koenzim (koenzim). Potonje tvari, za razliku od proteinske komponente enzima (apoenzima), imaju relativno malu molekulsku masu i u pravilu su termostabilne.
Kemijska priroda najvažnijih koenzima razjašnjena je 30-ih godina našeg stoljeća zahvaljujući radovima O. Warburga, R. Kuhna, P. Carrere i dr. Pokazalo se da ulogu koenzima u dvokomponentnim enzimima igra većinom vitamina (E, K, Q, B1, B2, B6, B12, C, H itd.) ili spojeva izgrađenih uz sudjelovanje vitamina, zbog čega se moraju unositi hranom. Mnogi enzimi velike molekularne težine pokazuju katalitičku aktivnost samo u prisutnosti specifičnih tvari niske molekularne težine koje se nazivaju koenzimi (ili kofaktori).
Karakteristična značajka dvokomponentnih enzima je da niti proteinski dio niti dodatna skupina pojedinačno nemaju zamjetnu katalitičku aktivnost. Samo njihov kompleks pokazuje enzimska svojstva. Istodobno, protein naglo povećava katalitičku aktivnost dodatne skupine, koja mu je svojstvena u slobodnom stanju u vrlo maloj mjeri; dodatna skupina stabilizira proteinski dio i čini ga manje osjetljivim na sredstva za denaturaciju.
Jednokomponentni enzimi su jednostavni proteini. Za jednokomponentne enzime koji nemaju dodatnu skupinu koja bi mogla doći u izravan kontakt s pretvorenim spojem. Tu funkciju obavlja dio proteinske molekule koji se naziva katalitički centar. Pretpostavlja se da je katalitički centar jednokomponentnog enzima jedinstvena kombinacija nekoliko aminokiselinskih ostataka smještenih u određenom dijelu proteinske molekule. Aminokiselinski ostaci koji tvore katalitički centar jednokomponentnog enzima nalaze se na različitim točkama u jednom polipeptidnom lancu. Dakle, katalitički centar nastaje u trenutku kada proteinska molekula dobije svoju inherentnu tercijarnu strukturu. Posljedično, promjena tercijarne strukture enzima pod utjecajem određenih čimbenika može dovesti do deformacije katalitičkog centra i promjene enzimske aktivnosti.
Osim katalitičkog centra koji nastaje kombinacijom radikala aminokiselina ili dodatkom koenzima, u enzimima se razlikuju još dva centra: supstratni i alosterički. Pod središtem supstrata podrazumijeva se dio molekule enzima odgovoran za pričvršćivanje tvari (supstrata) koja prolazi kroz enzimsku transformaciju. Često se ovo mjesto naziva "područje sidra" enzima, gdje, poput broda na sidru, postaje supstrat. Koncept katalitičkog i supstratnog centra ne treba uzimati kao apsolut. U pravim enzimima, supstratno mjesto može koincidirati (ili se preklapati s) katalitičkim mjestom. Štoviše, katalitički centar može biti konačno formiran u trenutku pričvršćivanja supstrata. Stoga se često govori o aktivnom središtu enzima, koji je kombinacija prvog i drugog.
Alosterično središte je dio molekule enzima, kao rezultat vezanja na koji određena tvar male (a ponekad i velike) molekularne težine mijenja tercijarnu strukturu proteinske molekule. Kao rezultat toga, mijenja se konfiguracija aktivnog centra, praćena povećanjem ili smanjenjem katalitičke aktivnosti enzima.
Enzimi kao biološki katalizatori imaju niz značajki koje ih razlikuju od anorganskih katalizatora:
enzimske reakcije odvijaju se u fiziološki normalnim uvjetima za živi organizam i ne zahtijevaju teške uvjete - povišenu temperaturu, visoku kiselost medija, prekomjerni tlak;
enzimi kao katalizatori su strogo specifični, kataliziraju samo određene biokemijske reakcije, djelujući samo na određeni supstrat;
enzimske reakcije u živim organizmima odvijaju se sekvencijalno, tako da je supstrat za svaki sljedeći enzim krajnji produkt enzimske reakcije koja mu prethodi;
brzina enzimskih reakcija je visoka, ali ovisi o određenim čimbenicima. Ubrzati reakciju za 10 8 -10 20 puta. Enzimske reakcije idu sa 100% iskorištenjem i ne daju nusprodukte. Catal se koristi za izražavanje katalitičke aktivnosti prema preporukama Međunarodne biokemijske unije. Catal (cat) je katalitička aktivnost koja može izvesti reakciju brzinom od 1 mola u sekundi;
svi enzimi su proteini. Molekularna težina enzima varira u širokim granicama od 12*10 3 do 10*10 6 Da.
1.3 Metode izolacije enzima
Proces izolacije proteina počinje prijenosom tkivnih proteina u otopinu. Da bi se to postiglo, tkivo (materijal) iz kojeg se dobiva enzim pažljivo se melje u homogenizatoru u prisutnosti puferske otopine. Radi boljeg uništavanja stanica u materijal se dodaje kvarcni pijesak ako se materijal melje u mužaru. Kao rezultat, dobiva se kaša - homogenat. Ako nije provedeno prethodno frakcioniranje staničnih organela, homogenat sadrži fragmente stanica, jezgri, kloroplasta i drugih staničnih organela, topljive pigmente i proteine.
Prilikom izolacije enzima iz tkiva živih organizama, uključujući biljke, potrebno je poštivati uvjete koji ne uzrokuju denaturaciju proteina. Svi radovi se izvode na niskoj temperaturi (4 0 C) i na pH vrijednostima puferske otopine koje su optimalne za ovaj enzim.
Nakon prijenosa enzima iz tkiva u otopljeno stanje, homogenat se podvrgava centrifugiranju kako bi se odvojio netopljivi dio materijala, a zatim se sljedeći enzimi izoliraju u zasebnim frakcijama ekstrakta-centrifugata.
Budući da su svi enzimi proteini, za dobivanje pročišćenih enzimskih pripravaka koriste se iste metode izolacije kao i kod rada s proteinima.
Uvod
1. Enzimi
1.1 Pojam "enzimi", biološka uloga enzima
1.2. Strukturne značajke jednostavnih i složenih enzima. Prednosti u odnosu na kemijske katalizatore
1.3 Metode izolacije enzima
1.4 Klasifikacija nomenklature enzima prema tipu katalizirane reakcije
1.5 Opseg
2. Biokataliza
2.1 Kako enzimi rade
2.2 Čimbenici koji utječu na reakcije fermentacije
3. Značajke biomimetike
Zaključak
Popis korištenih izvora
enzim katalizator reakcija
Uvod
Izabrala sam temu „Enzimi. Biokataliza. Mogućnosti biomimetike, jer su nedavno lijekovi koji imaju usmjereni učinak na enzimske procese u tijelu postali naširoko korišteni kao lijekovi. Kao što znate, u našem tijelu postoje mnogi enzimi koji doprinose provedbi metaboličkih procesa (disanje, probava, kontrakcija mišića, fotosinteza), koji određuju sam proces života. Stoga su lijekovi postali naširoko korišteni u liječenju bolesti popraćenih gnojno-nekrotičnim procesima, trombozom i tromboembolijom te probavnim poremećajima. Enzimski pripravci također su počeli nalaziti primjenu u liječenju onkoloških bolesti.
Enzimi imaju važnu ulogu u mnogim tehnološkim procesima. Visokokvalitetni enzimi omogućuju vam da poboljšate tehnologiju, smanjite troškove i čak dobijete nove proizvode.
Trenutno se enzimi koriste u više od 25 industrija: prehrambena, farmaceutska, celulozno-papirna, laka industrija, kao iu poljoprivredi.
Svrha mog sažetka je: detaljno proučavanje pojmova enzima i enzimske katalize (biokatalize).
U tom smislu, postalo mi je zanimljivo naučiti povijest pojave prvih enzima, strukturne značajke, njihova svojstva, klasifikaciju, princip djelovanja, metode za izolaciju enzima.
1. Enzimi
1.1 Pojam "enzimi", biološka uloga enzima
Čovjek je kroz svoju povijest postojanja koristio enzime, često nenamjerno.
Termin enzim predložio u 17. stoljeću kemičar Van Helmont kada je raspravljao o mehanizmima probave. U kon. XVIII - rano. 19. stoljeća već se znalo da se meso probavlja želučanim sokom, a škrob se pretvara u šećer djelovanjem sline. Međutim, mehanizam ovih pojava bio je nepoznat. U 19. stoljeću Louis Pasteur, proučavajući pretvorbu ugljikohidrata u etilni alkohol pod djelovanjem kvasca, došao je do zaključka da je taj proces (fermentacija) kataliziran određenim životna snaga nalazi u stanicama kvasca. Termin enzim(od grčkog ἐν- - u- i ζύμη - kvasac, kiselo tijesto) predložen je 1876. godine.
Prvi kristalni enzim (ureazu) izolirao je američki biokemičar D. Sumner 1926. godine.
Dakle, što su enzimi? Enzimi (od lat. fermentum - vrenje, kiselo tijesto) ili enzimi su organske tvari proteinske prirode koje se sintetiziraju u stanicama i višestruko ubrzavaju reakcije koje se u njima odvijaju bez podvrgavanja kemijskim transformacijama.
Do danas je poznato preko 3000 enzima. Svi oni imaju niz specifičnih svojstava koja ih razlikuju od anorganskih katalizatora. Samo u ljudskom tijelu svake sekunde odvijaju se tisuće enzimskih reakcija. Enzimi imaju važnu ulogu u svim životnim procesima, usmjeravajući i regulirajući tjelesni metabolizam.
Također treba napomenuti da sve divlje životinje postoje isključivo zahvaljujući biokatalizi. Nije ni čudo što je veliki ruski fiziolog, nobelovac I.P. Pavlov je enzime nazvao nositeljima života.
1.2. Strukturne značajke jednostavnih i složenih enzima. Prednosti u odnosu na kemijske katalizatore
Po strukturi enzimi mogu biti jednokomponentni, jednostavni proteini i dvokomponentni, složeni proteini. U drugom slučaju, ne samo proteinska komponenta, apoenzim (apoenzim ), ali i dodatna skupina neproteinske prirode - koenzim (koenzim) . Potonje tvari, za razliku od proteinska komponenta enzim (apoenzim), imaju relativno malu molekulsku masu i u pravilu su termostabilni.
Kemijska priroda najvažnijih koenzima razjašnjena je 30-ih godina našeg stoljeća zahvaljujući radovima O. Warburga, R. Kuhna, P. Carrere i dr. Pokazalo se da ulogu koenzima u dvokomponentnim enzimima igra većinom vitamina (E, K, Q, B1, B2, B6, B12, C, H itd.) ili spojeva izgrađenih uz sudjelovanje vitamina, zbog čega se moraju unositi hranom. Mnogi enzimi velike molekularne težine pokazuju katalitičku aktivnost samo u prisutnosti specifičnih tvari niske molekularne težine koje se nazivaju koenzimi (ili kofaktori).
Karakteristična značajka dvokomponentnih enzima je da niti proteinski dio niti dodatna skupina pojedinačno nemaju zamjetnu katalitičku aktivnost. Samo njihov kompleks pokazuje enzimska svojstva. Istodobno, protein naglo povećava katalitičku aktivnost dodatne skupine, koja mu je svojstvena u slobodnom stanju u vrlo maloj mjeri; dodatna skupina stabilizira proteinski dio i čini ga manje osjetljivim na sredstva za denaturaciju.
Jednokomponentni enzimi su jednostavni proteini.Jednokomponentni enzimi nemaju dodatnu skupinu koja bi mogla doći u izravni kontakt s pretvorenim spojem. Tu funkciju obavlja dio proteinske molekule koji se naziva katalitički centar. Pretpostavlja se da je katalitički centar jednokomponentnog enzima jedinstvena kombinacija nekoliko aminokiselinskih ostataka smještenih u određenom dijelu proteinske molekule. Aminokiselinski ostaci koji tvore katalitički centar jednokomponentnog enzima nalaze se na različitim točkama u jednom polipeptidnom lancu. Dakle, katalitički centar nastaje u trenutku kada proteinska molekula dobije svoju inherentnu tercijarnu strukturu. Posljedično, promjena tercijarne strukture enzima pod utjecajem određenih čimbenika može dovesti do deformacije katalitičkog centra i promjene enzimske aktivnosti.
Osim katalitičkog centra koji nastaje kombinacijom radikala aminokiselina ili dodatkom koenzima, u enzimima se razlikuju još dva centra: supstratni i alosterički. Pod središtem supstrata podrazumijeva se dio molekule enzima odgovoran za pričvršćivanje tvari (supstrata) koja prolazi kroz enzimsku transformaciju. Često se ovo mjesto naziva "područje sidra" enzima, gdje, poput broda na sidru, postaje supstrat. Koncept katalitičkog i supstratnog centra ne treba uzimati kao apsolut. U pravim enzimima, supstratno mjesto može koincidirati (ili se preklapati s) katalitičkim mjestom. Štoviše, katalitički centar može biti konačno formiran u trenutku pričvršćivanja supstrata. Stoga se često govori o aktivnom središtu enzima, koji je kombinacija prvog i drugog.
Alosterično središte je dio molekule enzima, kao rezultat vezanja na koji određena tvar male (a ponekad i velike) molekularne težine mijenja tercijarnu strukturu proteinske molekule. Kao rezultat toga, mijenja se konfiguracija aktivnog centra, praćena povećanjem ili smanjenjem katalitičke aktivnosti enzima.
Enzimi kao biološki katalizatori imaju niz značajki koje ih razlikuju od anorganskih katalizatora:
Enzimske reakcije odvijaju se u fiziološki normalnim uvjetima za živi organizam i ne zahtijevaju teške uvjete - povišenu temperaturu, visoku kiselost medija, prekomjerni tlak;
Enzimi kao katalizatori su strogo specifični, oni kataliziraju samo određene biokemijske reakcije, djelujući samo na određeni supstrat;
Enzimske reakcije u živim organizmima odvijaju se sekvencijalno, tako da je supstrat za svaki sljedeći enzim krajnji produkt enzimske reakcije koja mu prethodi;
Brzina enzimskih reakcija je visoka, ali ovisi o određenim čimbenicima. Ubrzati reakciju za 10 8 -10 20 puta. Enzimske reakcije idu sa 100% iskorištenjem i ne daju nusprodukte. Catal se koristi za izražavanje katalitičke aktivnosti prema preporukama Međunarodne biokemijske unije. Catal (cat) je katalitička aktivnost koja može izvesti reakciju brzinom od 1 mola u sekundi;
Svi enzimi su proteini. Molekularna težina enzima varira u širokim granicama od 12*10 3 do 10*10 6 Da.
1.3 Metode izolacije enzima
Proces izolacije proteina počinje prijenosom tkivnih proteina u otopinu. Da bi se to postiglo, tkivo (materijal) iz kojeg se dobiva enzim pažljivo se melje u homogenizatoru u prisutnosti puferske otopine. Radi boljeg uništavanja stanica u materijal se dodaje kvarcni pijesak ako se materijal melje u mužaru. Kao rezultat, dobiva se kaša - homogenat. Ako nije provedeno prethodno frakcioniranje staničnih organela, homogenat sadrži fragmente stanica, jezgri, kloroplasta i drugih staničnih organela, topljive pigmente i proteine.
Prilikom izolacije enzima iz tkiva živih organizama, uključujući biljke, potrebno je poštivati uvjete koji ne uzrokuju denaturaciju proteina. Svi radovi se izvode na niskoj temperaturi (4 0 C) i na pH vrijednostima puferske otopine koje su optimalne za ovaj enzim.
Nakon prijenosa enzima iz tkiva u otopljeno stanje, homogenat se podvrgava centrifugiranju kako bi se odvojio netopljivi dio materijala, a zatim se sljedeći enzimi izoliraju u zasebnim frakcijama ekstrakta-centrifugata.
Budući da su svi enzimi proteini, za dobivanje pročišćenih enzimskih pripravaka koriste se iste metode izolacije kao i kod rada s proteinima.
Metode odabira:
taloženje proteina organskim otapalima;
soljenje;
metoda elektroforeze;
metoda ionsko-izmjenjivačke kromatografije;
Metoda centrifugiranja
metoda gel filtracije;
metoda afinitetne kromatografije, ili metoda afinitetne kromatografije;
selektivna denaturacija.
1.4 Klasifikacija i nomenklatura enzima prema vrsti katalizirane reakcije
Klasifikacija i nomenklatura enzima temelji se na vrsti reakcije koju kataliziraju, budući da je katalizirana reakcija specifična značajka po kojoj se jedan enzim razlikuje od drugoga.
Godine 1961. posebna komisija Međunarodne biokemijske unije predložila je sustavnu nomenklaturu enzima. Enzimi su podijeljeni u 6 skupina ili klasa prema uobičajeni tip reakcije koje kataliziraju: oksidoreduktaze, transferaze, hidrolaze, liaze, izomeraze, ligaze.
Svaki enzim tada dobiva sustavno ime koje točno opisuje reakciju koju katalizira. Međutim, budući da su se mnoga od tih sustavnih naziva pokazala vrlo dugačkima i složenima, svakom je enzimu dodijeljeno i trivijalno, radno ime namijenjeno svakodnevnoj uporabi. U većini slučajeva sastoji se od naziva tvari na koju enzim djeluje, naznake vrste reakcije koja se katalizira i završetka -aza.
Međunarodna komisija za enzime razvila je sustav za dodjelu kodnih brojeva (šifara) pojedinim enzimima. Šifra za svaki enzim sadrži četiri broja odvojena točkama. Sastavlja se prema sljedećem principu:
A. Prvi broj označava kojoj klasi enzim pripada.
B. Drugi broj dodijeljen enzimu klasifikacijom označava potklasu. Za oksidoreduktaze, označava prirodu skupine u molekuli donora koja se podvrgava oksidaciji (1- označava alkoholnu skupinu -CH-OH; 2-aldehidnu ili ketonsku skupinu, itd.); za transferaze, priroda transportirane skupine; u hidrolazama, tip hidrolizabilne veze; u lijazama, vrsta veze koja se raskida; za izomeraze, tip katalizirane reakcije izomerizacije; za ligaze, vrsta novoformirane veze.B. Treći broj označava potklasu. Za oksidoreduktaze, označava za svaku skupinu donora vrstu uključenog akceptora (1 označava NAD + ili NASP + koenzim; 2- citokrom; 3- molekularni kisik, itd.); kod transferaza, treći broj označava vrstu skupine koja se transportira; u hidrolazama, ovaj broj određuje tip veze koja se može hidrolizirati, dok u lijazama, tip skupine koju treba odcijepiti; za izomeraze, specificira prirodu transformacije supstrata, a za ligaze, specificira prirodu formirajućeg spoja.
D. Četvrti broj označava serijski broj enzima u ovoj podklasi.
Klasifikacija šifara ima vrlo važnu prednost - eliminira potrebu za promjenom brojeva svih sljedećih enzima prilikom uključivanja novootkrivenih enzima na popis. Novi enzim može se staviti na kraj odgovarajuće podklase bez ometanja ostatka numeriranja.
Enzimi se široko koriste u industrijama kao što su pekarstvo, pivarstvo, vinarstvo, proizvodnja čaja, kože i krzna, proizvodnja sira, prirodnih sokova, kave, kuhanje (za preradu mesa) itd. U posljednjih godina enzimi su se počeli koristiti u finoj kemijskoj industriji za izvođenje takvih reakcija organska kemija, kao što su oksidacija, redukcija, deaminacija, dekarboksilacija, dehidracija, kondenzacija, kao i za odvajanje i izolaciju izomera L-serije aminokiselina (tijekom kemijske sinteze nastaju racemske smjese L- i D-izomera), koji su koristi se u industriji, poljoprivredi i medicini. Ovladavanje suptilnim mehanizmima djelovanja enzima nedvojbeno će pružiti neograničene mogućnosti dobivanja korisnih tvari u velikim količinama i velikom brzinom u laboratorijskim uvjetima s gotovo stopostotnim iskorištenjem.
Enzimi se koriste u proizvodnji deterdženata i papira, kao iu tehnološki procesi za proizvodnju kože i tekstila, farmaceutsku industriju (festal, mezimforte). Sada ih je postalo moguće koristiti u hrani za životinje.
Enzimi koji se koriste u prehrambenoj industriji širok raspon primjene, uključujući funkcije sinteze i razgradnje (razgradnje). Prilikom odabira enzima za pojedini prehrambeni proces potrebno je voditi računa o njegovom izvoru i biokemijskim karakteristikama, što je važno za certifikaciju.
Kao i drugi prehrambeni aditivi, uporaba enzima u hrani regulirana je zakonom.
2. Biokataliza
Biokataliza (enzimska kataliza), ubrzanje kemijskih reakcija pod utjecajem enzima. Životna aktivnost temelji se na brojnim kemijskim reakcijama cijepanja hranjivih tvari, sinteze potrebno za tijelo kemijski spojevi te pretvaranje njihove energije u energiju fizioloških procesa (rad mišića, bubrega, živčana aktivnost i tako dalje.). Sve te reakcije ne bi se mogle odvijati brzinom potrebnom za žive organizme, da mehanizmi njihovog ubrzanja uz pomoć biokatalize nisu nastali tijekom evolucije.
2.1 Kako enzimi rade
Tvar koja se transformira u prisutnosti enzima naziva se supstrat. Supstrat se pridružuje enzimu, što ubrzava kidanje jednih kemijskih veza u njegovoj molekuli i stvaranje drugih; nastali produkt se odvaja od enzima.
Enzimi se ne troše tijekom reakcije. Oni se oslobađaju po završetku reakcije i odmah su spremni za početak sljedeće reakcije. Teoretski, to može trajati unedogled, barem dok ne potroše sav supstrat. U praksi je zbog njihove osjetljivosti i organskog sastava životni vijek enzima ograničen.
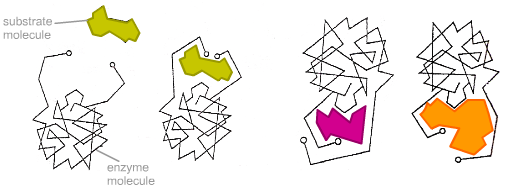
Prema slikovitom izrazu koji se koristi u biokemijskoj literaturi, enzim pristupa supstratu poput "ključa u bravu". Ovo je pravilo formulirao E. Fischer 1894. godine na temelju toga da je specifičnost djelovanja enzima unaprijed određena strogom korespondencijom između geometrijske strukture supstrata i aktivnog središta enzima. Enzim se veže za supstrat stvarajući kratkotrajni kompleks enzim-supstrat (stvaranje intermedijarnog kompleksa). Međutim, iako ovaj model objašnjava visoku specifičnost enzima, on ne objašnjava fenomen stabilizacije prijelaznog stanja koji se uočava u praksi. U 1950-ima ovo statično gledište zamijenjeno je hipotezom D. Koshlanda o induciranoj sukladnosti supstrata i enzima. Njegova se bit svodi na činjenicu da se prostorna korespondencija između strukture supstrata i aktivnog središta enzima stvara u trenutku njihove međusobne interakcije, što se može izraziti formulom "rukavica-ruka". Enzimi općenito nisu krute, već fleksibilne molekule. Aktivno mjesto enzima može promijeniti konformaciju nakon vezanja supstrata. Bočne skupine aminokiselina aktivnog mjesta zauzimaju položaj koji enzimu omogućuje obavljanje njegove katalitičke funkcije. U nekim slučajevima, molekula supstrata također mijenja konformaciju nakon vezanja na aktivno mjesto. Za razliku od modela ključ-brava, inducirani fit model objašnjava ne samo specifičnost enzima, već i stabilizaciju prijelaznog stanja.
Ali u procesu sve većeg razvoja znanosti, Koshlandovu hipotezu postupno zamjenjuje hipoteza topokemijske korespondencije. Zadržavajući glavne odredbe hipoteze o međusobno induciranom ugađanju supstrata i enzima, skreće pozornost na činjenicu da je specifičnost djelovanja enzima prvenstveno posljedica prepoznavanja onog dijela supstrata koji se ne mijenja tijekom katalize. . Između ovog dijela supstrata i supstratnog središta enzima nastaju brojne točkaste hidrofobne interakcije i vodikove veze.
2.2 Čimbenici koji utječu na enzimske reakcije
Na aktivnost enzima, a posljedično i na brzinu reakcija enzimske katalize, utječu različiti čimbenici:
· Koncentracija i dostupnost supstrata. Pri konstantnoj količini enzima, brzina raste s povećanjem koncentracije supstrata. Ova reakcija podliježe zakonu djelovanja mase i razmatra se u svjetlu Michaelis-Mentonove teorije.
· Koncentracija enzima. Koncentracija enzima uvijek je relativno niska. Brzina bilo kojeg enzimskog procesa uvelike ovisi o koncentraciji enzima. Za većinu primjene u hrani brzina reakcija proporcionalna je koncentraciji enzima. Izuzetak su oni slučajevi kada su reakcije dovedene do vrlo visoke razine niske razine supstrat.
· Temperatura reakcije. Do određene temperature (u prosjeku do 50°C) katalitička aktivnost raste, a za svakih 10°C brzina pretvorbe supstrata se povećava za oko 2 puta. Općenito, za enzime životinjskog podrijetla ona je između 40 i 50°C, a biljnog podrijetla između 50 i 60°C. Najoptimalnija temperatura je 37 o C, pri kojoj se procesi u živom organizmu odvijaju brzo uz uštedu velike količine energije. No, postoje enzimi s višim temperaturnim optimumom, primjerice papain ima optimum na 80°C. Istovremeno, katalaza ima optimalnu temperaturu djelovanja između 0 i -10°C.
· reakcija pH. Svaki enzim ima određeni raspon pH vrijednosti pri kojem enzim pokazuje maksimalnu aktivnost. Međutim najbolji uvjeti njihovo djelovanje je blizu neutralne pH vrijednosti. U izrazito kiselom ili izrazito alkalnom okruženju samo neki enzimi dobro rade. Utjecaj pH medija na djelovanje enzima temelji se na činjenici da dolazi do promjene naboja različitih proteinskih skupina u aktivnom središtu enzima, što uzrokuje značajnu promjenu konformacije polipeptidnog lanca.
· Trajanje procesa. Za reakciju enzimske katalize prvog reda, brzina reakcije opada tijekom vremena kako se smanjuje dostupnost supstrata. Za završetak takvih reakcija enzimske katalize potrebno je dosta vremena.
· Prisutnost inhibitora ili aktivatora. Kemikalije koje mogu izazvati štetno djelovanje na reakciju fermentacije nazivaju se "inhibitori". Kao takve tvari mogu djelovati metali (bakar, željezo, kalcij) ili spojevi iz supstrata. Neke tvari mogu aktivirati ili stabilizirati enzime. Prisutnost određenih iona u reakcijskom mediju može aktivirati stvaranje aktivnog supstrata enzimskog kompleksa, te će se u tom slučaju brzina enzimske reakcije povećati. Takve tvari nazivamo aktivatorima.
3. Značajke biomimetike
Znanje koje su ljudi dobili iz prirode koristi se u suvremenom svijetu posvuda, od građevinarstva do medicine. Danas je to znanje već konstituiralo novo znanstveno polje: biomimetiku. Ovaj pojam prva je uvela američka prirodoslovka Janine Benius.
Biomimetika je područje kemije koje modelira procese koji se odvijaju u divljini. Otkrića u području biomimetičkih sustava pripremaju revoluciju u području sinteze novih materijala. razlikovati:
biološki, proučavajući procese koji se odvijaju u biološki sustavi;
· teoretski, izgradnja matematičkih modela ovih procesa;
· tehnički, primjena modela teorijske biomimetike za rješavanje inženjerskih problema.
Institut za probleme kemijske fizike Ruske akademije znanosti u Černogolovki već je pronašao biomimetičke pristupe enzimatskoj fiksaciji dušika, anaerobnoj oksidaciji alkana (metan u metanol) i fotooksidaciji vode za proizvodnju kisika (to je ono što biljke rade tijekom fotosinteze ).
Boja Lotosan proizvedena u Njemačkoj vrlo je otporna na prljavštinu. Ideja je preuzeta iz cvjetova lotosa koji rastu u močvarnim područjima, a unatoč tome zadržavaju svoju bjelinu. Ispostavilo se da je stvar u mikroskopskim šiljcima koji prekrivaju površinu cvijeta. One sprječavaju zadržavanje čestica na laticama i omogućuju kišnici da ih lako ispere. Trenutno se programeri bore za stvaranje laganih, elastičnih i jakih (5 puta jačih od čelika) materijala temeljenih na webu. Ideologija biomimetike čvrsto je zauzela svoje mjesto u raznim disciplinama – inženjerstvu, kemijskoj tehnologiji, nanotehnologiji i mnogim drugim. Znanstvenici će pokušati pronaći kemijske analoge enzima i na temelju njih stvoriti nove industrijske procese. I ovaj će proces s vremenom samo dobiti na zamahu.
Zaključak
U ovom radu jedan od bioloških djelatne tvari naime enzimi. Enzimi su biološki katalizator priroda proteina, ubrzavanje kemijskih reakcija u živim organizmima i izvan njih. Enzimi imaju jedinstvena svojstva koja ih razlikuju od konvencionalnih organskih katalizatora. To je, prije svega, neobično visoka katalitička aktivnost. Drugo važno svojstvo enzima je selektivnost njihova djelovanja.
Važno svojstvo enzima, koje se mora uzeti u obzir u njihovoj praktičnoj uporabi, je stabilnost, tj. njihovu sposobnost održavanja katalitičke aktivnosti.
Zbog visoke specifičnosti enzima, u tijelu ne vlada kaos: svaki enzim obavlja strogo dodijeljene funkcije bez utjecaja na tijek mnogih desetaka i stotina drugih reakcija koje se odvijaju u njegovoj okolini. Uloga enzima u životu organizama je velika.
Budućnost enzima je vrlo zanimljiva. Tehnologija za otkrivanje i proizvodnju novih enzima napreduje velikom brzinom. Prije nego što se razvila uporaba i proizvodnja enzima najvećim dijelom putem pokušaja i pogrešaka. Budući da su detalji koji utječu na kemiju i djelovanje enzima bili slabo poznati, u pripravcima su korištene mješavine najsvestranijih enzima. Zahvaljujući novim istraživanjima, specifičniji enzimi mogu se koristiti u proizvodnji tržišnih proizvoda.
Tehnologije koje se danas razvijaju svakim danom otkrivaju sve nova i nova čuda stvaranja života, a "biomimetika" kao znanost za primjere bira izvrsne sustave u organizmima živih bića, stvarajući izume na njihovu sliku i priliku za dobrobit i dobrobit narod. Znanstvenici će pokušati pronaći kemijske analoge enzima i na temelju njih stvoriti nove industrijske procese.
Bibliografija
1. http://www.krugosvet.ru/articles/03/1000310/1000310a1.htm
2. Gabrielyan O.S., Maskaev F.N., Ponomarev S.Yu., Terenin V.I. Udžbenik hemije za 10. razred. - M., 2005.
3. Nechaev A.P., Kochetkova A.A., Zaitsev A.N. Prehrambeni aditivi - M., 2001.
4. Biokemija biljnih materijala / Ed. Shcherbakova V.G. M., 1999. (monografija).
5. http://www.gazeta.ru/science/2007/10/15_a_2241957.shtml?incut2
6. http://www.cleandex.ru/articles/2008/07/07/biomimetic-1
Prilog 1
stol 1
| Klase enzima | katalizirana reakcija | Primjeri enzima ili njihovih skupina (navedeni trivijalni nazivi) |
| Oksidoreduktaza | Prijenos vodikovih atoma ili elektrona s jedne tvari na drugu | Dehidrogenaza, oksidaza |
| Transferaze | Prijenos određene skupine atoma - metilne, acilne, fosfatne ili amino skupine - s jedne tvari na drugu | transaminaza, kinaza |
| Hidrolaze | Reakcije hidrolize | Lipaza, amilaza, peptidaza |
| Liase | Nehidrolitički dodatak supstratu | Dekarboksilaza, fumaraza, aldolaza |
| Izomeraze | intramolekularno preuređenje | Izomeraza, mutaza |
| Ligaze | Povezivanje dviju molekula kao rezultat stvaranja novih C-C veze, C-N, C-O ili C-S, povezani s razgradnjom ATP-a | Sintetaza |
Prilog 2
Neki primjeri uporabe enzima u industriji
tablica 2
| Enzim | Industrija | Korištenje | |
| amilaza (razgrađuje škrob) | pivovara | Saharizacija škroba sadržanog u sladu | |
| tekstil | Uklanjanje škroba nanesenog na niti tijekom dimenzioniranja | ||
pekara |
škrob glukoza. Stanice kvasca, fermentirajući glukozu, stvaraju ugljični dioksid, čiji mjehurići rahle tijesto i daju kruhu poroznu strukturu. Kruh bolje porumeni i dulje ostaje ustajao | ||
Proteaze (podjela |
papain | pivovara | Faze procesa kuhanja piva koje reguliraju kvalitetu pjene |
| meso | Omekšavanje mesa. Ovaj enzim je prilično otporan na porast temperature i nastavlja djelovati neko vrijeme kada se meso zagrijava. Tada se, naravno, deaktivira | ||
| farmaceutski | Dodaci pastama za zube za uklanjanje naslaga | ||
| ficin | fotografija | Ispiranje želatine s korištenog filma kako bi se ekstrahiralo srebro iz njega | |
| pepsin | hrana | Proizvodnja "gotovih" žitarica | |
| farmaceutski | Pomaže probavi (uz normalno djelovanje pepsina u želucu) | ||
| tripsin | hrana | Proizvodnja proizvoda za dječju hranu | |
| rennin | pravljenje sira | Zgrušavanje mlijeka (dobivanje ugruška kazeina) | |
|
stvaran proteaze |
Praonica | Deterdženti za pranje rublja s dodacima enzima | |
| koža | Odvajanje dlaka - metoda pri kojoj se ne oštećuju ni dlaka ni koža | ||
| tekstil | Vađenje vune iz ostataka ovčjih koža | ||
Odavno je utvrđeno da su svi enzimi proteini i da imaju sva svojstva proteina. Stoga se, kao i proteini, enzimi dijele na jednostavne i složene.
jednostavni enzimi sastoje se samo od aminokiselina, npr. pepsin , tripsin , lizozim.
Složeni enzimi(holoenzimi) u svom sastavu imaju proteinski dio, koji se sastoji od aminokiselina - apoenzim, i neproteinski dio - kofaktor. Kofaktor se, pak, može nazvati koenzimom ili prostetskom skupinom. Primjer bi mogao biti sukcinat dehidrogenaza(sadrži FAD) (u ciklusu trikarboksilne kiseline), aminotransferaze(sadrži piridoksal fosfat), peroksidaza(sadrži hem).
Za provedbu katalize potreban je punopravni kompleks apoproteina i kofaktora; oni ne mogu katalizirati odvojeno. Kofaktor je dio aktivnog centra, sudjeluje u vezivanju supstrata ili u njegovoj transformaciji.
Kao i mnogi proteini, enzimi mogu biti monomeri, tj. sastoji se od jedne podjedinice i polimeri koji se sastoji od nekoliko podjedinica.
Strukturna i funkcionalna organizacija enzima
U sastavu enzima razlikuju se regije koje obavljaju različite funkcije:
1. Aktivni centar - kombinacija aminokiselinskih ostataka (obično 12-16), osiguravajući izravno vezanje na molekulu supstrata i katalizu. Aminokiselinski radikali u aktivnom centru mogu biti u bilo kojoj kombinaciji, dok se aminokiseline nalaze u blizini, koje su značajno udaljene jedna od druge u linearnom lancu. Postoje dva odjeljka u aktivnom centru:
- sidro(kontakt, vezivanje) - odgovoran je za vezanje i orijentaciju podloge u aktivnom centru,
- katalitički- neposredno odgovoran za provedbu reakcije.
Dijagram strukture enzima
Enzimi koji u svom sastavu imaju više monomera mogu prema broju podjedinica imati više aktivnih centara. Također, dvije ili više podjedinica mogu činiti jedno aktivno mjesto.
U složenim enzimima funkcionalne skupine kofaktora nužno su smještene u aktivnom središtu.
Shema nastanka složenog enzima
2. Alosterično središte (allos- alien) - centar regulacije aktivnosti enzima, koji je prostorno odvojen od aktivnog centra i nije dostupan svim enzimima. Vezanje za alosterički centar molekule (nazvan aktivator ili inhibitor, kao i efektor, modulator, regulator) uzrokuje promjenu konfiguracije enzimskog proteina i, kao rezultat toga, brzinu enzimske reakcije.
Alosterički enzimi su polimerni proteini, aktivni i regulatorni centri smješteni su u različitim podjedinicama.

Shema strukture alosteričkog enzima
Produkt ove ili neke od sljedećih reakcija, supstrat reakcije ili neka druga tvar može djelovati kao takav regulator (vidi "Regulacija aktivnosti enzima").
Izoenzimi
Izoenzimi su molekularni oblici istog enzima koji proizlaze iz malih genetskih razlika u primarnoj strukturi enzima. Različiti izoenzimi određuju brzinu i smjer reakcije zbog različitih afiniteta prema supstratu.
Na primjer, dimerni enzim kreatin kinaza (CK) predstavljen je s tri izoenzimske forme, sastavljene od dvije vrste podjedinica: M (eng. mišića- mišić) i B (eng. mozak- mozak). Kreatin kinaza-1 (CK-1) sastoji se od podjedinica tipa B i lokalizirana je u mozgu, kreatin kinaza-2 (CK-2) ima po jednu M- i B-podjedinicu, aktivna je u miokardu, dvije M-podjedinice , specifično za skeletne mišiće.
Postoji i pet izoenzima laktat dehidrogenaza(uloga LDH) – enzim uključen u metabolizam glukoze. Razlike između njih su u različitom omjeru H podjedinica (eng. srce- srce) i M (eng. mišića- mišić). Laktat dehidrogenaza tipa 1 (H 4) i 2 (H 3 M 1) prisutna je u tkivima s aerobni metabolizam (miokard, mozak, kortikalni sloj bubrega), imaju veliki afinitet za mliječnu kiselinu (laktat) i pretvaraju je u piruvat. LDH-4 (H 1 M 3) i LDH-5 (M 4) nalaze se u tkivima sklonim anaerobni metabolizam (jetra, skeletni mišići, koža, bubrežna srž), imaju nizak afinitet za laktat i kataliziraju pretvorbu piruvata u laktat. U tkaninama sa srednji vrsta metabolizma (slezena, gušterača, nadbubrežne žlijezde, Limfni čvorovi) dominira LDH-3 (H 2 M 2).
