Linfonodi: numero, struttura, aumento (linfoadenopatia). Seni linfatici e migrazione cellulare
Pagina 6 di 6
I LINFONODI
I linfonodi (hodi lymphatici) sono gli organi più numerosi sistema immunitario, fungono da filtri biologici per la linfa (fluido tissutale) che scorre attraverso di essi. Si trovano sul sentiero vasi linfatici da organi e tessuti a dotti linfatici e tronchi linfatici. I linfonodi si trovano solitamente in gruppi. In un gruppo possono esserci due o più nodi e talvolta diverse dozzine di nodi. Ad esempio, il gruppo dei nodi mesenterici superiori ha 66-404, ascellari - 12-45, inguinali superficiali - 4-20 nodi.
Ogni linfonodo(nodus lymphaticus) è ricoperto all'esterno da una capsula di tessuto connettivo, da cui si estendono rami sottili all'interno dell'organo - traverse, trabecole capsulari(trabecole). Nel punto in cui i vasi linfatici efferenti lasciano il linfonodo, il nodo presenta una leggera depressione - cancelli(ilo). Nella regione del cancello, la capsula si ispessisce abbastanza fortemente, formando un ispessimento portale (ilare), più o meno profondamente sporgente nel nodo. Le trabecole portali si estendono dall'ispessimento portale nel parenchima del nodo. Il più lungo di loro si connette con trabecole capsulari.
Nei linfonodi, a cui scorre la linfa dalle estremità (inguinale, ascellare) e che sono anche chiamati omatici, più spesso una porta, in viscerale (mesenterica, tracheobronchiale) - fino a 3-4 porte. Attraverso il cancello, le arterie, i nervi entrano nel linfonodo, escono le vene e i vasi linfatici efferenti.
All'interno del linfonodo, tra le trabecole, si trova lo stroma reticolare. È rappresentato da fibre reticolari e cellule reticolari che formano una rete tridimensionale con anse di varie dimensioni e forme.
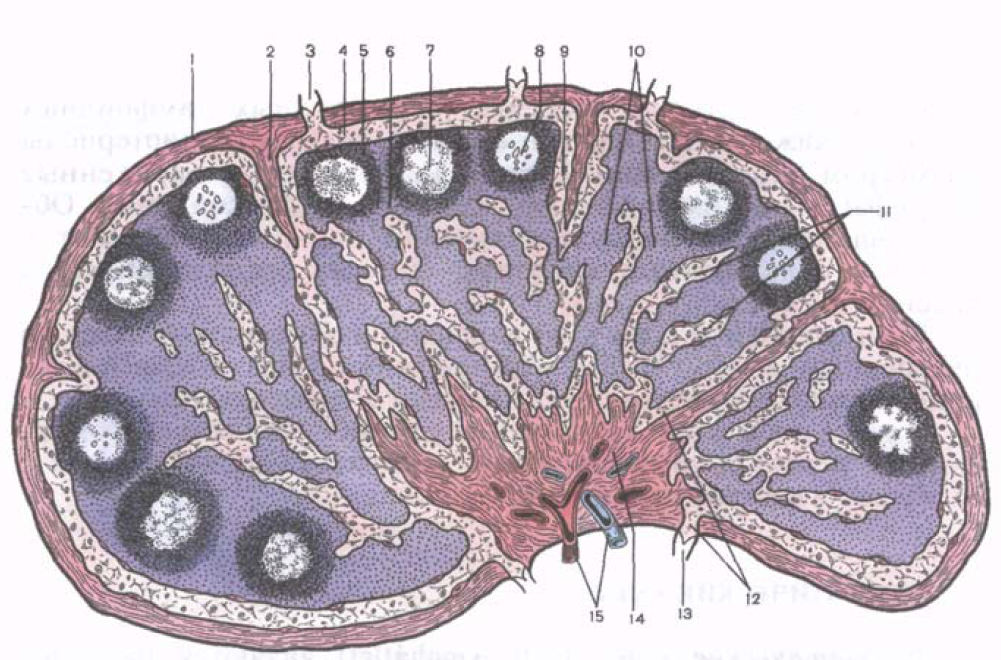
Riso. 39. Struttura microscopica linfonodo.
1 - capsula; 2 - trabecola; 3 - portando il vaso linfatico; 4 - seno linfatico sottocapsulare; 5 - sostanza corticale; 6 - zona paracorticale (dipendente dal timo); 7 - nodulo linfoide; 8 - il centro di riproduzione del nodulo linfoide; 9 - seno linfatico corticale; 10 - fili polposi; 11 - seni cerebrali; 12 - seno portale; 13 - vaso linfatico efferente; 14 - ispessimento del portale; 15 - vasi sanguigni.
Gli elementi cellulari del tessuto linfoide si trovano nelle anse dello stroma reticolare.
Il parenchima del linfonodo è diviso in corticale e midollo (Fig. 39). La corteccia è più scura sulle sezioni istologiche colorate a causa di elementi cellulari densamente distesi, è più vicina alla capsula e occupa le parti periferiche del nodo. Accendino midollo(midollo) si trova più vicino alla porta del nodo e ne occupa la parte centrale. Nella sostanza corticale ci sono formazioni arrotondate con un diametro di 0,5-1,0 mm - noduli linfoidi(noduli linfoidi). Ci sono noduli linfoidi senza un centro di riproduzione e con centro di allevamento(centro germinativo, centrum germinale).
Il tessuto linfoide diffuso si trova intorno ai noduli linfoidi. In esso si distingue un plateau corticale, che comprende aree di tessuto linfoide tra i noduli - la zona internodulare. La composizione del plateau corticale comprende anche tessuto situato all'esterno dei noduli linfoidi, tra questi e la capsula. All'interno dei noduli, direttamente al confine con il midollo, spicca una striscia di tessuto linfoide: la sostanza pericorticale, o zona timo-dipendente (paracorticale).(paracortex, s.zona thymodedependens), contenente prevalentemente linfociti T. In questa zona sono presenti venule post-capillari rivestite da un endotelio cubico, attraverso le cui pareti i linfociti migrano nel flusso sanguigno.
Il parenchima del midollo è rappresentato da filamenti di tessuto linfoide - fili polposi(corde midollari). Si estendono da reparti interni sostanza corticale alla porta del linfonodo e insieme ai noduli linfoidi forma una zona B-dipendente. I fili di polpa sono collegati tra loro, risultando in trame complesse.
Il parenchima del linfonodo è permeato da una fitta rete di stretti canali - seni linfatici(sinus lymphatici), attraverso il quale scorre la linfa che entra nel nodo seno sottocapsulare (marginale).(seno subcapsulare) al seno portale. Lungo le trabecole capsulari giacciono seni corticali(seno corticale) e midollo(seno midollare). Questi ultimi raggiungono la porta del linfonodo (ispessimento portale) e confluiscono nel seno portale qui situato. Nel lume dei seni c'è una piccola rete ad anello formata da fibre e cellule reticolari, nei cui anelli possono rimanere bloccate particelle estranee, cellule morte e tumorali.
Sviluppo e caratteristiche dell'età linfonodi. I linfonodi e il loro stroma si sviluppano dal mesenchima vicino ai plessi emergenti dei vasi sanguigni e linfatici, a partire dalla 5-6a settimana di vita dell'embrione. Si formano i segnalibri dei linfonodi in diverse aree del corpo umano periodi diversi prima della nascita e anche dopo.
Nel processo di sviluppo del nodo, il lume del vaso linfatico si trasforma in un seno sottocapsulare (marginale). I seni intermedi si sviluppano sulla base di un plesso linfatico ramificato, tra i cui vasi crescono filamenti di tessuto connettivo embrionale. Qui vengono infuse le cellule della serie linfoide. A partire dalla 19a settimana, in alcuni linfonodi si può vedere il confine delineato tra la corteccia e il midollo. I noduli linfoidi nei linfonodi iniziano a formarsi già nel periodo prenatale. I centri di riproduzione nei noduli linfoidi compaiono poco prima e poco dopo la nascita. I principali processi di modellamento legati all'età nei linfonodi terminano entro 10-12 anni.
Cambiamenti legati all'età in linfonodi(diminuzione della quantità di linfoide e proliferazione del tessuto adiposo) si osservano già nell'adolescenza. Il tessuto connettivo cresce nello stroma e nel parenchima dei nodi, compaiono gruppi di cellule adipose. Allo stesso tempo, il numero di linfonodi nei gruppi regionali diminuisce. Molti piccoli linfonodi vengono completamente sostituiti dal tessuto connettivo e cessano di esistere come organi del sistema immunitario. I linfonodi adiacenti, spesso di medie dimensioni, si uniscono tra loro e formano nodi più grandi di forma segmentale o nastriforme.
Vasi e nervi dei linfonodi. Ogni linfonodo comprende da 1-2 a 10 piccoli rami arteriosi dalle arterie più vicine. Le venule formate dai capillari si fondono nelle vene, vanno alle porte dell'organo e lasciano il nodo insieme ai vasi linfatici efferenti.
Vegetativo fibre nervose i linfonodi sono ottenuti dai plessi situati vicino alle arterie, nonché dai tronchi nervosi che passano vicino ai nodi.
Domande per l'auto-ripetizione e l'autocontrollo
1. Quali organi sono gli organi centrali del sistema immunitario, quali sono gli organi periferici e perché?
2. Quali caratteristiche morfologiche sono tipiche per gli organi centrali del sistema immunitario, quali per quelli periferici?
3. Ricordi di quali elementi strutturali sono costituiti il midollo osseo e il timo?
4. Cosa è comune nella struttura degli organi periferici del sistema immunitario?
5. Nelle pareti di quali organi si trovano i noduli linfoidi? Qual è la loro struttura?
6. Quali elementi strutturali del tessuto linfoide sono inclusi nella polpa bianca della milza?
7. Quali formazioni ci sono nei linfonodi, attraverso le quali scorre la linfa dai vasi linfatici afferenti a quelli efferenti?
Stato di Chelyabinsk Accademia medica
Dipartimento di Istologia, Citologia ed Embriologia
Conferenza
Organi periferici dell'emopoiesi e dell'immunogenesi
Elenco diapositive.
1. Tessuto reticolare del linfonodo (335).
2. Tessuto reticolare della milza (schema) (336).
3. Linfonodo (schema) (339).
4. Linfonodo. Cordoni carnosi (diagramma) (338).
5. Linfonodo. Seni (340).
6. Milza (diagramma) (341).
7. Milza (342).
8. Milza. follicolo linfoide. arteria centrale (343)
9. Seni cerebrali di un linfonodo non stimolato (390).
10. Seni cerebrali del linfonodo stimolato (391).
11. Fibre reticolari (schema) (337).
12. Plasmacellule della milza di topo (373).
13. Macrophage, linfociti, blastocytes in un nodo di linfa (371).
14. cellula dendritica e linfocita (376).
15. Linfoblasti e linfociti nella milza (369).
16. Follicoli linfoidi della placca di Peyre (355).
17. Zona B di un linfonodo di un topo immunizzato con una forte trasformazione blastica e venule postcapillari attive (386).
Piano.
1. caratteristiche generali organi periferici dell'ematopoiesi e delle difese immunitarie.
2. Istofisiologia del linfonodo: origine di sviluppo, struttura, caratteristiche delle zone corticale e midollare, zone T e B, funzioni.
3. Caratteristiche del tessuto linfoide.
4. Istofisiologia della milza: origine di sviluppo, struttura, caratteristiche delle zone corticale e midollare, zone T e B, funzioni.
5. Linfopoiesi T e B.
Scopo della lezione:
1. Conoscere le caratteristiche morfologiche e funzionali degli organi periferici dell'emopoiesi e delle difese immunitarie.
2. Dare il concetto di tessuto linfoide.
3. Descrivere in dettaglio le caratteristiche della linfopoiesi T e B.
Gli organi ematopoietici periferici includono linfonodi, milza, tonsille, processo appendicolare e follicoli linfoidi nella parete tratto digerente, vie aeree e sistema urinario. Negli organi periferici dell'ematopoiesi, c'è un incontro di cellule immunocompetenti con antigeni. Successivamente, vengono attivate le risposte immunitarie, che si basano sulla differenziazione antigene-dipendente dei linfociti, con conseguente formazione di cellule effettrici che inattivano l'antigene, compresi i T-killer citotossici e le plasmacellule che producono anticorpi.
I linfonodi.
In un adulto ci sono fino a 1000 linfonodi, la cui dimensione varia dalla dimensione di una capocchia di spillo a un piccolo chicco di fagiolo (in media 1 cm).
Il linfonodo è a forma di fagiolo e si trova lungo il decorso dei vasi linfatici. Dalla superficie convessa vi entrano i vasi linfatici afferenti. La superficie concava del linfonodo è chiamata porta. Nella regione del cancello, un'arteria e nervi entrano nel linfonodo e ne escono una vena e un vaso linfatico. Dalla superficie, il linfonodo è ricoperto da una capsula costituita da denso tessuto connettivo, nei cui strati profondi sono presenti cellule muscolari lisce che promuovono la promozione della linfa. Il contenuto di cellule muscolari lisce e fibre elastiche nelle capsule dei linfonodi non è lo stesso. Pertanto, i linfonodi inguinali e mesenterici nell'uomo sono ricchi di cellule muscolari. Allo stesso tempo, i linfonodi senili sono caratterizzati, di regola, da un aumento del contenuto di fibre elastiche. Intorno alla capsula del tessuto connettivo si trova un potente strato di tessuto adiposo, che circonda costantemente il linfonodo.
Le trabecole fibrose si estendono dalla superficie interna della capsula e si anastomizzano l'una con l'altra nelle parti centrali dei linfonodi. Lo stroma del linfonodo è rappresentato da tessuto connettivo sciolto non formato e tessuto reticolare. Grappoli di linfociti compaiono nel tessuto reticolare del linfonodo. Il tessuto reticolare infiltrato di linfociti è chiamato tessuto linfoide. Dalla capsula del linfonodo, il tessuto linfoide forma ammassi sferici, chiamati noduli secondari o follicoli linfoidi. Dai follicoli linfoidi, i fili si estendono all'interno del nodo, chiamati corde midollari (corde cerebrali). I cordoni polmonari si anastomizzano ripetutamente l'uno con l'altro. La presenza di noduli secondari (follicoli linfoidi) giacenti lungo la periferia, e di cordoni polposi (cordoni cerebrali) che occupano la parte centrale del nodo, permettono di isolare la corticale e la midollare del linfonodo. Tra la corticale e il midollo si trova la zona paracorticale.
La sostanza corticale si trova lungo la periferia del nodo ed è rappresentata da follicoli linfoidi, in cui la parte centrale è leggermente colorata e la parte periferica è più scura. La parte centrale è chiamata centro luminoso, che contiene principalmente linfociti grandi (immaturi). A causa del fatto che in questa zona si trovano numerose mitosi, è stato chiamato il centro della riproduzione. A causa del fatto che sotto l'influenza dell'antigene in questa zona, i processi di proliferazione dei linfociti procedono rapidamente e abbastanza intensamente, è chiamato il centro reattivo. I centri luminosi (centri di riproduzione) non si trovano in tutti i follicoli e le loro dimensioni sono molto variabili. Quindi, negli animali tenuti in condizioni asettiche, non ci sono centri luminosi. La parte periferica, di colore scuro, del follicolo linfoide è chiamata zona del mantello, in cui predominano i piccoli linfociti. I follicoli linfoidi non sono formazioni permanenti: possono apparire e scomparire di nuovo.
I follicoli linfoidi e le corde polpose sono circondati da seni linfonodali, che sono spazi simili a fessure riempiti di tessuto reticolare. La linfa scorre attraverso i seni. Esistono diversi tipi di seni, tra cui seno marginale, seno corticale intermedio, seno cerebrale e seno portale. Il seno marginale (sottocapsulare) è limitato dalla capsula del tessuto connettivo del linfonodo e dalla superficie del follicolo linfoide. Il seno corticale intermedio è delimitato dalla superficie delle trabecole e dalla superficie laterale del follicolo linfoide. I seni cerebrali giacciono tra le corde polpose ramificate. Il seno portale (seno terminale) si trova nella regione della porta del linfonodo. Il muro di tutti i seni del linfonodo è rivestito da speciali cellule reticolari modificate - cellule costiere. Le cellule costiere acquisiscono le caratteristiche delle cellule endoteliali con elevata attività fagocitica. Ci sono numerosi pori tra le cellule costiere, che creano ampie connessioni tra i lumi dei seni e il tessuto linfoide dei cordoni polposi e dei follicoli linfoidi. Grazie alle cellule costiere, la linfa che scorre attraverso i seni viene filtrata e liberata dai composti estranei.
Nel linfonodo si distinguono le zone T e B. La zona B è rappresentata da follicoli linfoidi e cordoni polposi. In questa zona, la differenziazione antigene-dipendente dei linfociti B avviene sotto l'influenza di un microambiente specifico, che comprende cellule reticolari, cellule dendritiche del primo tipo, macrofagi e un piccolo numero di linfociti T. La zona T è rappresentata dal tessuto linfoide della zona paracorticale. In questa zona, la differenziazione antigene-dipendente dei linfociti T avviene sotto l'influenza di un microambiente specifico, che comprende cellule reticolari, cellule dendritiche del secondo tipo (cellule interdigitate), macrofagi, nonché un piccolo numero di linfociti B e plasmacellule .
Nella zona paracorticale sono presenti sezioni specializzate del flusso sanguigno - "venule postcapillari", la cui parete è rivestita da cellule endoteliali cubiche o prismatiche. Queste cellule endoteliali hanno un reticolo endoplasmatico ben sviluppato, vescicole citoplasmatiche e microvilli. Le venule postcapillari sono il sito di invasione dei linfociti T e B nel linfonodo. I linfociti T e B inizialmente aderiscono alle cellule endoteliali e poi passano tra di loro, acquisendo polarità citoplasmatica. Dopo la penetrazione nel tessuto linfoide, i linfociti popolano le zone T e B dove avviene la loro differenziazione antigene-dipendente.
I linfonodi sono riccamente innervati. Le fibre nervose amielinizzate e non mielinizzate entrano nel linfonodo insieme all'arteria.
Funzioni del linfonodo.
1. Funzione linfopoietica (ematopoietica). La linfa che scorre attraverso i seni del linfonodo si arricchisce di linfociti T e B maturi, lasciando il tessuto linfoide attraverso i pori tra le cellule costiere.
2. Funzione immunologica. A causa dei linfociti T e B formati nei linfonodi, questi ultimi sono coinvolti nella regolazione dell'immunità cellulare e umorale.
3. Funzione barriera (protettiva). La linfa che scorre attraverso i seni viene liberata dai composti estranei a causa dell'attività fagocitaria delle cellule costiere.
4. Funzione di deposito. Normalmente, una certa quantità di linfa indugia nel linfonodo e viene interrotta dal flusso linfatico. Se necessario, entra nuovamente nella circolazione linfatica.
5. Funzione di scambio. I linfonodi prendono Partecipazione attiva nel metabolismo, comprese proteine, grassi, carboidrati e altri composti. I nutrienti nella linfa possono essere catturati dai macrofagi ed essere degradati dagli enzimi lisosomiali.
Sviluppo. I linfonodi si sviluppano nell'ottava-decima settimana dell'embriogenesi da accumuli di cellule mesenchimali vicino ai vasi sanguigni e lungo i vasi linfatici. Lungo la periferia di questi accumuli si forma una capsula di tessuto connettivo a partire dal mesenchima. Tra il mesenchima del rudimento del nodo e la capsula si forma uno spazio: il seno sottocapsulare, da cui partono i seni perinodali corticali, che separano i noduli l'uno dall'altro; i seni cerebrali partono dai seni perinodulari. Le trabecole si estendono dalla capsula del tessuto connettivo in profondità nel rudimento mesenchimale del nodo. Le cellule mesenchimali del rudimento linfonodale si differenziano nel suo stroma reticolare. Presto le cellule staminali invadono i rudimenti dei linfonodi e inizia la mielopoiesi, che dura per un periodo di tempo relativamente breve. Alla 16a settimana, i linfociti B invadono il centro dei linfonodi, pochi giorni dopo (linfociti B) invadono anche le loro parti periferiche e i linfociti T sono gli ultimi a invadere. Da questo momento inizia la linfopoiesi nei linfonodi, che continua prima e dopo la nascita. Entro la 20a settimana di embriogenesi, i linfonodi acquisiscono le caratteristiche dei linfonodi finali (definitivi).
Struttura. I linfonodi si trovano lungo i vasi sanguigni e linfatici, hanno una forma ovale oa forma di fagiolo. All'esterno, i linfonodi sono ricoperti da una capsula di tessuto connettivo, da cui si estendono le trabecole. La capsula e le trabecole comprendono collagene, fibre elastiche e miociti lisci. Sulla superficie concava dei linfonodi ci sono cancelli. L'arteria e i nervi entrano nella porta, le vene e l'uscita del vaso linfatico efferente. I vasi linfatici afferenti entrano dal lato convesso opposto. Lo stroma dei linfonodi è tessuto reticolare, costituito da cellule reticolari e fibre reticolari. Il diametro dei linfonodi va da 0,5 a 1 cm.
Alla periferia dei linfonodi c'è una sostanza corticale più scura, rappresentata dai linfonodi, e al centro - un midollo più chiaro, rappresentato dai cordoni midollari. I linfonodi hanno una zona corticale (corteccia), un midollo e una zona paracorticale situata tra la zona corticale (linfonodi) e i filamenti del midollo.
zona corticale rappresentato da noduli linfatici (nodulus lymphaticus), il cui diametro varia da 0,5 a 1 mm. Lo stroma dei noduli linfatici è rappresentato dal tessuto reticolare, prevalentemente fibre reticolari localizzate circolarmente. I linfonodi contengono macrofagi liberi, cellule dendritiche, linfociti B e linfoblasti B. Al centro dei linfonodi c'è leggero centro (centrum lucidum). Questo centro è anche chiamato centro germinale, poiché qui si moltiplicano i linfoblasti B. così come il centro reattivo, perché qui avviene la reazione tra macrofagi e antigeni. In altre parole, nei centri luminosi c'è un'attivazione di linfociti da parte di antigeni, riproduzione di linfoblasti (immunoblasti, plasmablasti) e fagocitosi di antigeni e cellule linfoidi.
macrofagi i linfonodi svolgono una funzione fagocitica e processano gli antigeni da uno stato corpuscolare a uno stato molecolare, accumulando molecole di antigene a una quantità tale da causare la differenziazione dipendente dall'antigene dei linfociti B.
Cellule dendritiche i linfonodi sono macrofagi che hanno perso la capacità di fagocitare. Nelle cellule dendritiche ci sono processi, organelli poco sviluppati di importanza generale. Il citoplasma di queste cellule è debolmente colorato, sulla loro superficie sono presenti recettori per le immunoglobuline. Le immunoglobuline sono attaccate a questi recettori e gli antigeni sono attaccati alle estremità libere delle immunoglobuline. Gli antigeni delle cellule dendritiche, insieme agli antigeni dei macrofagi e con la partecipazione di T-helper, stimolano i linfociti B alla proliferazione, differenziazione e attività funzionale (produzione di anticorpi).
Da dove vengono i linfociti B nella zona corticale? Vengono qui dal midollo osseo rosso con flusso sanguigno. I linfociti B che entrano nel linfonodo sono esposti agli antigeni fagocitati dai macrofagi, agli antigeni trattenuti sui recettori delle cellule dendritiche e alle linfochine secrete dai T-helper. Sotto l'influenza di tutte queste influenze, i linfociti B subiscono trasformazione blastica, proliferazione e differenziazione dipendente dall'antigene. Come risultato di questa differenziazione, i linfociti B si trasformano in cellule effettrici: plasmacellule e cellule di memoria. Le plasmacellule sono in grado di produrre anticorpi volti a distruggere quegli antigeni sotto l'influenza dei quali hanno subito una differenziazione antigene-dipendente. Quindi, le plasmacellule e le cellule della memoria entrano nel flusso sanguigno generale attraverso le venule postcapillari e, dopo una breve circolazione, passano nel tessuto connettivo. Nel tessuto connettivo, svolgono ciascuna la propria funzione: le plasmacellule secernono anticorpi e le cellule della memoria, avendo incontrato un antigene familiare, subiscono cellule effettrici di differenziazione ed entrano in una reazione immunitaria volta a distruggere questo antigene.
Quindi, i linfonodi sono zona dei linfociti B.Se un antigene entra nel corpo, i noduli si sviluppano gradualmente.
Ci sono 4 fasi di sviluppo. Nella fase I si forma un centro luminoso; in questo centro i linfoblasti vanno incontro a divisione mitotica.
Nella fase II, questo centro si espande; su una sezione di un linfonodo ci sono fino a 10 divisioni mitotiche.
Allo stadio III appare una corona attorno ai centri luminosi dei noduli, costituita da piccoli linfociti; il numero di celle in divisione diminuisce, il centro luminoso si restringe.
Allo stadio IV, le cellule in divisione sono singole; attorno a uno stretto centro luminoso c'è una corona, costituita principalmente da celle di memoria.
L'intero ciclo di cambiamenti dal momento in cui l'antigene entra all'inizio dello stadio IV (stadio di riposo) dura 2-3 giorni. Una settimana dopo che l'antigene è entrato nel corpo, le corde cerebrali si espandono, il numero di linfociti e plasmociti nei seni del linfonodo aumenta. Se gli antigeni non entrano nel corpo (condizioni sterili), non ci sono centri luminosi nei linfonodi.
Zona paracorticale (paracortex) si trova tra i linfonodi e le corde cerebrali. Questa zona contiene cellule interdigitate, linfociti T e linfoblasti T. Le cellule interdigitate sono così chiamate perché hanno processi che penetrano tra le estremità dei processi delle cellule interdigitate vicine. Le cellule interdigitali sono macrofagi che hanno perso la capacità di fagocitosi, contengono organelli poco sviluppati di importanza generale e hanno un citoplasma debolmente colorato. Le cellule interdigitate producono glicoproteine che stimolano la differenziazione dei linfociti T e le glicoproteine situate sotto la membrana plasmatica agiscono come recettori che trattengono gli antigeni coinvolti nella differenziazione dei linfociti T. In questa zona c'è un'interazione cooperativa di cellule immunocompetenti. Quando il timo viene rimosso (timectomia), la zona paracorticale (timo-dipendente) è scarsamente espressa.
Quindi, la zona paracorticale è zona dei linfociti T, O zona timo-dipendente.
Il midollo dei linfonodi più leggero, formato come risultato dell'intreccio delle corde cerebrali. Lo stroma del midollo è anche tessuto reticolare. La composizione delle corde cerebrali comprende le plasmacellule. I linfociti B, i macrofagi e le cellule reticolari, cioè i cordoni cerebrali, sono la zona dei linfociti B. I capillari sanguigni scorrono nelle corde del cervello.
Seni dei linfonodi. Tra la capsula e i linfonodi c'è un seno sottocapsulare (sinus subcapsularis), tra le trabecole e i linfonodi ci sono i seni perinodulari (sinus perinodularis) che si estendono dal seno sottocapsulare, tra le trabecole e le corde cerebrali ci sono i seni cerebrali (seno medullaris) che si estende dai seni perinodulari.
I seni sono rivestiti da cellule reticoloendoteliali, cioè speciali cellule endoteliali simili ai reticolociti. Tra le cellule reticoloendoteliali ci sono cellule costiere - macrofagi. Questi macrofagi fagocitano gli antigeni presenti nella linfa che scorre nei seni. Le cellule reticoloendoteliali dei seni sulla superficie della parete adiacente alla capsula e alle trabecole giacciono sulla membrana basale e sulla superficie rivolta verso i linfonodi e le corde cerebrali giacciono sulla rete di fibre reticolari che intrecciano i linfonodi e corde cerebrali. Ciò contribuisce al flusso di linfociti e plasmacellule dai noduli e dai cordoni cerebrali nel lume dei seni.
Funzioni dei linfonodi .
La funzione ematopoietica, che consiste nella differenziazione antigene-dipendente dei linfociti, che si traduce nella formazione di cellule effettrici e di cellule della memoria coinvolte nelle reazioni immunitarie, è una funzione della difesa immunitaria.
Funzione protettiva, che consiste nel fatto che i macrofagi fagocitano batteri, frammenti cellulari, antigeni che si trovano nella linfa che scorre attraverso i seni.
Inoltre, la linfa è arricchita di linfociti. La linfa si deposita nei linfonodi.
I linfonodi del mesentere dell'intestino sono coinvolti nel metabolismo dei lipidi che vengono assorbiti capillari linfatici villi e trasportati ai linfonodi.
I linfonodi O linfonodi sono organi del sistema linfatico umano. Sono ovali, rotondi e talvolta a forma di nastro e sono distribuiti in tutto il corpo umano, comprese le ascelle, e sono interconnessi da vasi linfatici. Le loro dimensioni vanno da 0,5 a 50 mm, dipinte in colore rosato. I linfonodi sono il sito di concentrazione di B, T e altre cellule immunitarie.
I linfonodi svolgono il ruolo di trappole e filtri per particelle estranee, per cui sono necessari normale funzionamento sistema immunitario umano. Nei linfonodi c'è una densa concentrazione di globuli bianchi (linfociti e macrofagi).
I linfonodi sono di importanza clinica. Si infiammano o si allargano varie malattie sia infettive che oncologiche. L'importanza dello stato dei linfonodi per determinare la presenza di cancro è importante.
I linfonodi non fanno parte del sistema umano per combattere le malattie associate all'avvelenamento. sostanze tossiche, questi compiti sono svolti dai reni e dal fegato.
I linfonodi infiammati vengono diagnosticati con una biopsia. Le malattie che causano l'infiammazione dei linfonodi hanno un certo decorso e localizzazione.
La struttura dei linfonodi
I linfonodi sono circondati da capsule fibrose e all'interno della capsula fibrosa si estende per formare una trabecola. La sostanza del linfonodo è divisa in sostanza corticale e midollo, circondata ovunque dalla corteccia, ad eccezione dell'ilo, dove il midollo entra in contatto con la superficie.
Fibre reticolari sottili, elastina e fibre reticolari formano una struttura reticolare di supporto - una rete reticolare all'interno del nodo, in cui i globuli bianchi sono densamente concentrati come i follicoli nella corteccia. In altri luoghi sono presenti solo leucociti isolati. La funzione della rete reticolare non è solo quella di fornire supporto, la sua superficie serve per l'adesione di cellule dendritiche, macrofagi e linfociti. Promuove il metabolismo con il sangue attraverso le venule endoteliali e fornisce anche i processi necessari per l'aspetto e la maturazione delle cellule immunitarie.
Il linfonodo ha un canale - il seno linfatico, rivestito da cellule endoteliali e reticolari, fibroblasti, che fornisce un flusso regolare di linfa. Pertanto, il seno sottocapsulare è un seno situato direttamente nella capsula e il suo endotelio è continuato da un vaso linfatico afferente. I seni linfatici, insieme al parenchima, costituiscono un'unica unità morfologica e fisiologica. Sul lato convesso, diversi vasi afferenti entrano nella capsula, portando la linfa nel seno situato sotto la capsula. Questo seno è chiamato marginale o circolare. Questo seno è un'estesa formazione a fessura che copre l'intero parenchima del nodo, che si trova sotto la capsula e si interrompe solo nei punti di penetrazione delle trabecole nel parenchima. Proprio lì, il seno marginale passa nei seni interstiziali (intermediari), che in seguito sono i seni cerebrali, passando nella parte cerebrale del nodo, dove la loro ulteriore connessione non è più monitorata. A differenza dei precedenti, i seni cerebrali sono grandi e la loro struttura sembra essere spugnosa a causa del fatto che le loro cellule endoteliali sono più alte. I seni intermedi e marginali sono in stretto contatto con i follicoli linfatici, creando connessioni funzionali. I seni cerebrali si uniscono alle porte del linfonodo, formando così vasi efferenti che portano fuori la linfa.
Le pareti dei seni linfatici sono composte da cellule endoteliali, chiamate litoriali. Alcune di queste cellule sono a forma di stella e dotate di processi che attraversano trasversalmente il seno e ne collegano le pareti opposte come dei ponti. L'accumulo di queste cellule è un filtro per la linfa che scorre attraverso di esse.
La differenza tra seni linfatici e vasi sanguigni è che hanno una membrana basale sul lato delle trabecole e della capsula, mentre non esiste tale membrana sul lato del parenchima del vaso linfatico. Questo può essere visto se visto con un microscopio elettronico.
Dove c'è tessuto linfatico, le cellule endoteliali sono strettamente premute contro le fibre reticolari che sostituiscono la membrana basale. Il citoplasma delle cellule endoteliali dei seni è costituito da un sottile reticolo endoplasmatico vescicolare liscio e le cellule situate vicino al parenchima linfatico sono costituite da lisosomi e reticolo endoplasmatico granulare.
Posizione dei linfonodi
I linfonodi si trovano lungo i vasi linfatici in gruppi fino a 10 nodi, così come vicino ai vasi sanguigni e alle grandi vene.
I linfonodi si trovano in gruppi in modo da creare una barriera alla diffusione di infezioni e cellule tumorali. Si trovano, ad esempio, nei seguenti punti: pieghe del ginocchio, regione inguinale, pieghe ulnari, ascelle. I linfonodi, che si trovano nel collo, proteggono gli organi della testa e gli organi circoncervicali da infezioni e tumori.
Linfonodi ingrossati
Un aumento dei linfonodi indica la presenza di una malattia nell'area in cui si trova il nodo. Molto spesso questo è associato a malattie infettive, e raramente con tumori.
Linfoadenite acuta - l'infiammazione del linfonodo si verifica quando c'è processo purulento. I sintomi principali sono un aumento del linfonodo, dolore quando si avverte. Durante il processo infiammatorio sopra il linfonodo infiammato, la pelle può diventare rossa. Potrebbe essere necessaria un'apertura chirurgica, se non viene eseguita in tempo, il linfonodo può rompersi e il suo contenuto penetra nei tessuti circostanti - si sviluppa il flemmone.
Nei bambini con tubercolosi c'è un aumento dei linfonodi, che è uno dei sintomi della malattia.
Inoltre, un aumento dei linfonodi può essere associato a una malattia come " graffio di gatto". In cui un microbo penetra attraverso un graffio - Bartonella, che è portato dai gatti.
Inoltre, un aumento dei linfonodi è associato a malattie respiratorie ed è una conseguenza di un'eccessiva risposta del sistema immunitario all'infezione.
Con la sifilide, si verifica un aumento dei linfonodi all'inguine dopo la comparsa di un'ulcera sui genitali.
Un aumento prolungato di diversi linfonodi può indicare la presenza di HIV, brucellosi, mononucleosi, listeriosi.
Nei tumori, un aumento dei linfonodi può essere associato alla diffusione delle metastasi, nonché allo sviluppo di un tumore direttamente nel linfonodo (linfogranulomatosi, linfosarcoma).
Il parenchima dei linfonodi è permeato da una fitta rete di canali (fessure) - seni linfatici, attraverso i quali la linfa che entra nel nodo scorre dal seno sottocapsulare (marginale) a quello portale. Direttamente sotto la capsula del nodo, tra esso e il parenchima, c'è un seno sottocapsulare (marginale), in cui scorrono i vasi linfatici afferenti. Dal seno sottocapsulare al parenchima del nodo, lungo le trabecole capsulari, partono i seni intermedi della corticale e del midollo. Questi ultimi raggiungono la porta del linfonodo (ispessimento ilare) e confluiscono nel seno portale, da cui originano i vasi linfatici efferenti. Il seno sottocapsulare (marginale) scorre anche nel seno portale, coprendo il parenchima dell'organo lungo la periferia (sotto la capsula) e terminando nella regione della porta del nodo. I seni intermedi della sostanza corticale passano in profondità nell'organo tra i noduli linfoidi, a volte si piegano, coprendo il nodulo da un lato o dall'altro (il seno corticale nodulare rotondo). Localizzati lungo le trabecole capsulari, i seni corticali, da un lato, sono adiacenti al tessuto connettivo delle trabecole e, dall'altro, al parenchima linfoide della sostanza corticale.
Nel midollo, i seni si trovano in due modi.
Alcuni seni cerebrali intermedi si trovano tra cordoni polposi adiacenti (seni interpolmonici). Altri sono (in sezione istologica) tra i cordoni polposi da un lato e la trabecola ilare dall'altro (seni trabecolari). I seni midollari sono più larghi dei seni sottocapsulari e corticali. Le pareti sottili dei seni dal lato del loro lume sono rivestite da cellule endoteliali (costiere) ispessite. Il seno marginale dal lato della capsula, così come le pareti dei seni corticale, cerebrale e portale, adiacenti alle trabecole e all'ispessimento portale, presentano uno strato continuo di cellule costiere. Le pareti dei seni, orientate verso il parenchima linfoide, sono costruite in modo tale che attraverso di esse dalla corticale e dal midollo nella linfa e nel direzione inversa linfociti, macrofagi e altre cellule in movimento possono facilmente penetrare. Nel lume dei seni è presente una rete finemente ad anello formata da fibre e cellule reticolari. Nei circuiti di questa rete possono indugiare particelle estranee, corpi microbici e cellule tumorali che entrano nel linfonodo insieme alla linfa.
Utilizzando la microscopia a scansione di preparazioni corrosive e native di V.
K. Shishlo e A. A. Mironov (1990) hanno mostrato che la rete di cellule reticolari e i loro processi, così come le fibre che esistono nei seni, servono a creare turbolenza nel flusso linfatico. Questo facilita il filtraggio della linfa attraverso la rete all'interno dei seni. Per quanto riguarda le cellule che rivestono le pareti dei seni, ci sono due opinioni. Un certo numero di autori considera queste cellule come cellule vicine all'endoteliale, essendo, per così dire, una continuazione dell'endotelio dei vasi linfatici afferenti. Secondo un altro punto di vista, queste cellule sono cellule reticolari modificate con capacità di fagocitosi. Il nome "costiere" fu dato a queste celle da N. Siegmund (1923). Y. Mori e K. Lennert (1969) hanno chiamato le cellule del seno retoteliale. Nella struttura fine delle cellule retoteliali si notano differenze a seconda della loro localizzazione - vicino al seno marginale, seni intermedi della corteccia e del midollo. In particolare, L. V. Chernyshenko (1966) indica che l'endotelio del seno marginale dei linfonodi parietali della cavità addominale nei feti e nei neonati ha una struttura cellulare, mentre nei linfonodi pancreatici e gastrici superiori e anteriori ha un "sinciziale" " struttura.
La maggior parte delle cellule costiere (retoteliali) contiene filamenti sottili lungo l'asse longitudinale delle cellule. Le cellule vicine sono collegate da desmosomi. Contrariamente alle cellule del seno marginale, le cellule costiere dei seni intermedi contengono un gran numero di organelli. Contengono numerose vescicole del reticolo citoplasmatico liscio e lunghi tubuli del reticolo citoplasmatico granulare.
Come mostrato da Yu. I. Borodin e V. N. Grigoriev (1983), le cellule che formano la parete esterna del seno sono interconnesse aderendo l'una all'altra e formando contatti complessi come quelli interdigitali. Allo stesso tempo, lungo i contatti si verificano macchie e zone di obliterazione, che indicano la densità di questi contatti. La forma dei nuclei cellulari della parete esterna del seno marginale è ovale o allungata, e talvolta anche a forma di bastoncino. La cromatina è a grana fine, distribuita principalmente lungo la periferia del nucleo. La membrana citoplasmatica forma pieghe rivolte sia verso il lume del seno che verso il tessuto connettivo adiacente. A volte i linfociti "si adattano" molto vicino alle cellule del rivestimento esterno del seno ei loro processi entrano nelle invaginazioni delle cellule della parete del seno. Gli organelli sono distribuiti uniformemente in tutto il citoplasma. I mitocondri sono spesso di forma rotonda o ovale, con un piccolo numero di creste. I reticoli citoplasmatici granulari e non granulari sono poco sviluppati, predomina il reticolo granulare. C'è un gran numero di ribosomi liberi e politiche sotto forma di catene o rosette. I lisosomi sono pochi, densi di elettroni, arrotondati, con contenuto granulare. Nella zona perinucleare del citoplasma è presente un complesso lamellare costituito da cisterne e vescicole appiattite. Le vescicole si trovano in tutto il citoplasma della cellula, a volte si fondono formando vacuoli. Pertanto, le cellule che formano la parete esterna del seno assomigliano all'endotelio nell'ultrastruttura.
Quando si studia muro interno seno V. N. Grigoriev ha identificato 3 tipi di cellule che differiscono l'una dall'altra in caratteristiche morfologiche. Le cellule del 1° tipo hanno processi e contatto tra loro per mezzo di una semplice giunzione di processi. Nel lume tra i processi citoplasmatici vi sono fasci di fibre reticolari. I nuclei (raramente inclusi nel taglio) occupano la parte centrale della cellula. La loro forma è ovale, tondeggiante, a volte irregolare; la cromatina è a grana fine; gli organelli si trovano principalmente nella zona del pericarion. I mitocondri sono rotondi o ovali, con poche creste. Il reticolo citoplasmatico granulare è ben sviluppato. Il citoplasma di queste cellule, così come le cellule che formano la parete esterna del seno, contiene un gran numero di ribosomi e polisomi liberi. Alcuni lisosomi sembrano formazioni arrotondate dense di elettroni con contenuto granulare. Il complesso lamellare si trova più spesso vicino al nucleo. L'attività pinocitotica in queste cellule non è espressa. La parete interna del seno marginale, rappresentata dalle cellule di tipo 1, presenta pori in cui talvolta sono visibili i linfociti. Le cellule del 2o tipo, che rivestono la parete interna del seno, a differenza delle cellule del 1o tipo, sono appiattite, allungate. Si contattano l'un l'altro tramite un semplice adattamento dei processi. I nuclei sono ovali oa forma di bastoncino, la cromatina è a grana fine. Gli organelli di queste cellule, contrariamente agli organelli delle cellule di tipo 1, sono poco sviluppati: sono visibili singoli mitocondri, un reticolo citoplasmatico liscio e ribosomi liberi. Molte vescicole pinocitiche. Le cellule del 3o tipo si trovano raramente; si trovano direttamente nel lume dei seni vicino alle cellule del 2 ° tipo e sono in stretto contatto con esse. Hanno una forma ovale, i processi di queste cellule formano stretti contatti con il corpo della propria cellula. I contorni della membrana nucleare sono contorti, il che indica un aumento della superficie del nucleo. La cromatina è a grana fine. Gli organelli si sviluppano allo stesso modo delle cellule di tipo 1. Tuttavia, a differenza di quest'ultimo, le cellule di tipo 3 contengono molti lisosomi e vescicole pinocitiche.
La dimensione delle cellule costiere dei seni cerebrali supera significativamente la dimensione delle cellule costiere della parete interna del seno marginale. Pertanto, i rapporti di volume di quest'ultimo sono notevolmente maggiori di quelli per le cellule costiere dei seni cerebrali. Con una diminuzione della funzione del sistema immunitario negli animali (e anche con immunodeficienza), come G. Sainte-Marie e F.-S. Peng (1990), i seni sottocapsulari si espandono. Sembra che abbiano pochi linfociti. Allo stesso tempo, i seni del midollo sono pieni di numerosi macrofagi. I seni sono caratterizzati dalla penetrazione delle cellule nella zona nodulare, e ciò avviene sullo sfondo dell'atrofia dei noduli linfoidi, la presenza dei cosiddetti linfociti scuri, che sono considerati cellule danneggiate. Secondo N. Chizini-Garcia, S. R. Machardo (1992), anche qui nei seni sono presenti mastociti che si distinguono per dimensione eterogenea, forma e proprietà tintoriali dei granuli. È possibile che contengano eparina, ma è meno nei seni cerebrali che nel resto del linfonodo.
Nel funzionamento dei linfonodi, che si fanno passare la linfa e fungono da filtri biologici, sono coinvolte tutte le loro strutture: corteccia e midollo, numerosi seni linfatici ramificati nel parenchima. A questo proposito, sono interessanti i dati sui processi dinamici nei linfonodi e sul ruolo dei linfociti T e B in essi. Secondo P. V. Pigarevsky (1991), normale componenti strutturali Le zone T e B dei linfonodi viscerali e somatici sono composte per il 90-95% da linfociti di piccole e medie dimensioni e cellule reticolari e solo il 5% sono forme cellulari della serie plasmacitica. Nella zona T, il numero di T-helper è maggiore di T-soppressori, ma questo rapporto può cambiare durante il giorno. Normalmente, all'interno delle zone T e B dei linfonodi somatici e viscerali, non si verifica alcuna ristrutturazione a causa della formazione di un clone di cellule sensibili all'antigene necessarie per lo sviluppo di una risposta immunitaria. Nella zona T, sono state osservate raramente cellule in divisione mitotica (dallo 0,02 allo 0,06%, si è scoperto che cambiamenti legati all'età questo indicatore non è interessato). A. Yu Letyagin (1991) ritiene che la struttura spazio-temporale quotidiana del linfonodo sia costituita da complessi morfofunzionali ritmicamente temporali. Il complesso selezionato "A" è caratterizzato da un aumento del numero di strutture linfoidi del linfonodo a seguito del ricircolo e della proliferazione dei linfociti. Il complesso "B" è caratterizzato da una significativa e rapida diminuzione del numero di linfociti nell'organo dovuta all'emigrazione di queste cellule nella circolazione periferica sullo sfondo dell'attivazione di fattori dinamici del microambiente e dell'attività dei sistemi di drenaggio che assicurano il fuoriuscita di fluido dall'organo. Il complesso "B 2" è caratterizzato da un equilibrio instabile di cellule e fluidi nell'organo. Allo stesso tempo, c'è un aumento della migrazione dei linfociti sotto l'influenza attiva dei fattori del microambiente. Tutti questi dati sono presentati in modo più completo nella monografia di Yu. I. Borodin, V. A. Trufakin et al. (1992), postulando che “il processo di migrazione e ricircolo degli elementi linfoidi, anche in assenza di immunizzazione, non è casuale. I linfociti "conoscono" i confini della loro area di azione, il loro percorso di movimento nel sistema linfoide e nei tessuti periferici. Tale ordine sorge nel processo di ontogenesi sia di un singolo linfocita che dell'intero sistema linfoide, e correla con la capacità di sintetizzare e trasportare recettori specifici.
I. T. Gegin e A. I. Krayushkin (1991) prendono noduli linfoidi con territori adiacenti, cordoni polposi come continuazione di noduli in profondità nel midollo e portando vasi linfatici come unità strutturale e funzionale nei linfonodi. Nella monografia di Yu I. Borodin, M. R. Sapin et al. (1992) hanno riassunto i tentativi individuali di suddividere in qualche modo il tessuto del linfonodo in unità strutturali. Quindi, G. Sainte-Marie et al. (1984, 1990), Yu. E. Vyrenkov, V. K. Shishlo e Yu. G. Antropova (1993) non sono stati individuati in modo molto convincente come unità strutturale compartimento linfonodale. Questo settore, che, secondo gli autori, comprende la parte centrale del linfonodo, corrispondente alla regione paracorticale, diversi noduli linfoidi e cordoni polposi giacenti in questo settore. parte centrale chiamato unità, o T-dominio. Quest'ultimo è formato da elementi stromali, varie popolazioni di linfociti T e un piccolo numero di linfociti B che migrano verso i rispettivi domini B. Il dominio T si estende nello spazio extranodulare, dove avviene la migrazione selettiva dei linfociti attraverso le pareti delle venule con alto endotelio. Yu. E. Vyrenkov, V. K. Shishlo e Yu. G. Antropova (1993) indicano che ogni compartimento è "dedicato" a un solo vaso linfatico afferente, 1-6 noduli linfoidi.
A. I. Krayushkin (1994) scrive della presenza nei linfonodi di parti strutturali e funzionali corrispondenti a organi e regioni del corpo che sono eterogenei per funzione e struttura. Esaminando i linfonodi di conigli di diverse età, ha mostrato che nel linfonodo centrale mesenterico (viscerale), che riceve linfa sia dall'intestino tenue che da quello crasso, i coloranti introdotti nelle pareti di questi organi, entrando nel linfonodo, riempire i seni, ciascuno nella sua parte nodo. Questo autore ha anche notato che i vasi linfatici da intestino tenue avvicinarsi a un lato (a sinistra) del linfonodo mesenterico e dal colon - al lato opposto (a destra) di questo nodo. Yu I. Borodin (1994) ha anche scritto sulla corrispondenza dei vasi linfatici afferenti con una certa parte del parenchima del linfonodo. Secondo A. I. Krayushkin, i seni linfatici in cui entra la linfa dalle pareti dell'intestino tenue sono più larghi di quei seni che "appartengono" all'intestino crasso. Questo fatto indica anche un maggior carico di trasporto dei seni della parte "intestino tenue" del linfonodo rispetto a quello della parte "colon". Questa ipotesi è coerente con i dati di N. Reed (1989), che ha scoperto che l'intestino tenue ha una maggiore capacità di assorbimento, e nelle sue pareti, grande quantità sostanze che nell'intestino crasso.
La stessa presenza di parti morfofunzionali si osserva nei linfonodi poplitei somatici, ai quali affluisce linfa dai tessuti superficiali e profondi dell'arto. Come mostrato da A. I. Krayushkin (1994), linfa dalla pelle e tessuto sottocutaneo, e nell'altro - attraverso vasi profondi, dalle capsule delle articolazioni, muscoli, tendini, fascia dell'arto pelvico del coniglio. Il colorante iniettato nei muscoli e in altre strutture localizzate in profondità dell'arto viene inviato attraverso i vasi linfatici profondi al linfonodo popliteo e si trova nei seni della parte anteriore di questo nodo. I seni linfatici nella parte posteriore del linfonodo sono pieni di colorante che proviene dai tessuti superficiali (pelle e tessuto sottocutaneo). L'autore osserva che i seni intermedi del midollo sono più larghi in quella parte del linfonodo, a cui scorre la linfa dai tessuti superficiali dell'arto. Si può presumere che il parenchima linfoide adiacente ai seni linfatici, che riceve linfa dalle pareti dell'intestino tenue (nodi mesenterici) o dalla cute e dal tessuto sottocutaneo (nodi poplitei), subisca un carico funzionale maggiore rispetto al parenchima del l'altra parte di questi nodi.
I dati ottenuti da AI Krayushkin confermano questa ipotesi. Indagando sul tessuto linfoide dei linfonodi, in cui scorrono i vasi linfatici, trasportando linfa da organi funzionalmente diversi, A. I. Krayushkin ha scoperto fatti interessanti. In quella parte del linfonodo dove scorre la linfa dalle pareti dell'intestino tenue, il parenchima linfoide è più alto indicatori quantitativi che nell'altra parte del nodo, interconnessa con l'intestino crasso. Nella parte "tenue" del linfonodo mesenterico, i noduli linfoidi (zona B) sono più grandi, il loro diametro varia da 275 a 750 micron (in media 467 micron). L'area occupata dai noduli linfoidi è il 20,3% dell'area di taglio del linfonodo mesenterico. Un'ampia area sulle sezioni del nodo è occupata anche da fili polposi. In queste parti del linfonodo mesenterico, c'è anche un contenuto più elevato di forme blastiche di cellule, grandi linfociti e plasmociti, che indica un aumento delle funzioni linfocito- e immunopoietiche qui. Nella parte "colonica" del linfonodo, il diametro dei noduli linfoidi è molto più piccolo -349 μm (200-625 μm) e l'area dei noduli linfoidi sulla sezione del nodo è solo del 13,1%. In quella parte del nodo mesenterico, dove entra la linfa dell'intestino tenue, la zona paracorticale (zona T) occupa un'area 3 volte inferiore (8,1%) rispetto alla parte in cui scorre la linfa dell'intestino crasso (25,9% ).
Nel linfonodo popliteo somatico esistono differenze anche nell'organizzazione del parenchima linfoide nelle parti da cui fluisce la linfa diverse regioni arti. In quella parte del nodo, a cui si avvicinano i vasi linfatici della pelle e del tessuto sottocutaneo, sono presenti parametri morfometrici più elevati di noduli linfoidi e corde polpose (zone B). Il diametro dei noduli linfoidi in questa parte era di 375 μm (193-646 μm) e la loro area era il 15,2% dell'intera sezione del nodo. In un'altra parte del linfonodo popliteo, a cui scorre la linfa dai tessuti profondi dell'arto (muscoli, tendini, capsule articolari), il diametro dei noduli linfoidi era inferiore a 302 micron (123-492 micron) e la loro area sul taglio occupato metà area -7,9%. La zona T paracorticale è risultata più ampia nella parte in cui entra la linfa dai tessuti profondi dell'arto.
A. I. Krayushkin spiega tali differenze in due zone morfofunzionali adiacenti del linfonodo popliteo con un effetto più forte e costante sulla pelle degli "antigeni ambiente esterno". Non è un caso che nella pelle si trovino i noduli linfoidi perivascolari, che sono strutture immunitarie della pelle. Lo sviluppo predominante di noduli linfoidi e cordoni polposi (zone B) in quella parte del linfonodo mesenterico centrale, dove la linfa entra dall'intestino tenue, e nel nodo popliteo, a cui viene inviata la linfa dalla pelle e dal tessuto sottocutaneo, indica la formazione di risposte immunitarie da queste parti di tipo umorale. Queste reazioni producono anticorpi. Molti ricercatori hanno dimostrato che i noduli linfoidi contengono complessi immunitari. Secondo V. I. Novikov e A. A. Vlasov (1989), S. T. Lee, F. Paraskevas e J. Maeba (1985), S. T. Lee e F. Paraskevas (1988), i complessi antigene-specifici includono determinanti dell'antigene, molecole di classe II di istocompatibilità e immunoglobulina determinanti. Macrofagi e linfociti T sono necessari per la formazione di un tale complesso.
V. I. Novikov et al. (1990) notano che le cellule dei linfonodi periferici dopo il contatto con l'antigene in vitro secernono fattori specifici dell'antigene. Questi fattori inibiscono la migrazione dei macrofagi e aumentano la loro attività funzionale, e contribuiscono anche alla differenziazione finale delle cellule progenitrici della serie granulociti-macrofagi lungo la via monocitica. Secondo gli studi di S. K. Drinker, N. Field e N. Ward (1934), è nei linfonodi che si trova fino al 99% del materiale antigenico. Pertanto, le cellule attivate dall'antigene si accumulano selettivamente in questi nodi, che, come mostrato da V. I. Novikov e A. A. Vlasov (1989), V. I. Novikov, A. A. Vlasov e I. G. Sidorovich (1991), partecipano a reazioni immunologiche contro questo antigene. Al culmine della risposta immunitaria, le cellule linfonodali secernono un antigene, uno specifico fattore umorale che migliora la genesi degli anticorpi nel periodo produttivo sopprimendo la funzione dei T-soppressori. Gli autori concludono che le cellule dei linfonodi "partecipano non solo all'accumulo e all'elaborazione del materiale antigenico catturato in una forma che, con il flusso di linfa e sangue, raggiunge gli organi centrali dell'immunità (in particolare, midollo osseo), causando cambiamenti osservati nella produzione di immunomodulatori in esso, ma anche nella regolazione delle fasi successive nello sviluppo della risposta immunitaria, compreso il periodo produttivo di questa reazione. N. van Rooijen (1987) suggerisce che esiste un modo di migrazione delle cellule che si differenziano nei linfonodi in cellule che formano anticorpi. In una risposta immunitaria indipendente dal timo, le cellule B reattive all'antigene ricevono le informazioni necessarie dai macrofagi presentanti l'antigene nella zona internodulare della parte periferica della corteccia. M. Dohrzanski e T. Yang (1991) hanno mostrato che i linfociti T di vari linfonodi differiscono in numero e caratteristiche funzionali.
GV Kovalevsky (1992) ha identificato 3 stadi di cambiamenti nella morfologia funzionale della risposta immunitaria del linfonodo agli antigeni dipendenti dal timo. 1. Fase ridistributiva - 1° giorno della risposta immunitaria. I linfonodi regionali stimolati dall'antigene producono un agente umorale che promuove il rilascio di linfociti T dai linfonodi non regionali. Allo stesso tempo, in quest'ultima compaiono focolai di devastazione della zona paracorticale sullo sfondo della linfocitosi più acuta dei seni. Nel midollo si verifica l'autofagia delle plasmacellule e si formano macrofagi sferici giganti. 2. Fase proliferativa - il 3° giorno della risposta immunitaria, il momento della massima eliminazione degli antigeni. Alcune aree della zona T perdono la loro consueta composizione di piccole cellule e si trasformano in campi di "grandi cellule pironinofile". Si presume che tutte le sottopopolazioni di linfociti T specifici (aiutanti, amplificatori, soppressori, assassini, ecc.) derivino da essi. Pertanto, in questa fase, l'autoregolazione della risposta immunitaria si dispiega nella zona paracorticale. 3. Lo stadio finale, relativo alla morfogenesi, si manifesta al 5-6° giorno della risposta immunitaria. C'è una massiccia mobilizzazione dei linfociti nei seni dei linfonodi regionali. Il ricircolo coinvolge linfociti T non sensibilizzati, che ricevono inoltre informazioni antigeniche attraverso l'interazione di contatto (peripolesi) con i macrofagi del seno. Come osserva G. V. Kovalevsky, i linfociti T sensibilizzati vengono estratti dall'endotelio delle venule postcapillari dei linfonodi non regionali e vi popolano i luoghi sorti nella prima fase. Le "increspature" dei centri di riproduzione si osservano più a lungo, maggiore è stata la dose di antigene.
Secondo G. G. Csanaky, V. Kalasz e T. Rahr (1991), dopo la stimolazione antigenica, aumentano rapidamente sia il numero di vene con endotelio alto che la massa del linfonodo.
G. Sainte-Marie e F. S. Peng (1985), T. S. Smirnova (1992) ritengono che le cellule situate nella parte superficiale della sua corteccia (direttamente sotto il seno marginale) contribuiscano al trasferimento di antigeni dalla linfa che affluisce nel parenchima del linfonodo, chiamato zona marginale. Secondo G. Sainte-Marie e F. S. Peng (1985), lo stroma della zona subcapsulare è rappresentato da cellule reticolari fibroblastiche che formano una rete ad anello. J. E. Veldman, F. J. Heuning e I. Molendar (1978), M. Dobashi, K. Terashima e J. Imai (1982) indicano che nella zona subcapsulare i linfociti si trasformano in immunoblasti, plasmablasti e plasmacellule, indipendentemente dalla regolamentazione e formazione dei centri di riproduzione.
Secondo T. S. Smirnova (1992), questo processo può procedere indipendentemente dallo stato dei centri di riproduzione, dove lo sviluppo e trasformazioni cellulari si verificano molto più velocemente che in altre strutture del linfonodo. T. S. Smirnova ha anche studiato i cambiamenti ritmico-temporali nella popolazione di cellule linfoidi nella zona marginale e ha confrontato i dati ottenuti con i modelli della composizione cellulare nelle zone T- e B-dipendenti dello stesso nodo. L'analisi dei risultati ha mostrato l'assenza di "componenti comuni", che sono servite come base per l'affermazione sulla "relativa autonomia funzionale" della zona marginale. L'autore ritiene che questa zona sia il sito di ingresso nel parenchima del linfonodo di piccoli linfociti e mastociti dalla linfa che entra nel nodo.
Un certo ritmo nella struttura delle formazioni linfoidi dei linfonodi è indicato in molti studi. Nella letteratura scientifica ci sono prove che la massa dei linfonodi somatici e viscerali cambia durante il giorno. Secondo Yu P. Hussar (1969, 1975), la massa massima dei linfonodi dei ratti bianchi cade a 18 ore e il minimo a 3 ore. massima densità anche la posizione dei linfociti nei linfonodi ascellari, inguinali e mesenterici cade nelle ore 18. Yu I. Borodin et al. (1992) hanno rivelato bioritmi di 24 ore di composizione cellulare nel plateau corticale dei linfonodi inguinali di topi CBA. Nell'altopiano corticale dei linfonodi mesenterici si osserva un ritmo di 12 ore di cambiamenti nel numero di cellule linfoidi: un aumento di notte e di giorno, una diminuzione al mattino e alla sera. Gli autori spiegano questi fatti con l'attività motoria durante i pasti notturni e giorno. La diminuzione del numero di cellule nel plateau corticale si verifica durante il sonno degli animali. In questo plateau di linfonodi biforcati, il contenuto massimo di cellule si osserva di notte e il minimo durante il giorno.
Yu I. Borodin et al. si consideri che l'aumento del numero di cellule nella fase notturna è associato alla migrazione delle cellule in questo momento della giornata dal timo, il che è coerente con le conclusioni di Yu P. Khussar (1975). Ciò non esclude la possibilità di ridistribuzione delle cellule nei linfonodi stessi, nonché il loro rilascio nel flusso sanguigno in condizioni di attività motoria animale. Riguarda anche il ricircolo dei linfociti esistenti nel corpo. È impossibile non notare, come ritengono gli autori, l'instabilità dei ritmi circadiani nella composizione cellulare del plateau corticale, che dipende da una serie di ragioni: la posizione dei linfonodi nel corpo, i livelli di proliferazione, cellule ricircolo, ecc.
Un modello diverso di ritmi cellulari è stato trovato nella zona paracorticale dipendente dal timo dei topi CBA. Nei linfonodi inguinali, il numero massimo di cellule della serie linfoide cade nelle ore diurne e serali. Nella zona paracorticale dei linfonodi mesenterici si osserva una diminuzione del numero di cellule durante il periodo di attività motoria degli animali durante la notte. Un aumento del numero di cellule è stato notato durante il giorno anche a causa dell'attività motoria. Gli autori considerano le dinamiche quotidiane nella composizione cellulare in relazione alle diverse direzioni di migrazione cellulare che coinvolgono il timo, la milza, altri gruppi di linfonodi e il flusso sanguigno. Il sincronismo dei bioritmi quotidiani della composizione cellulare nell'altopiano corticale e nella zona paracorticale sottolinea la relazione funzionale di varie strutture linfoidi in questi organi. Secondo N. Metcalf, S. Youngberger e W. Metcalf (1971), nei ratti il tasso di ricircolo dei linfociti B è inferiore a quello dei linfociti T. Secondo i dati di A. Ya. Friedenshtein e E. A. Luria (1980), nella sostanza corticale, dove ci sono molte venule e capillari sanguigni, I linfociti B migrano dal sangue attraverso le pareti di questi microvasi nel parenchima dei linfonodi, nei loro noduli linfoidi e nei cordoni polposi. Esistono prove in letteratura che fino allo 0,2% di tutti i linfociti B si trova in queste strutture dei linfonodi.
Anche la migrazione dei linfociti dai noduli linfoidi obbedisce alle leggi dei ritmi quotidiani. Nei noduli linfoidi dei linfonodi della biforcazione è stato riscontrato un ritmo di 12 ore di attività cellulare con un aumento del numero di cellule in queste strutture nelle ore mattutine e serali, tra le quali si è verificata una leggera diminuzione delle cellule contenute in loro. "Accumulo di cellule" nei noduli linfoidi durante il giorno Yu I. Borodin et al. (1992) spiegano la presenza di attività mitotica in queste strutture, così come il ricircolo dei linfociti. Gli autori ritengono che nelle ore serali i linfociti migrino dai noduli linfoidi di qualsiasi linfonodo, ovunque si trovino. Questo processo è associato all'inizio dell'attività motoria serale degli animali. L'attività motoria è stata rilevata sia nelle ore prima dell'alba che durante il giorno (alimentazione degli animali). Gli autori sono giunti alla conclusione che la formazione di cellule nei noduli linfoidi dei linfonodi si osserva durante il sonno degli animali e una diminuzione del loro numero durante il periodo di attività fisica. Negli animali che conducono uno stile di vita notturno, il processo di migrazione dei linfociti dai noduli linfoidi avviene naturalmente di notte.
Nei filamenti polposi dei linfonodi somatici (inguinali) e viscerali (biforcazione e mesenterici), si osserva un ritmo di 12 ore di attività cellulare. Al mattino e alla sera, il numero di cellule della serie linfoide nei cordoni pulpari diminuisce e durante il giorno e la notte aumenta, il che non è coerente con i bioritmi delle cellule nei noduli linfoidi. Pertanto, Yu I. Borodin et al. (1992) concludono che i cordoni pulpari non sono strutture completamente B-dipendenti dei linfonodi. La dinamica delle cellule nei cordoni polposi è più simile agli stessi processi nel plateau corticale e nella zona paracorticale, e gli autori suggeriscono un ruolo cumulativo dei cordoni polposi in relazione alle cellule della serie linfoide. Uno studio biotecnologico delle caratteristiche funzionali dei cordoni pulpari ha rivelato la loro relazione con le zone B e T dei linfonodi. L'afflusso di linfociti nei cordoni pulpari dall'esterno è stato notato nella prima metà della giornata e l'immigrazione - di notte, quando attività fisica animali è molto alto.
Per quanto riguarda i bioritmi nelle strutture linfoidi di altri organi del sistema immunitario, Yu P. Hussar, Yu Teikes e X. Lyaene (1971), L. Scheving et al. (1972) indicano cambiamenti nella massa della milza nei ratti durante il giorno. Si osserva un aumento della massa durante le ore di riposo, la massa massima si nota prima dell'alba e la minima - di giorno e di sera.
Approssimativamente la stessa immagine di un aumento del numero di cellule della serie linfoide al mattino e una diminuzione nelle ore serali e diurne è stata osservata da Yu P. Hussar (1975) nella polpa bianca della milza nei topi maschi CBA . Un aumento significativo del numero di linfociti e un aumento della densità della loro posizione nella polpa bianca della milza possono essere attribuiti alla migrazione di queste cellule dal midollo osseo, dove in questo momento il numero di tali cellule diminuisce. Di notte è stato notato anche un aumento dell'attività mitotica nella milza.
È possibile che si verifichi un aumento della massa di tessuto linfoide nella milza nelle prime ore del mattino e nella seconda metà delle ore diurne a causa della ridistribuzione attiva delle cellule linfoidi in condizioni di cambiamenti nei carichi funzionali di vari organi durante il giorno. Si può presumere che durante il giorno i linfociti siano più "occupati" con il controllo degli antigeni alimentari nelle pareti degli organi digestivi e in altri organi che lavorano attivamente durante le ore diurne. Come scrivono Yu I. Borodin e altri. (1992), nelle ore serali e notturne, il "sistema esperto" registra il rilascio di cellule dalla milza nel sangue e nelle zone B-dipendenti dei linfonodi. È possibile che il "controllo" del sangue, che viene effettuato tutte le 24 ore su 24, raggiunga un massimo nelle ore premattutine. Come mostrato da G. Fernandes et al. (1976), durante il giorno nella milza, c'è un numero minimo di linfociti T con un contenuto massimo simultaneo nel sangue periferico.
Gli esperimenti condotti da T. S. Smirnova con infliggere ferite agli animali indicano anche cambiamenti significativi nella composizione cellulare dei linfonodi (nella loro zona marginale). Dopo la lesione (il 1°-2° giorno) in quest'area, il numero di piccoli linfociti è aumentato del 75%. Questo aumento di l "/ 2 volte era maggiore che in altre aree del linfonodo. T. S. Smirnova ha concluso che i linfociti arrivano alla zona marginale dal sito della lesione. L'autore non spiega da dove provengono i linfociti nell'area di lesione e perché è da lì che entrano nel linfonodo. Come sottolinea T. S. Smirnova, entro il 7-8 ° giorno dopo la lesione, la "densità di popolazione" dei linfociti nella zona marginale è normalizzata. Allo stesso tempo, richiama l'attenzione su un diverso comportamento di altre cellule della serie linfoide, il numero che nella zona marginale non aumenta, ma, al contrario, diminuisce. Pertanto, entro il 3 ° giorno dopo la lesione, il numero di linfociti medi diminuisce di più di 3 volte, cellule che si dividono mitoticamente - di 6 volte, forme blastiche di cellule - di 21/2 volte, plasmacellule immature - 3 volte, plasmacellule mature - 10 volte T. S. Smirnova richiama anche l'attenzione sulla presenza nel post-traumatico periodo nella zona marginale del linfonodo regionale dei mastociti, su quale aumenta bruscamente entro il 3o giorno. Il numero di mastociti aumenta anche nell'area della lesione. Questo sincronismo della comparsa dei mastociti nel sito della lesione e della zona marginale indica, secondo l'autore, un possibile aumento dell'intensità del flusso sanguigno locale, la stimolazione dell'attività fagocitaria dei macrofagi e la presenza di chemiotassi nei linfociti . Allo stesso tempo, T. S. Smirnova fa riferimento ai dati di N. A. Yurina e A. I. Radostina (1977) sul ruolo dei mastociti nel corpo e J. Raud et al. (1989) sulla localizzazione periarteriosa dei mastociti per aiutare a guidare la migrazione dei leucociti. In caso di trauma nella zona marginale, cambia anche il ritmo della popolazione cellulare. È vero, l'ampiezza delle fluttuazioni e dei cambiamenti identificati da T. S. Smirnova dopo l'infortunio diminuisce.
Sulla base degli studi condotti, T. S. Smirnova ritiene che nel piano funzionale la zona marginale occupi una posizione speciale nel linfonodo. L'autore ritiene che la zona marginale sia la sede di ingresso di "linfociti e mastociti nel parenchima dei linfonodi dal canale linfatico, sia in condizioni normali che in risposta a traumi chirurgici". Pertanto, allo stato attuale degli studi morfologici, le osservazioni cronobiologiche sono molto promettenti. Consentono di comprendere meglio i modelli dei processi morfogenetici a livello cellulare, tissutale e di organo. Per quanto riguarda i linfonodi, si è anche scoperto (nell'esperimento) che i bioritmi giornalieri dell'afflusso di sangue al tessuto linfoide sono direttamente coerenti con i ritmi giornalieri dell'afflusso di sangue alle regioni tissutali. I cambiamenti locali nei linfonodi sono influenzati da fattori ormonali e nervosi, le dinamiche della popolazione quotidiana di mastociti. È possibile che i mastociti presenti nei tessuti perivascolari e linfoidi, nei seni, nella capsula e nelle trabecole dei linfonodi influenzino sia il microambiente che la formazione della risposta immunitaria. I mastociti possono formare non solo gruppi di 3-5 elementi, ma anche strutture "a fungo" che iniziano nella regione della porta del nodo e continuano lungo le trabecole e i vasi fino al plateau internodale corticale. I dettagli dell'assorbimento dei granuli di mastociti rilasciati da parte delle cellule reticolari non sono ancora chiari. L'autore ritiene che la zona marginale sia il sito di ingresso nel parenchima del linfonodo di piccoli linfociti e mastociti dalla linfa che entra nel nodo.
La deposizione dei primi linfonodi è stata riscontrata in embrioni umani di 5-6 settimane. Secondo V. A. Trufakin (1967), i primi linfonodi mesenterici iniziano a formarsi nell'ottava settimana dello sviluppo intrauterino. V. A. Florensov (1983) ha scoperto che la prima deposizione dei linfonodi è già stata osservata negli embrioni di 7 settimane. I linfonodi anatomicamente formati diventano nei feti di 9 settimane. M. A. Dolgova (1967), N. A. Zharikova (1979) e altri ricercatori indicano questa età (8-10 settimane), in cui inizia la formazione dei linfonodi. Va notato che i tempi della formazione dei linfonodi, secondo diversi autori, di regola, sono diversi. Ciò può essere compreso considerando quanto segue. In primo luogo, vari gruppi di linfonodi servivano spesso come oggetto di studio. In secondo luogo, non è stata presa in considerazione la salute della madre che ha portato questi embrioni e feti, le condizioni per ottenere il materiale, ecc.. A questo proposito, si dovrebbe concordare con G. V. Kharlova (1963) che la formazione dei linfonodi è una risposta compensativa alle condizioni di esistenza dell'organismo.
Poiché i linfonodi si trovano sui percorsi del flusso linfatico da organi e tessuti, la comparsa precoce dei nodi non è sorprendente. Già nelle prime settimane di sviluppo dell'embrione, nel fluido tissutale compaiono prodotti metabolici, comprese proteine grossolane e persino particelle di cellule distrutte formate a seguito del rinnovamento cellulare. Poiché le cellule morte, le proteine grossolane e le possibili cellule mutanti sono particelle estranee, sono necessarie strutture immunitarie per il loro riconoscimento e distruzione. Tali strutture sono i linfonodi formati nel corpo dell'embrione, che sono filtri biologici sui percorsi del movimento dei fluidi verso il flusso sanguigno. È probabile che la comparsa nel corpo dell'embrione di prodotti metabolici e particelle estranee nella quantità in cui diventa pericolosa per l'organismo in crescita sia lo stimolo, il punto di partenza per la formazione dei linfonodi. In diverse regioni del corpo, viene creata una tale necessità per l'aspetto dei linfonodi e dei loro gruppi regionali tempo diverso. Pertanto, l'aspetto delle schede dei nodi in varie zone corpo umano si verifica in vari periodi dello sviluppo intrauterino, fino alla nascita e anche dopo di essa.
La formazione di un linfonodo inizia con l'isolamento di un gruppo di cellule mesenchimali vicino a un vaso linfatico o tra vasi linfatici adiacenti. Quindi, nel processo di sviluppo, l'ammasso cellulare si invagina nel lume del vaso linfatico adiacente, la cui parete esterna dà origine alla capsula del linfonodo risultante. Il lume del vaso linfatico si trasforma ulteriormente nel seno sottocapsulare (marginale). I seni intermedi si sviluppano sulla base di un plesso ramificato di vasi linfatici, tra i quali crescono fili di tessuto connettivo embrionale. In futuro, aumenta il numero di cellule mesenchimali nel rudimento del nodo. Al 3-4° mese di sviluppo intrauterino, i linfociti sono determinati nei linfonodi in via di sviluppo.
A. Yasushi (1992) ha scoperto che nei feti i noduli linfoidi iniziano a comparire alla 16a settimana di sviluppo sotto il seno sottocapsulare. Dalla 18a settimana si riscontrano costantemente noduli linfoidi ben visibili. L'autore spiega l'assenza di centri di riproduzione nei noduli con l'immaturità dei tessuti e delle cellule dendritiche nodulari, nonché con la mancanza di stimolazione durante lo sviluppo embrionale. Secondo J. Westerga e W. Timens (1989), le cellule B di medie dimensioni sono rilevate nei noduli linfoidi e nelle sezioni esterne della sostanza corticale dei linfonodi nei feti. A partire dalla 19a settimana, in alcuni nodi si può vedere il confine delineato tra la futura corticale e il midollo. Pertanto, i noduli linfoidi nei linfonodi compaiono già nel periodo prenatale. P. Fusari (1965) ha osservato la formazione di noduli in un feto di 51/2 mesi, V. A. Florensov (1964) - alla 34a settimana di sviluppo intrauterino. I centri di riproduzione nei noduli linfoidi compaiono poco prima della nascita o poco dopo.
La differenziazione dei linfonodi continua non solo nei neonati, ma anche in infanzia. I principali processi di modellamento legati all'età nei linfonodi terminano all'età di 10-12 anni, ma la ristrutturazione di questi nodi avviene per tutta la vita in accordo con le mutevoli condizioni di esistenza. L'involuzione legata all'età dei linfonodi può essere osservata dall'adolescenza. Con l'aumentare dell'età, il loro numero diminuisce e aumenta la dimensione media dei nodi rimanenti. Questo perché molti piccoli linfonodi sono completamente sostituiti da tessuti connettivi e adiposi fibrosi densi. I nodi vicini crescono insieme e formano nodi più grandi di forma segmentale o simile a un nastro. Dall'adolescenza, gruppi di cellule adipose compaiono nello stroma e nel parenchima dei linfonodi. Con l'aumentare dell'età, la quantità di tessuto connettivo nei nodi aumenta, la capsula si ispessisce e le trabecole ilari crescono notevolmente; le fibre dello stroma reticolare si ispessiscono. Il tessuto connettivo e adiposo fibroso denso con l'aumentare dell'età sposta gradualmente il parenchima linfoide nei linfonodi. Allo stesso tempo, la quantità di sostanza corticale nei nodi diminuisce e il contenuto del midollo aumenta relativamente. I seni intermedi nel midollo si espandono. Esistono anche caratteristiche legate all'età della composizione cellulare dei linfonodi; aumenta il numero di linfociti piccoli e macrofagi, mentre diminuisce il numero di linfociti medi.
