Terapia para la EPOC estable. Pautas clínicas: Enfermedad pulmonar obstructiva crónica Pautas federales para la EPOC
La clasificación de la EPOC (enfermedad pulmonar obstructiva crónica) es amplia e incluye una descripción de los estadios más comunes de la enfermedad y las variantes en las que se presenta. Y aunque no todos los pacientes evolucionan con la EPOC según el mismo escenario y no todos pueden identificarse como de un determinado tipo, la clasificación siempre sigue siendo relevante: la mayoría de los pacientes encajan en ella.
Etapas de la EPOC
La primera clasificación (clasificación espirográfica de la EPOC), que determinaba los estadios de la EPOC y sus criterios, fue propuesta allá por 1997 por un grupo de científicos unidos en un comité llamado World COPD Initiative (en inglés, el nombre suena "Global Initiative for Chronic enfermedad pulmonar obstructiva" y abreviado como GOLD). Según ella, hay cuatro etapas principales, cada una de las cuales está determinada principalmente por FEV, es decir, el volumen de flujo espiratorio forzado en el primer segundo:
- EPOC grado 1 no es diferente síntomas especiales. La luz de los bronquios se estrecha bastante, el flujo de aire también se limita no demasiado. El paciente no experimenta dificultades en la vida cotidiana, experimenta dificultad para respirar solo durante la actividad física activa y tos húmeda- solo ocasionalmente, con una alta probabilidad por la noche. En esta etapa, pocas personas acuden al médico, generalmente por otras enfermedades.
- El grado de EPOC 2 se vuelve más pronunciado. La dificultad para respirar comienza inmediatamente cuando se intenta realizar actividad física, la tos aparece por la mañana, acompañada de una secreción de esputo notable, a veces purulenta. El paciente nota que se ha vuelto menos resistente y comienza a sufrir enfermedades respiratorias recurrentes, desde un simple SARS hasta bronquitis y neumonía. Si el motivo para ir al médico no es la sospecha de EPOC, tarde o temprano el paciente aún lo consulta debido a infecciones concomitantes.
- El grado 3 de la EPOC se describe como una etapa difícil: si el paciente tiene la fuerza suficiente, puede solicitar la discapacidad y esperar con confianza que se le emita un certificado. La dificultad para respirar aparece incluso con un esfuerzo físico menor, hasta subir un tramo de escaleras. El paciente está mareado, ojos oscuros. La tos aparece con más frecuencia, al menos dos veces al mes, se vuelve de naturaleza paroxística y se acompaña de dolores en el pecho. Al mismo tiempo, la apariencia cambia: el cofre se expande, las venas se hinchan en el cuello, la piel cambia de color a cianótica o rosada. El peso corporal disminuye bruscamente o disminuye bruscamente.
- La EPOC en etapa 4 significa que puede olvidarse de cualquier capacidad de trabajo: el flujo de aire que ingresa a los pulmones del paciente no excede el treinta por ciento del volumen requerido. Cualquier esfuerzo físico, hasta cambiarse de ropa o procedimientos de higiene, provoca dificultad para respirar, sibilancias en el pecho, mareos. La respiración en sí es pesada, laboriosa. El paciente tiene que usar constantemente un cilindro de oxígeno. En los peores casos, se requiere hospitalización.
Sin embargo, en 2011, GOLD concluyó que tales criterios son demasiado vagos y que es incorrecto hacer un diagnóstico únicamente sobre la base de la espirometría (que determina el volumen de la exhalación). Además, no todos los pacientes desarrollaron la enfermedad de forma secuencial, desde una etapa leve hasta una etapa grave; en muchos casos, fue imposible determinar la etapa de la EPOC. Se desarrolló un cuestionario CAT, que es llenado por el propio paciente y le permite determinar la condición de manera más completa. En él, el paciente necesita determinar, en una escala del uno al cinco, qué tan pronunciados son sus síntomas:
- tos: uno corresponde a la afirmación "sin tos", cinco "constantemente";
- esputo: uno es "sin esputo", cinco es "el esputo sale constantemente";
- una sensación de opresión en el pecho: "no" y "muy fuerte", respectivamente;
- dificultad para respirar: desde "sin dificultad para respirar en absoluto" hasta "falta de aliento con el más mínimo esfuerzo";
- actividad del hogar - de "sin restricciones" a "muy limitada";
- salir de casa - de "con confianza por necesidad" a "ni siquiera por necesidad";
- sueño - de " Buen sueño» a «insomnio»;
- energía - de "lleno de energía" a "sin energía en absoluto".
El resultado se determina por puntuación. Si hay menos de diez, la enfermedad casi no tiene efecto en la vida del paciente. Menos de veinte, pero más de diez, tiene un efecto moderado. Menos de treinta - tiene una fuerte influencia. Más de treinta - tiene un gran impacto en la vida.
También se tienen en cuenta los indicadores objetivos del estado del paciente, que se pueden registrar mediante instrumentos. Los principales son la tensión de oxígeno y la saturación de hemoglobina. En una persona sana, el primer valor no baja de ochenta y el segundo no baja de noventa. En pacientes, dependiendo de la gravedad de la condición, los números varían:
- con relativamente leve - hasta ochenta y noventa en presencia de síntomas;
- en el curso moderado- hasta sesenta y ochenta;
- en casos severos, menos de cuarenta y alrededor de setenta y cinco.
 Después de 2011, según GOLD, la EPOC ya no tiene etapas. Solo hay grados de gravedad, que indican la cantidad de aire que ingresa a los pulmones. Y la conclusión general sobre el estado del paciente no parece que "se encuentre en un determinado estadio de la EPOC", sino que "se encuentre en un determinado grupo de riesgo de exacerbaciones, efectos adversos y muerte por EPOC". Hay cuatro en total.
Después de 2011, según GOLD, la EPOC ya no tiene etapas. Solo hay grados de gravedad, que indican la cantidad de aire que ingresa a los pulmones. Y la conclusión general sobre el estado del paciente no parece que "se encuentre en un determinado estadio de la EPOC", sino que "se encuentre en un determinado grupo de riesgo de exacerbaciones, efectos adversos y muerte por EPOC". Hay cuatro en total.
- Grupo A: bajo riesgo, pocos síntomas. Un paciente pertenece al grupo si no tuvo más de una exacerbación en un año, obtuvo menos de diez puntos en CAT y la dificultad para respirar ocurre solo durante el esfuerzo.
- Grupo B: bajo riesgo, muchos síntomas. El paciente pertenece al grupo si no hubo más de una exacerbación, pero la dificultad para respirar ocurre con frecuencia y se anotó más de diez puntos en CAT.
- Grupo C: alto riesgo, pocos síntomas. El paciente pertenece al grupo si tuvo más de una exacerbación por año, se presenta disnea durante el ejercicio y el puntaje CAT es menor a diez puntos.
- Grupo D: alto riesgo, muchos síntomas. Más de una exacerbación, la falta de aire se produce con el menor esfuerzo y más de diez puntos en CAT.
La clasificación, aunque se hizo de tal manera que tuviera en cuenta la condición de un paciente en particular, todavía no incluía dos indicadores importantes que afectan la vida del paciente y están indicados en el diagnóstico. Estos son los fenotipos y comorbilidades de la EPOC.
Fenotipos de la EPOC
 En la enfermedad pulmonar obstructiva crónica, hay dos fenotipos principales que determinan cómo se ve el paciente y cómo progresa la enfermedad.
En la enfermedad pulmonar obstructiva crónica, hay dos fenotipos principales que determinan cómo se ve el paciente y cómo progresa la enfermedad.
tipo de bronquitis:
- Causa. La causa es la bronquitis crónica, cuyas recaídas ocurren durante al menos dos años.
- Cambios en los pulmones. La fluorografía muestra que las paredes de los bronquios están engrosadas. En la espirometría, se puede ver que el flujo de aire se debilita y solo ingresa parcialmente a los pulmones.
- La edad clásica del descubrimiento es de cincuenta años o más.
- Características de la apariencia del paciente. El paciente tiene un color de piel cianótico pronunciado, el tórax tiene forma de barril, el peso corporal suele crecer debido al aumento del apetito y puede acercarse al borde de la obesidad.
- El síntoma principal es una tos, paroxística, con abundante esputo purulento.
- Infecciones: a menudo, porque los bronquios no pueden filtrar el patógeno.
- Deformación del músculo cardíaco del tipo "cor pulmonale" - a menudo.
El cor pulmonale es un síntoma concomitante en el que el ventrículo derecho se agranda y la frecuencia cardíaca se acelera; de esta manera, el cuerpo trata de compensar la falta de oxígeno en la sangre:
- Radiografía. Se puede ver que el corazón está deformado y agrandado, y se mejora el patrón de los pulmones.
- Capacidad difusa de los pulmones, es decir, el tiempo que tardan las moléculas de gas en entrar en la sangre. Normalmente, si disminuye, entonces no mucho.
- Pronóstico. Según las estadísticas, el tipo de bronquitis tiene una mayor tasa de mortalidad.
La gente llama al tipo de bronquitis "edema azul" y esta es una descripción bastante precisa: un paciente con este tipo de EPOC suele ser de color azul pálido, con sobrepeso, tose constantemente, pero está alerta: la dificultad para respirar no lo afecta tanto como los pacientes con otro tipo.
 tipo enfisematoso:
tipo enfisematoso:
- Causa. La causa es el enfisema crónico.
- Cambios en los pulmones. En la fluorografía, se ve claramente que las particiones entre los alvéolos se destruyen y se forman cavidades llenas de aire: ampollas. Con la espirometría, se registra la hiperventilación: el oxígeno ingresa a los pulmones, pero no se absorbe en la sangre.
- La edad clásica de descubrimiento es de sesenta años o más.
- Características de la apariencia del paciente. El paciente tiene un color de piel rosado, el tórax también tiene forma de barril, las venas se hinchan en el cuello, el peso corporal disminuye debido a la disminución del apetito y puede acercarse al límite de valores peligrosos.
- El síntoma principal es la dificultad para respirar, que se puede observar incluso en reposo.
- Las infecciones son raras, porque los pulmones todavía hacen frente a la filtración.
- La deformación del tipo "cor pulmonale" es rara, la falta de oxígeno no es tan pronunciada.
- Radiografía. La imagen muestra las ampollas y la deformidad del corazón.
- Habilidad difusa - obviamente muy reducida.
- Pronóstico. Según las estadísticas, este tipo tiene una esperanza de vida más larga.
Al tipo enfisematoso se le llama popularmente “pink puffer” y esto también es bastante acertado: un paciente con este tipo de hodl suele ser delgado, con un color de piel anormalmente rosado, se asfixia constantemente y prefiere no volver a salir de casa.
Si un paciente tiene signos de ambos tipos, habla de un fenotipo de EPOC mixto: ocurre con bastante frecuencia en una amplia variedad de variaciones. También en últimos años Los científicos han identificado varios subtipos:
- con exacerbaciones frecuentes. Se establece si el paciente es enviado al hospital con exacerbaciones al menos cuatro veces al año. Ocurre en las etapas C y D.
- Con asma bronquial. Ocurre en un tercio de los casos: con todos los síntomas de la EPOC, el paciente experimenta alivio si usa medicamentos para combatir el asma. También tiene ataques de asma.
- Comienzo temprano. Se caracteriza por un progreso rápido y se explica por una predisposición genética.
- A una edad temprana. La EPOC es una enfermedad de los ancianos, pero también puede afectar a personas más jóvenes. En este caso, por regla general, es muchas veces más peligroso y tiene una alta tasa de mortalidad.
Enfermedades concomitantes
 Con la EPOC, el paciente tiene una gran posibilidad de sufrir no solo la obstrucción en sí, sino también las enfermedades que la acompañan. Entre ellos:
Con la EPOC, el paciente tiene una gran posibilidad de sufrir no solo la obstrucción en sí, sino también las enfermedades que la acompañan. Entre ellos:
- Enfermedad cardiovascular, desde enfermedad coronaria hasta insuficiencia cardíaca. Ocurren en casi la mitad de los casos y se explican de manera muy simple: con la falta de oxígeno en el cuerpo, el sistema cardiovascular experimenta un gran estrés: el corazón se mueve más rápido, la sangre fluye más rápido a través de las venas, la luz de los vasos se estrecha. Después de un tiempo, el paciente comienza a notar dolores en el pecho, pulso fluctuante, dolores de cabeza y dificultad para respirar cada vez mayor. Un tercio de los pacientes cuya EPOC se acompaña de enfermedades cardiovasculares mueren a causa de ellas.
- Osteoporosis. Ocurre en un tercio de los casos. No fatal, pero sí muy desagradable y también provocada por la falta de oxígeno. Su principal síntoma es la fragilidad ósea. Como resultado, la columna vertebral del paciente se dobla, la postura se deteriora, la espalda y las extremidades duelen, se observan calambres nocturnos en las piernas y debilidad general. Disminución de la resistencia, movilidad de los dedos. Cualquier fractura se cura durante mucho tiempo y puede ser fatal. A menudo hay problemas con tracto gastrointestinal- estreñimiento y diarrea, que son causados por la presión de la columna curvada sobre los órganos internos.
- Depresión. Ocurre en casi la mitad de los pacientes. A menudo, sus peligros permanecen subestimados, mientras que el paciente, mientras tanto, sufre de disminución del tono, falta de energía y motivación, pensamientos suicidas, aumento de la ansiedad sentimientos de soledad y problemas de aprendizaje. Todo se ve bajo una luz sombría, el estado de ánimo está constantemente deprimido. El motivo es tanto la falta de oxígeno como el impacto que tiene la EPOC en la vida del paciente. La depresión no es fatal, pero es difícil de tratar y reduce significativamente el placer que el paciente puede obtener de la vida.
- Infecciones. Ocurren en el setenta por ciento de los pacientes y causan la muerte en un tercio de los casos. Esto se explica por el hecho de que los pulmones afectados por la EPOC son muy vulnerables a cualquier patógeno y es difícil eliminar la inflamación en ellos. Además, cualquier aumento en la producción de esputo es una disminución del flujo de aire y un riesgo de insuficiencia respiratoria.
- Síndrome de apnea del sueño. Con apnea, el paciente deja de respirar por la noche durante más de diez segundos. Como resultado, sufre de constante hambre de oxígeno e incluso puede morir por insuficiencia respiratoria.
- Cáncer. Ocurre con frecuencia y causa la muerte en uno de cada cinco casos. Se explica, como las infecciones, por la vulnerabilidad de los pulmones.
En los hombres, la EPOC suele ir acompañada de impotencia y en los ancianos provoca cataratas.
Diagnóstico y discapacidad
 La formulación del diagnóstico de la EPOC implica toda una fórmula que siguen los médicos:
La formulación del diagnóstico de la EPOC implica toda una fórmula que siguen los médicos:
- el nombre de la enfermedad es enfermedad pulmonar crónica;
- fenotipo EPOC - mixto, bronquitis, enfisematoso;
- la gravedad de la obstrucción bronquial, de leve a extremadamente grave;
- severidad de los síntomas de la EPOC - determinada por CAT;
- frecuencia de exacerbaciones: más de dos frecuentes, menos raras;
- acompañando enfermedades.
Como resultado, cuando el examen se completa de acuerdo con el plan, el paciente recibe un diagnóstico que suena, por ejemplo, así: “enfermedad pulmonar obstructiva crónica del tipo bronquitis, grado II de obstrucción bronquial con síntomas graves, exacerbaciones frecuentes, agravada por la osteoporosis”.
Según los resultados del examen, se elabora un plan de tratamiento y el paciente puede solicitar la discapacidad: cuanto más grave es la EPOC, más probable es que el primer grupo sea entregado.
Y aunque la EPOC no se trata, el paciente debe hacer todo lo que esté a su alcance para mantener su salud en un cierto nivel, y entonces aumentará tanto la calidad como la duración de su vida. Lo principal es permanecer optimista en el proceso y no descuidar los consejos de los médicos.
Los objetivos del tratamiento de la EPOC se pueden dividir en 4 grupos principales:
Aliviar los síntomas y mejorar la calidad de vida;
Reducir los riesgos futuros, etc.; prevención de exacerbaciones;
Ralentizar la progresión de la enfermedad;
Disminución de la mortalidad.
La terapia de la EPOC incluye enfoques farmacológicos y no farmacológicos. Los tratamientos farmacológicos incluyen broncodilatadores, combinaciones de ICS y broncodilatadores de acción prolongada (LABD), inhibidores de la fosfodiesterasa-4, teofilina y vacunación contra la influenza y infección neumocócica.
Los métodos no farmacológicos incluyen dejar de fumar, rehabilitación pulmonar, oxigenoterapia, soporte respiratorio y cirugía.
El tratamiento de las exacerbaciones de la EPOC se considera por separado.
3.1 Tratamiento conservador.
Dejar de fumar.
Se recomienda dejar de fumar a todos los pacientes con EPOC.Comentarios. El abandono del hábito tabáquico es la intervención más eficaz y con mayor impacto en la progresión de la EPOC. El consejo habitual de un médico lleva a dejar de fumar en el 7,4% de los pacientes (un 2,5% más que en los controles), y como resultado de una consulta de 3-10 minutos, la frecuencia de abandono del hábito de fumar alcanza alrededor del 12%. Con más tiempo e intervenciones más complejas, incluido el desarrollo de habilidades, capacitación en resolución de problemas y apoyo psicosocial, las tasas de abandono del hábito de fumar pueden llegar al 20-30%.
En ausencia de contraindicaciones, se recomiendan agentes farmacológicos para el tratamiento de la dependencia del tabaco para apoyar los esfuerzos para dejar de fumar.
Comentarios. La farmacoterapia apoya eficazmente los esfuerzos para dejar de fumar. Los medicamentos de primera línea para el tratamiento de la dependencia del tabaco incluyen vareniclina, bupropión de liberación prolongada y medicamentos de reemplazo de nicotina.
Una combinación de asesoramiento médico, grupos de apoyo, desarrollo de habilidades y terapia de reemplazo de nicotina da como resultado que el 35 % deje de fumar después de 1 año, mientras que el 22 % sigue sin fumar después de 5 años.
Principios de farmacoterapia para la EPOC estable.
Las clases farmacológicas de fármacos utilizados en el tratamiento de la EPOC se presentan en la Tabla. 5.
Tabla 5 Clases farmacológicas de fármacos utilizados en el tratamiento de la EPOC.
| clase farmacológica | Preparativos |
| KDBA | salbutamol fenoterol |
| DDBA | Vilanterol Indacaterol Salmeterol Olodaterol Formoterol |
| KDAH | bromuro de ipratropio |
| DDAH | Bromuro de aclidinio Bromuro de glicopirronio Bromuro de tiotropio Bromuro de umeclidinio |
| IGCS | Beclometasona Budesonida Mometasona Fluticasona Furoato de fluticasona Ciclosonida |
| Combinaciones fijas DDAH/DDBA | Bromuro de glicopirronio/indacaterol Bromuro de tiotropio/olodaterol Bromuro de umeclidinio/vilanterol Bromuro de aclidinio/formoterol |
| Combinaciones fijas de ICS/LABA | Beclometasona/formoterol Budesonida/formoterol Fluticasona/salmeterol Furoato de fluticasona/vilanterol |
| Inhibidores de la fosfodiesterasa-4 | Roflumilast |
| Otro | teofilina |
Nota. SABA - agonistas β2 de acción corta, KDAH - anticolinérgicos de acción corta, LABA - agonistas β2 de acción prolongada, DDAC - anticolinérgicos de acción prolongada.
Al prescribir farmacoterapia, se recomienda apuntar a lograr el control de los síntomas y reducir los riesgos futuros - td; Exacerbaciones y mortalidad de la EPOC (Apéndice D5) .
Comentarios. La decisión de continuar o finalizar el tratamiento se recomienda en función de la reducción de riesgos futuros (exacerbaciones). Esto se debe al hecho de que no se sabe cómo la capacidad de correlacionar producto medicinal mejorar la función pulmonar o reducir los síntomas con su capacidad para reducir el riesgo de exacerbaciones de la EPOC. Hasta la fecha, no hay pruebas sólidas de que alguna farmacoterapia en particular retrase la progresión de la enfermedad (medida por la tasa media de disminución del FEV1 mínimo) o reduzca la mortalidad, aunque se han publicado datos preliminares que indican tales efectos.
broncodilatadores.
Los broncodilatadores incluyen agonistas β2 y anticolinérgicos, incluidos fármacos de acción corta (duración del efecto de 3 a 6 horas) y de acción prolongada (duración del efecto de 12 a 24 horas).
Se recomienda que todos los pacientes con EPOC reciban broncodilatadores de acción corta para usar según sea necesario.
Nivel de persuasión de las recomendaciones A (nivel de evidencia - 1).
Comentarios. El uso de broncodilatadores de acción corta a demanda también es posible en pacientes tratados con LABD. Al mismo tiempo, el uso regular de dosis altas de broncodilatadores de acción corta (incluso a través de un nebulizador) en pacientes que reciben DDBD no está justificado, y debe recurrirse a él solo en los casos más difíciles. En tales situaciones, es necesario evaluar de manera integral la necesidad del uso de DDBD y la capacidad del paciente para realizar inhalaciones correctamente.
agonistas β2.
Para el tratamiento de la EPOC, se recomienda utilizar los siguientes agonistas β2 de acción prolongada (LABA): formoterol, salmeterol, indacaterol, olodaterol (Apéndice D6).
Nivel de fuerza de la recomendación A (nivel de evidencia - 1).
Comentarios. Influyendo en el FEV1 y la disnea, el indacaterol y el olodaterol son al menos tan buenos como el formoterol, el salmeterol y el bromuro de tiotropio. En cuanto a su efecto sobre el riesgo de exacerbaciones moderadas/graves, los LABA (indacaterol, salmeterol) son inferiores al bromuro de tiotropio.
En el tratamiento de pacientes con EPOC con enfermedades cardiovasculares concomitantes, se recomienda evaluar el riesgo de desarrollar complicaciones cardiovasculares antes de prescribir ABAP.
Comentarios. La activación de los receptores β-adrenérgicos del corazón bajo la acción de los agonistas β2 presumiblemente puede causar isquemia, insuficiencia cardíaca, arritmias y también aumentar el riesgo de muerte súbita. Sin embargo, en ensayos clínicos controlados en pacientes con EPOC, no se obtuvieron datos sobre un aumento en la frecuencia de arritmias, mortalidad cardiovascular o global con el uso de agonistas β2.
En el tratamiento de la EPOC, a diferencia del asma, los LABA se pueden utilizar como monoterapia (sin ICS).
Fármacos anticolinérgicos.
Para el tratamiento de la EPOC, se recomiendan los siguientes anticolinérgicos de acción prolongada (LDAC): bromuro de tiotropio, bromuro de aclidinio, bromuro de glicopirronio, bromuro de umeclidinio (Apéndice D6).
Nivel de persuasión de las recomendaciones A (nivel de evidencia - 1).
Comentarios. El bromuro de tiotropio tiene la mayor base de evidencia entre los DDAC. El bromuro de tiotropio aumenta la función pulmonar, alivia los síntomas, mejora la calidad de vida y reduce el riesgo de exacerbaciones de la EPOC.
El bromuro de aclidinio y el bromuro de glicopirronio mejoran la función pulmonar, la calidad de vida y reducen la necesidad de medicamentos de rescate. En estudios de hasta 1 año, el bromuro de aclidinio, el bromuro de glicopirronio y el bromuro de umeclidinio redujeron el riesgo de exacerbaciones de la EPOC, pero hasta la fecha no se han realizado estudios a largo plazo de más de 1 año, similares a los estudios con bromuro de tiotropio.
Los anticolinérgicos inhalados generalmente se toleran bien y los eventos adversos (AA) son relativamente raros con su uso.
En pacientes con EPOC y enfermedades cardiovasculares concomitantes se recomienda el uso de DDAC.
Nivel de persuasión de las recomendaciones A (nivel de evidencia - 1).
Comentarios. Se ha sospechado que los anticolinérgicos de acción corta (SAC) causan EA cardíacos, pero no hay informes de una mayor incidencia de EA cardíacos en relación con los DDAC. En el estudio UPLIFT de 4 años, los pacientes tratados con bromuro de tiotropio tuvieron significativamente menos eventos cardiovasculares y la mortalidad general entre ellos fue menor que en el grupo de placebo. En el estudio TIOSPIR (duración media del tratamiento 2,3 años), el bromuro de tiotropio en inhalador líquido demostró ser muy seguro, sin diferencias con el bromuro de tiotropio en polvo seco en cuanto a mortalidad, EA cardíacos graves y exacerbaciones de la EPOC.
Combinaciones de broncodilatadores.
Se recomienda una combinación de broncodilatadores con diferentes mecanismos de acción para lograr una mayor broncodilatación y alivio de los síntomas.
Nivel de persuasión de las recomendaciones A (nivel de evidencia - 1).
Comentarios. Por ejemplo, la combinación de CAAC con CABA o LABA mejora el FEV1 en mayor medida que cualquiera de los monocomponentes. SABA o LABA se pueden administrar en combinación con DDAC si DDAA solo no proporciona suficiente alivio de los síntomas.
Para el tratamiento de la EPOC se recomienda el uso de combinaciones fijas de DDAH/LABA: bromuro de glicopirronio/indacaterol, bromuro de tiotropio/olodaterol, bromuro de umeclidinio/vilanterol, bromuro de aclidinio/formoterol.
Nivel de persuasión de las recomendaciones A (nivel de evidencia - 1).
Comentarios. Estas combinaciones mostraron una ventaja sobre el placebo y sus monocomponentes en cuanto al efecto sobre el FEV1 mínimo, la disnea y la calidad de vida, no inferior a ellos en cuanto a seguridad. En comparación con el bromuro de tiotropio, todas las combinaciones de DDAC/LABA mostraron efectos superiores sobre la función pulmonar y la calidad de vida. En cuanto al efecto sobre la disnea, no se demostró ningún beneficio con la combinación de bromuro de umeclidinio/vilanterol, y solo el bromuro de tiotropio/olodaterol fue significativamente superior a la monoterapia con bromuro de tiotropio en cuanto al efecto sobre el PHI.
Al mismo tiempo, las combinaciones DDAC/LABA aún no han demostrado ventajas sobre la monoterapia con bromuro de tiotropio en cuanto a su efecto sobre el riesgo de exacerbaciones moderadas/graves de la EPOC.
Glucocorticosteroides inhalados y sus combinaciones con agonistas β2.
Se recomienda prescribir corticosteroides inhalados solo además de la terapia en curso con DDBD en pacientes con EPOC con antecedentes de BA y con eosinofilia en sangre (el contenido de eosinófilos en la sangre sin exacerbación es más de 300 células por 1 μl).
Nivel de persuasión de las recomendaciones B (nivel de evidencia - 1).
Comentarios. En la EA, los efectos terapéuticos e indeseables de los ICS dependen de la dosis utilizada, pero en la EPOC no existe tal dependencia de la dosis, y en los estudios a largo plazo solo se utilizaron dosis medias y altas de ICS. La respuesta de los pacientes con EPOC al tratamiento con ICS no se puede predecir en función de la respuesta a los corticosteroides orales, los resultados de una prueba de broncodilatación o la presencia de hiperreactividad bronquial.
También se recomienda que los pacientes con EPOC y exacerbaciones frecuentes (2 o más exacerbaciones moderadas en 1 año o al menos 1 exacerbación grave que requiera hospitalización) prescriban ICS además de LABD.
Nivel de persuasión de las recomendaciones B (nivel de evidencia - 1).
Comentarios. El tratamiento a largo plazo (6 meses) con ICS y combinaciones de ICS/LABA reduce la frecuencia de exacerbaciones de la EPOC y mejora la calidad de vida de los pacientes.
ICS se puede utilizar como terapia doble (LABA/IGCS) o triple (LAAA/LABA/IGCS). La terapia triple se ha estudiado en estudios en los que la adición de una combinación de ICS/LABA al tratamiento con bromuro de tiotropio resultó en una mejoría función pulmonar, calidad de vida y una reducción adicional en la frecuencia de las agudizaciones, especialmente las graves. Sin embargo, la terapia triple requiere mayor estudio en estudios más prolongados.
En pacientes con EPOC con alto riesgo de agudizaciones y sin eosinofilia sanguínea, con el mismo grado de evidencia, se recomienda prescribir LAAC o IGCS/LABA.
Nivel de persuasión de las recomendaciones A (nivel de evidencia - 1).
Comentarios. El principal efecto esperado del nombramiento de ICS en pacientes con EPOC es una reducción en el riesgo de exacerbaciones. En este sentido, los ICS/LABA no son superiores a la monoterapia con DDAH (bromuro de tiotropio). Estudios recientes muestran que la ventaja de las combinaciones de ICS/LABA sobre los broncodilatadores en cuanto al efecto sobre el riesgo de exacerbaciones es solo en pacientes con eosinofilia en sangre.
No se recomienda el uso de ICS en pacientes con EPOC con función pulmonar conservada y sin antecedentes de exacerbaciones recurrentes.
Nivel de persuasión de las recomendaciones B (nivel de evidencia - 1).
Comentarios. La terapia con ICS y combinaciones de ICS/LABA no afecta la tasa de disminución del FEV1 y la mortalidad en la EPOC.
Dado el riesgo de efectos adversos graves, no se recomiendan los ICS en la EPOC como parte del tratamiento inicial.
Nivel de persuasión de las recomendaciones B (nivel de evidencia - 1).
Comentarios. Los efectos indeseables de los ICS incluyen candidiasis oral y ronquera. Existe evidencia de un mayor riesgo de neumonía, osteoporosis y fracturas con combinaciones de ICS y ICS/LABA. El riesgo de neumonía en pacientes con EPOC aumenta con el uso no solo de fluticasona, sino también de otros ICS. El inicio del tratamiento con ICS se acompañó de un mayor riesgo de desarrollar diabetes mellitus en pacientes con patología respiratoria.
Roflumilast.
Roflumilast inhibe la EPOC respuesta inflamatoria al inhibir la enzima fosfodiesterasa-4 y aumentar el contenido intracelular de monofosfato de adenosina cíclico.
Roflumilast se recomienda para pacientes con EPOC con FEV1< 50% от должного, с хроническим бронхитом и частыми обострениями, несмотря на применение ДДБД для уменьшения частоты среднетяжелых и тяжелых обострений .
Nivel de persuasión de las recomendaciones A (nivel de evidencia - 1).
Roflumilast no está recomendado para el tratamiento de los síntomas de la EPOC.
Nivel de persuasión de las recomendaciones A (nivel de evidencia - 1).
Comentarios. Roflumilast no es un broncodilatador, aunque durante el tratamiento a largo plazo en pacientes que reciben salmeterol o bromuro de tiotropio, roflumilast aumenta adicionalmente el FEV1 en 50-80 ml.
El efecto de roflumilast sobre la calidad de vida y los síntomas es débil. La droga causa efectos indeseables significativos, típicos entre los cuales se encuentran desórdenes gastrointestinales y dolor de cabeza, así como pérdida de peso.
Glucocorticosteroides orales.
Se recomienda evitar el tratamiento a largo plazo con corticoides orales en pacientes con EPOC, ya que dicho tratamiento puede empeorar su pronóstico a largo plazo.
Comentarios. Aunque una dosis alta de corticosteroides orales (igual a ≥30 mg de prednisolona oral por día) mejora la función pulmonar a corto plazo, no se dispone de datos sobre los beneficios del uso a largo plazo de corticosteroides orales en dosis bajas o medias y altas con un aumento significativo del riesgo de EA. Sin embargo, este hecho no impide el nombramiento de corticosteroides orales durante las exacerbaciones.
Los corticosteroides orales causan varios efectos indeseables graves; una de las más importantes en relación con la EPOC es la miopatía esteroidea, cuyos síntomas son debilidad muscular, disminución de la actividad física e insuficiencia respiratoria en pacientes con EPOC extremadamente grave.
teofilina.
Sigue habiendo controversia sobre el mecanismo exacto de acción de la teofilina, pero este fármaco tiene actividad broncodilatadora y antiinflamatoria. La teofilina mejora significativamente la función pulmonar en la EPOC y posiblemente mejora la función de los músculos respiratorios, pero aumenta el riesgo de EA. Existe evidencia de que dosis bajas de teofilina (100 mg 2 r/día) reducen de forma estadísticamente significativa la frecuencia de exacerbaciones de la EPOC.
La teofilina se recomienda para el tratamiento de la EPOC como terapia adyuvante en pacientes con síntomas graves.
Comentarios. El efecto de la teofilina sobre la función pulmonar y los síntomas de la EPOC es menos pronunciado que el formoterol y el salmeterol LABA.
La duración exacta de la acción de la teofilina, incluyendo drogas modernas con liberación lenta, en la EPOC se desconoce.
Al prescribir teofilina, se recomienda controlar su concentración en la sangre y ajustar la dosis del medicamento según los resultados obtenidos.
Nivel de persuasión de las recomendaciones C (nivel de evidencia - 3).
Comentarios. La farmacocinética de la teofilina se caracteriza por diferencias interindividuales y una tendencia a las interacciones farmacológicas. La teofilina tiene un rango de concentración terapéutico estrecho y puede provocar toxicidad. Los AA más comunes incluyen irritación gástrica, náuseas, vómitos, diarrea, aumento de la diuresis, signos de estimulación del sistema nervioso central (dolor de cabeza, nerviosismo, ansiedad, agitación) y arritmias cardíacas.
Medicamentos antibacterianos.
Se recomienda el nombramiento de macrólidos (azitromicina) en el régimen de terapia a largo plazo para pacientes con EPOC con bronquiectasias y frecuentes exacerbaciones purulentas.
Nivel de fuerza de la recomendación C (nivel de evidencia - 2).
Comentarios. Un metaanálisis reciente mostró que el tratamiento a largo plazo con macrólidos (eritromicina, claritromicina y azitromicina) en 6 estudios que duraron de 3 a 12 meses resultó en una reducción del 37% en la incidencia de exacerbaciones de la EPOC en comparación con el placebo. Además, las hospitalizaciones disminuyeron un 21%. El uso generalizado de macrólidos está limitado por el riesgo de aumentar la resistencia bacteriana a los mismos y los efectos secundarios (pérdida de audición, cardiotoxicidad).
Fármacos mucoactivos.
Este grupo incluye varias sustancias con diferentes mecanismos de acción. El uso regular de mucolíticos en la EPOC se ha estudiado en varios estudios con resultados contradictorios.
Se recomienda el nombramiento de N-acetilcisteína y carbocisteína para pacientes con EPOC con fenotipo de bronquitis y exacerbaciones frecuentes, especialmente si no se está tratando con ICS.
Nivel de fuerza de la recomendación C (nivel de evidencia - 3).
Comentarios. La N-aceticisteína y la carbocisteína pueden presentar propiedades antioxidantes y pueden reducir las exacerbaciones, pero no mejoran la función pulmonar ni la calidad de vida de los pacientes con EPOC.
Elección del inhalador.
Se recomienda educar a los pacientes con EPOC sobre el uso correcto de los inhaladores al inicio del tratamiento y luego monitorear su uso en las visitas posteriores.Comentarios. Una proporción significativa de pacientes comete errores al usar inhaladores. Cuando se usa un inhalador de polvo de dosis medida (DPI), no se requiere coordinación entre presionar el botón e inhalar, pero se necesita un esfuerzo inspiratorio suficiente para crear un flujo inspiratorio suficiente. Cuando se utiliza un inhalador de aerosol de dosis medida (MAI), no se requiere un flujo inspiratorio alto, pero el paciente debe poder coordinar la activación del inhalador con el inicio de la inspiración.
Se recomienda el uso de espaciadores al prescribir PDI para eliminar el problema de coordinación y reducir la deposición de la droga en el tracto respiratorio superior.
Nivel de persuasión de las recomendaciones A (nivel de evidencia - 3).
En pacientes con EPOC grave, se recomienda dar preferencia a un PDI (incluso con espaciador) o un inhalador líquido.
Nivel de persuasión de las recomendaciones A (nivel de evidencia - 3).
Comentarios. Esta recomendación se basa en que el flujo inspiratorio no siempre es suficiente en pacientes con EPOC grave que utilizan DPI.
Los principios básicos para elegir el inhalador correcto se describen en el Apéndice G7.
Manejo de la EPOC estable.
Se recomienda a todos los pacientes con EPOC implementar medidas no farmacológicas, prescribir un broncodilatador de acción corta para usar según sea necesario, vacunarse contra la influenza y la infección neumocócica y tratar las comorbilidades.Comentarios. Las intervenciones no farmacológicas incluyen el abandono del hábito tabáquico, la técnica de inhalación y el entrenamiento en autocuidado, la vacunación antigripal y antineumocócica, el fomento de la actividad física, la valoración de la necesidad de oxigenoterapia de larga duración (VCT) y la ventilación no invasiva (VNI).
Se recomienda a todos los pacientes con EPOC que prescriban DDBD, una combinación de DDAC/LABA o uno de estos medicamentos en monoterapia (Apéndice B) .
Nivel de persuasión de las recomendaciones A (nivel de evidencia - 1).
Si el paciente tiene síntomas graves (mMRC ≥ 2 o CAT ≥ 10), se recomienda prescribir una combinación de LAAD/LABA inmediatamente después de establecer el diagnóstico de EPOC.
Nivel de persuasión de las recomendaciones A (nivel de evidencia - 1).
Comentarios. La mayoría de los pacientes con EPOC presentan síntomas graves como dificultad para respirar y reducción de la tolerancia al ejercicio. El nombramiento de una combinación de DDAH / LABA permite, debido a la broncodilatación máxima, aliviar la dificultad para respirar, aumentar la tolerancia al ejercicio y mejorar la calidad de vida de los pacientes.
Se recomienda iniciar monoterapia con un único broncodilatador de acción prolongada (LABA o LABA) en pacientes asintomáticos (mMRC< 2 или САТ.
Nivel de persuasión de las recomendaciones A (nivel de evidencia - 1).
Comentarios. La ventaja de DDAH es un efecto más pronunciado sobre el riesgo de exacerbaciones.
Con la persistencia de los síntomas (dificultad para respirar y reducción de la tolerancia al ejercicio) en el contexto de la monoterapia con LABD solo, se recomienda aumentar la terapia broncodilatadora: transferir a una combinación de DDAH / LABA (Apéndice B) .
También se recomienda el nombramiento de una combinación de DDAH/LABA en lugar de monoterapia para exacerbaciones repetidas (2 o más exacerbaciones moderadas en 1 año o al menos 1 exacerbación grave que requiere hospitalización) en pacientes sin indicaciones de asma y sin eosinofilia en sangre (Apéndice B) .
Nivel de persuasión de las recomendaciones A (nivel de evidencia - 2).
Comentarios. La combinación de DDAC/LABA bromuro de glicopirronio/indacaterol en el estudio FLAME redujo el riesgo de exacerbaciones moderadas/graves de la EPOC de manera más efectiva que la combinación de ICS/LABA (fluticasona/salmeterol) en pacientes con EPOC con FEV1 25-60 % previsto y sin eosinofilia alta en sangre.
Si se producen exacerbaciones repetidas en un paciente con EPOC y BA o con eosinofilia en sangre durante el tratamiento con LABA solo, se recomienda al paciente que prescriba LABA/ICS (Apéndice B).
Nivel de persuasión de las recomendaciones A (nivel de evidencia - 2).
Comentarios. El criterio para la eosinofilia en sangre es el contenido de eosinófilos en la sangre (sin exacerbación) 300 células por 1 µl.
Si se producen exacerbaciones repetidas en pacientes con EPOC con asma o eosinofilia durante el tratamiento con una combinación de DDAC/LABA, se recomienda al paciente la adición de ICS (Apéndice B).
Nivel de persuasión de las recomendaciones A (nivel de evidencia - 2).
Comentarios. El paciente también puede llegar a la triple terapia con una eficacia insuficiente de la terapia IGCS/LABA, cuando se añade LAAA al tratamiento.
La terapia triple con LAAA/LABA/IGCS se puede administrar actualmente de dos maneras: 1) usando una combinación fija de LAAA/LABA y un inhalador ICS separado; 2) usando una combinación fija de LABA/IGCS y un inhalador DDAH separado. La elección entre estos métodos depende de la terapia inicial, el cumplimiento con diferentes inhaladores y la disponibilidad de medicamentos.
En caso de exacerbaciones repetidas en terapia con una combinación de LAAA/LABA en un paciente sin asma y eosinofilia o recaída de exacerbaciones en terapia triple (LAHA/LABA/IGCS), se recomienda aclarar el fenotipo de la EPOC y prescribir medicamentos específicos para el fenotipo. terapia (roflumilast, N-acetilcisteína, azitromicina, etc. ; – apéndice B).
Nivel de persuasión de las recomendaciones B (nivel de evidencia - 3).
No se recomienda reducir el volumen de la terapia broncodilatadora (en ausencia de EA) incluso en el caso de máximo alivio de los síntomas.
Fuerza de la recomendación A (nivel de evidencia -2).
Comentarios. Esto se debe al hecho de que la EPOC es una enfermedad progresiva, por lo que no es posible la normalización completa de la función pulmonar.
En pacientes con EPOC sin agudizaciones recurrentes y con función pulmonar conservada (FEV1 50% del predicho), se recomienda suspender completamente los ICS, siempre que se prescriba DDBD.
Nivel de fuerza de la recomendación B (nivel de evidencia -2).
Comentarios. Si, en opinión del médico, el paciente no necesita continuar el tratamiento con ICS, o si se han producido EA debido a dicha terapia, entonces ICS puede cancelarse sin aumentar el riesgo de exacerbaciones.
En pacientes con FEV1< 50% от должного, получающих тройную терапию, рекомендуется постепенная отмена ИГКС со ступенчатым уменьшением его дозы в течение 3 месяцев .
Fuerza de la recomendación A (nivel de evidencia -3).
Comentarios. valor FEV1< 50% ранее считалось фактором риска частых обострений ХОБЛ и рассматривалось как показание к назначению комбинации ИГКС/ДДБА. В настоящее время такой подход не рекомендуется, поскольку он приводит к нежелательным эффектам и неоправданным затратам , хотя в реальной практике ИГКС и комбинации ИГКС/ДДБА назначаются неоправданно часто.
3.2 Tratamiento quirúrgico.
La cirugía de reducción de volumen pulmonar se recomienda para pacientes con EPOC con enfisema del lóbulo superior y poca tolerancia al ejercicio.Nivel de persuasión de las recomendaciones C (nivel de evidencia - 3).
Comentarios. La cirugía de reducción de volumen pulmonar se realiza extirpando parte del pulmón para reducir la hiperinflación y lograr un bombeo más eficiente de los músculos respiratorios. En la actualidad, para reducir el volumen pulmonar, también es posible utilizar métodos menos invasivos: oclusión de bronquios segmentarios con válvulas, pegamento especial, etc.;
Se recomienda el trasplante de pulmón para una serie de pacientes con EPOC muy grave en presencia de las siguientes indicaciones: índice BODE ≥ 7 puntos (BODE - B - índice de masa corporal (índice de masa corporal), O - obstrucción (obstrucción) D - disnea ( dificultad para respirar), E - tolerancia al ejercicio (tolerancia a la actividad física)), FEV1< 15% от должных, ≥ 3 обострений в предшествующий год, 1 обострение с развитием острой гиперкапнической дыхательной недостаточности (ОДН), среднетяжелая-тяжелая легочная гипертензия (среднее давление в легочной артерии ≥35 мм) .
Nivel de persuasión de las recomendaciones C (nivel de evidencia - 3).
Comentarios. El trasplante de pulmón puede mejorar la calidad de vida y el rendimiento funcional en pacientes con EPOC cuidadosamente seleccionados.
3.3 Otros tratamientos.
Oxigenoterapia a largo plazo.
Una de las complicaciones más graves de la EPOC que se desarrolla en sus etapas tardías (terminales) es la insuficiencia respiratoria crónica (IRC). El síntoma principal de la insuficiencia renal crónica es el desarrollo de hipoxemia, etc.; disminución del contenido de oxígeno en la sangre arterial (PaO2).El APV es actualmente una de las pocas terapias que puede reducir la mortalidad en pacientes con EPOC. La hipoxemia no solo acorta la vida de los pacientes con EPOC, sino que también tiene otras consecuencias adversas importantes: deterioro de la calidad de vida, desarrollo de policitemia, aumento del riesgo de arritmias cardíacas durante el sueño y desarrollo y progresión de hipertensión pulmonar. El APV puede reducir o eliminar todos estos efectos negativos de la hipoxemia.
El APV se recomienda para pacientes con EPOC e insuficiencia renal crónica (consulte el apéndice D8 para conocer las indicaciones).
Fuerza de la recomendación A (nivel de evidencia -1).
Comentarios. Cabe destacar que la presencia de signos clínicos corazón pulmonar sugiere cita anterior de APV.
La corrección de la hipoxemia con oxígeno es el método más fundamentado fisiopatológicamente para tratar la ERC. A diferencia de una fila condiciones de emergencia(neumonía, edema pulmonar, trauma), el uso de oxígeno en pacientes con hipoxemia crónica debe ser constante, prolongado y generalmente realizado en casa, por lo que esta forma de terapia se denomina APV.
Se recomienda evaluar los parámetros de intercambio de gases, en los que se basan las indicaciones de APV, solo durante el estado estable de los pacientes, etc.; 3-4 semanas después de la exacerbación de la EPOC.
Nivel de persuasión de las recomendaciones C (nivel de evidencia - 3).
Comentarios. Es este tiempo el que se requiere para restaurar el intercambio de gases y el transporte de oxígeno después de un período de ODN. Antes de prescribir APV a pacientes con EPOC, se recomienda asegurarse de que se han agotado las posibilidades de la terapia farmacológica y que posible terapia no conduce a un aumento de la PaO2 por encima de los valores límite.
Al prescribir oxigenoterapia, se recomienda esforzarse por alcanzar valores de PaO2 de 60 mm y SaO2 del 90%.
Nivel de persuasión de las recomendaciones C (nivel de evidencia - 3).
No se recomienda el APV para pacientes con EPOC que continúan fumando; no recibir una terapia farmacológica adecuada dirigida a controlar el curso de la EPOC (broncodilatadores, ICS); insuficientemente motivado para este tipo de terapia.
Nivel de persuasión de las recomendaciones C (nivel de evidencia - 3).
Se recomienda a la mayoría de los pacientes con EPOC realizar APV durante al menos 15 horas al día con intervalos máximos entre sesiones que no superen las 2 horas seguidas, con un flujo de oxígeno de 1-2 l/min.
Nivel de persuasión de las recomendaciones B (nivel de evidencia - 2).
Ventilación prolongada del hogar.
La hipercapnia (td; aumento de la tensión parcial de dióxido de carbono en sangre arterial - PaCO2 ≥ 45 mm) es un marcador de disminución de la reserva ventilatoria con etapas terminales enfermedades pulmonares y también sirve como factor de pronóstico negativo para pacientes con EPOC. La hipercapnia nocturna cambia la sensibilidad del centro respiratorio al CO2, lo que lleva a niveles más altos de PaCO2 durante el día, lo que tiene Consecuencias negativas para la función del corazón, el cerebro y los músculos respiratorios. La disfunción de los músculos respiratorios, combinada con una alta carga resistiva, elástica y de umbral en el aparato respiratorio, exacerba aún más la hipercapnia en pacientes con EPOC, desarrollando así un "círculo vicioso" que solo puede romperse mediante asistencia respiratoria (ventilación pulmonar).En pacientes con EPOC e insuficiencia renal crónica estable que no necesitan cuidados intensivos, es posible llevar a cabo asistencia respiratoria a largo plazo de forma continua en el hogar, la llamada ventilación pulmonar a largo plazo en el hogar (LHVL).
El uso de DDWL en pacientes con EPOC se acompaña de una serie de efectos fisiopatológicos positivos, el principal de los cuales es la mejora de los parámetros de intercambio de gases: un aumento de PaO2 y una disminución de PaCO2, una mejora en la función de los músculos respiratorios, un aumento en la tolerancia al ejercicio, una mejora en la calidad del sueño y una disminución en LHI. Estudios recientes han demostrado que con parámetros adecuadamente seleccionados de ventilación pulmonar no invasiva (VNI), es posible una mejora significativa en la supervivencia de los pacientes con EPOC complicada con ERC hipercápnica.
DDWL se recomienda para pacientes con EPOC que cumplen los siguientes criterios:
- La presencia de síntomas de insuficiencia renal crónica: debilidad, dificultad para respirar, dolores de cabeza matutinos;
- Presencia de uno de los siguientes: PaCO2 55 mm, PaCO2 50-54 mm y episodios de desaturaciones nocturnas (SaO2< 88% в течение более 5 мин во время O2-терапии 2 л/мин), PaCO2 50-54 мм и частые госпитализации вследствие развития повторных обострений (2 и более госпитализаций за 12 мес).
Nivel de persuasión de las recomendaciones A (nivel de evidencia - 1).
Sociedad Respiratoria Rusa
enfermedad pulmonar obstructiva crónica
Chuchalin Alejandro Grigorievich |
Director de la Institución Presupuestaria del Estado Federal "Instituto de Investigación en Neumología" FMBA |
Rusia, Presidente de la Junta de la Federación |
|
sociedad respiratoria, jefe |
|
neumólogo especialista freelance |
|
Ministerio de Salud de la Federación Rusa, Académico de la Academia Rusa de Ciencias Médicas, Profesor, |
|
Aisanov Zaurbek Ramazanovich |
Jefe del Departamento de Fisiología Clínica |
Y investigación clínica FSBI "NII |
|
Avdeev Sergey Nikolaevich |
Subdirector de trabajo científico, |
Jefe del departamento clínico de la Institución Presupuestaria del Estado Federal "NII |
|
neumología" FMBA de Rusia, profesor, MD |
|
Andrei Belevsky |
Profesor del Departamento de Neumología, SBEI HPE |
Stanislavovich |
La Universidad Médica de Investigación Nacional de Rusia lleva el nombre de N.I. Pirogova, cabeza |
laboratorio de rehabilitación de la Institución Presupuestaria del Estado Federal "NII |
|
neumología" FMBA de Rusia , profesor, d.m.s. |
|
Leshchenko Ígor Viktorovich |
Catedrático del Departamento de Fisiología y |
neumología GBOU VPO USMU, jefe |
|
neumólogo independiente, Ministerio de Salud |
|
Región y administración de Sverdlovsk |
|
cuidado de la salud de Ekaterimburgo, científico |
|
jefe de la clínica "Médico |
|
Asociación "Hospital Nuevo", profesor, |
|
Doctor en Ciencias Médicas, Honorable Doctor de Rusia, |
|
Meshcheryakova Natalia Nikolaevna |
Profesor asociado del Departamento de Neumología, Universidad Nacional de Investigación Médica de Rusia |
lleva el nombre de N. I. Pirogova, investigadora líder |
|
laboratorio de rehabilitación de la Institución Presupuestaria del Estado Federal "NII |
|
neumología" FMBA de Rusia, Ph.D. |
|
Ovcharenko Svetlana Ivánovna |
Profesor del Departamento de Terapia de la Facultad No. |
1 Facultad de Medicina, GBOU VPO Primera |
|
MGMU ellos. A ELLOS. Sechenov, profesor, MD, |
|
Honorable Doctor de la Federación Rusa |
|
Shmelev Evgeny Ivánovich |
Jefe del Departamento de Diferencial |
diagnóstico de tuberculosis CNIIT RAMS, médico |
|
Miel. Sci., profesor, d.m.s., estañado |
|
trabajador de la ciencia de la Federación Rusa. |
Metodología |
||
Definición de EPOC y epidemiología |
||
Cuadro clínico de la EPOC |
||
Principios de diagnóstico |
||
Pruebas funcionales en diagnóstico y monitorización |
||
curso de la EPOC |
||
Diagnóstico diferencial de la EPOC |
||
Clasificación moderna de la EPOC. Integrado |
||
evaluación de la severidad de la corriente. |
||
Terapia para la EPOC estable |
||
Exacerbación de la EPOC |
||
Terapia para la exacerbación de la EPOC |
||
EPOC y comorbilidades |
||
Rehabilitación y educación del paciente |
||
1. Metodología
Métodos utilizados para recolectar/seleccionar evidencia:
búsqueda en bases de datos electrónicas.
Descripción de los métodos utilizados para recolectar/seleccionar evidencia:
Métodos utilizados para evaluar la calidad y solidez de la evidencia:
Consenso de expertos;
Descripción |
||||||
evidencia |
||||||
Metanálisis Alta calidad, revisiones sistemáticas |
||||||
ensayos controlados aleatorios (ECA) o |
||||||
ECA con muy bajo riesgo de sesgo |
||||||
Metanálisis realizados cualitativamente, sistemáticos o |
||||||
ECA con bajo riesgo de sesgo |
||||||
Metanálisis, ECA sistemáticos o de alto riesgo |
||||||
errores sistemáticos |
||||||
alta calidad |
revisiones sistemáticas |
investigación |
||||
control de caso |
grupo |
investigación. |
||||
Revisiones de alta calidad de estudios de casos y controles o |
||||||
estudios de cohortes con muy bajo riesgo de efectos |
||||||
errores de mezcla o sistemáticos y la probabilidad media |
||||||
causalidad |
||||||
Estudios de casos y controles bien realizados o |
||||||
estudios de cohortes con un riesgo medio de efectos de confusión |
||||||
o errores sistemáticos y la probabilidad media de errores causales |
||||||
interconexiones |
||||||
Estudios de casos y controles o de cohortes con |
||||||
alto riesgo de efectos de confusión o efectos sistémicos |
||||||
errores y la probabilidad media de una relación causal |
||||||
Estudios no analíticos (por ejemplo, descripciones de casos, |
||||||
series de casos) |
||||||
Opinión experta |
||||||
Métodos utilizados para analizar la evidencia:
Revisiones sistemáticas con tablas de evidencia.
Descripción de los métodos utilizados para el análisis de la evidencia:
Al seleccionar publicaciones como posibles fuentes de evidencia, se revisa la metodología utilizada en cada estudio para asegurar su validez. El resultado del estudio influye en el nivel de evidencia asignado a la publicación, lo que a su vez afecta la fuerza de las recomendaciones que se derivan de ella.
El estudio metodológico se basa en varias preguntas clave que se centran en aquellas características del diseño del estudio que tienen un impacto significativo en la validez de los resultados y conclusiones. Estas preguntas clave pueden variar según los tipos de estudios y los cuestionarios utilizados para estandarizar el proceso de evaluación de publicaciones. Las recomendaciones utilizaron el cuestionario MERGE desarrollado por el Departamento de Salud de Nueva Gales del Sur. Este cuestionario está destinado a una evaluación y adaptación detallada de acuerdo con los requisitos de la Sociedad Respiratoria Rusa (RRS) para mantener un equilibrio óptimo entre el rigor metodológico y la aplicación práctica.
El proceso de evaluación, por supuesto, puede verse afectado por el factor subjetivo. Para minimizar los posibles errores, cada estudio se evaluó de forma independiente, es decir. al menos dos miembros independientes del grupo de trabajo. Cualquier diferencia en las evaluaciones ya fue discutida por todo el grupo en con toda la fuerza. Si era imposible llegar a un consenso, se involucraba a un experto independiente.
Tablas de evidencia:
Los miembros del grupo de trabajo completaron las tablas de evidencia.
Métodos utilizados para formular recomendaciones:
Descripción |
|
Al menos un metanálisis, revisión sistemática o ECA |
|
demostrando la sostenibilidad de los resultados |
|
Grupo de pruebas que incluye los resultados del estudio evaluados |
|
sostenibilidad general de los resultados |
|
evidencia extrapolada de estudios clasificados como 1++ |
|
Grupo de pruebas que incluye los resultados del estudio evaluados |
|
sostenibilidad general de los resultados; |
|
evidencia extrapolada de estudios clasificados 2++ |
|
evidencia de nivel 3 o 4; |
|
evidencia extrapolada de estudios clasificados 2+ |
Puntos de buenas prácticas (GPP):
Análisis Economico:
No se realizó análisis de costos y no se analizaron publicaciones sobre farmacoeconomía.
revisión por pares externos;
Revisión interna por pares.
Este borrador de directrices ha sido revisado por pares por expertos independientes a quienes se les ha pedido que comenten principalmente sobre la medida en que la interpretación de la evidencia subyacente a las recomendaciones es comprensible.
Se recibieron comentarios de médicos de atención primaria y terapeutas de distrito sobre la inteligibilidad de la presentación de recomendaciones y su valoración de la importancia de las recomendaciones como herramienta de trabajo en la práctica diaria.
El borrador también se envió a un revisor no médico para recibir comentarios desde la perspectiva del paciente.
Los comentarios recibidos de los expertos fueron cuidadosamente sistematizados y discutidos por el presidente y los miembros del grupo de trabajo. Se discutió cada elemento y se registraron los cambios resultantes en las recomendaciones. Si no se realizaron cambios, se registraron las razones para negarse a realizarlos.
Consulta y valoración de expertos:
La versión preliminar se publicó para discusión pública en el sitio web de RPO para que los participantes que no asistieron al congreso pudieran participar en la discusión y mejora de las recomendaciones.
Grupo de trabajo:
Para la revisión final y control de calidad, las recomendaciones fueron analizadas nuevamente por los miembros del grupo de trabajo, quienes llegaron a la conclusión de que se tomaron en cuenta todos los comentarios y comentarios de los expertos, el riesgo de errores sistemáticos en el desarrollo de recomendaciones se minimizó.
2. Definición de EPOC y epidemiología
Definición
La EPOC es una enfermedad prevenible y tratable caracterizada por una limitación persistente del flujo aéreo que suele ser progresiva y se asocia con una marcada respuesta inflamatoria crónica de los pulmones a partículas o gases patógenos. En algunos pacientes, las exacerbaciones y las comorbilidades pueden afectar la gravedad general de la EPOC (GOLD 2014).
Tradicionalmente, la EPOC combina bronquitis crónica y enfisema pulmonar.La bronquitis crónica suele definirse clínicamente como la presencia de tos con
producción de esputo durante al menos 3 meses durante los próximos 2 años.
El enfisema se define morfológicamente como la presencia de dilatación permanente de las vías aéreas distales a los bronquiolos terminales, asociada a destrucción de las paredes alveolares, no asociada a fibrosis.
En pacientes con EPOC, ambas condiciones están presentes con mayor frecuencia y, en algunos casos, es bastante difícil distinguirlas clínicamente en las primeras etapas de la enfermedad.
El concepto de EPOC no incluye el asma bronquial y otras enfermedades asociadas a la obstrucción bronquial poco reversible (fibrosis quística, bronquiectasias, bronquiolitis obliterante).
Epidemiología
Predominio
La EPOC es actualmente problema mundial. En algunas partes del mundo la prevalencia de la EPOC es muy alta (más del 20% en Chile), en otras es menor (alrededor del 6% en México). Las razones de esta variabilidad son las diferencias en la forma de vida de las personas, su comportamiento y el contacto con diversos agentes dañinos.
Uno de los Estudios Globales (el proyecto BOLD) brindó una oportunidad única para estimar la prevalencia de la EPOC utilizando cuestionarios estandarizados y pruebas de función pulmonar en poblaciones adultas mayores de 40 años, tanto en países desarrollados como en vías de desarrollo. La prevalencia de EPOC estadio II y superior (GOLD 2008), según el estudio BOLD, entre personas mayores de 40 años fue del 10,1±4,8%; incluso para hombres - 11,8±7,9% y para mujeres - 8,5±5,8%. Según un estudio epidemiológico sobre la prevalencia de la EPOC en la región de Samara (residentes de 30 años o más), la prevalencia de la EPOC en la muestra total fue del 14,5% (hombres -18,7%, mujeres - 11,2%). Según los resultados de otro estudio ruso realizado en la región de Irkutsk, la prevalencia de la EPOC en personas mayores de 18 años entre la población urbana fue del 3,1%, entre la rural del 6,6%. La prevalencia de la EPOC aumentaba con la edad: en el grupo de edad de 50 a 69 años, el 10,1% de los hombres de la ciudad y el 22,6% de los del área rural padecían la enfermedad. Casi uno de cada dos hombres mayores de 70 años que viven en áreas rurales ha sido diagnosticado con EPOC.
Mortalidad
Según la OMS, la EPOC es actualmente la cuarta causa de muerte en el mundo. Alrededor de 2,75 millones de personas mueren cada año a causa de la EPOC, lo que representa el 4,8 % de todas las causas de muerte. En Europa, la mortalidad por EPOC varía considerablemente, desde 0,20 por 100.000 habitantes en Grecia, Suecia, Islandia y Noruega, hasta 80 por 100.000
V Ucrania y Rumania.
EN período de 1990 a 2000 letalidad deenfermedad cardiovascular
V en general y por ictus disminuyeron un 19,9% y un 6,9%, respectivamente, mientras que la mortalidad por EPOC aumentó un 25,5%. Se observa un aumento particularmente pronunciado de la mortalidad por EPOC entre las mujeres.
Predictores de mortalidad en pacientes con EPOC son factores como la gravedad obstrucción bronquial, el estado nutricional (índice de masa corporal), la resistencia física según la prueba de la marcha de 6 minutos y la gravedad de la disnea, la frecuencia y gravedad de las agudizaciones, la hipertensión pulmonar.
Las principales causas de muerte en pacientes con EPOC son la insuficiencia respiratoria (IR), cáncer de pulmón, enfermedades cardiovasculares y tumores de otra localización.
Importancia socioeconómica de la EPOC
EN En los países desarrollados, los costes económicos totales asociados a la EPOC en la estructura de las enfermedades pulmonares ocupan 2º después del cáncer de pulmón y 1º
en términos de costes directos, superando en 1,9 veces los costes directos del asma bronquial. Los costes económicos por paciente asociados a la EPOC son tres veces superiores a los de un paciente con asma bronquial. Los pocos informes de costes médicos directos en la EPOC indican que más del 80% de los recursos materiales se destinan a la atención hospitalaria de los pacientes y menos del 20% a la atención ambulatoria. Se ha establecido que el 73% de los costos son para el 10% de los pacientes con un curso severo de la enfermedad. El mayor daño económico lo provoca el tratamiento de las agudizaciones de la EPOC. En Rusia, la carga económica de la EPOC, teniendo en cuenta los costos indirectos, incluido el ausentismo (ausentismo) y el presentismo (trabajo menos efectivo debido a la mala salud), es de 24,1 mil millones de rublos.
3. Cuadro clínico de la EPOC
En condiciones de exposición a factores de riesgo (tabaquismo, tanto activo como pasivo, contaminantes exógenos, combustibles bioorgánicos, etc.), la EPOC suele desarrollarse lentamente y progresar gradualmente. La peculiaridad del cuadro clínico es que por mucho tiempo la enfermedad procede sin manifestaciones clínicas pronunciadas (3, 4; D).
Los primeros signos de que los pacientes buscan atención médica son tos, a menudo con producción de esputo y/o dificultad para respirar. Estos síntomas son más pronunciados por la mañana. Durante las estaciones frías, se producen "resfriados frecuentes". Este es el cuadro clínico del debut de la enfermedad, que el médico considera una manifestación de bronquitis del fumador, y el diagnóstico de EPOC en esta etapa prácticamente no se realiza.
La tos crónica, que suele ser el primer síntoma de la EPOC, también suele ser subestimada por los pacientes, ya que se considera una consecuencia esperada del tabaquismo y/o la exposición a factores ambientales adversos. Por lo general, los pacientes producen una pequeña cantidad de esputo viscoso. Un aumento en la producción de tos y esputo ocurre con mayor frecuencia en los meses de invierno, durante las exacerbaciones infecciosas.
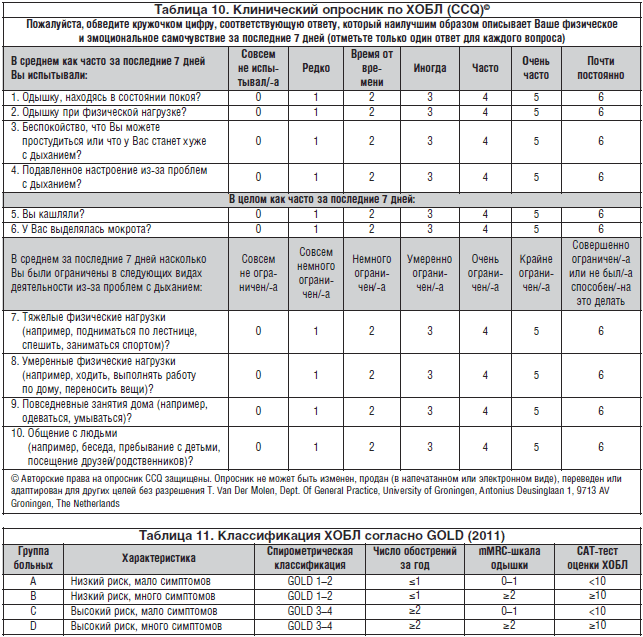
La dificultad para respirar es el síntoma más importante de la EPOC (4; D). A menudo sirve como motivo de búsqueda de ayuda médica y el principal motivo que limita la actividad laboral del paciente. El impacto de la disnea en la salud se evalúa mediante el cuestionario del British Medical Council (MRC). Al principio, se nota dificultad para respirar con un nivel relativamente alto de actividad física, como correr en terreno llano o subir escaleras. A medida que avanza la enfermedad, la disnea empeora y puede limitar incluso la actividad diaria, y posteriormente se presenta en reposo, obligando al paciente a quedarse en casa (tabla 3). Además, la valoración de la disnea en la escala MRC es una herramienta sensible para predecir la supervivencia de los pacientes con EPOC.
Tabla 3. Valoración de la disnea según la escala de disnea del Medical Research Council Scale (MRC)
Descripción |
|||
Siento dificultad para respirar solo con fuerte físico |
|||
carga |
|||
Me quedo sin aliento cuando camino rápido en terreno llano o |
|||
subiendo una colina suave |
|||
Debido a la dificultad para respirar, camino más lentamente en terreno llano, |
|||
que la gente de la misma edad, o me detiene |
|||
respiro mientras camino a nivel del suelo en mi habitual |
|||
templa para mi |
Al describir la clínica de la EPOC, es necesario tener en cuenta los rasgos característicos de esta enfermedad en particular: su inicio subclínico, ausencia síntomas específicos la progresión constante de la enfermedad.
La gravedad de los síntomas varía según la fase del curso de la enfermedad (curso estable o exacerbación). Se debe considerar estable la condición en la que la gravedad de los síntomas no cambia significativamente durante semanas o incluso meses, y en este caso, la progresión de la enfermedad se puede detectar solo con un seguimiento dinámico a largo plazo (6-12 meses) de la paciente.
Las exacerbaciones de la enfermedad tienen un impacto significativo en el cuadro clínico: empeoramiento recurrente de la condición (que dura al menos 2-3 días), acompañado de un aumento en la intensidad de los síntomas y trastornos funcionales. Durante una exacerbación, hay un aumento en la gravedad de la hiperinflación y la llamada. trampas de aire en combinación con un flujo espiratorio reducido, lo que conduce a un aumento de la disnea, que suele acompañarse de la aparición o intensificación de sibilancias remotas, sensación de presión en el pecho y disminución de la tolerancia al ejercicio. Además, hay un aumento en la intensidad de la tos, la cantidad de esputo, la naturaleza de su separación, el color y el cambio de viscosidad (aumento o disminución brusca). Al mismo tiempo, los indicadores de desempeño se deterioran respiración externa y gases en sangre: disminución de los indicadores de velocidad (FEV1, etc.), puede producirse hipoxemia e incluso hipercapnia.
El curso de la EPOC es una alternancia de una fase estable y una exacerbación de la enfermedad, pero en diferentes personas se desarrolla de manera diferente. Sin embargo, la progresión de la EPOC es común, especialmente si el paciente continúa expuesto a partículas o gases patógenos inhalados.
El cuadro clínico de la enfermedad también depende seriamente del fenotipo de la enfermedad y viceversa, el fenotipo determina las características de las manifestaciones clínicas de la EPOC. Durante muchos años, ha habido una división de los pacientes en fenotipos enfisematosos y bronquitis.
El tipo de bronquitis se caracteriza por un predominio de signos de bronquitis (tos, esputo). El enfisema en este caso es menos pronunciado. En el tipo enfisematoso, por el contrario, el enfisema es la principal manifestación patológica, la dificultad para respirar prevalece sobre la tos. Sin embargo, en la práctica clínica, es muy raro distinguir el fenotipo enfisematoso o bronquitis de la EPOC en la denominada EPOC. forma "pura" (sería más correcto hablar de un fenotipo predominantemente bronquitis o predominantemente enfisematoso de la enfermedad). Las características de los fenotipos se presentan con más detalle en la Tabla 4.
Tabla 4. Características clínicas y de laboratorio de los dos fenotipos principales de la EPOC
Peculiaridades |
externo |
nutrición reducida |
||||
tez rosada |
cianosis difusa |
|||||
Extremidades - frío |
miembros cálidos |
|||||
síntoma predominante |
||||||
Escaso - más a menudo mucoso |
Abundante - más a menudo mucoso |
|||||
infección bronquial |
||||||
corazón pulmonar |
||||||
etapa terminal |
||||||
Radiografía |
hiperinflación, |
Ganar |
pulmonar |
|||
pecho |
bulloso |
cambios, |
aumentar |
|||
corazón "vertical" |
tamaño del corazón |
|||||
Hematocrito, % |
||||||
PaO2 |
||||||
PaCO2 |
||||||
Difusión |
pequeño |
|||||
capacidad |
rechazar |
|||||
Si es imposible señalar el predominio de uno u otro fenotipo, se debe hablar de un fenotipo mixto. En entornos clínicos, los pacientes con un tipo mixto de enfermedad son más comunes.
Además de los anteriores, actualmente se distinguen otros fenotipos de la enfermedad. En primer lugar, esto se refiere al llamado fenotipo de superposición (combinación de EPOC y BA). A pesar de que es necesario diferenciar cuidadosamente a los pacientes con EPOC y asma bronquial y una diferencia significativa en la inflamación crónica en estas enfermedades, en algunos pacientes la EPOC y el asma pueden estar presentes al mismo tiempo. Este fenotipo puede desarrollarse en pacientes fumadores que padecen asma bronquial. Junto con esto, como resultado de estudios a gran escala, se ha demostrado que alrededor del 20-30% de los pacientes con EPOC pueden tener una obstrucción bronquial reversible, y en composición celular los eosinófilos aparecen durante la inflamación. Algunos de estos pacientes también pueden atribuirse al fenotipo EPOC + BA. Estos pacientes responden bien a la terapia con corticosteroides.
Otro fenotipo que se ha discutido recientemente es el de los pacientes con exacerbaciones frecuentes (2 o más exacerbaciones por año, o 1 o más exacerbaciones que resultan en hospitalización). La importancia de este fenotipo está determinada por el hecho de que el paciente sale de la exacerbación con parámetros funcionales reducidos de los pulmones, y la frecuencia de las exacerbaciones afecta directamente la esperanza de vida de los pacientes y requiere un enfoque individual del tratamiento. La identificación de muchos otros fenotipos requiere mayor aclaración. Varios estudios recientes han llamado la atención sobre la diferencia en manifestaciones clínicas EPOC entre hombres y mujeres. Al final resultó que, las mujeres se caracterizan por una hiperreactividad más pronunciada de las vías respiratorias, notan una dificultad para respirar más pronunciada en los mismos niveles de obstrucción bronquial que en los hombres, etc. Con los mismos indicadores funcionales en mujeres, la oxigenación ocurre mejor que en hombres. Sin embargo, las mujeres son más propensas a desarrollar exacerbaciones, muestran un efecto menor. entrenamiento físico en los programas de rehabilitación, evalúan la calidad de vida inferior según cuestionarios estándar.
Es bien conocido que los pacientes con EPOC tienen numerosas manifestaciones extrapulmonares de la enfermedad debido al efecto sistémico de la enfermedad crónica.
5
1 FGBOU VO RNIMU ellos. NI Pirogov del Ministerio de Salud de Rusia, Moscú
2 Instituto de Investigación de Neumología, Agencia Federal Médica y Biológica de Rusia, Moscú
3 Institución Educativa Presupuestaria del Estado Federal de Educación Superior USMU del Ministerio de Salud de Rusia, Ekaterimburgo
4 FGAOU VO Primera Universidad Médica Estatal de Moscú. I. M. Sechenov del Ministerio de Salud de Rusia (Universidad Sechenov), Moscú
5 FGBNU "TsNIIT", Moscú
Para cita: Chuchalin A.G., Aisanov Z.R., Avdeev S.N., Leshchenko I.V., Ovcharenko S.I., Shmelev E.I. Directrices clínicas federales para el diagnóstico y tratamiento de la enfermedad pulmonar obstructiva crónica // BC. 2014. Nº 5. art. 331
1. Metodología
1. Metodología
Métodos utilizados para recolectar/seleccionar evidencia:
. búsqueda en bases de datos electrónicas.
Descripción de los métodos utilizados para recolectar/seleccionar evidencia:
. La base de evidencia para las recomendaciones son las publicaciones incluidas en la Biblioteca Cochrane, las bases de datos EMBASE y MEDLINE. La profundidad de búsqueda fue de 5 años.
Métodos utilizados para evaluar la calidad y solidez de la evidencia:
. consenso de expertos;
. evaluación de la significancia de acuerdo con el esquema de calificación (Tabla 1).
Métodos utilizados para analizar la evidencia:
. revisiones de metanálisis publicados;
. revisiones sistemáticas con tablas de evidencia.
Descripción de los métodos utilizados para analizar la evidencia.
Al seleccionar publicaciones como posibles fuentes de evidencia, se revisa la metodología utilizada en cada estudio para asegurar su validez. El resultado del estudio influye en el nivel de evidencia asignado a la publicación, lo que a su vez afecta la fuerza de las recomendaciones que se derivan de ella.
El estudio metodológico se basa en varias preguntas clave que se centran en aquellas características del diseño del estudio que tienen un impacto significativo en la validez de los resultados y conclusiones. Estas preguntas clave pueden variar según los tipos de estudios y los cuestionarios utilizados para estandarizar el proceso de evaluación de publicaciones. Las recomendaciones utilizaron el cuestionario MERGE desarrollado por el Departamento de Salud de Nueva Gales del Sur. Este cuestionario está destinado a una evaluación y adaptación detallada de acuerdo con los requisitos de la Sociedad Respiratoria Rusa para mantener un equilibrio óptimo entre el rigor metodológico y la posibilidad de aplicación práctica.
El proceso de evaluación, por supuesto, puede verse afectado por el factor subjetivo. Para minimizar posibles errores, cada estudio fue evaluado de forma independiente, es decir, por al menos dos miembros independientes del grupo de trabajo. Cualquier diferencia en las evaluaciones ya fue discutida por todo el grupo. Si era imposible llegar a un consenso, se involucraba a un experto independiente.
Tablas de evidencia:
. las tablas de evidencia fueron llenadas por miembros del grupo de trabajo.
Métodos utilizados para formular recomendaciones:
. consenso de expertos.
Recomendaciones clave:
Al presentar el texto de las recomendaciones (Tabla 1).1 y 2).
2. Definición de enfermedad pulmonar obstructiva crónica (EPOC) y epidemiología
Definición:
La EPOC es una enfermedad caracterizada por una disfunción ventilatoria obstructiva parcialmente reversible que suele ser progresiva y se asocia a un aumento de la respuesta inflamatoria crónica de los pulmones ante la acción de partículas o gases patógenos. En algunos pacientes, las exacerbaciones y las comorbilidades pueden afectar la gravedad general de la EPOC.
Tradicionalmente, la EPOC combina bronquitis crónica y enfisema.
La bronquitis crónica suele definirse clínicamente como la presencia de tos con producción de esputo durante al menos 3 meses. durante los próximos 2 años. El enfisema se define morfológicamente como la presencia de dilatación permanente de las vías aéreas distales a los bronquiolos terminales, asociada a destrucción de las paredes alveolares, no asociada a fibrosis. En pacientes con EPOC, ambas condiciones están presentes con mayor frecuencia y es difícil distinguirlas clínicamente.
El concepto de EPOC no incluye el asma bronquial (AB) y otras enfermedades asociadas a la obstrucción bronquial poco reversible (fibrosis quística, bronquiectasias, bronquiolitis obliterante).
Epidemiología
Predominio
La EPOC es actualmente un problema mundial. En algunas partes del mundo, la prevalencia de la EPOC es muy alta (más del 20% en Chile), en otras es menor (alrededor del 6% en México). Las razones de esta variabilidad son las diferencias en la forma de vida de las personas, su comportamiento y el contacto con diversos agentes dañinos.
Uno de los estudios globales (el proyecto BOLD) brindó una oportunidad única para estimar la prevalencia de la EPOC utilizando cuestionarios estandarizados y pruebas de función pulmonar en poblaciones adultas mayores de 40 años tanto en países desarrollados como en vías de desarrollo. La prevalencia de la EPOC en estadio II y superior (GOLD 2008), según el estudio BOLD, entre las personas mayores de 40 años fue del 10,1±4,8%, incluidos los hombres - 11,8±7,9% y las mujeres - 8,5±5,8%. Según un estudio epidemiológico sobre la prevalencia de la EPOC en la región de Samara (residentes de 30 años o más), la prevalencia de la EPOC en la muestra total fue del 14,5% (entre hombres - 18,7%, entre mujeres - 11,2%). Según los resultados de otro estudio ruso realizado en la región de Irkutsk, la prevalencia de la EPOC en personas mayores de 18 años entre la población urbana fue del 3,1%, entre la población rural: 6,6%. La prevalencia de la EPOC aumentaba con la edad: en el grupo de edad de 50 a 69 años, el 10,1% de los hombres de la ciudad y el 22,6% de los del área rural padecían la enfermedad. Casi uno de cada dos hombres mayores de 70 años que viven en áreas rurales ha sido diagnosticado con EPOC.
Mortalidad
Según la OMS, la EPOC es actualmente la cuarta causa de muerte en el mundo. Alrededor de 2,75 millones de personas mueren cada año a causa de la EPOC, lo que representa el 4,8 % de todas las causas de muerte. En Europa, la mortalidad por EPOC varía considerablemente: de 0,2 por 100 mil habitantes en Grecia, Suecia, Islandia y Noruega a 80 por 100 mil en Ucrania y Rumania.
Entre 1990 y 2000, la mortalidad por enfermedad cardiovascular (ECV) en general y accidente cerebrovascular disminuyó un 19,9% y un 6,9%, respectivamente, mientras que la mortalidad por EPOC aumentó un 25,5%. Se observa un aumento particularmente pronunciado de la mortalidad por EPOC entre las mujeres.
Predictores de mortalidad en pacientes con EPOC son factores como la severidad de la obstrucción bronquial, el estado nutricional (índice de masa corporal (IMC)), la resistencia física según la prueba de caminata de 6 minutos y la severidad de la disnea, la frecuencia y severidad de las agudizaciones , hipertensión pulmonar.
Las principales causas de muerte en pacientes con EPOC son la insuficiencia respiratoria (FR), el cáncer de pulmón, las ECV y los tumores de otras localizaciones.
Importancia socioeconómica de la EPOC
En los países desarrollados, los costes económicos totales asociados a la EPOC, en la estructura de las enfermedades pulmonares, ocupan el 2º lugar tras el cáncer de pulmón y el 1º en costes directos, superando en 1,9 veces los costes directos de la AB. Los costes económicos por paciente asociados a la EPOC son 3 veces superiores a los de cada paciente con asma. Los pocos informes de costes médicos directos en la EPOC indican que más del 80% de los recursos materiales se destinan a la atención hospitalaria de los pacientes y menos del 20% a la atención ambulatoria. Se ha establecido que el 73% de los costos son para el 10% de los pacientes con un curso severo de la enfermedad. El mayor daño económico lo provoca el tratamiento de las agudizaciones de la EPOC. En Rusia, la carga económica de la EPOC, teniendo en cuenta los costos indirectos, incluido el ausentismo (ausentismo) y el presentismo (trabajo menos efectivo debido a la mala salud), es de 24,1 mil millones de rublos.
3. Cuadro clínico de la EPOC
En condiciones de exposición a factores de riesgo (tabaquismo, tanto activo como pasivo, contaminantes exógenos, combustibles bioorgánicos, etc.), la EPOC suele desarrollarse lentamente y progresar gradualmente. La peculiaridad del cuadro clínico es que durante mucho tiempo la enfermedad transcurre sin manifestaciones clínicas pronunciadas (3, 4; D).
Los primeros signos de que los pacientes buscan atención médica son tos, a menudo con producción de esputo y/o dificultad para respirar. Estos síntomas son más pronunciados por la mañana. Durante las estaciones frías, se producen "resfriados frecuentes". Este es el cuadro clínico del inicio de la enfermedad.
La tos crónica, generalmente el primer síntoma de la EPOC, a menudo es subestimada por pacientes y médicos, ya que se considera una consecuencia esperada del tabaquismo y/o la exposición a factores ambientales adversos. Por lo general, los pacientes producen una pequeña cantidad de esputo viscoso. Un aumento en la producción de tos y esputo ocurre con mayor frecuencia en los meses de invierno, durante las exacerbaciones infecciosas.
La dificultad para respirar es el síntoma más importante de la EPOC (4; D). A menudo sirve como motivo de búsqueda de ayuda médica y el principal motivo que limita la actividad laboral del paciente. El impacto en la salud de la disnea se evalúa mediante el cuestionario del British Medical Research Council (mMRC). Inicialmente, la dificultad para respirar se nota con un nivel relativamente alto de actividad física, por ejemplo, correr en terreno llano o caminar por las escaleras. A medida que avanza la enfermedad, la disnea empeora y puede limitar incluso la actividad diaria, y posteriormente se presenta en reposo, obligando al paciente a quedarse en casa (tabla 3). Además, la valoración de la disnea en la escala mMRC es una herramienta sensible para predecir la supervivencia de los pacientes con EPOC.
Al describir la clínica de la EPOC, es necesario tener en cuenta las características propias de esta enfermedad en particular: su inicio subclínico, la ausencia de síntomas específicos y la progresión constante de la enfermedad.
La gravedad de los síntomas varía según la fase del curso de la enfermedad (curso estable o exacerbación). Se debe considerar estable el estado en el que la gravedad de los síntomas no cambia significativamente durante semanas o incluso meses, y en este caso, la progresión de la enfermedad se puede detectar solo con un seguimiento dinámico a largo plazo (6-12 meses) de la paciente.
Las exacerbaciones de la enfermedad tienen un efecto especial en el cuadro clínico: deterioro recurrente de la condición (que dura al menos 2-3 días), acompañado de un aumento en la intensidad de los síntomas y trastornos funcionales. Durante una agudización, se produce un aumento de la gravedad de la hiperinsuflación y de los llamados "trampas de aire" en combinación con una disminución del flujo espiratorio, lo que conduce a un aumento de la disnea, que suele acompañarse de la aparición o intensificación de sibilancias a distancia, una sensación de presión en el pecho y disminución de la tolerancia al ejercicio. Además, hay un aumento en la intensidad de la tos, la cantidad de esputo, la naturaleza de su separación, el color y el cambio de viscosidad (aumento o disminución brusca). Al mismo tiempo, empeoran los indicadores de la función respiratoria externa (FR) y los gases sanguíneos: disminuyen los indicadores de velocidad (volumen espiratorio forzado en 1 s (FEV1), etc.), puede presentarse hipoxemia e incluso hipercapnia. Las exacerbaciones pueden comenzar gradualmente, gradualmente, o pueden caracterizarse por un rápido deterioro en la condición del paciente con el desarrollo de insuficiencia respiratoria aguda, con menos frecuencia insuficiencia ventricular derecha.
El curso de la EPOC es una alternancia de una fase estable y una exacerbación de la enfermedad, pero en diferentes personas se desarrolla de manera diferente. Sin embargo, la progresión de la EPOC es común, especialmente si el paciente continúa expuesto a partículas o gases patógenos inhalados. El cuadro clínico de la enfermedad también depende seriamente del fenotipo de la enfermedad y viceversa, el fenotipo determina las características de las manifestaciones clínicas de la EPOC. Durante muchos años, ha habido una división de los pacientes en fenotipos enfisematosos y bronquitis.
El tipo de bronquitis se caracteriza por un predominio de signos de bronquitis (tos, esputo). El enfisema en este caso es menos pronunciado. En el tipo enfisematoso, por el contrario, el enfisema es la principal manifestación patológica, la dificultad para respirar prevalece sobre la tos. Sin embargo, en la práctica clínica es muy raro distinguir el fenotipo enfisematoso o bronquitis de la EPOC en la forma denominada "pura" (sería más correcto hablar de un fenotipo predominantemente bronquitis o predominantemente enfisematoso de la enfermedad). Las características de los fenotipos se presentan con más detalle en la Tabla 4.
Si es imposible señalar el predominio de uno u otro fenotipo, se debe hablar de un fenotipo mixto. En entornos clínicos, los pacientes con un tipo mixto de enfermedad son más comunes.
Además de los anteriores, actualmente se distinguen otros fenotipos de la enfermedad. En primer lugar, esto se refiere al llamado fenotipo de superposición (combinación de EPOC y BA). Es necesario diferenciar cuidadosamente a los pacientes con EPOC y asma. Pero a pesar de las diferencias significativas en la inflamación crónica en estas enfermedades, en algunos pacientes la EPOC y el asma pueden estar presentes al mismo tiempo. Este fenotipo puede desarrollarse en fumadores con asma. Junto con esto, como resultado de estudios a gran escala, se demostró que alrededor del 20-30% de los pacientes con EPOC pueden tener una obstrucción bronquial reversible y los eosinófilos aparecen en la composición celular durante la inflamación. Algunos de estos pacientes también pueden atribuirse al fenotipo EPOC + BA. Estos pacientes responden bien a la terapia con corticosteroides.
Otro fenotipo que se ha discutido recientemente son los pacientes con exacerbaciones frecuentes (2 o más exacerbaciones por año o 1 o más exacerbaciones que resultan en hospitalización). La importancia de este fenotipo está determinada por el hecho de que el paciente emerge de una exacerbación con parámetros funcionales reducidos de los pulmones, y la frecuencia de las exacerbaciones afecta directamente la esperanza de vida de los pacientes, es necesario un enfoque individual del tratamiento. La identificación de muchos otros fenotipos requiere mayor aclaración. Varios estudios recientes han llamado la atención sobre las diferencias en las manifestaciones clínicas de la EPOC entre hombres y mujeres. Al final resultó que, las mujeres se caracterizan por una hiperreactividad más pronunciada del tracto respiratorio, notan una dificultad para respirar más pronunciada a los mismos niveles de obstrucción bronquial que en los hombres, etc. Con los mismos indicadores funcionales, la oxigenación en las mujeres es mejor que en hombres. Sin embargo, las mujeres son más propensas a desarrollar exacerbaciones, demuestran un menor efecto del entrenamiento físico en los programas de rehabilitación y califican su calidad de vida (CdV) más baja según los cuestionarios estándar.
Es bien sabido que los pacientes con EPOC presentan numerosas manifestaciones extrapulmonares de la enfermedad debido al efecto sistémico de la inflamación crónica inherente a la EPOC. En primer lugar, esto se refiere a la disfunción de los músculos esqueléticos periféricos, lo que contribuye significativamente a la disminución de la tolerancia al ejercicio. La inflamación crónica persistente juega un papel importante en el daño del endotelio vascular y el desarrollo de aterosclerosis en pacientes con EPOC, lo que a su vez contribuye al crecimiento de ECV (hipertensión arterial (HA), enfermedad coronaria (CHD), infarto agudo de miocardio ( IAM), insuficiencia cardiaca (IC) ) en pacientes con EPOC y aumenta el riesgo de mortalidad. Los cambios en el estado nutricional se manifiestan claramente. A su vez, un estado nutricional reducido puede servir como factor de riesgo independiente para la muerte de los pacientes. La inflamación sistémica también contribuye al desarrollo de la osteoporosis. Los pacientes con EPOC tienen signos de osteoporosis más pronunciados en comparación con los mismos grupos de edad de personas sin EPOC. Recientemente, se ha prestado atención al hecho de que, además de la policitemia, se produce anemia en el 10-20% de los pacientes con EPOC. Su causa no se comprende por completo, pero hay razones para creer que es el resultado de un efecto sistémico de la inflamación crónica en la EPOC.
Un impacto significativo en el cuadro clínico de la enfermedad lo ejercen los trastornos neuropsiquiátricos, que se manifiestan por pérdida de memoria, depresión, aparición de "miedos" y trastornos del sueño.
Los pacientes con EPOC se caracterizan por el desarrollo frecuente de comorbilidades que se dan en pacientes de edad avanzada, independientemente de su presencia de EPOC, pero si está presente, es más probable (CC, hipertensión, aterosclerosis de los vasos de las extremidades inferiores, etc.). Otro comorbilidades(diabetes mellitus (DM), enfermedad por reflujo gastroesofágico, adenoma de próstata, artritis) pueden coexistir con la EPOC porque forman parte del proceso de envejecimiento y también tienen un impacto significativo en el cuadro clínico del paciente con EPOC.
En el proceso de natural desarrollo de la EPOC el cuadro clínico puede cambiar teniendo en cuenta las complicaciones emergentes de la enfermedad: neumonía, neumotórax, ND aguda (ARN), embolismo pulmonar (EP), bronquiectasias, hemorragia pulmonar, desarrollo de cor pulmonale y su descompensación con falla circulatoria severa.
Resumiendo la descripción del cuadro clínico, se debe enfatizar que la gravedad de las manifestaciones clínicas de la enfermedad depende de muchos de los factores anteriores. Todo ello, junto con la intensidad de exposición a los factores de riesgo, el ritmo de progresión de la enfermedad crea la aparición del paciente en diferentes periodos de su vida.
4. Principios del diagnóstico
Para el diagnóstico correcto de la EPOC, es necesario, en primer lugar, confiar en las disposiciones clave (básicas) que surgen de la definición de la enfermedad. El diagnóstico de EPOC debe considerarse en todos los pacientes con tos, producción de esputo o disnea y se identifican los factores de riesgo de EPOC. EN vida real en las primeras etapas de la enfermedad, el fumador no se considera enfermo, porque evalúa la tos como Condicion normal, Si actividad laboral aún no se ha roto. Incluso la aparición de dificultad para respirar que ocurre durante el esfuerzo físico es considerada por él como resultado de la vejez o el desentrenamiento.
El factor anamnésico clave que ayuda a establecer el diagnóstico de la EPOC es el establecimiento del hecho de la exposición por inhalación a los órganos respiratorios de agentes patógenos, principalmente humo de tabaco. Al evaluar el estado de fumador, siempre se indica el índice de persona fumadora (paquetes-año). Al recopilar una anamnesis, también se debe prestar mucha atención a la identificación de episodios de tabaquismo pasivo. Esto se aplica a todos los grupos de edad, incluida la exposición al humo de tabaco fetal en el útero como resultado del tabaquismo de la propia mujer embarazada o de quienes la rodean. Las exposiciones ocupacionales por inhalación, junto con el tabaquismo, se consideran factores que contribuyen a la aparición de la EPOC. Preocupa diversas formas la contaminación del aire en el lugar de trabajo, incluidos los gases y aerosoles, y la exposición al humo de los combustibles fósiles.
Así, el diagnóstico de la EPOC debe incluir las siguientes áreas:
- identificación de factores de riesgo;
- objetivación de síntomas de obstrucción;
- monitorización de la función respiratoria de los pulmones.
De ello se deduce que el diagnóstico de la EPOC se basa en el análisis de una serie de etapas:
- creación de un retrato verbal del paciente sobre la base de la información obtenida de una conversación con él (recopilación cuidadosa de anamnesis);
- examen (físico) objetivo;
- resultados de estudios de laboratorio e instrumentales. El diagnóstico de EPOC siempre debe ser confirmado por espirometría. Valores de FEV1 postbroncodilatación/capacidad vital forzada (FVC)<70% - обязательный признак ХОБЛ, который существует на всех стадиях заболевания.
Debido a que la EPOC no tiene manifestaciones específicas y el criterio diagnóstico es un indicador espirométrico, la enfermedad puede permanecer sin diagnosticar durante mucho tiempo. El problema del infradiagnóstico también está relacionado con el hecho de que muchas personas con EPOC no se sienten enfermas debido a la falta de dificultad para respirar en una determinada etapa del desarrollo de la enfermedad y no caen en el campo de visión del médico. De ello se deduce que, en la gran mayoría de los casos, la EPOC se diagnostica en las etapas incapacitantes de la enfermedad.
Una conversación detallada con cada paciente fumador contribuirá a la detección temprana de la enfermedad, ya que con un interrogatorio activo y la ausencia de quejas, se pueden identificar signos característicos del desarrollo de inflamación crónica en el árbol bronquial, principalmente tos.
Durante la conversación con el paciente, puede utilizar el cuestionario para el diagnóstico de la EPOC* (Tabla 5).
En el proceso de formación de cambios irreversibles en el árbol bronquial y el parénquima pulmonar, aparece dificultad para respirar (en una conversación con el paciente, es necesario evaluar su gravedad, conexión con la actividad física, etc.).
En las primeras etapas de la enfermedad (si por alguna razón el paciente en este momento aún llama la atención del médico), el examen no revela anomalías características de la EPOC, pero la ausencia de síntomas clínicos no excluye su presencia. Con un aumento del enfisema y un componente irreversible de la obstrucción bronquial, la exhalación puede ocurrir a través de los labios bien cerrados o doblados, lo que indica un colapso espiratorio pronunciado de los bronquios pequeños y ralentiza el flujo de aire exhalado, lo que alivia la condición de los pacientes. Otros signos de hiperinflación pueden ser un tórax en forma de barril, una dirección horizontal de las costillas, una disminución del embotamiento cardíaco.
La inclusión de los músculos Scalenae y Sternocleidomastoideus en el acto de respirar es un indicador de un mayor agravamiento de la violación de la mecánica de la respiración y un aumento en la carga sobre el aparato respiratorio. Otro signo puede ser el movimiento paradójico de la pared anterior de la cavidad abdominal: su retracción durante la inspiración, lo que indica fatiga del diafragma. El aplanamiento del diafragma conduce a la retracción de las costillas inferiores durante la inspiración (signo de Hoover) y al ensanchamiento del ángulo cifoesternal. Con la fatiga de los músculos respiratorios, a menudo se produce hipercapnia, lo que requiere una evaluación adecuada.
Durante el examen físico de los pacientes, es posible objetivar la presencia de obstrucción bronquial al escuchar estertores sibilantes secos, y durante la percusión, un sonido de percusión encajonado confirma la presencia de hiperinsuflación.
De los métodos de diagnóstico de laboratorio, los estudios obligatorios incluyen un análisis de sangre clínico y un examen citológico de esputo. Con enfisema severo y un paciente joven, se debe determinar α1-antitripsina. Con una exacerbación de la enfermedad, la leucocitosis neutrofílica con un cambio punzante y un aumento en la VSG son los más comunes. La presencia de leucocitosis sirve como argumento adicional a favor de un factor infeccioso como causa de la exacerbación de la EPOC. Se pueden detectar tanto la anemia (resultado de un síndrome inflamatorio general) como la policitemia. Síndrome policitémico (aumento del número de glóbulos rojos, nivel alto de hemoglobina -
>16 g/dl en mujeres y >18 g/dl en hombres, un aumento del hematocrito >47% en mujeres y >52% en hombres) puede indicar la existencia de hipoxemia grave y prolongada.
El examen citológico del esputo proporciona información sobre la naturaleza proceso inflamatorio y el grado de su expresión. La determinación de células atípicas aumenta el estado de alerta oncológico y requiere el uso de métodos de examen adicionales.
Cultural investigación microbiológica Es recomendable realizar esputo con progresión incontrolada del proceso infeccioso y usarlo para la selección de una terapia antibiótica racional. Con el mismo propósito, examen bacteriológico contenido bronquial obtenido por broncoscopia.
Se debe realizar una radiografía de tórax en todos los pacientes con sospecha diagnóstica de EPOC. Este método no es una herramienta sensible para hacer un diagnóstico, pero permite excluir otras enfermedades acompañadas de síntomas clínicos similares (tumor, tuberculosis, insuficiencia cardíaca congestiva, etc.) y en el período de exacerbación: detectar neumonía, derrame pleural , neumotórax espontáneo, etc. Además, se pueden detectar los siguientes signos radiológicos de obstrucción bronquial: aplanamiento de la cúpula y limitación de la movilidad del diafragma en movimientos respiratorios, cambio en el tamaño anteroposterior de la cavidad torácica, expansión del espacio retroesternal, ubicación vertical del corazón.
El examen broncoscópico sirve como un método adicional para diagnosticar la EPOC para excluir otras enfermedades y condiciones que ocurren con síntomas similares.
Se realizan electrocardiografía y ecocardiografía para excluir el origen cardíaco de los síntomas respiratorios e identificar signos de hipertrofia del corazón derecho.
Todos los pacientes con sospecha de EPOC deben realizarse una espirometría.
5. Pruebas de diagnóstico funcional
seguimiento del curso de la EPOC
La espirometría es el método principal para diagnosticar y documentar los cambios en la función pulmonar en la EPOC. A partir de los indicadores de la espirometría se construyó una clasificación de la EPOC según la gravedad de los trastornos obstructivos de la ventilación. Le permite excluir otras enfermedades con síntomas similares.
La espirometría es el estudio inicial preferido para evaluar la presencia y la gravedad de la obstrucción de las vías respiratorias.
Metodología
. Existen varias recomendaciones para el uso de la espirometría como método de diagnóstico y determinación de la gravedad de la enfermedad pulmonar obstructiva.
. El estudio de la función pulmonar por el método de la espirometría forzada puede considerarse finalizado si se obtienen 3 maniobras respiratorias técnicamente aceptables. Al mismo tiempo, los resultados deben ser reproducibles: los indicadores FVC máximo y siguiente, así como los indicadores FEV1 máximo y siguiente, no deben diferir en más de 150 ml. En los casos en que el valor de FVC no exceda los 1000 ml, la diferencia máxima permitida tanto en FVC como en FEV1 no debe exceder los 100 ml.
. Si no se obtienen resultados reproducibles después de 3 intentos, las maniobras de respiración deben continuarse hasta los 8 intentos. Más maniobras de respiración pueden causar fatiga al paciente y, en casos raros, una disminución del FEV1 o FVC.
. Si los valores caen en más del 20% del valor inicial como resultado de maniobras forzadas repetidas, se deben detener las pruebas adicionales en aras de la seguridad del paciente, y la dinámica de los indicadores debe reflejarse en el informe. El informe debe presentar resultados gráficos y valores numéricos de al menos 3 mejores intentos.
. Los resultados de intentos técnicamente aceptables pero no reproducibles se pueden utilizar para escribir una conclusión que indique que no son reproducibles.
Manifestaciones espirométricas de la EPOC
Durante la espirometría, la EPOC se manifiesta por la limitación del flujo de aire espiratorio debido al aumento de la resistencia de las vías respiratorias (fig. 1).
Los trastornos de la ventilación de tipo obstructivo se caracterizan por una disminución de la relación FEV1/FVC<0,7.
Hay una depresión de la parte espiratoria de la curva de flujo-volumen y su codo descendente adopta una forma cóncava. La pérdida de linealidad en la mitad inferior de la curva flujo-volumen es un rasgo característico de los trastornos de la ventilación obstructiva, incluso cuando la relación FEV1/FVC es >0,7. La gravedad de los cambios depende de la gravedad de los trastornos obstructivos.
Con la progresión de la obstrucción bronquial, hay una mayor disminución del flujo espiratorio, un aumento de las "trampas de aire" e hiperinflación de los pulmones, lo que conduce a una disminución de la FVC. Para descartar trastornos mixtos obstructivos-restrictivos, es necesario medir la capacidad pulmonar total (TLC) mediante pletismografía corporal.
Para evaluar la gravedad del enfisema, se deben examinar REL y DSL de difusión.
Prueba de reversibilidad (prueba de broncodilatación)
Si se registran signos de obstrucción bronquial durante el estudio de espirometría inicial, es recomendable realizar una prueba de reversibilidad (prueba broncodilatadora) para determinar el grado de reversibilidad de la obstrucción bajo la influencia de fármacos broncodilatadores.
Para estudiar la reversibilidad de la obstrucción se realizan pruebas con broncodilatadores inhalados, se valora su efecto sobre el FEV1. No se recomiendan otros indicadores de la curva de flujo-volumen, que se derivan y calculan principalmente a partir de la FVC.
Metodología
. Al realizar la prueba, se recomienda utilizar broncodilatadores de acción corta en la dosis única máxima:
- para agonistas β2 - salbutamol 400 mcg;
- para fármacos anticolinérgicos - bromuro de ipratropio 160 mcg.
. En algunos casos, es posible utilizar una combinación de anticolinérgicos y agonistas β2 acción corta a las dosis indicadas. Los inhaladores de aerosol de dosis medida deben usarse con un espaciador.
. El estudio espirométrico repetido debe realizarse después de 15 minutos. después de la inhalación
agonistas β2 o después de 30-45 minutos. después de la inhalación de fármacos anticolinérgicos o su combinación con
agonistas β2.
Criterios para una respuesta positiva
Una prueba de broncodilatación se considera positiva si, después de la inhalación de un broncodilatador, el coeficiente de broncodilatación (CBD) alcanza o supera el 12% y el aumento absoluto es de 200 ml o más:
CBD \u003d (FEV1 después (ml) - FEV1 ref (ml) / FEV1 ref. (ml)) x 100%
Aumento absoluto (ml) = FEV1 después (ml) - FEV1 ref. (ml)
donde FEV1 ref. - el valor del indicador espirométrico antes de la inhalación del broncodilatador, FEV1 después - el valor del indicador después de la inhalación del broncodilatador.
Para concluir una prueba broncodilatadora positiva, se deben cumplir ambos criterios.
Al evaluar una prueba de broncodilatación, es importante tener en cuenta las reacciones adversas de del sistema cardiovascular: taquicardia, arritmia, aumento de la tensión arterial, así como la aparición de síntomas como agitación o temblor.
La variabilidad técnica de los resultados de la espirometría se puede minimizar con la calibración regular del equipo, la instrucción cuidadosa del paciente y la capacitación del personal.
valores propios
Los valores adecuados dependen de parámetros antropométricos, principalmente altura, sexo, edad, raza. Sin embargo, también se debe tener en cuenta la variación individual. Entonces, en personas con indicadores de referencia por encima del nivel promedio, con el desarrollo de patología pulmonar, estos indicadores disminuirán en relación con los iniciales, pero aún pueden permanecer dentro de la norma de la población.
Seguimiento (estudios en serie)
El monitoreo de los indicadores espirométricos (FEV1 y FVC) refleja de manera confiable la dinámica de cambios en la función pulmonar durante el seguimiento a largo plazo, sin embargo, es necesario tener en cuenta la posibilidad de variabilidad técnica y biológica de los resultados.
En individuos sanos, los cambios en FVC y FEV1 se consideran clínicamente significativos si la diferencia supera el 5% durante estudios repetidos dentro de 1 día y el 12% dentro de varias semanas.
Un aumento en la tasa de disminución de la función pulmonar (más de 40 ml/año) no es un signo obligatorio de EPOC. Además, no se puede confirmar individualmente, ya que el nivel aceptable de variabilidad del FEV1 dentro de un estudio supera significativamente este valor y es de 150 ml.
Monitoreo del flujo espiratorio máximo (PEF)
PSV se utiliza para excluir el aumento de la variabilidad diaria en los indicadores, más característicos del asma y la respuesta a la terapia con medicamentos.
Registrado mejor indicador después de 3 intentos de realizar una maniobra forzada con una pausa no superior a 2 s después de la inspiración. La maniobra se realiza sentado o de pie. Se toman más medidas si la diferencia entre los 2 valores máximos de PSV supera los 40 l/min.
El PEF se usa para estimar la variabilidad del flujo de aire a través de múltiples mediciones tomadas durante al menos 2 semanas. Se puede registrar una mayor variabilidad con mediciones dobles en 1 día. Las mediciones más frecuentes mejoran la estimación. En este caso, se logra un aumento en la precisión de la medición en particular en pacientes con cumplimiento reducido.
La variabilidad del PSV se calcula mejor como la diferencia entre los valores máximo y mínimo como porcentaje del PSV diario promedio o máximo.
El límite superior de los valores normales para la variabilidad del indicador máximo es de aproximadamente el 20 % cuando se realizan 4 o más mediciones en 1 día. Sin embargo, puede ser menor cuando se utilizan medidas dobles.
La variabilidad del PSV puede aumentar en enfermedades con las que la EA se diferencia con mayor frecuencia. Por lo tanto, en la práctica clínica, existe un menor nivel de especificidad para el aumento de la variabilidad en PSV que en los estudios de población.
Los valores de PEF deben interpretarse teniendo en cuenta la situación clínica. El estudio PSV es aplicable únicamente para el seguimiento de pacientes con diagnóstico ya establecido de EPOC.
6. Diagnóstico diferencial de la EPOC
La tarea principal del diagnóstico diferencial de la EPOC es la exclusión de enfermedades con síntomas similares. A pesar de las diferencias bastante definidas entre la AB y la EPOC en los mecanismos de desarrollo, manifestaciones clínicas y principios de prevención y tratamiento, estas 2 enfermedades tienen algunas características comunes. Además, también es posible una combinación de estas enfermedades en una persona.
El diagnóstico diferencial de AB y EPOC se basa en la integración de datos clínicos básicos, los resultados de pruebas funcionales y de laboratorio. Las características de la inflamación en la EPOC y BA se muestran en la Figura 2.
Los principales puntos de entrada para el diagnóstico diferencial de estas enfermedades se dan en la Tabla 6.
En ciertas etapas de desarrollo de la EPOC, especialmente en la primera reunión con el paciente, se hace necesario diferenciarla de una serie de enfermedades con síntomas similares. Sus principales características distintivas se muestran en la Tabla 7.
El diagnóstico diferencial en diferentes etapas del desarrollo de la EPOC tiene sus propias características. En la EPOC leve lo principal es identificar diferencias con otras enfermedades asociadas a factores de agresión ambiental que se presentan de forma subclínica o con pocos síntomas. En primer lugar, esto se aplica a varias opciones. bronquitis crónica. La dificultad surge a la hora de realizar diagnóstico diferencial en pacientes con EPOC grave. Está determinado no solo por la gravedad de la condición del paciente, la gravedad de los cambios irreversibles, sino también por un gran conjunto de enfermedades concomitantes (CI, hipertensión, enfermedades metabólicas, etc.).
7. Clasificación moderna de la EPOC.
Evaluación integral de la gravedad del curso de la enfermedad.
La clasificación de la EPOC (Tabla 8) en los últimos años se basó en indicadores del estado funcional de los pulmones, en base a los valores posbroncodilatadores de FEV1, y en ella se distinguían 4 estadios de la enfermedad.
El Comité de Expertos del programa GOLD 2011 abandonó el uso del término “estadios”, ya que este indicador se basa únicamente en el valor de FEV1 y no era adecuado para caracterizar la gravedad de la enfermedad. Estudios recientes han demostrado que la estadificación no está disponible en todos los casos de la enfermedad. No hay evidencia de la existencia real de las etapas de la EPOC (la transición de una etapa a otra con la terapia moderna). Al mismo tiempo, los valores de FEV1 siguen siendo relevantes, ya que reflejan el grado (de leve - estadio I, respectivamente, a extremadamente grave - estadio IV) de la gravedad de la limitación del flujo aéreo. Se utilizan en una evaluación integral de la gravedad de los pacientes con EPOC.
En la revisión del documento GOLD en 2011, se propuso nueva clasificación, basado en una valoración integral de la gravedad de los pacientes con EPOC. Tiene en cuenta no solo la gravedad de la obstrucción bronquial (el grado de alteración de la permeabilidad bronquial) según los resultados de un estudio de espirometría, sino también los datos clínicos del paciente: el número de exacerbaciones de la EPOC al año y la gravedad de los síntomas clínicos. según los resultados de mMRC (Tabla 3) y COPD Assessment Test (CAT) (Tabla 9).
Se sabe que el "estándar de oro" para evaluar el impacto de los síntomas en la CV son los resultados del St. George's Hospital Respiratory Questionnaire (SGRQ), su escala de "síntomas". En la práctica clínica, la prueba de evaluación CAT ha encontrado un uso más amplio y, más recientemente, el Cuestionario Clínico de la EPOC (CCQ).
En GOLD 2013 se amplió más la evaluación de los síntomas debido al uso de la escala CCQ, que permite objetivar los síntomas tanto de 1 día como de la última semana y darles una característica no solo cualitativa, sino también clínica ( Tabla 10).
La puntuación final se calcula a partir de la suma de las puntuaciones obtenidas al contestar todas las preguntas, y se divide por 10. Con su valor<1 симптомы оцениваются как невыраженные, а при ≥1 - выраженные, т. е. оказывающие влияние на жизнь пациента. Вместе с тем еще окончательно не установлены значения CCQ, соответствующие выраженному влиянию симптомов на КЖ, эквивалентные значениям SGRQ. Пограничными значениями отличия выраженных от невыраженных симптомов предлагаются значения 1,0-1,5 (GOLD 2014).
La clasificación de la EPOC basada en las recomendaciones del programa GOLD se presenta en la tabla 11.
A la hora de valorar el grado de riesgo, se recomienda seleccionar el mayor grado según la limitación al flujo aéreo GOLD o antecedentes de agudizaciones.
En la nueva edición de GOLD 2013, se agregó una disposición de que si un paciente tuvo al menos una exacerbación en el año anterior que condujo a la hospitalización (es decir, una exacerbación grave), el paciente debe clasificarse como de alto riesgo.
Así, una valoración integral del impacto de la EPOC en un paciente concreto combina la valoración de los síntomas con la clasificación espirométrica con la valoración del riesgo de agudizaciones.
Con lo anterior en mente, un diagnóstico de EPOC podría verse así:
“Enfermedad pulmonar obstructiva crónica…” seguida de una evaluación de:
- gravedad (I-IV) de la obstrucción bronquial;
- gravedad de los síntomas clínicos: grave (CAT ≥10, mMRC ≥2, CCQ ≥1), no expresada (CAT<10, mMRC <2, CCQ <1);
- frecuencia de las exacerbaciones: raras (0-1), frecuentes (≥2);
- fenotipo EPOC (si es posible);
- enfermedades concomitantes.
El papel de las enfermedades concomitantes es extremadamente importante en la evaluación de la gravedad de la EPOC, sin embargo, incluso en la última recomendación GOLD de 2013, no encontró un lugar digno en la clasificación anterior.
8. Tratamiento de la EPOC estable
El objetivo principal del tratamiento es prevenir la progresión de la enfermedad. Los objetivos del tratamiento se describen en la Tabla 12.
Las principales direcciones de tratamiento:
I. Efectos no farmacológicos:
- reducir la influencia de los factores de riesgo;
- programas educativos.
Los métodos no farmacológicos de exposición se presentan en la tabla 13.
En pacientes con enfermedad grave (GOLD 2-4), se debe utilizar la rehabilitación pulmonar como medida necesaria.
II. Tratamiento médico
La elección del volumen de la terapia farmacológica se basa en la gravedad de los síntomas clínicos, el valor del FEV1 posbroncodilatador y la frecuencia de las exacerbaciones de la enfermedad (Tablas 14, 15).
Esquemas de terapia farmacológica para pacientes con EPOC, compilados teniendo en cuenta una evaluación integral de la gravedad de la EPOC (la frecuencia de las exacerbaciones de la enfermedad, la gravedad de los síntomas clínicos, la etapa de la EPOC, determinada por el grado de alteración de la permeabilidad bronquial) , se dan en la Tabla 16.
Otros tratamientos incluyen oxigenoterapia, soporte respiratorio y tratamiento quirúrgico.
Terapia de oxigeno
Se encontró que la administración prolongada de oxígeno (O2) (>15 h/día) aumenta la supervivencia en pacientes con ND crónica e hipoxemia severa en reposo (B, 2++).
soporte respiratorio
La ventilación no invasiva (VNI) se utiliza ampliamente en pacientes con EPOC extremadamente grave de curso estable.
La combinación de VNI con oxigenoterapia a largo plazo puede ser eficaz en pacientes seleccionados, especialmente en presencia de hipercapnia manifiesta durante el día.
Cirugía
Cirugía de reducción de volumen pulmonar (LUL)
RULA se realiza extirpando parte del pulmón para reducir la hiperinflación y lograr un bombeo más eficiente de los músculos respiratorios. Su uso se realiza en pacientes con enfisema del lóbulo superior y baja tolerancia al ejercicio.
Trasplante de pulmón
El trasplante de pulmón puede mejorar la calidad de vida y el rendimiento funcional en pacientes cuidadosamente seleccionados con EPOC muy grave. Los criterios de selección son FEV1<25% от должной величины, РаО2 <55 мм рт. ст., РаСО2 >50 mm Hg Arte. al respirar aire ambiente e hipertensión pulmonar (Pra > 40 mm Hg).
9. Exacerbación de la EPOC
Definición y significado de las agudizaciones de la EPOC
El desarrollo de exacerbaciones es un rasgo característico del curso de la EPOC. Tal como lo define GOLD (2013): “Una exacerbación de la EPOC es un evento agudo caracterizado por un empeoramiento de los síntomas respiratorios que va más allá de sus fluctuaciones diarias normales y conduce a un cambio en el régimen de la terapia utilizada”.
La exacerbación de la EPOC es una de las razones más comunes por las que los pacientes buscan atención médica de emergencia. El desarrollo frecuente de exacerbaciones en pacientes con EPOC conduce a un deterioro a largo plazo (hasta varias semanas) de la función respiratoria y del intercambio gaseoso, una progresión más rápida de la enfermedad, una disminución significativa de la calidad de vida de los pacientes y se asocia con costos económicos significativos para el tratamiento. Además, las exacerbaciones de la EPOC conducen a la descompensación de enfermedades crónicas concomitantes. Las exacerbaciones graves de la EPOC son la principal causa de muerte en los pacientes. En los primeros 5 días desde el inicio de las agudizaciones, el riesgo de desarrollar IAM aumenta en más de 2 veces.
Clasificación de las exacerbaciones de la EPOC
Una de las clasificaciones de gravedad de las exacerbaciones de la EPOC más conocidas, propuesta por el grupo de trabajo sobre exacerbaciones de la EPOC, se presenta en la Tabla 17.
Steer et al. desarrollaron una nueva escala para evaluar el pronóstico de los pacientes con agudización de la EPOC ingresados en el hospital. Se identificaron los 5 predictores más potentes de desenlace letal: 1) la gravedad de la disnea en la escala eMRCD; 2) eosinopenia en sangre periférica (<0,05 клеток x109/л); 3) признаки консолидации паренхимы легких по данным рентгенографии грудной клетки; 4) ацидоз крови (pH <7,3) и 5) мерцательная аритмия. Перечисленные признаки были объединены в шкалу DECAF (по аббревиатуре первых букв в английской транскрипции) (табл. 17).
Esta escala ha demostrado una excelente capacidad discriminatoria para predecir la muerte durante una exacerbación de la EPOC.
Causas de las exacerbaciones
Las causas más comunes de las exacerbaciones de la EPOC son las infecciones respiratorias bacterianas y virales y los contaminantes del aire, pero no se pueden determinar las causas de aproximadamente el 20-30% de los casos de exacerbaciones.
Entre las bacterias en la exacerbación de la EPOC, Haemophilus influenzae no tipificable, Streptococcus pneumoniae y Moraxella catarrhalis juegan el papel más importante. Los estudios en los que participaron pacientes con exacerbaciones graves de la EPOC han demostrado que las enterobacterias gramnegativas y Pseudomonas aeruginosa pueden ser más comunes en dichos pacientes (Tabla 18).
Los rinovirus son una de las causas más comunes de infecciones virales respiratorias agudas y pueden ser una causa importante de exacerbaciones de la EPOC. Se observa que las exacerbaciones de la EPOC se desarrollan con mayor frecuencia en los meses de otoño-invierno. El aumento en el número de exacerbaciones de la EPOC puede estar asociado con un aumento en la prevalencia de infecciones virales respiratorias en los meses de invierno y un aumento en la sensibilidad del epitelio del tracto respiratorio superior a las mismas en la estación fría.
Las condiciones que pueden parecerse y/o exacerbar las exacerbaciones incluyen neumonía, EP, insuficiencia cardíaca congestiva, arritmias, neumotórax y derrame pleural. Estas condiciones deben diferenciarse de las exacerbaciones y, si están presentes, se debe realizar el tratamiento adecuado.
10. Tratamiento de la exacerbación de la EPOC
Las tácticas de manejo de pacientes con EPOC con diversos grados de gravedad de exacerbación se presentan en la Tabla 19.
Broncodilatadores inhalados
El nombramiento de broncodilatadores inhalados es uno de los eslabones principales en el tratamiento de las agudizaciones de la EPOC (A, 1++). Tradicionalmente, a los pacientes con exacerbaciones de la EPOC se les prescriben agonistas β2 de acción rápida (salbutamol, fenoterol) o anticolinérgicos de acción rápida (bromuro de ipratropio). La eficacia de los agonistas β2 y el bromuro de ipratropio en las exacerbaciones de la EPOC es aproximadamente la misma (B, 2++), la ventaja de los agonistas β2 es un inicio de acción más rápido y los fármacos anticolinérgicos: alta seguridad y buena tolerabilidad. Hoy en día, muchos expertos consideran que la terapia combinada de agonista β2/bromuro de ipratropio es la estrategia óptima para el tratamiento de las exacerbaciones de la EPOC (B, 2++), especialmente en el tratamiento de pacientes con EPOC con exacerbaciones graves.
GKS
Según los estudios clínicos sobre exacerbaciones de la EPOC que requieren hospitalización, los corticosteroides sistémicos reducen el tiempo de inicio de la remisión, mejoran la función pulmonar (FEV1) y reducen la hipoxemia (PaO2), y también pueden reducir el riesgo de recaída temprana y fracaso del tratamiento, reducir la duración de estancia en el hospital (A, 1+). Por lo general, se recomienda un ciclo de prednisolona oral de 30 a 40 mg/día durante 5 a 14 días (B, 2++). Según datos recientes, los pacientes con exacerbación de la EPOC y eosinofilia en sangre >2% tienen la mejor respuesta a los corticoides sistémicos (C, 2+).
Una alternativa más segura a los corticoides sistémicos en las exacerbaciones de la EPOC son los corticoides inhalados, especialmente los nebulizados (B, 2++).
Terapia antibacteriana (ABT)
Dado que las bacterias son la causa de lejos de todas las exacerbaciones de la EPOC (50%), es importante determinar las indicaciones para prescribir ABT en el desarrollo de las exacerbaciones. Las guías actuales recomiendan antibióticos para pacientes con las exacerbaciones más graves de la EPOC, como aquellos con exacerbaciones de Anthonisen tipo I (es decir, si hay aumento de la disnea, aumento del volumen de esputo y grado de purulencia) o tipo II (presencia de 2 de los 3 signos enumerados). ) (B, 2++). En pacientes con escenarios similares de exacerbación de la EPOC, los antibióticos son más efectivos, ya que la causa de tales exacerbaciones es una infección bacteriana. También se recomiendan antibióticos para pacientes con exacerbaciones graves de la EPOC que requieren VNI o invasiva (D, 3). El uso de biomarcadores como la proteína C reactiva (PCR) ayuda a mejorar el diagnóstico y manejo de los pacientes con exacerbaciones de la EPOC (C, 2+). Un aumento de los niveles de PCR ≥15 mg/l durante la exacerbación de la EPOC es un signo sensible de una infección bacteriana.
La elección de los antibióticos más apropiados para tratar una exacerbación de la EPOC depende de muchos factores, como la gravedad de la EPOC, los factores de riesgo de un resultado adverso del tratamiento (p. ej., edad avanzada, valores bajos de FEV1, exacerbaciones frecuentes previas y comorbilidades de antibióticos anteriores). terapia (D, 3)).
En las exacerbaciones leves y moderadas de la EPOC sin factores de riesgo, se recomienda el nombramiento de macrólidos modernos (azitromicina, claritromicina), cefalosporinas (cefixima, etc.) (Tabla 18). Se recomienda amoxicilina/clavulanato o fluoroquinolonas respiratorias (levofloxacina o moxifloxacina) como agentes de primera línea para pacientes con exacerbaciones graves de la EPOC y factores de riesgo (B, 2++). En alto riesgo de infección por P. aeruginosa, ciprofloxacino y otros fármacos con actividad antipseudomónica (B, 2++).
Terapia de oxigeno
La hipoxemia supone una amenaza real para la vida del paciente, por lo que la oxigenoterapia es una prioridad en el tratamiento de la IRA en el contexto de la EPOC (B, 2++). El objetivo de la oxigenoterapia es lograr una PaO2 en el rango de 55-65 mm Hg. Arte. y SaO2 88-92%. En la IRA en pacientes con EPOC, las cánulas nasales o una máscara de Venturi se utilizan con mayor frecuencia para administrar O2. Cuando se administra O2 a través de una cánula, un flujo de O2 de 1 a 2 l/min es suficiente para la mayoría de los pacientes (D, 3). La máscara de Venturi se considera el método preferido de suministro de O2, ya que permite proporcionar valores bastante precisos de la fracción de O2 en la mezcla inhalada (FiO2), independientemente de la ventilación minuto y el flujo inspiratorio del paciente. En promedio, la oxigenoterapia con FiO2 al 24 % aumenta la PaO2 en 10 mm Hg. Art., y con FiO2 28% - por 20 mm Hg. Arte. Después de iniciar o cambiar el régimen de oxigenoterapia dentro de los próximos 30-60 minutos. se recomienda una gasometría arterial para monitorizar la PaCO2 y el pH (D, 3).
NVL
NVL: conducción de beneficios de ventilación sin establecer vías respiratorias artificiales. El desarrollo de esta nueva línea de soporte respiratorio permite descargar de forma segura y eficaz los músculos respiratorios, restablecer el intercambio gaseoso y reducir la disnea en pacientes con IRA. Durante la VNI, la relación entre el paciente y el respirador se realiza mediante mascarillas nasales o faciales (menos frecuentemente cascos y boquillas), el paciente está consciente, por lo general, no se requiere el uso de sedantes y relajantes musculares. Otra ventaja importante de la VNI es la posibilidad de su rápida terminación, así como su inmediata reanudación, en caso de ser necesario. A continuación se indican las indicaciones y contraindicaciones de la VNI.
Los criterios de inclusión de la VNI para la IRA en el contexto de la EPOC son:
1. Síntomas y signos de IRA:
- falta de aliento pronunciada en reposo;
- frecuencia respiratoria >24, participación en la respiración de los músculos respiratorios auxiliares, paradoja abdominal.
2. Signos de alteración del intercambio gaseoso:
- PaCO2 >45 mmHg Art., pH<7,35;
- PaO2/FiO2<200 мм рт. ст.
Los criterios de exclusión de la VNI para la IRA son:
1. Deja de respirar.
2. Hemodinámica inestable (hipotensión, arritmias no controladas o isquemia miocárdica).
3. Incapacidad para proteger el tracto respiratorio (alteración de la tos y la deglución).
4. Secreción bronquial excesiva.
5. Signos de alteración de la conciencia (agitación o depresión), incapacidad del paciente para cooperar con el personal médico.
Los pacientes con IRA que requieren intubación traqueal de emergencia y asistencia respiratoria invasiva se consideran candidatos inadecuados para este método de asistencia respiratoria (C, 2+). La VNI es la única terapia probada que puede reducir la mortalidad en pacientes con EPOC y IRA (A, 1++).
Soporte respiratorio invasivo
La ventilación mecánica está indicada para pacientes con EPOC con IRA, en quienes la terapia médica u otra terapia conservadora (VNI) no conduce a una mejoría adicional de la condición (B, 2++). Las indicaciones para la ventilación deben tener en cuenta no solo la falta de efecto de los métodos conservadores de terapia, la gravedad de los indicadores funcionales, sino también la velocidad de su desarrollo y la posible reversibilidad del proceso que causó ARF.
Las indicaciones absolutas para la ventilación mecánica en ARF en el contexto de la exacerbación de la EPOC son:
1) paro respiratorio;
2) alteraciones pronunciadas de la conciencia (estupor, coma);
3) hemodinámica inestable (PAS<70 мм рт. ст., частота сердечных сокращений <50/мин. или >160/minuto);
4) fatiga de los músculos respiratorios.
Las indicaciones relativas para la ventilación mecánica en ARF en el contexto de la exacerbación de la EPOC son:
1) frecuencia respiratoria >35/min.;
2) pH de la sangre arterial<7,25;
3) PaO2<45 мм рт. ст., несмотря на проведение кислородотерапии.
Como regla general, al prescribir soporte respiratorio, se lleva a cabo una evaluación clínica y funcional integral del estado del paciente. El destete de la ventilación mecánica debe comenzar lo antes posible en pacientes con EPOC (B, 2++), porque cada día adicional de soporte respiratorio invasivo aumenta significativamente el riesgo de complicaciones de la ventilación mecánica, especialmente como la neumonía asociada a la ventilación (A, 1+).
Métodos de movilización y remoción.
secreciones bronquiales
La sobreproducción de secreciones y la mala evacuación de las vías respiratorias pueden ser un problema grave para muchos pacientes con una exacerbación grave de la EPOC.
Según estudios recientes, la terapia con fármacos mucoactivos (acetilcisteína, carbocisteína, erdosteína) acelera la resolución de las agudizaciones de la EPOC y contribuye de forma adicional a reducir la gravedad de la inflamación sistémica (C, 2+).
Con la exacerbación de la EPOC, se puede lograr una mejora significativa en la condición utilizando métodos especiales para mejorar la función de drenaje de las vías respiratorias. Por ejemplo, la ventilación por percusión de alta frecuencia es un método de terapia respiratoria en el que se administran al paciente pequeños volúmenes de aire ("percusiones") a una frecuencia ajustable alta.
(60-400 ciclos/min.) y nivel de presión controlado a través de un circuito especial de respiración abierta (fazitron). La "percusión" se puede administrar a través de una máscara, boquilla, tubo endotraqueal y traqueotomía. Otro método son las oscilaciones de alta frecuencia (oscilaciones) de la pared torácica, que se transmiten a través del tórax hacia las vías respiratorias y el flujo de gas que pasa a través de ellas. Las vibraciones de alta frecuencia se crean utilizando un chaleco inflable que se ajusta firmemente alrededor del pecho y está conectado a un compresor de aire.
11. EPOC y comorbilidades
La EPOC, junto con la hipertensión, la enfermedad de las arterias coronarias y la diabetes, constituyen el grupo principal de enfermedades crónicas: representan más del 30% de todas las demás patologías humanas. La EPOC a menudo se combina con estas enfermedades, lo que puede empeorar significativamente el pronóstico de los pacientes.
Las comorbilidades más comunes en la EPOC se presentan en la Tabla 20.
En pacientes con EPOC, el riesgo de muerte aumenta con el aumento del número de enfermedades concomitantes y no depende del valor de FEV1 (fig. 3).
Todas las causas de muerte en pacientes con EPOC se muestran en la Tabla 21.
Según amplios estudios poblacionales, el riesgo de muerte por ECV en pacientes con EPOC aumenta de 2 a 3 veces en comparación con pacientes de los mismos grupos de edad y sin EPOC y es aproximadamente el 50% del número total de muertes.
La patología cardiovascular es la principal patología que acompaña a la EPOC. Este es probablemente el grupo de enfermedades más frecuentes y graves que coexisten con la EPOC. Entre ellos, se debe distinguir la enfermedad de las arterias coronarias, la insuficiencia cardíaca crónica, la fibrilación auricular, la hipertensión, que, aparentemente, es el acompañante más común de la EPOC.
A menudo, el tratamiento de estos pacientes se vuelve controvertido: los fármacos (inhibidores de la enzima convertidora de angiotensina, bloqueadores β) utilizados para la enfermedad de las arterias coronarias y/o la hipertensión pueden empeorar el curso de la EPOC (riesgo de desarrollar tos, dificultad para respirar, aparición o aumento de la obstrucción bronquial), y los medicamentos recetados para la EPOC (broncodilatadores, corticosteroides), pueden afectar negativamente el curso de la enfermedad cardiovascular (el riesgo de desarrollar arritmia cardíaca, aumento de la presión arterial). Sin embargo, el tratamiento de la ECV en pacientes con EPOC debe realizarse de acuerdo con las recomendaciones estándar, ya que no hay evidencia de que deban ser tratados de manera diferente en presencia de EPOC. Si es necesario prescribir bloqueadores beta a pacientes con EPOC con patología cardiovascular concomitante, se debe dar preferencia a los bloqueadores beta selectivos.
La osteoporosis y la depresión son comorbilidades importantes que a menudo se subdiagnostican. Sin embargo, se asocian con una disminución del estado de salud y un mal pronóstico. Se debe evitar el nombramiento de cursos repetidos de corticosteroides sistémicos para las exacerbaciones, ya que su uso aumenta significativamente el riesgo de osteoporosis y fracturas.
En los últimos años, los casos de combinación de síndrome metabólico y diabetes en pacientes con EPOC se han vuelto más frecuentes. La DM tiene un impacto significativo en el curso de la EPOC y empeora el pronóstico de la enfermedad. En pacientes con EPOC en combinación con diabetes tipo 2, la ND es más pronunciada, las exacerbaciones son más comunes, se observa un curso más grave de enfermedad coronaria, insuficiencia cardíaca crónica e hipertensión, la hipertensión pulmonar aumenta con menor gravedad de la hiperinsuflación.
En pacientes con EPOC leve, la causa más común de muerte es el cáncer de pulmón. En pacientes con EPOC grave, la función pulmonar reducida limita significativamente la posibilidad de cirugía para el cáncer de pulmón.
12. Rehabilitación y educación del paciente
Uno de los métodos de tratamiento adicionales recomendados para pacientes con EPOC, a partir del estadio II de la enfermedad, es la rehabilitación pulmonar. Ha demostrado ser eficaz para mejorar la tolerancia al ejercicio (A, 1++), la actividad diaria, reducir la percepción de disnea (A, 1++), ansiedad y depresión (A, 1+), y reducir el número y duración de las hospitalizaciones (A, 1++), tiempo de recuperación tras el alta hospitalaria y, en general, aumento de la CV (A, 1++) y supervivencia (B, 2++).
La rehabilitación pulmonar es un programa integral de intervenciones basado en la terapia centrada en el paciente, que incluye, además del entrenamiento físico, programas educativos y psicosociales destinados a mejorar el estado físico y emocional de los pacientes y asegurar la adherencia a largo plazo del paciente a las conductas encaminadas en el mantenimiento de la salud.
De acuerdo con las recomendaciones ERS/ATS de 2013, el curso de rehabilitación debe continuar para
6-12 semanas (al menos 12 lecciones, 2 rublos / semana, con una duración de 30 minutos o más) e incluye los siguientes componentes:
1) entrenamiento físico;
2) corrección del estado nutricional;
3) educación del paciente;
4) apoyo psicosocial.
Este programa se puede llevar a cabo tanto de forma ambulatoria como en un ámbito hospitalario.
El principal componente de la rehabilitación pulmonar es el entrenamiento físico, que puede aumentar la eficacia de los broncodilatadores de acción prolongada (B, 2++). Un enfoque integrado para su implementación es especialmente importante, combinando ejercicios de fuerza y resistencia: caminar, entrenar los músculos de las extremidades superiores e inferiores con la ayuda de expansores, mancuernas, máquinas de pasos, ejercicios en un ergómetro de bicicleta. Durante estos entrenamientos, varios grupos de articulaciones también están involucrados en el trabajo, se desarrollan habilidades motoras finas de la mano.
Todos los ejercicios deben combinarse con ejercicios de respiración destinados a desarrollar el patrón de respiración correcto, lo que aporta beneficios adicionales (C, 2+). Además, la gimnasia respiratoria debe incluir el uso de simuladores especiales (Threshold PEP, IMT), que involucran diferencialmente los músculos respiratorios inspiratorios y espiratorios en el trabajo.
La corrección del estado nutricional debe tener como objetivo mantener la fuerza muscular con suficientes proteínas y vitaminas en la dieta.
Además de la rehabilitación física, se debe prestar mucha atención a las actividades destinadas a cambiar el comportamiento de los pacientes enseñándoles las habilidades de auto-reconocimiento de los cambios en el curso de la enfermedad y los métodos para su corrección.
* Enfermedades crónicas de las vías respiratorias, una guía para médicos de atención primaria, 2005.