Какво е характерно за ензимите. Структурна и функционална организация на ензимите. Регулиране на ензимната активност. Определяне на амилазната активност на урината
Ензими
ЕНЗИМИ-ов; мн.(единица ензим, -а; м.). [от лат. fermentum - квас] Biol., Chem.Специфични протеинови катализатори, присъстващи във всички живи клетки, които регулират метаболизма и следователно играят важна роля във всички жизнени процеси; ензими. ферментационен ензим. Е. гниене. Е. окисляване. Активността на ензимите зависи от приема на витамини. Изследване на свойствата на отделните ензими.
◁ Ензимен, th, th. Biol., Chem. f-та реакция. F отрови.Ензимен, th, th. F-ти вещества. Изследване на ензимни процеси.
ензими(от лат. fermentum - квас) (ензими), биологични катализатори, присъстващи във всички живи клетки. Извършват трансформацията на веществата в тялото, като по този начин насочват и регулират неговия метаболизъм. от химическа природа- протеини. Ензимите имат оптимална активност при определени стойности на pH, често наличието на необходимите коензими и кофактори и липсата на инхибитори. Всеки тип ензим катализира трансформацията на определени вещества (субстрати), понякога само на едно вещество. Поради това многобройни био химична реакцияизпълнява в клетките огромен бройразлични ензими. Всички ензими са разделени на 6 класа: оксидоредуктази, трансферази, хидролази, лиази, изомерази и лигази. Много ензими са изолирани от живи клетки и получени в кристална форма (за първи път през 1926 г.). Ензимните препарати се използват в медицината, хранителната и леката промишленост. Изучава ензимна ензимология.
ЕНЗИМИЕНЗИМИ (от латински "fermentum" - ферментация, квас), ензими, специфични протеини, които увеличават скоростта на химичните реакции в клетките на всички живи организми. По химическа природа - протеини, които имат оптимална активност при определено pH, наличие на необходимите коензими и кофактори и отсъствие на инхибитори. Ензимите се наричат още биокатализатори по аналогия с катализаторите. (см.КАТАЛИЗАТОРИ)по химия. Всеки тип ензим катализира трансформацията на определени вещества (субстрати), понякога само на едно вещество в една посока. Следователно многобройни биохимични реакции в клетките се извършват от огромен брой различни ензими. Разделени на 6 класа: оксидоредуктази, трансферази, хидролази (см.ХИДРОЛАЗИ), лиази (см.ВРЪЗКА), изомерази (см.ИЗОМЕРАЗИ)и лигази (см.ЛИГАЗИ). Много ензими са изолирани от живи клетки и получени в кристална форма (за първи път през 1926 г.).
Ролята на ензимите в организма
Ензимите участват в осъществяването на всички метаболитни процеси, в внедряването на генетична информация. Храносмилане и асимилация хранителни веществасинтез и разграждане на протеини (см.ПРОТЕИНИ (органични съединения)), нуклеинова киселина (см.НУКЛЕИНОВА КИСЕЛИНА), дебел (см.МАЗНИНИ), въглехидрати (см.ВЪГЛЕХИДРАТИ)и други съединения в клетките и тъканите на всички организми – всички тези процеси са невъзможни без участието на ензими. Всяка проява на функциите на живия организъм - дишане, мускулна контракция, нервно-психическа дейност, възпроизводство и др. - се осигурява от действието на ензими. Индивидуалните характеристики на клетките, изпълняващи определени функции, до голяма степен се определят от уникален набор от ензими, чието производство е генетично програмирано. Липсата дори на един ензим или някакъв негов дефект може да доведе до сериозни негативни последици за организма.
Каталитични свойства на ензимите
Ензимите са най-активните сред всички известни катализатори. Повечето реакции в клетката протичат милиони и милиарди пъти по-бързо, отколкото ако протичат в отсъствието на ензими. Например една молекула от ензима каталаза (см.КАТАЛАЗА)той е в състояние да преобразува до 10 хиляди молекули водороден пероксид, токсичен за клетките, образуван при окисляването на различни съединения, във вода и кислород за секунда. Каталитичните свойства на ензимите се дължат на способността им значително да намалят енергията на активиране на съединенията, влизащи в реакцията, т.е. в присъствието на ензими е необходима по-малко енергия за "започване" на тази реакция.
История на откриването на ензимите
Процесите, протичащи с участието на ензими, са познати на човека от дълбока древност, тъй като приготвянето на хляб, сирене, вино и оцет се основава на ензимни процеси. Но едва през 1833 г. за първи път е изолирано активно вещество от покълнали ечемични зърна, което превръща нишестето в захар и се нарича диастаза (сега този ензим се нарича амилаза (см.амилази)). В края на 19в доказано е, че сокът, получен от разтриването на клетките на дрождите, съдържа сложна смес от ензими, които осигуряват процеса алкохолна ферментация. Оттогава започва интензивно изследване на ензимите - тяхната структура и механизъм на действие. Тъй като ролята на биокатализата беше разкрита в изследването на ферментацията, именно с този процес бяха свързани два процеса, установени от 19 век. имената са „ензим” (в превод от гръцки „от мая”) и „ензим”. Вярно е, че последният синоним се използва само в рускоезичната литература научно направление, занимаващ се с изучаването на ензими и процеси с тяхно участие, традиционно се нарича ензимология. През първата половина на 20в беше установено, че ензимите са протеини по химическа природа и през втората половина на века за много стотици ензими вече беше определена последователността на аминокиселинните остатъци и беше установена пространствената структура. През 1969 г. за първи път е извършен химическият синтез на ензима рибонуклеаза. Направен е огромен напредък в разбирането на механизма на действие на ензимите.
Местоположение на ензимите в тялото
В клетката част от ензимите се намират в цитоплазмата, но най-вече ензимите са свързани с определени клетъчни структури, където проявяват своето действие. В ядрото например има ензими, отговорни за репликацията - синтеза на ДНК (см.ДЕЗОКСИРИБОНУКЛЕИНОВИ КИСЕЛИНИ)(ДНК полимераза), за нейната транскрипция - образуването на РНК (см.РИБОНУКЛЕИНОВИ КИСЕЛИНИ)(РНК полимераза). В митохондриите има ензими, отговорни за натрупването на енергия, в лизозомите - повечето от хидролитичните ензими, участващи в разграждането на нуклеинови киселини и протеини.
Условия за действие на ензимите
Всички реакции с участието на ензими протичат главно в неутрална, слабо алкална или леко кисела среда. Максималната активност на всеки отделен ензим обаче се проявява при строго определени стойности на pH. За действието на повечето ензими при топлокръвните животни най-благоприятната температура е 37-40 o C. При растенията при температури под 0 o C действието на ензимите не спира напълно, въпреки че жизнената активност на растенията рязко намалява. Ензимните процеси, като правило, не могат да протичат при температури над 70 o C, тъй като ензимите, както всички протеини, са обект на термична денатурация (структурно разрушаване).
Размери на ензимите и тяхната структура
Молекулното тегло на ензимите, както и на всички други протеини, е в диапазона от 10 хиляди до 1 милион (но може да бъде и повече). Те могат да се състоят от една или повече полипептидни вериги и могат да бъдат сложни протеини. Съставът на последния, заедно с протеиновия компонент (апоензим), включва нискомолекулни съединения - коензими (кофактори, коензими), включително метални йони, нуклеотиди, витамини и техните производни. Някои ензими се образуват под формата на неактивни прекурсори (проензими) и стават активни след определени промени в структурата на молекулата, например след като от нея се отцепи малък фрагмент. Те включват храносмилателни ензимитрипсин (см.ТРИПСИН)и химотрипсин (см.химотрипсин), които се синтезират от клетките на панкреаса под формата на неактивни прекурсори (трипсиноген и химотрипсиноген) и придобиват активност в тънко червокато част от панкреатичен сок. Много ензими образуват така наречените ензимни комплекси. Такива комплекси, например, са вградени в клетъчните мембрани или клетъчните органели и участват в транспорта на вещества.
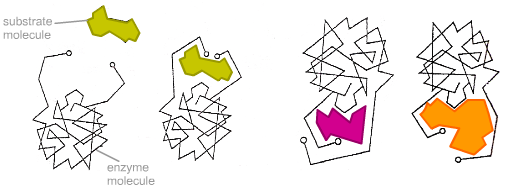
Веществото (субстрат), подложено на преобразуване, се свързва с определено място на ензима, преди активен център, който се образува от странични вериги от аминокиселини, които често са разположени в участъци от полипептидната верига, които са значително отдалечени един от друг. Например, активният център на молекулата на химотрипсин се образува от хистидинови остатъци (см.ХИСТИДИН), разположен в полипептидната верига на позиция 57, серин (см. SERIN)на позиция 195 и аспарагинова киселина на позиция 102 (в молекулата на химотрипсина има 245 аминокиселини). По този начин сложното полагане на полипептидната верига в протеиновата молекула - ензимът осигурява възможност няколко странични вериги от аминокиселини да бъдат на строго определено място и на определено разстояние една от друга. Коензимите също са част от активния център (белтъчната част и непротеиновият компонент поотделно нямат ензимна активност и придобиват свойствата на ензим само когато се комбинират заедно).
Протичането на процесите с участието на ензими
Повечето ензими се характеризират с висока специфичност (селективност) на действие, когато превръщането на всеки реагент (субстрат) в реакционен продукт се извършва от специален ензим. В този случай действието на ензима може да бъде строго ограничено до един субстрат. Например ензимът уреаза (см.УРЕАЗА), който участва в разграждането на уреята до амоняк и въглероден диоксид, не реагира на метилурея, която е подобна по структура. Много ензими действат върху няколко структурно свързани съединения или върху един тип химична връзка (например ензимът фосфатаза, който разцепва фосфодиестерна връзка (см.ФОСФАТАЗИ)).
Ензимът осъществява своето действие чрез образуването на ензимно-субстратен комплекс, който след това се разлага, за да образува продукти ензимна реакцияи освобождаване на ензима. В резултат на образуването на ензимно-субстратен комплекс, субстратът променя своята конфигурация; в този случай ензимно-химичната връзка, която се преобразува, е отслабена и реакцията протича с по-нисък първоначален разход на енергия и следователно с много по-висока скорост. Мярка за скоростта на ензимната реакция е количеството субстрат, което е претърпяло трансформация за единица време, или количеството образуван продукт. Много ензимни реакции, в зависимост от концентрацията на субстрата и реакционния продукт в средата, могат да протичат както директно, така и обратна посока(излишъкът на субстрата измества реакцията към образуването на продукта, докато при прекомерно натрупване на последния ще настъпи синтеза на субстрата). Това означава, че ензимните реакции могат да бъдат обратими. Например карбоанхидраза (см.КАРБОАНХИДРАЗА)кръвта преобразува въглеродния диоксид, идващ от тъканите, във въглеродна киселина (H 2 CO 3), а в белите дробове, напротив, катализира превръщането на въглеродната киселина във вода и въглероден диоксид, който се отстранява по време на издишване. Трябва обаче да се помни, че ензимите, подобно на други катализатори, не могат да изместят термодинамичното равновесие на химическата реакция, а само значително ускоряват постигането на това равновесие.
Номенклатура на имената на ензимите
Когато се наименува ензим ca, името на субстрата се взема за основа и се добавя наставката "aza". Така по-специално се появиха протеинази - ензими, които разграждат протеини (протеини), липази (разграждат липиди или мазнини) и др. Някои ензими получиха специални (тривиални) имена, например храносмилателни ензими - пепсин (см.ПЕПСИН), химотрипсин (см.химотрипсин)и трипсин (см.ТРИПСИН).
В клетките на тялото протичат няколко хиляди различни метаболитни реакции и следователно има толкова много ензими. За да се въведе такова разнообразие в една система, беше прието международно споразумение за класификация на ензимите. В съответствие с тази система всички ензими, в зависимост от вида на реакциите, които катализират, бяха разделени на шест основни класа, всеки от които включва редица подкласове. Освен това всеки ензим получава четирицифрен кодов номер (шифър) и име, указващо реакцията, която този ензим катализира. Ензими, които катализират същата реакция в организмите различни видове, могат значително да се различават помежду си по протеиновата си структура, но в номенклатурата имат общо име и един кодов номер.
Болести, свързани с нарушено производство на ензими
Липсата или намаляването на активността на всеки ензим (често прекомерна активност) при хората води до развитие на заболявания (ензимопатии) или смърт на организма. По този начин, наследствено заболяване на децата - галактоземия (води до умствена изостаналост) - се развива поради нарушение на синтеза на ензима, отговорен за превръщането на галактозата (см.ГАЛАКТОЗА)в лесно смилаема глюкоза (см.ГЛЮКОЗА). Причината за друго наследствено заболяване - фенилкетонурия, придружено от разстройство умствена дейност, е загубата от чернодробните клетки на способността да синтезират ензим, който катализира превръщането на аминокиселината фенилаланин (см.фенилаланин)към тирозин (см.ТИРОЗИН). Определянето на активността на много ензими в кръвта, урината, гръбначния мозък, семенните и други телесни течности се използва за диагностициране на редица заболявания. С помощта на този анализ на кръвния серум е възможно да се открие ранна фазаинфаркт на миокарда, вирусен хепатит, панкреатит, нефрит и други заболявания.
Използване на ензими от човека
Тъй като ензимите запазват свойствата си извън тялото, те се използват успешно в различни индустрии. Например протеолитичен ензим от папая (от сок от папая (см.ПАПАЯ)) - в пивоварната, за омекотяване на месо; пепсин - при производството на "готови" зърнени култури и като лекарство; трипсин - в производството на продукти за бебешка храна; ренин (сирище от стомаха на теле) - в производството на сирене. Каталазата се използва широко в хранително-вкусовата и каучуковата промишленост, а целулазата и пектидазата, които разграждат полизахаридите, се използват за избистряне на плодови сокове. Ензимите са необходими при установяване на структурата на протеини, нуклеинови киселини и полизахариди, в генното инженерство и др. С помощта на ензими се получават лекарства и сложни химични съединения.
Открита е способността на някои форми на рибонуклеинови киселини (рибозими) да катализират отделни реакции, тоест да действат като ензими. Може би, по време на еволюцията на органичния свят, рибозимите са служили като биокатализатори, преди ензимната функция да бъде прехвърлена на протеини, по-добре адаптирани да изпълняват тази задача.
- (от лат. fermentum ферментация, закваска), ензими, биокатализатори, специфични. протеини, присъстващи във всички живи клетки и играещи ролята на биол. катализатори. Чрез тях се реализира ген. информация и всички процеси на обмен се извършват ... ... Биологичен енциклопедичен речник
- (лат. Fermentum квас, от fervere да бъде горещ). Органични вещества, които ферментират други органични тела, без самите те да се разлагат. Речник чужди думивключени в руския език. Чудинов A.N., 1910. ЕНЗИМИ ... ... Речник на чуждите думи на руския език
- (от лат. fermentum закваска) (ензими) биологични катализатори, присъстващи във всички живи клетки. Извършват трансформацията на веществата в тялото, като по този начин насочват и регулират неговия метаболизъм. Химическата природа на протеините. Ензими ..... Голям енциклопедичен речник
- (от латински fermentum закваска), биологични катализатори, присъстващи във всички живи клетки. Извършват трансформации (метаболизъм) на вещества в тялото. Химическата природа на протеините. Участва в множество биохимични реакции в клетката ... ... Съвременна енциклопедия
Съществува., брой синоними: 2 биокатализатори (1) ензими (2) Речник на синонимите на ASIS. В.Н. Тришин. 2013 ... Речник на синонимите
Ензими. Вижте ензими. (
История на обучението
Срок ензимпредложен през 17 век от химика ван Хелмонт, когато се обсъждат механизмите на храносмилането.
В кон. XVIII – ран. 19 век вече беше известно, че месото се усвоява от стомашния сок, а нишестето се превръща в захар под действието на слюнката. Механизмът на тези явления обаче беше неизвестен.
Класификация на ензимите
Според вида на катализираните реакции ензимите се разделят на 6 класа според йерархичната класификация на ензимите (KF, - Enzyme Comission code). Предложена е класификация Международен съюзбиохимия и молекулярна биология (Международен съюз по биохимия и молекулярна биология). Всеки клас съдържа подкласове, така че ензимът се описва с набор от четири числа, разделени с точки. Например пепсинът има името EC 3.4.23.1. Първото число грубо описва механизма на реакцията, катализирана от ензима:
- CF 1: Оксидоредуктазакоито катализират окисление или редукция. Пример: каталаза, алкохол дехидрогеназа.
- CF 2: Трансферази, които катализират трансфера химични групиот една субстратна молекула към друга. Сред трансферазите особено се отличават киназите, които пренасят фосфатна група, като правило, от молекула на АТФ.
- CF 3: Хидролазикоито катализират хидролизата химически връзки. Пример: естерази, пепсин, трипсин, амилаза, липопротеин липаза.
- CF 4: Лиаза, като катализира разкъсването на химичните връзки без хидролиза с образуването на двойна връзка в един от продуктите.
- CF 5: Изомерази, които катализират структурни или геометрични промени в молекулата на субстрата.
- CF 6: Лигази, катализирайки образуването на химични връзки между субстратите, дължащи се на АТФ хидролиза. Пример: ДНК полимераза.
Кинетични изследвания
Най-простото описание кинетикаедносубстратни ензимни реакции е уравнението на Михаелис-Ментен (виж фиг.). Към днешна дата са описани няколко механизма на действие на ензима. Например, действието на много ензими се описва със схемата на механизма "пинг-понг".
През 1972-1973г. е създаден първият квантово-механичен модел на ензимна катализа (автори М. В. Волкенштейн, Р. Р. Догонадзе, З. Д. Урушадзе и др.).
Структура и механизъм на действие на ензимите
Активността на ензимите се определя от тяхната триизмерна структура.
Както всички протеини, ензимите се синтезират като линейна верига от аминокиселини, която се нагъва по специфичен начин. Всяка аминокиселинна последователност се сгъва по специфичен начин и получената молекула (протеинова глобула) има уникални свойства. Няколко протеинови вериги могат да бъдат комбинирани в протеинов комплекс. Третичната структура на протеините се разрушава при нагряване или излагане на определени химикали.
Активно място на ензими
В активния център условно разпределете:
- каталитичен център - директно химически взаимодействащ със субстрата;
- свързващ център (контактно или "котвящо" място) - осигуряване на специфичен афинитет към субстрата и образуване на ензим-субстратния комплекс.
За да катализира реакция, ензимът трябва да се свърже с един или повече субстрати. Протеиновата верига на ензима е сгъната по такъв начин, че на повърхността на глобулата се образува празнина или вдлъбнатина, където се свързват субстратите. Тази област се нарича място за свързване на субстрата. Обикновено той съвпада с активното място на ензима или се намира близо до него. Някои ензими също съдържат места за свързване на кофактори или метални йони.
Ензимът се свързва със субстрата:
- почиства субстрата от водното "шуба"
- подрежда реагиращите молекули на субстрата в пространството по начина, необходим за протичане на реакцията
- подготвя за реакцията (например поляризира) субстратните молекули.
Обикновено прикрепването на ензим към субстрат става благодарение на йонни или водородни връзки, рядко поради ковалентни връзки. В края на реакцията нейният продукт (или продукти) се отделят от ензима.
В резултат на това ензимът намалява енергията на активиране на реакцията. Това е така, защото в присъствието на ензима реакцията протича по различен път (всъщност протича различна реакция), например:
При липса на ензим:
- A+B = AB
В присъствието на ензим:
- A+F = AF
- AF+V = AVF
- AVF \u003d AV + F
където A, B - субстрати, AB - реакционен продукт, F - ензим.
Ензимите не могат сами да осигурят енергия за ендергонични реакции (които изискват енергия). Следователно ензимите, които извършват такива реакции, ги свързват с екзергонични реакции, които протичат с освобождаване на повече енергия. Например, реакциите на синтез на биополимер често се свързват с реакцията на хидролиза на АТФ.
Активните центрове на някои ензими се характеризират с явлението кооперативност.
Специфичност
Ензимите обикновено показват висока специфичност за техните субстрати (субстратна специфичност). Това се постига чрез частична комплементарност на формата, разпределението на заряда и хидрофобните участъци върху молекулата на субстрата и на мястото на свързване на субстрата върху ензима. Ензимите обикновено също показват високо нивостереоспецифичност (образувайте като продукт само един от възможните стереоизомери или използвайте само един стереоизомер като субстрат), региоселективност (образувайте или прекъсвайте химична връзка само в една от възможните позиции на субстрата) и хемоселективност (катализира само една химична реакция от няколко възможни за дадени условия). Въпреки общото високо ниво на специфичност, степента на субстратна и реакционна специфичност на ензимите може да бъде различна. Например ендопептидазата трипсин разкъсва пептидна връзка само след аргинин или лизин, освен ако не са последвани от пролин, а пепсинът е много по-малко специфичен и може да разкъса пептидна връзка след много аминокиселини.
Модел с ключалка
Хипотезата за индуцирано прилягане на Кошланд
По-реалистична ситуация е в случай на индуцирано съвпадение. Неправилните субстрати - твърде големи или твърде малки - не пасват на активното място
През 1890 г. Емил Фишер предполага, че специфичността на ензимите се определя от точното съответствие между формата на ензима и субстрата. Това предположение се нарича модел на ключалката. Ензимът се свързва със субстрата, за да образува краткотраен ензимно-субстратен комплекс. Въпреки това, въпреки че този модел обяснява високата специфичност на ензимите, той не обяснява феномена на стабилизиране на преходното състояние, който се наблюдава на практика.
Модел с предизвикано прилягане
През 1958 г. Даниел Кошланд предлага модификация на модела ключ-заключване. Ензимите обикновено не са твърди, а гъвкави молекули. Активното място на ензима може да промени конформацията след свързване със субстрата. Страничните групи на аминокиселините на активния център заемат позиция, която позволява на ензима да изпълнява своята каталитична функция. В някои случаи молекулата на субстрата също променя конформацията след свързване с активното място. За разлика от модела ключ-заключване, моделът на индуцираното прилягане обяснява не само спецификата на ензимите, но и стабилизирането на преходното състояние. Този модел беше наречен "ръчна ръкавица".
Модификации
Много ензими претърпяват модификации след синтеза на протеиновата верига, без които ензимът не показва своята активност в пълна степен. Такива модификации се наричат посттранслационни модификации (обработка). Един от най-често срещаните видове модификация е добавянето на химични групи към страничните остатъци на полипептидната верига. Например, добавянето на остатък от фосфорна киселина се нарича фосфорилиране и се катализира от ензима киназа. Много еукариотни ензими са гликозилирани, т.е. модифицирани с въглехидратни олигомери.
Друг често срещан тип посттранслационни модификации е разцепването на полипептидна верига. Например, химотрипсин (протеаза, участваща в храносмилането) се получава чрез разцепване на полипептидна област от химотрипсиноген. Химотрипсиногенът е неактивен прекурсор на химотрипсин и се синтезира в панкреаса. Неактивната форма се транспортира до стомаха, където се превръща в химотрипсин. Този механизъм е необходим, за да се избегне разцепването на панкреаса и други тъкани, преди ензимът да навлезе в стомаха. Неактивен ензимен прекурсор също се нарича "зимоген".
Ензимни кофактори
Някои ензими изпълняват каталитичната функция самостоятелно, без допълнителни компоненти. Има обаче ензими, които изискват непротеинови компоненти за катализа. Кофакторите могат да бъдат или неорганични молекули (метални йони, клъстери желязо-сяра и т.н.), или органични (например флавин или хем). Органичните кофактори, които са силно свързани с ензима, се наричат също простетични групи. Органичните кофактори, които могат да бъдат отделени от ензима, се наричат коензими.
Ензим, който изисква кофактор, за да прояви каталитична активност, но не е свързан с него, се нарича апо-ензим. Апо-ензим в комбинация с кофактор се нарича холо-ензим. Повечето от кофакторите са свързани с ензима чрез нековалентни, но доста силни взаимодействия. Има и простетични групи, които са ковалентно свързани с ензима, като тиамин пирофосфат в пируват дехидрогеназата.
Ензимна регулация
Някои ензими имат места за свързване на малки молекули и могат да бъдат субстрати или продукти на метаболитния път, в който ензимът влиза. Те намаляват или повишават активността на ензима, което създава възможност за обратна връзка.
Инхибиране на крайния продукт
Метаболитен път - верига от последователни ензимни реакции. Често крайният продукт на метаболитен път е инхибитор на ензим, който ускорява първата от реакциите в този метаболитен път. Ако крайният продукт е твърде много, тогава той действа като инхибитор за първия ензим и ако след това крайният продукт стане твърде малък, тогава първият ензим се активира отново. По този начин инхибирането от крайния продукт според принципа на отрицателната обратна връзка е важен начин за поддържане на хомеостазата (относителното постоянство на условията на вътрешната среда на тялото).
Влияние на условията на околната среда върху ензимната активност
Активността на ензимите зависи от условията в клетката или организма – налягане, киселинност на средата, температура, концентрация на разтворени соли (йонна сила на разтвора) и др.
Множество форми на ензими
Множеството форми на ензими могат да бъдат разделени на две категории:
- Изоензими
- Правилни форми за множествено число (вярно)
Изоензими- Това са ензими, чийто синтез е кодиран от различни гени, имат различни първични структури и различни свойства, но катализират една и съща реакция. Видове изоензими:
- Органични - ензими на гликолизата в черния дроб и мускулите.
- Клетъчна - цитоплазмена и митохондриална малат дехидрогеназа (ензимите са различни, но катализират една и съща реакция).
- Хибридни - ензими с кватернерна структура, се образуват в резултат на нековалентно свързване на отделни субединици (лактатдехидрогеназа - 4 субединици от 2 вида).
- Мутантни – образуват се в резултат на единична мутация на ген.
- Алоензими – кодирани от различни алели на един и същи ген.
Правилни форми за множествено число(true) са ензими, чийто синтез е кодиран от един и същи алел на един и същ ген, те имат същата първична структура и свойства, но след синтез върху рибозомите претърпяват модификация и стават различни, въпреки че катализират една и съща реакция.
Изоензимите са различни на генетично ниво и се различават от първичната последователност, а истинските множествени форми стават различни на пост-транслационно ниво.
медицинско значение
За първи път е установена връзката между ензимите и наследствените метаболитни заболявания А. Гарродомпрез 1910-те години Гаррод нарича болестите, свързани с ензимни дефекти, "вродени грешки на метаболизма".
Ако настъпи мутация в гена, кодиращ определен ензим, аминокиселинната последователност на ензима може да се промени. В същото време, в резултат на повечето мутации, неговата каталитична активност намалява или напълно изчезва. Ако един организъм получи два от тези мутантни гени (по един от всеки родител), химическата реакция, катализирана от този ензим, престава да протича в тялото. Например, появата на албиноси се свързва с прекратяването на производството на ензима тирозиназа, който е отговорен за един от етапите в синтеза на тъмния пигмент меланин. Фенилкетонурия се свързва с намалена или липсваща активност на ензима фенилаланин-4-хидроксилаза в черния дроб.
Понастоящем са известни стотици наследствени заболявания, свързани с ензимни дефекти. Разработени са методи за лечение и профилактика на много от тези заболявания.
Практическа употреба
Ензимите се използват широко в националната икономика - храна, текстилна индустрия, по фармакология и медицина. Повечето лекарства влияят върху хода на ензимните процеси в организма, като стартират или спират определени реакции.
Още по-широка област на приложение на ензимите в научно изследванеи в медицината.
Бележки
Литература
Вижте какво представляват "ензимите" в други речници:
ЕНЗИМИ- (син. ензими; фр. диастаза), биол. агенти, които катализират повечето хим. реакции, които са в основата на жизнената дейност на клетката и организма. Редица характерни свойства са термолабилност, специфичност на действие, висока каталитична ефективност, ... ... Голям медицинска енциклопедия
- (от лат. fermentum ферментация, закваска), ензими, биокатализатори, специфични. протеини, присъстващи във всички живи клетки и играещи ролята на биол. катализатори. Чрез тях се реализира ген. информация и всички процеси на обмен се извършват ... ... Биологичен енциклопедичен речник
- (лат. Fermentum квас, от fervere да бъде горещ). Органични вещества, които ферментират други органични тела, без самите те да се разлагат. Речник на чуждите думи, включени в руския език. Чудинов A.N., 1910. ЕНЗИМИ ... ... Речник на чуждите думи на руския език
- (от лат. fermentum закваска) (ензими) биологични катализатори, присъстващи във всички живи клетки. Извършват трансформацията на веществата в тялото, като по този начин насочват и регулират неговия метаболизъм. Химическата природа на протеините. Ензими ..... Голям енциклопедичен речник
- (от латински fermentum закваска), биологични катализатори, присъстващи във всички живи клетки. Извършват трансформации (метаболизъм) на вещества в тялото. Химическата природа на протеините. Участва в множество биохимични реакции в клетката ... ... Съвременна енциклопедия
Съществува., брой синоними: 2 биокатализатори (1) ензими (2) Речник на синонимите на ASIS. В.Н. Тришин. 2013 ... Речник на синонимите
Ензими. Вижте ензими. (
Въведение
1. Ензими
1.1 Терминът "ензими", биологична роляензими
1.2 Структурни особености на прости и сложни ензими. Предимства пред химическите катализатори
1.3 Методи за изолиране на ензими
1.4 Класификация на номенклатурата на ензимите според вида на катализираната реакция
1.5 Обхват
2. Биокатализа
2.1 Как работят ензимите
2.2 Фактори, влияещи върху реакциите на ферментация
3. Характеристики на биомиметиката
Заключение
Списък на използваните източници
ензимна каталитична реакция
Въведение
Избрах темата „Ензими. Биокатализа. Възможности на биомиметиката”, защото наскоро като лекарствазапочнаха да използват широко лекарства, които имат насочен ефект върху ензимните процеси на тялото. Както знаете, в нашето тяло има много ензими, които допринасят за осъществяването на метаболитни процеси (дишане, храносмилане, мускулна контракция, фотосинтеза), които определят самия процес на живот. Поради това лекарствата са широко използвани при лечението на заболявания, придружени от гнойно-некротични процеси, тромбоза и тромбоемболия и храносмилателни разстройства. Ензимните препарати започват да намират приложение и при лечението на онкологични заболявания.
Ензимите играят важна роля в много технологични процеси. Висококачествените ензими ви позволяват да подобрите технологията, да намалите разходите и дори да получите нови продукти.
В момента ензимите се използват в повече от 25 индустрии: хранително-вкусова промишленост, фармацевтична, целулозно-хартиена, лека промишленост, както и в селското стопанство.
Целта на моето резюме е: подробно проучване на понятията ензим и ензимна катализа (биокатализа).
В тази връзка ми стана интересно да науча историята на появата на първите ензими, структурни характеристики, техните свойства, класификация, принцип на действие, методи за изолиране на ензими.
1. Ензими
1.1 Терминът "ензими", биологичната роля на ензимите
През цялата си история на съществуване човекът е използвал ензими, често без да го има предвид.
Срок ензимпредложен през 17-ти век от химика Ван Хелмонт при обсъждането на механизмите на храносмилането. В кон. XVIII – ран. 19 век вече се знаеше, че месото се смила стомашен соки нишестето се превръща в захар чрез слюнката. Механизмът на тези явления обаче беше неизвестен. През 19 век Луи Пастьор, изучавайки превръщането на въглехидратите в етанолпод въздействието на дрождите, стигна до извода, че този процес (ферментация) се катализира от някаква жизнена сила, намираща се в клетките на дрождите. Срок ензим(от гръцки ἐ ν- - в- и ζύμη - мая, закваска) е предложен през 1876г.
Първият кристален ензим (уреаза) е изолиран от американския биохимик Д. Съмнър през 1926 г.
И така, какво представляват ензимите? Ензими (от лат. fermentum - ферментация, закваска) или ензими - органична материяпротеинова природа, които се синтезират в клетките и многократно ускоряват протичащите в тях реакции, без да претърпяват химични трансформации.
Към днешна дата са известни над 3000 ензима. Всички те имат редица специфични свойства, които ги отличават от неорганичните катализатори. Само в човешкото тялоВсяка секунда протичат хиляди ензимни реакции. Ензимите играят важна роля във всички жизнени процеси, като насочват и регулират метаболизма на организма.
Трябва също да се отбележи, че всички Жива природасъществува единствено чрез биокатализа. Нищо чудно, че великият руски физиолог, Нобелов лауреатИ.П. Павлов нарича ензимите носители на живота.
1.2 Структурни особености на прости и сложни ензими. Предимства пред химическите катализатори
По структура ензимите могат да бъдат еднокомпонентни прости протеини и двукомпонентни сложни протеини. Във втория случай ензимът съдържа не само протеиновия компонент, апоензима ( апоензим), но и допълнителна група от непротеинова природа - коензим (коензим). Последните вещества, за разлика от протеиновия компонент на ензима (апоензим), имат относително малко молекулно тегло и като правило са термостабилни.
Химическата природа на най-важните коензими е изяснена през 30-те години на нашия век благодарение на трудовете на О. Варбург, Р. Кун, П. Карера и др.Оказва се, че ролята на коензимите в двукомпонентните ензими се играе от повечето витамини (Е, К, Q, В1, В2, В6, В12, С, Н и др.) или съединения, изградени с участието на витамини, поради което трябва да се приемат с храната. Много ензими с голямо молекулно тегло проявяват каталитична активност само в присъствието на специфични вещества с ниско молекулно тегло, наречени коензими (или кофактори).
Характерна особеност на двукомпонентните ензими е, че нито протеиновата част, нито допълнителната група поотделно имат забележима каталитична активност. Само техният комплекс проявява ензимни свойства. В същото време протеинът рязко повишава каталитичната активност на допълнителната група, която му е присъща в свободно състояние в много малка степен; допълнителната група стабилизира протеиновата част и я прави по-малко уязвима към денатуриращи агенти.
Еднокомпонентните ензими са прости протеини. За еднокомпонентни ензими, които нямат допълнителна група, която може да влезе в пряк контакт с преобразуваното съединение. Тази функция се изпълнява от част от протеиновата молекула, наречена каталитичен център. Предполага се, че каталитичният център на еднокомпонентния ензим е уникална комбинация от няколко аминокиселинни остатъка, разположени в определена част от протеиновата молекула. Аминокиселинните остатъци, които образуват каталитичния център на еднокомпонентен ензим, са разположени в различни точки в една полипептидна верига. Следователно каталитичният център възниква в момента, когато протеиновата молекула придобие присъщата си третична структура. Следователно промяната в третичната структура на ензима под въздействието на определени фактори може да доведе до деформация на каталитичния център и промяна в ензимната активност.
В допълнение към каталитичния център, образуван от комбинация от аминокиселинни радикали или добавяне на коензим, в ензимите се разграничават още два центъра: субстратен и алостеричен. Под субстратния център се разбира частта от ензимната молекула, отговорна за прикрепването на вещество (субстрат), подложено на ензимна трансформация. Често това място се нарича "зона на закрепване" на ензима, където, като кораб на котва, става субстратът. Концепцията за каталитичен и субстратен център не трябва да се приема като абсолютна. В реалните ензими мястото на субстрата може да съвпада с (или да се припокрива) с каталитичното място. Освен това, каталитичният център може да бъде окончателно образуван по време на прикрепването на субстрата. Ето защо те често говорят за активния център на ензима, който е комбинация от първия и втория.
Алостеричният център е част от ензимната молекула, в резултат на прикрепването към която определено нискомолекулно (а понякога и високомолекулно) вещество променя третичната структура на протеиновата молекула. В резултат на това конфигурацията на активния център се променя, придружено от повишаване или намаляване на каталитичната активност на ензима.
Ензимите като биологични катализатори имат редица характеристики, които ги различават от неорганичните катализатори:
ензимните реакции протичат при физиологично нормални условия за живия организъм и не изискват сурови условия - повишена температура, висока киселинност на средата, прекомерно налягане;
ензимите като катализатори са строго специфични, те катализират само определени биохимични реакции, действайки само върху определен субстрат;
ензимните реакции в живите организми протичат последователно, така че субстратът за всеки следващ ензим е крайният продукт на предшестващата го ензимна реакция;
скоростта на ензимните реакции е висока, но зависи от определени фактори. Ускорете реакцията с 10 8 -10 20 пъти. Ензимните реакции протичат със 100% добив и не дават странични продукти. Catal се използва за изразяване на каталитична активност съгласно препоръките на Международния биохимичен съюз. Catal (cat) е каталитична активност, способна да извърши реакция със скорост от 1 mol за секунда;
всички ензими са протеини. Молекулното тегло на ензимите варира в широки граници от 12*103 до 10*106 Da.
1.3 Методи за изолиране на ензими
Процесът на изолиране на протеин започва с прехвърлянето на тъканни протеини в разтвор. За целта тъканта (материалът), от който се получава ензимът, се смила внимателно в хомогенизатор в присъствието на буферен разтвор. За по-добро разрушаване на клетките към материала се добавя кварцов пясък, ако материалът е смлян в хаван. В резултат на това се получава каша - хомогенат. Ако не е извършено предварително фракциониране на клетъчни органели, хомогенатът съдържа фрагменти от клетки, ядра, хлоропласти и други клетъчни органели, разтворими пигменти и протеини.
При изолиране на ензими от тъканите на живи организми, включително растения, е необходимо да се спазват условия, които не причиняват денатурация на протеини. Цялата работа се извършва при ниска температура (4 0 C) и при стойности на pH на буферния разтвор, които са оптимални за този ензим.
След прехвърлянето на ензимите от тъканта в разтворено състояние, хомогенатът се подлага на центрофугиране за отделяне на неразтворимата част от материала, след което се изолират следните ензими в отделни фракции на екстракта-центрофугата.
Тъй като всички ензими са протеини, за получаване на пречистени ензимни препарати се използват същите методи за изолиране, както при работа с протеини.
Въведение
1. Ензими
1.1 Терминът "ензими", биологичната роля на ензимите
1.2 Структурни особености на прости и сложни ензими. Предимства пред химическите катализатори
1.3 Методи за изолиране на ензими
1.4 Класификация на номенклатурата на ензимите според вида на катализираната реакция
1.5 Обхват
2. Биокатализа
2.1 Как работят ензимите
2.2 Фактори, влияещи върху реакциите на ферментация
3. Характеристики на биомиметиката
Заключение
Списък на използваните източници
ензимна каталитична реакция
Въведение
Избрах темата „Ензими. Биокатализа. Възможностите на биомиметиката, тъй като напоследък като лекарства широко се използват лекарства, които имат насочен ефект върху ензимните процеси на тялото. Както знаете, в нашето тяло има много ензими, които допринасят за осъществяването на метаболитни процеси (дишане, храносмилане, мускулна контракция, фотосинтеза), които определят самия процес на живот. Поради това лекарствата са широко използвани при лечението на заболявания, придружени от гнойно-некротични процеси, тромбоза и тромбоемболия и храносмилателни разстройства. Ензимните препарати започват да намират приложение и при лечението на онкологични заболявания.
Ензимите играят важна роля в много технологични процеси. Висококачествените ензими ви позволяват да подобрите технологията, да намалите разходите и дори да получите нови продукти.
В момента ензимите се използват в повече от 25 индустрии: хранително-вкусова промишленост, фармацевтична, целулозно-хартиена, лека промишленост, както и в селското стопанство.
Целта на моето резюме е: подробно проучване на понятията ензим и ензимна катализа (биокатализа).
В тази връзка ми стана интересно да науча историята на появата на първите ензими, структурни характеристики, техните свойства, класификация, принцип на действие, методи за изолиране на ензими.
1. Ензими
1.1 Терминът "ензими", биологичната роля на ензимите
През цялата си история на съществуване човекът е използвал ензими, често без да го има предвид.
Срок ензимпредложен през 17-ти век от химика Ван Хелмонт при обсъждането на механизмите на храносмилането. В кон. XVIII – ран. 19 век вече беше известно, че месото се усвоява от стомашния сок, а нишестето се превръща в захар под действието на слюнката. Механизмът на тези явления обаче беше неизвестен. През 19 век Луи Пастьор, изучавайки превръщането на въглехидратите в етилов алкохол под действието на дрожди, стигна до извода, че този процес (ферментация) се катализира от определен жизнена силанамерени в клетките на дрождите. Срок ензим(от гръцки ἐν- - в- и ζύμη - мая, закваска) е предложен през 1876г.
Първият кристален ензим (уреаза) е изолиран от американския биохимик Д. Съмнър през 1926 г.
И така, какво представляват ензимите? Ензими (от латински fermentum - ферментация, квас) или ензими - органични вещества с протеинова природа, които се синтезират в клетките и многократно ускоряват протичащите в тях реакции, без да претърпяват химични трансформации.
Към днешна дата са известни над 3000 ензима. Всички те имат редица специфични свойства, които ги отличават от неорганичните катализатори. Само в човешкото тяло всяка секунда протичат хиляди ензимни реакции. Ензимите играят важна роля във всички жизнени процеси, като насочват и регулират метаболизма на организма.
Трябва също да се отбележи, че всички диви животни съществуват единствено благодарение на биокатализата. Нищо чудно, че великият руски физиолог, Нобелов лауреат И.П. Павлов нарича ензимите носители на живота.
1.2 Структурни особености на прости и сложни ензими. Предимства пред химическите катализатори
По структура ензимите могат да бъдат еднокомпонентни прости протеини и двукомпонентни сложни протеини. Във втория случай не само протеиновият компонент, апоензимът (апоензим ), но също така и допълнителна група от непротеинова природа - коензим (коензим) . Последните вещества, за разлика от протеинов компонентензим (апоензим), имат относително малко молекулно тегло и като правило са термостабилни.
Химическата природа на най-важните коензими е изяснена през 30-те години на нашия век благодарение на трудовете на О. Варбург, Р. Кун, П. Карера и др.Оказва се, че ролята на коензимите в двукомпонентните ензими се играе от повечето витамини (Е, К, Q, В1, В2, В6, В12, С, Н и др.) или съединения, изградени с участието на витамини, поради което трябва да се приемат с храната. Много ензими с голямо молекулно тегло проявяват каталитична активност само в присъствието на специфични вещества с ниско молекулно тегло, наречени коензими (или кофактори).
Характерна особеност на двукомпонентните ензими е, че нито протеиновата част, нито допълнителната група поотделно имат забележима каталитична активност. Само техният комплекс проявява ензимни свойства. В същото време протеинът рязко повишава каталитичната активност на допълнителната група, която му е присъща в свободно състояние в много малка степен; допълнителната група стабилизира протеиновата част и я прави по-малко уязвима към денатуриращи агенти.
Еднокомпонентните ензими са прости протеини.Еднокомпонентните ензими нямат допълнителна група, която може да влезе в пряк контакт със съединението, което се превръща. Тази функция се изпълнява от част от протеиновата молекула, наречена каталитичен център. Предполага се, че каталитичният център на еднокомпонентния ензим е уникална комбинация от няколко аминокиселинни остатъка, разположени в определена част от протеиновата молекула. Аминокиселинните остатъци, които образуват каталитичния център на еднокомпонентен ензим, са разположени в различни точки в една полипептидна верига. Следователно каталитичният център възниква в момента, когато протеиновата молекула придобие присъщата си третична структура. Следователно промяната в третичната структура на ензима под въздействието на определени фактори може да доведе до деформация на каталитичния център и промяна в ензимната активност.
В допълнение към каталитичния център, образуван от комбинация от аминокиселинни радикали или добавяне на коензим, в ензимите се разграничават още два центъра: субстратен и алостеричен. Под субстратния център се разбира частта от ензимната молекула, отговорна за прикрепването на вещество (субстрат), подложено на ензимна трансформация. Често това място се нарича "зона на закрепване" на ензима, където, като кораб на котва, става субстратът. Концепцията за каталитичен и субстратен център не трябва да се приема като абсолютна. В реалните ензими мястото на субстрата може да съвпада с (или да се припокрива) с каталитичното място. Освен това, каталитичният център може да бъде окончателно образуван по време на прикрепването на субстрата. Ето защо те често говорят за активния център на ензима, който е комбинация от първия и втория.
Алостеричният център е част от ензимната молекула, в резултат на прикрепването към която определено нискомолекулно (а понякога и високомолекулно) вещество променя третичната структура на протеиновата молекула. В резултат на това конфигурацията на активния център се променя, придружено от повишаване или намаляване на каталитичната активност на ензима.
Ензимите като биологични катализатори имат редица характеристики, които ги различават от неорганичните катализатори:
Ензимните реакции протичат при физиологично нормални за живия организъм условия и не изискват сурови условия - повишена температура, висока киселинност на средата, прекомерно налягане;
Ензимите като катализатори са строго специфични, те катализират само определени биохимични реакции, действайки само върху определен субстрат;
Ензимните реакции в живите организми протичат последователно, така че субстратът за всеки следващ ензим е крайният продукт на предшестващата го ензимна реакция;
Скоростта на ензимните реакции е висока, но зависи от определени фактори. Ускорете реакцията с 10 8 -10 20 пъти. Ензимните реакции протичат със 100% добив и не дават странични продукти. Catal се използва за изразяване на каталитична активност съгласно препоръките на Международния биохимичен съюз. Catal (cat) е каталитична активност, способна да извърши реакция със скорост от 1 mol за секунда;
Всички ензими са протеини. Молекулното тегло на ензимите варира в широки граници от 12*103 до 10*106 Da.
1.3 Методи за изолиране на ензими
Процесът на изолиране на протеин започва с прехвърлянето на тъканни протеини в разтвор. За целта тъканта (материалът), от който се получава ензимът, се смила внимателно в хомогенизатор в присъствието на буферен разтвор. За по-добро разрушаване на клетките към материала се добавя кварцов пясък, ако материалът е смлян в хаван. В резултат на това се получава каша - хомогенат. Ако не е извършено предварително фракциониране на клетъчни органели, хомогенатът съдържа фрагменти от клетки, ядра, хлоропласти и други клетъчни органели, разтворими пигменти и протеини.
При изолиране на ензими от тъканите на живи организми, включително растения, е необходимо да се спазват условия, които не причиняват денатурация на протеини. Цялата работа се извършва при ниска температура (4 0 C) и при стойности на pH на буферния разтвор, които са оптимални за този ензим.
След прехвърлянето на ензимите от тъканта в разтворено състояние, хомогенатът се подлага на центрофугиране за отделяне на неразтворимата част от материала, след което се изолират следните ензими в отделни фракции на екстракта-центрофугата.
Тъй като всички ензими са протеини, за получаване на пречистени ензимни препарати се използват същите методи за изолиране, както при работа с протеини.
Методи за избор:
утаяване на протеин от органични разтворители;
изсоляване;
метод на електрофореза;
метод на йонообменна хроматография;
Методът на центрофугиране
метод на гел филтрация;
метод на афинитетна хроматография или метод на афинитетна хроматография;
селективна денатурация.
1.4 Класификация и номенклатура на ензимите според вида на катализираната реакция
Класификацията и номенклатурата на ензимите се основава на типа реакция, която катализират, тъй като катализираната реакция е специфичната характеристика, по която един ензим се различава от друг.
През 1961 г. специална комисия на Международния биохимичен съюз предлага систематична номенклатура на ензимите. Ензимите са подразделени на 6 групи или класове според общ типреакциите, които катализират: оксидоредуктази, трансферази, хидролази, лиази, изомерази, лигази.
След това на всеки ензим се дава систематично име, което точно описва реакцията, която катализира. Въпреки това, тъй като много от тези систематични имена се оказаха много дълги и сложни, на всеки ензим беше присвоено тривиално, работно име, предназначено за ежедневна употреба. В повечето случаи се състои от името на веществото, върху което действа ензимът, указание за вида на катализираната реакция и окончанието -аза.
Международната ензимна комисия е разработила система за присвояване на кодови номера (шифри) на отделни ензими. Кодът на всеки ензим съдържа четири числа, разделени с точки. Съставен е по следния принцип:
А. Първото число показва към кой клас принадлежи ензимът.
B. Второто число, присвоено на ензим чрез класификация, обозначава подкласа. За оксидоредуктазите той показва естеството на групата в донорната молекула, която претърпява окисление (1- означава алкохолна група -CH-OH; 2-алдехидна или кетонна група и т.н.); за трансферазите, естеството на транспортираната група; в хидролазите, вида на хидролизируемата връзка; в лиазите, видът на връзката, която се разкъсва; за изомеразите, типът катализирана реакция на изомеризация; за лигазите, видът на новообразуваната връзка.Б. Третото число показва подкласа. За оксидоредуктазите той показва за всяка група донори вида на участващия акцептор (1 означава NAD + или NASP + коензим; 2- цитохром; 3- молекулярен кислород и т.н.); при трансферазите третото число обозначава вида на транспортираната група; в хидролазите, това число определя вида на хидролизируемата връзка, докато в лиазите, вида на групата, която трябва да се отцепи; за изомеразите, той определя естеството на трансформацията на субстрата, а за лигазите, той определя естеството на образуващото се съединение.
D. Четвъртото число показва серийния номер на ензимите в този подклас.
Класификацията на шифрите има много важно предимство - премахва необходимостта от промяна на номерата на всички следващи ензими при включването на новооткрити ензими в списъка. Новият ензим може да бъде поставен в края на съответния подклас, без да се нарушава останалата част от номерацията.
Ензимите се използват широко в такива индустрии като печене, пивоварство, винопроизводство, производство на чай, кожа и кожи, производство на сирене, натурални сокове, кафе, готвене (за преработка на месо) и др. AT последните годиниензимите започнаха да се използват във фината химическа промишленост за извършване на такива реакции органична химия, като окисление, редукция, дезаминиране, декарбоксилиране, дехидратация, кондензация, както и за разделяне и изолиране на изомери на L-серия аминокиселини (по време на химичния синтез се образуват рацемични смеси от L- и D-изомери), които са използвани в индустрията, селското стопанство и медицината. Овладяването на фините механизми на действие на ензимите несъмнено ще предостави неограничени възможности за получаване на полезни вещества в големи количества и с висока скорост в лабораторни условия с почти 100% добив.
Ензимите се използват в производството на перилни препарати и хартия, както и в технологични процесиза производството на кожа и текстил, фармацевтичната промишленост (фестал, мезимфорт). Сега стана възможно използването им в храната на животните.
Ензими, използвани в хранително-вкусовата промишленост широк обхватприложения, включително функциите на синтез и разлагане (разграждане). При избора на ензим за конкретен хранителен процес трябва да се обърне внимание на неговия източник и биохимични характеристики, което е важно за сертифицирането.
Подобно на други хранителни добавки, употребата на ензими в храните се регулира от закона.
2. Биокатализа
Биокатализа (ензимна катализа), ускоряване на химичните реакции под въздействието на ензими. Жизнената дейност се основава на многобройни химични реакции на разделяне на хранителни вещества, синтез необходими за тялото химични съединенияи трансформиране на тяхната енергия в енергия на физиологични процеси (работа на мускулите, бъбреците, нервна дейности т.н.). Всички тези реакции не биха могли да протичат с необходимата за живите организми скорост, ако механизмите за тяхното ускоряване с помощта на биокатализа не са възникнали в хода на еволюцията.
2.1 Как работят ензимите
Вещество, което претърпява трансформация в присъствието на ензим, се нарича субстрат. Субстратът се присъединява към ензима, което ускорява разкъсването на едни химични връзки в неговата молекула и създаването на други; полученият продукт се отделя от ензима.
Ензимите не подлежат на износване по време на реакцията. Те се освобождават при завършване на реакцията и веднага са готови да започнат следващата реакция. Теоретично това може да продължи безкрайно, поне докато изчерпят целия субстрат. На практика, поради тяхната чувствителност и органичен състав, продължителността на живота на ензимите е ограничена.
Според образния израз, използван в биохимичната литература, ензимът се доближава до субстрата като „ключ към ключалка“. Това правило е формулирано от E. Fischer през 1894 г. въз основа на факта, че специфичността на действието на ензима се определя от стриктното съответствие между геометричната структура на субстрата и активния център на ензима. Ензимът се свързва със субстрата, за да образува краткотраен комплекс ензим-субстрат (образуване на междинен комплекс). Въпреки това, въпреки че този модел обяснява високата специфичност на ензимите, той не обяснява феномена на стабилизиране на преходното състояние, който се наблюдава на практика. През 50-те години този статичен възглед е заменен от хипотезата на Д. Кошланд за индуцираното съответствие на субстрата и ензима. Същността му се свежда до факта, че пространственото съответствие между структурата на субстрата и активния център на ензима се създава в момента на тяхното взаимодействие помежду си, което може да се изрази с формулата „ръкавица-ръка“. Ензимите обикновено не са твърди, а гъвкави молекули. Активното място на ензима може да промени конформацията след свързване със субстрата. Страничните групи на аминокиселините на активния център заемат позиция, която позволява на ензима да изпълнява своята каталитична функция. В някои случаи молекулата на субстрата също променя конформацията след свързване с активното място. За разлика от модела ключ-заключване, моделът на индуцираното прилягане обяснява не само спецификата на ензимите, но и стабилизирането на преходното състояние.
Но в процеса на нарастващо развитие на науката, хипотезата на Кошланд постепенно се заменя с хипотезата за топохимично съответствие. Запазвайки основните положения на хипотезата за взаимно индуцирана настройка на субстрата и ензима, той обръща внимание на факта, че спецификата на действието на ензимите се обяснява предимно с разпознаването на тази част от субстрата, която не се променя по време на катализа. . Между тази част на субстрата и субстратния център на ензима възникват множество точкови хидрофобни взаимодействия и водородни връзки.
2.2 Фактори, влияещи върху ензимните реакции
Активността на ензимите и следователно скоростта на реакциите на ензимната катализа се влияе от различни фактори:
· Концентрация и достъпност на субстрата. При постоянно количество ензим скоростта нараства с увеличаване на концентрацията на субстрата. Тази реакция се подчинява на закона за масовото действие и се разглежда в светлината на теорията на Михаелис-Ментон.
· Ензимна концентрация. Концентрацията на ензими винаги е относително ниска. Скоростта на всеки ензимен процес силно зависи от концентрацията на ензима. За повечето хранителни приложенияскоростта на реакциите е пропорционална на концентрацията на ензимите. Изключение правят случаите, когато реакциите са доведени до много ниски нивасубстрат.
· Реакционна температура. До определена температура (средно до 50°C) каталитичната активност нараства, като за всеки 10°C скоростта на превръщане на субстрата се увеличава около 2 пъти. Като цяло, за ензими от животински произход тя е между 40 и 50°C, а за растителни – между 50 и 60°C. Най-оптималната температура е 37 o C, при която процесите в живия организъм протичат бързо, спестявайки голямо количество енергия. Има обаче ензими с по-висок температурен оптимум, например папаинът има оптимум при 80°C. В същото време каталазата има оптимална температура на действие между 0 и -10°C.
· рН на реакцията. Всеки ензим има определен диапазон от стойности на pH, при които ензимът проявява максимална активност. въпреки това най-добри условиятяхното функциониране са близки до неутралните стойности на pH. В рязко кисела или рязко алкална среда само някои ензими работят добре. Влиянието на pH на средата върху действието на ензимите се основава на факта, че има промяна в заряда на различни протеинови групи в активния център на ензима, което води до значителна промяна в конформацията на полипептидната верига. .
· Продължителност на процеса. За реакция на ензимна катализа от първи ред скоростта на реакцията намалява с времето, тъй като наличността на субстрата намалява. Такива реакции на ензимна катализа отнемат доста дълго време, за да завършат.
· Наличие на инхибитори или активатори. Химикали, способни да причинят вреден ефектвърху реакцията на ферментация се наричат "инхибитори". Като такива вещества могат да действат метали (мед, желязо, калций) или съединения от субстрати. Някои вещества могат да активират или стабилизират ензимите. Наличието на определени йони в реакционната среда може да активира образуването на активния субстрат на ензимния комплекс и в този случай скоростта на ензимната реакция ще се увеличи. Такива вещества се наричат активатори.
3. Характеристики на биомиметиката
Знанието, получено от хората от природата, се използва в съвременния свят навсякъде, от строителството до медицината. Днес това знание вече е съставило нова област на науката: биомиметика. Този термин е въведен за първи път от американския натуралист Джанин Бениус.
Биомиметиката е област от химията, която моделира процесите, протичащи в дивата природа. Откритията в областта на биомиметичните системи подготвят революция в областта на синтеза на нови материали. Разграничаване:
биологични, изучаващи процесите, протичащи в биологични системи;
· теоретични, изграждане на математически модели на тези процеси;
· технически, прилагане на модели на теоретична биомиметика за решаване на инженерни проблеми.
Институтът по проблеми на химическата физика на Руската академия на науките в Черноголовка вече е открил биомиметични подходи за ензимна азотна фиксация, анаеробно окисление на алкани (метан до метанол) и фотоокисление на вода за производство на кислород (това правят растенията по време на фотосинтеза ).
Продуктът боя Lotosan, произведен в Германия, е много устойчив на замърсяване. Идеята е взета от лотосови цветя, които растат в блатисти райони и въпреки това запазват своята белота. Оказа се, че въпросът е в микроскопичните шипове, покриващи повърхността на цветето. Те предотвратяват задържането на частици по листенцата и позволяват на дъждовната вода лесно да ги отмие. В момента разработчиците се борят да създадат леки, еластични и здрави (5 пъти по-здрави от стоманата) уеб-базирани материали. Идеологията на биомиметиката твърдо зае мястото си в различни дисциплини - инженерство, химични технологии, нанотехнологии и много други. Учените ще се опитат да намерят химически аналози на ензими и да създадат нови промишлени процеси на тяхна основа. И този процес само ще набира скорост с времето.
Заключение
В тази статия един от биологичните активни веществаа именно ензими. Ензимите са биологичен катализаторбелтъчна природа, ускоряване на химичните реакции в живите организми и извън тях. Ензимите имат уникални свойства, които ги отличават от конвенционалните органични катализатори. Това е преди всичко необичайно висока каталитична активност. Друго важно свойство на ензимите е селективността на тяхното действие.
Важно свойство на ензимите, което трябва да се вземе предвид при практическото им използване, е стабилността, т.е. способността им да поддържат каталитична активност.
Поради високата специфичност на ензимите, в тялото не цари хаос: всеки ензим изпълнява строго възложените му функции, без да засяга хода на много десетки и стотици други реакции, протичащи в неговата среда. Ролята на ензимите в живота на организмите е голяма.
Бъдещето на ензимите е много интересно. Технологията за откриване и производство на нови ензими напредва с бързи темпове. Преди да се развие използването и производството на ензими през по-голямата частчрез проба и грешка. Тъй като детайлите, които влияят върху химията и действието на ензимите, са били слабо известни, в препаратите са използвани смеси от най-универсалните ензими. Благодарение на нови изследвания, по-специфични ензими могат да бъдат използвани в производството на предлагани на пазара продукти.
Днес развиващите се технологии всеки ден разкриват все повече и повече нови чудеса на сътворяването на живота, а „биомиметиката“ като наука избира за примери отлични системи в организмите на живите същества, създавайки изобретения по техен образ и подобие в полза и полза на хората. Учените ще се опитат да намерят химически аналози на ензими и да създадат нови промишлени процеси на тяхна основа.
Библиография
1. http://www.krugosvet.ru/articles/03/1000310/1000310a1.htm
2. Габриелян О.С., Маскаев Ф.Н., Пономарев С.Ю., Теренин В.И. Учебник по химия 10 клас. - М., 2005.
3. Нечаев А.П., Кочеткова А.А., Зайцев А.Н. Хранителни добавки - М., 2001.
4. Биохимия на растителни материали / Ed. Щербакова В.Г. М., 1999.
5. http://www.gazeta.ru/science/2007/10/15_a_2241957.shtml?incut2
6. http://www.cleandex.ru/articles/2008/07/07/biomimetic-1
Приложение 1
маса 1
| Ензимни класове | катализирана реакция | Примери за ензими или техните групи (дадени са тривиални имена) |
| Оксидоредуктаза | Прехвърляне на водородни атоми или електрони от едно вещество в друго | Дехидрогеназа, оксидаза |
| Трансферази | Пренасяне на определена група атоми - метилова, ацилова, фосфатна или аминогрупа - от едно вещество в друго | трансаминаза, киназа |
| Хидролази | Реакции на хидролиза | Липаза, амилаза, пептидаза |
| Лиаза | Нехидролитично добавяне към субстрат | Декарбоксилаза, фумараза, алдолаза |
| Изомерази | вътрешномолекулно пренареждане | Изомераза, мутаза |
| Лигази | Свързването на две молекули в резултат на образуването на нови C-C връзки, C-N, C-O или C-S, свързани с разграждането на АТФ | Синтетаза |
Приложение 2
Някои примери за употребата на ензими в промишлеността
таблица 2
| Ензим | Индустрия | Използване | |
| Амилаза (разгражда нишестето) | пивоварна | Захаризиране на нишестето, съдържащо се в малца | |
| текстил | Отстраняване на нишестето, нанесено върху конците по време на оразмеряването | ||
пекарна |
нишесте глюкоза. Клетките на дрождите, ферментирайки глюкоза, образуват въглероден диоксид, чиито мехурчета разхлабват тестото и придават на хляба пореста структура. Хлябът покафенява по-добре и остава застоял по-дълго | ||
Протеази (разделяне |
папаин | пивоварна | Етапи на процеса на варене, които регулират качеството на пяната |
| месо | Омекотяване на месото. Този ензим е доста устойчив на повишаване на температурата и продължава да действа известно време, когато месото се нагрява. След това, разбира се, се дезактивира | ||
| фармацевтични | Добавки за паста за зъби за отстраняване на плака | ||
| фицин | снимка | Отмиване на желатина от използвания филм, за да се извлече среброто в него | |
| пепсин | храна | Производство на "готови" зърнени храни | |
| фармацевтични | Помощ за храносмилането (в допълнение към нормалното действие на пепсин в стомаха) | ||
| трипсин | храна | Производство на продукти за бебешка храна | |
| ренин | производство на сирене | Коагулация на мляко (получаване на съсирек от казеин) | |
|
истински протеази |
Пералня | Перилни препарати с ензимни добавки | |
| Кожа | Разделяне на космите – метод, при който не се уврежда нито косата, нито кожата | ||
| текстил | Извличане на вълна от остатъци от овчи кожи | ||
Отдавна е установено, че всички ензими са протеини и имат всички свойства на протеините. Следователно, подобно на протеините, ензимите се делят на прости и сложни.
прости ензимиса съставени само от аминокиселини, напр. пепсин , трипсин , лизозим.
Комплексни ензими(холоензими) имат в състава си белтъчна част, състояща се от аминокиселини – апоензим, и небелтъчна част – кофактор. Кофактор, от своя страна, може да бъде посочен като коензим или простетична група. Пример може да бъде сукцинат дехидрогеназа(съдържа FAD) (в цикъла на трикарбоксилната киселина), аминотрансферази(съдържат пиридоксал фосфат), пероксидаза(съдържа хем).
За осъществяването на катализа е необходим пълноценен комплекс от апопротеин и кофактор, те не могат да катализират поотделно. Кофакторът е част от активния център, участва в свързването на субстрата или в неговата трансформация.
Както много протеини, ензимите могат да бъдат мономери, т.е. се състои от една подединица и полимерисъстоящ се от няколко субединици.
Структурна и функционална организация на ензимите
В състава на ензима се разграничават области, които изпълняват различни функции:
1. Активен център - комбинация от аминокиселинни остатъци (обикновено 12-16), която осигурява директно свързване към субстратната молекула и катализа. Аминокиселинните радикали в активния център могат да бъдат във всяка комбинация, докато аминокиселините са разположени наблизо, които са значително отдалечени една от друга в линейната верига. В активния център има две секции:
- котва(контакт, свързване) - отговаря за свързването и ориентацията на субстрата в активния център,
- каталитичен- пряко отговорен за изпълнението на реакцията.
Схема на структурата на ензимите
Ензимите, които имат няколко мономера в състава си, могат да имат няколко активни центъра според броя на субединиците. Също така две или повече субединици могат да образуват едно активно място.
При сложните ензими функционалните групи на кофактора задължително се намират в активния център.
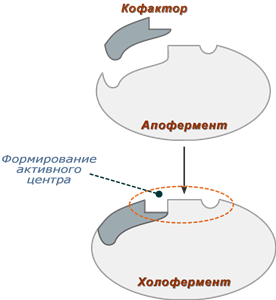
Схема на образуване на сложен ензим
2. Алостеричен център (allos- чужд) - центърът за регулиране на ензимната активност, който е пространствено отделен от активния център и не е достъпен за всички ензими. Свързването към алостеричния център на всяка молекула (наречена активатор или инхибитор, както и ефектор, модулатор, регулатор) предизвиква промяна в конфигурацията на ензимния протеин и в резултат на това скоростта на ензимната реакция.
Алостеричните ензими са полимерни протеини, активните и регулаторните центрове са разположени в различни субединици.

Схема на структурата на алостеричен ензим
Продуктът от тази или една от следващите реакции, субстратът на реакцията или друго вещество може да действа като такъв регулатор (виж "Регулиране на ензимната активност").
Изоензими
Изоензимите са молекулярни форми на един и същи ензим, произтичащи от малки генетични разлики в първичната структура на ензима. Различните изоензими определят скоростта и посоката на реакцията поради различния афинитет към субстрата.
Например димерният ензим креатинкиназа (СК) е представен от три изоензимни форми, съставени от два вида субединици: М (англ. мускул- мускул) и B (англ. мозък- мозък). Креатин киназа-1 (СК-1) се състои от субединици тип В и е локализирана в мозъка, креатин киназа-2 (СК-2) има една М- и В-субединица, активна е в миокарда, две М-субединици, специфични за скелетните мускули.
Има и пет изоензима лактат дехидрогеназа(роля на LDH) - ензим, участващ в метаболизма на глюкозата. Разликите между тях са в различното съотношение на Н субединиците (англ. сърце- сърце) и М (англ. мускул- мускул). Лактат дехидрогеназа тип 1 (H 4) и 2 (H 3 M 1) присъства в тъкани с аеробикаметаболизъм (миокард, мозък, кортикален слой на бъбреците), имат висок афинитет към млечна киселина (лактат) и я превръщат в пируват. LDH-4 (H 1 M 3) и LDH-5 (M 4) се намират в тъкани, склонни към анаеробниметаболизъм (черен дроб, скелетни мускули, кожа, бъбречна медула), имат нисък афинитет към лактат и катализират превръщането на пируват в лактат. В тъкани с междинентип метаболизъм (далак, панкреас, надбъбречни жлези, Лимфните възли) е доминиран от LDH-3 (H 2 M 2).
