Скоростта на ензимната реакция зависи от. Зависимост на скоростта на ензимната реакция от температурата
Лекция №6
Основи на ензимната катализа.
Разказизучаване на кинетиката на ензимните реакции. Зависимост на скоростта на ензимната реакция от температурата, pH, концентрацията на ензима и концентрацията на субстрата. Извеждане на уравнението на Михаелис-Ментен. ензимна активност. Каталитичната константа е броят на оборотите на ензима. Максималната скорост на ензимната реакция (V max). Константа на дисоциация на ензим-субстратния комплекс (K s). Константа на Михаелис-Ментен (K m).
Кратка история на изследването на кинетиката на ензимните реакции.
Ензимната кинетика изучава моделите на влияние на химическата природа на реагиращите вещества (ензими, субстрати) и условията на тяхното взаимодействие (концентрация, рН на средата, температура, наличие на активатори или инхибитори) върху скоростта на ензимната реакция. Основната цел на изучаването на кинетиката на ензимните реакции е да се получи информация, която може да помогне за изясняване на молекулярния механизъм на действие на ензима.
Общите принципи на кинетиката на химичните реакции се прилагат и за ензимните реакции.
Най-ранният опит да се опишат математически ензимните реакции е направен от Дюкло през 1898 г. Браун (1902 г.) и независимо Анри (1903 г.) са първите, които изказват хипотезата, че по време на реакцията се образува комплекс ензим-субстрат. Това предположение се основава на три експериментални факта:
1. папаинът образува неразтворимо съединение с фибрин (Wurtz, 1880);
2. захарозата предпазва ензима инвертаза от топлинна денатурация (O'Sullivan и Thompson, 1890);
3. Фишър през 1898-1899 г. показва, че ензимите са стереохимични специфични катализатори.
МАЙКЛИС, Леонор
Леонор Михаелис - немски биохимик и органичен химик, основател на кинетиката на ензимните процеси. Основните трудове са посветени на изучаването на ензимните реакции. През 1913 г. той въвежда константа (константа на Майкълис) в уравнението на зависимостта на скоростта на ензимната реакция от концентрацията на субстрата в стационарно състояние (уравнение на Майкълис-Ментен).
Зависимост на скоростта на ензимната реакция от температурата, pH, концентрацията на ензима и концентрацията на субстрата.
Предварителните експерименти за изследване на кинетиката на ензимните реакции показаха, че скоростта на реакцията E + S E + P, противно на теоретичните очаквания, не зависи от концентрацията на ензима и субстрата, както в случая на конвенционален вторичен реакция на поръчката.
В същото време за ензимите са приложими три основни критерия, които са характерни и за неорганичните катализатори, а именно:
1. Те остават непроменени след реакцията, т.е. освободени, те могат да реагират отново с нови субстратни молекули (въпреки че страничните ефекти на условията на околната среда върху активността на ензима не могат да бъдат изключени).
2. Ензимите са в състояние да действат в незначителни концентрации (например, една молекула от ензима ренин, съдържаща се в лигавицата на стомаха на теле, извива около 10 6 молекули млечен казеиноген за 10 минути при температура 37 ° C) . Наличието или отсъствието на ензим или друг катализатор не влияе върху стойността на равновесната константа и свободната енергия (ΔG).
3. Катализаторите само увеличават скоростта, с която системата се доближава до термодинамичното равновесие, без да изместват равновесната точка.
Активността на ензима се влияе от всички онези фактори, които могат да причинят промяна в неговата структура, а именно такива фактори включват:
3. Сили, действащи в течни среди (хидродинамични сили, хидростатично наляганеи повърхностно напрежение)
4. Химически агенти (алкохол, урея или водороден прекис и др.)
5. Облъчване (светлина, звук, йонизиращо лъчение)
6. Различни химични съединения, които чрез свързване с ензими могат да променят скоростта на реакциите, катализирани от ензими.
Понякога намаляването на каталитичната активност, причинено, например, от промяна на pH, е обратимо. В такива случаи връщането към първоначалните условия е придружено от възстановяване на ензимната активност. Възможна е и необратима промяна в ензимната активност.
Нека разгледаме влиянието на различни фактори върху скоростта на ензимната реакция.
Температурен ефект
Едно от основните уравнения на химичната кинетика е уравнението на Арениус, което изразява зависимостта на константата на скоростта на реакцията от температурата:
Обаче температурният диапазон на ензимните реакции, за които е приложимо уравнението на Арениус, е много тесен за повечето ензими. Какво се случва, ако се опитаме да принудим ензима да катализира процеса още по-бързо, като повишим температурата над физиологично допустимата? При високи температури, когато процесът на термична инактивация на ензима започва да доминира, зависимостта на скоростта на реакцията от температурата, описана от уравнението на Арениус, се нарушава - а именно след определен температурен максимум скоростта на реакцията бързо пада до нула . От друга страна, когато температурата падне под 0°C, скоростта на реакцията също пада до нула, т.е. реакцията спира напълно. По този начин ензимните реакции имат камбанообразна зависимост на скоростта на реакцията от температурата, което се обяснява със суперпозицията на два ефекта - увеличаване на скоростта на реакцията с повишаване на температурата и ускоряване на термичната денатурация на протеиновата молекула, което води до ензим инактивиране при високи температури. Денатурацията на повечето протеини започва в температурния диапазон от 45 до 50°C и завършва много бързо при 55°C. Спирането на ензимните реакции при ниски температури се дължи на факта, че водни разтворизамръзвам.
По този начин термолабилността или чувствителността към повишаване на температурата е една от характерни свойстваензими, които рязко ги отличават от неорганичните катализатори. При температура 90°C почти всички ензими губят своята активност (изключение правят само два ензима - миокиназа, която издържа на нагряване до 100°C, ДНК полимераза от термофилни бактерии при макс. 90°C). Оптималната температура за действие на повечето ензими при топлокръвните животни е 40-45°С; при тези условия скоростта на реакцията е максимална поради увеличаване на кинетичната енергия на реагиращите молекули. При ниски температури (4 ° C и по-ниски) ензимите като правило не се разрушават, въпреки че тяхната активност пада почти до нула. Това явление се дължи на промяна в структурата на активния център на ензима поради намаляване на плътността на водата. Във всички случаи времето на излагане на съответната температура има значение. Понастоящем за пепсин, трипсин и редица други ензими е доказано наличието на пряка връзка между скоростта на инактивиране на ензима и степента на денатурация на протеина. По този начин влиянието на температурата върху скоростта на ензимната реакция се подчинява на уравнението на Арениус само в сравнително тесен температурен диапазон от 4-45°C. Извън този диапазон скоростта на ензимните реакции рязко намалява, което се отчита и използва в хранителните технологии и при съхранението на храни и лекарства, съдържащи ензими. Дай примери.

Влияние на pH на средата.
Ензимите, както всички протеини, са изградени от аминокиселини. В зависимост от pH, радикалите на някои аминокиселини, а оттам и протеинът като цяло, могат да придобият заряд. Заредените групи често са част от активните центрове на ензимите, тъй като редица механизми на ензимна катализа се основават на киселинен или основен тип катализа. Необходимо условие за осъществяване на киселинна или основна катализа може да бъде наличието на определен заряд върху йонизиращите се групи на активния център. От това следва, че каталитично активната форма на ензима съществува само в едно строго определено състояние на йонизация и в зависимост от pH, по-голяма или по-малка част от целия ензим, присъстващ в сместа, може да се превърне в него.
Зависимостта на ензимната активност от рН е камбановидна с доста тесен максимум. За различните ензими стойността на pH, при която ензимът има максимална активност, е различна. В експеримента изследването на рН зависимостите на ензимните реакции често се използва за изследване на броя и свойствата на йоногенните групи.
При определяне на зависимостта на ензимната активност от концентрацията на водородни йони реакцията се провежда при различни значения pH на средата, обикновено при оптимална температура и в присъствието на достатъчно високи (насищащи) концентрации на субстрата. Фигурата и таблицата показват оптималните стойности на pH за редица ензими.

Ориз. Зависимост на ензимната активност от pH.
 |
От данните в табл. 4.3 може да се види, че pH-оптимумът на действието на ензимите е в рамките физиологични стойности. Изключение прави пепсинът, чийто рН оптимум е 2,0 (при рН 6,0 той е неактивен и нестабилен). Това се обяснява, първо, със структурната организация на ензимната молекула и, второ, с факта, че пепсинът е компонент на стомашния сок, съдържащ свободни солна киселина, което създава оптимална кисела среда за действието на този ензим. От друга страна, рН оптимумът на аргиназата се намира в силно алкалната зона (около 10,0); няма такава среда в чернодробните клетки, следователно, in vivo аргиназата функционира, очевидно, не в своята оптимална рН зона на средата.
Според съвременните концепции ефектът от промените в рН на средата върху ензимната молекула се състои в ефекта върху състоянието и степента на йонизация на киселинни и основни групи (по-специално COOH групите на дикарбоксилните аминокиселини, SH групата на цистеина, имидазоловия азот на хистидина, NH2 групата на лизина и др.). При резки промени от оптималното pH на средата, ензимите могат да претърпят конформационни промени, водещи до загуба на активност поради денатурация или промяна в заряда на ензимната молекула. При различни стойности на pH на средата, активният център може да бъде в частично йонизирана или нейонизирана форма, което засяга третичната структура на протеина и съответно образуването на активния ензимно-субстратен комплекс. В допълнение, състоянието на йонизация на субстратите и кофакторите е важно.
Белтъчната природа на ензимите определя появата на редица свойства в тях, които като цяло не са характерни за неорганичните катализатори: олигодинамичност, специфичност, зависимост на скоростта на реакцията от температурата, рН на средата, концентрациите на ензими и субстрати и наличието на активатори и инхибитори.
Под олигодинамиченензимите разбират високата ефективност на действие в много малки количества. Такава висока ефективност се обяснява с факта, че ензимните молекули непрекъснато се регенерират по време на тяхната каталитична активност. Типичната ензимна молекула може да се регенерира милиони пъти в минута. Трябва да се каже, че неорганичните катализатори също са способни да ускорят преобразуването на такова количество вещества, което многократно надвишава собствената им маса. Но никой неорганичен катализатор не може да се сравни с ензимите по отношение на ефективността.
Такъв пример е ензимът ренин, който се произвежда от стомашната лигавица на преживните животни. Една молекула от него за 10 минути при 37°C е в състояние да предизвика коагулация (подсирване) на около милион молекули млечен казеиноген.
Друг пример висока ефективносткаталазата осигурява ензими. Една молекула от този ензим при 0°C разгражда около 50 000 молекули водороден пероксид за секунда:
2 H2O2 2 H2O + O2
Действието на каталазата върху водородния пероксид е да промени енергията на активиране на тази реакция от приблизително 75 kJ/mol без катализатор до 21 kJ/mol в присъствието на ензима. Ако се използва колоидна платина като катализатор за тази реакция, тогава енергията на активиране е само 50 kJ/mol.
7.2.2. Когато се изследва влиянието на който и да е фактор върху скоростта на ензимната реакция, всички други фактори трябва да останат непроменени и, ако е възможно, да имат оптимална стойност.
Мярка за скоростта на ензимните реакции е количеството субстрат, което е претърпяло трансформация за единица време, или количеството на образувания продукт. Промяната в скоростта се извършва в началния етап на реакцията, когато продуктът все още практически липсва и обратната реакция не се случва. Освен това в началния етап на реакцията концентрацията на субстрата съответства на първоначалното му количество.
7.2.3. Зависимост на скоростта на ензимната реакция (V) от концентрацията на ензима[E](Фигура 7.3). При висока концентрация на субстрата (многократно по-висока от концентрацията на ензима) и при постоянство на други фактори скоростта на ензимната реакция е пропорционална на концентрацията на ензима. Следователно, знаейки скоростта на реакцията, катализирана от ензима, може да се направи заключение за количеството му в изследвания материал.
Фигура 7.3.Зависимост на скоростта на ензимната реакция от концентрацията на ензима
7.2.4. Зависимост на скоростта на реакцията от концентрацията на субстрата[С]. Графиката на зависимостта има формата на хипербола (Фигура 7.4). При постоянна концентрация на ензима скоростта на катализираната реакция нараства с увеличаване на концентрацията на субстрата до максималната стойност Vmax, след което остава постоянна. Това трябва да се обясни с факта, че при високи концентрации на субстрата всички активни центрове на ензимните молекули са свързани с молекулите на субстрата. Всеки излишен субстрат може да се свърже с ензима само след образуването на реакционния продукт и освобождаването на активния център.

Фигура 7.4.Зависимост на скоростта на ензимната реакция от концентрацията на субстрата.
Зависимостта на скоростта на реакцията от концентрацията на субстрата може да се изрази чрез уравнението на Михаелис-Ментен:
 ,
,
където V е скоростта на реакцията при концентрация на субстрат [S], Vmax е максималната скорост и KM е константата на Михаелис.
Константата на Михаелис е равна на концентрацията на субстрата, при която скоростта на реакцията е половината от максималната. Определянето на KM и Vmax е важно практическа стойност, тъй като позволява количествено описание на повечето ензимни реакции, включително реакции, включващи два или повече субстрата. различни химически вещества, които променят активността на ензимите, влияят по различен начин на стойностите на Vmax и KM.
7.2.5. Зависимостта на скоростта на реакцията от t - температурата, при която протича реакцията (Фигура 7.5) е сложен. Температурната стойност, при която скоростта на реакцията е максимална, е температурният оптимум на ензима. Оптималната температура за повечето ензими в човешкото тяло е приблизително 40°C. За повечето ензими оптималната температура е равна или по-висока от температурата, при която се съхраняват клетките.
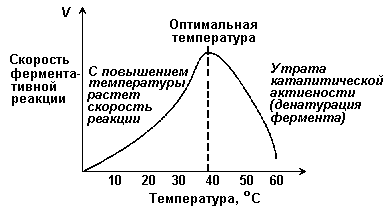
Фигура 7.5.Зависимостта на скоростта на ензимната реакция от температурата.
При по-ниски температури (0° - 40°C) скоростта на реакцията нараства с повишаване на температурата. Когато температурата се повиши с 10°C, скоростта на ензимната реакция се удвоява (температурният коефициент Q10 е равен на 2). Увеличаването на скоростта на реакцията се обяснява с увеличаването на кинетичната енергия на молекулите. При по-нататъшно повишаване на температурата връзките, които поддържат вторичната и третичната структура на ензима, се разрушават, т.е. термична денатурация. Това е придружено от постепенна загуба на каталитична активност.
7.2.6. Зависимостта на скоростта на реакцията от рН на средата (Фигура 7.6). При постоянна температура ензимът работи най-ефективно в тесен диапазон на pH. Стойността на pH, при която скоростта на реакцията е максимална, е оптималното pH на ензима. За повечето ензими в човешкото тяло оптималното pH е в рамките на pH 6–8, но има ензими, които са активни при стойности на pH извън този диапазон (например пепсин, който е най-активен при pH 1,5–2,5).
Промяната на рН както към киселинната, така и към алкалната страна от оптималното води до промяна в степента на йонизация на киселинните и основните групи аминокиселини, които изграждат ензима (например COOH групи на аспартат и глутамат, NH2 групи на лизин и др.). Това води до промяна в конформацията на ензима, което води до промяна в пространствената структура на активния център и намаляване на неговия афинитет към субстрата. В допълнение, при екстремни стойности на pH, ензимът се денатурира и инактивира.

Фигура 7.6.Зависимост на скоростта на ензимната реакция от pH на средата.
Трябва да се отбележи, че оптималната характеристика на pH на ензима не винаги съвпада с pH на неговата непосредствена вътреклетъчна среда. Това предполага, че средата, в която се намира ензимът, до известна степен регулира неговата активност.
7.2.7. Зависимост на скоростта на реакцията от наличието на активатори и инхибитори . Активаторите повишават скоростта на ензимната реакция. Инхибиторите забавят скоростта на ензимната реакция.
Неорганичните йони могат да действат като ензимни активатори. Смята се, че тези йони карат ензима или субстратните молекули да приемат конформация, която насърчава образуването на ензим-субстратен комплекс. Това увеличава вероятността от взаимодействие между ензима и субстрата, а оттам и скоростта на реакцията, катализирана от ензима. Например активността на слюнчената амилаза се повишава в присъствието на хлоридни йони.
Механизмът на действие на ензимите. Каталитичен (активен) център. коензими и кофактори. Конкурентно и неконкурентно инхибиране. Използването на конкурентни инхибитори като лекарства.
активен център(Ac) е част от ензимната молекула, която специфично взаимодейства със субстрата и участва пряко в катализата. Тъй като, като правило, се намира в ниша (джоб). Могат да се разграничат два региона в Ac: субстрат-свързващият регион, площ на субстрата (контактна подложка) и всъщност каталитичен център .
Повечето субстрати образуват най-малко три връзки с ензима, поради което молекулата на субстрата е прикрепена към активния център по единствения възможен начин, който осигурява субстратната специфичност на ензима. Каталитичният център осигурява избора на пътя на химичната трансформация и каталитичната специфичност на ензима.
Група регулаторни ензими имат алостерични центрове , които са извън активния център. Към алостеричния център могат да бъдат прикрепени „+“ или „–“ модулатори, които регулират активността на ензимите.
Има прости ензими, състоящи се само от аминокиселини и сложни, които включват и нискомолекулни органични съединения с непротеинова природа (коензими) и (или) метални йони (кофактори).
Коензими- Това са органични вещества с небелтъчна природа, които участват в катализата като част от каталитичното място на активния център. В този случай протеиновият компонент се нарича апоензим и каталитично активната форма на сложен протеин - холоензим . Така: холоензим = апоензим + коензим.
Те функционират като коензими:
Нуклеотидите
Коензим Q
· Глутатион
Производни на водоразтворими витамини:
Коензим, който е свързан с протеин чрез ковалентни връзки, се нарича протезна група . Това са например FAD, FMN, биотин, липоева киселина. Протетичната група не се отделя от протеиновата част. Коензим, който е свързан с протеин чрез нековалентни връзки, се нарича косубстрат . Това са например OVER +, NADP +. Косубстратът е прикрепен към ензима по време на реакцията.
Ензимни кофактори- това са метални йони, необходими за проявата на каталитичната активност на много ензими. Като кофактори действат йони на калий, магнезий, калций, цинк, мед, желязо и др. Тяхната роля е разнообразна, стабилизират субстратните молекули, активния център на ензима, неговата третична и кватернерна структура, осигуряват свързване на субстрата и катализа. Например, АТФ се свързва с кинази само заедно с Mg 2+.
Концентрацията на ензима оказва значително влияние върху скоростта на ензимната реакция. При насищаща субстратна концентрация, осигуряваща V max ,начална скоростензимната реакция ще зависи преди всичко от концентрацията на ензима. Тази зависимост е правопропорционална, което показва, че началната скорост е мярка за количеството ензим. Графично това е показано на фиг. 8.5.
Ориз. 8.5.Влиянието на концентрацията на ензима [E] върху скоростта на ензимната реакция ( V0)
Влияние на температурата върху ензимната активност.Общият изглед на кривата, характеризираща ефекта на температурата върху ензимната активност, може да бъде представен като графика, показана на фиг. 8.6.
Оптималната температура, при която се наблюдава максимална активност за повечето ензими, е в диапазона 37-50 0 С, но някои ензими имат температурен оптимум извън тази зона.

Ориз. 8.6.Ефект на температурата върху ензимната активност
Ефектът на температурата върху ензимната активност, който лесно може да бъде изследван експериментално, е много сложен, тъй като се дължи на редица фактори, а именно:
Ефектът на температурата върху скоростта на разцепване на ES комплекса върху свободния ензим и реакционния продукт, т.е. върху константата на скоростта на реакцията
Влиянието на температурата върху афинитета на ензима към субстрата, т.е. върху константите k+1и к _,;
Влияние върху топлината на йонизация и следователно върху процесите на йонизация на всички компоненти на реакцията: самия ензим, субстрата, междинните и крайните продукти на реакцията;
Влияние върху образуването на съединения като "ензимен активатор" или "ензимен инхибитор";
Влияние върху процеса на денатурация на ензимния протеин.
Добре известното уравнение на Арениус, характеризиращо влиянието на температурата върху скоростта химическа реакция, може да се приложи към лявата страна на температурната крива (виж Фиг. 8.6):
Това уравнение дава възможност да се определи енергията на активиране чрез определяне на стойностите на Q 10 за дадена ензимна реакция.
За обикновени химични реакции Q 10 = 2-3, за ензимни реакции (лявата страна на температурната крива) Q 10 = 1-2, а стойността на Q 10 = 1 е типична за температури, близки до оптималните.
Дясната страна на температурната крива показва рязко намаляване на скоростта на ензимната реакция при температури над оптималните. И това зависи преди всичко от денатурацията на ензимния протеин. Следователно много важен показател, характеризиращ съотношението на ензима към температурата, е неговата термична стабилност.
Термичната стабилност на ензима се състои, така да се каже, от два критерия: величината на температурата и времето на нейното действие върху ензима. В допълнение, термичната стабилност на различни ензими може да бъде повлияна от такива фактори като рН на средата, нейния солев състав, защитно действиесубстрат.
Влияние на pH върху активността на ензимите.Всеки ензим се характеризира с определен тесен диапазон от стойности на pH, при които проявява максимална активност.
Формата на кривите, описващи зависимостта на ензимната активност от рН, отразява способността на важните за този ензим протон-донорни или протон-акцепторни групи в активния център на ензима да преминат в състояние с необходимата степен на йонизация при определени Стойности на pH (виж Фиг. 8.7).

Ориз. 8.7.Криви, характеризиращи зависимостта на ензимната активност от pH
В допълнение към влиянието на pH върху състоянието на йонизация на активния център на ензима, ходът на представените криви ще зависи и от други фактори. По-специално, промяната в pH на средата променя състоянието на йонизация на субстрата (ако е заредено вещество), ES и EP комплекси, в някои, например, редокс реакции, H + йони
сами могат да участват в реакцията; в допълнение, скоростта на денатурация на ензимния протеин зависи от рН.
При експериментално изследване на ензимната активност като функция от рН трябва да се помни, че оптимумът на рН зависи от състава на средата (от естеството на използвания буфер); рН оптимуми директно и обратна реакцияможе да бъде напълно различен; при действието на един и същи ензим върху различни субстрати, рН оптимумите също могат да бъдат различни. В допълнение към концепцията за оптимално pH, концепцията за стабилност на pH е много важна. Това е диапазонът на pH, в който ензимът или ензимният препарат запазва своята активност за определен период от време. Стабилността на рН също зависи от редица фактори, сред които, в допълнение към вече споменатите, формата на ензимния препарат, степента на неговото пречистване и др.
Всичко по-горе предполага, че чрез промяна на температурния режим и рН може до известна степен да се регулира каталитичната активност на ензима.
Влияние на активатори и инхибитори.Активаторите са вещества, които повишават активността на ензимите. Добри примери за такива съединения са аминокиселината цистеин и редуцираният глутатион, съдържащ свободна SH група. Техният активиращ ефект се състои в това, че те възстановяват дисулфидните връзки с образуването на SH-групи, необходими за проявата на каталитичната активност на тиоловите ензими. В допълнение, някои ензими се активират от метали, които или участват в изграждането на активния център, или стабилизират пространствената конформация на ензимния протеин и по този начин осигуряват проявата на каталитични функции.
Инхибиторите са вещества, които специфично намаляват активността на ензимите. Намалете или пълна загубаЕнзимната активност може да бъде причинена от различни видове денатуриращи ефекти, в който случай е по-правилно да се използва терминът "инактивиране" на ензима.
Механизмът на действие на инхибиторите може да бъде много разнообразен:
Инхибиторът взаимодейства с апоензима, като са възможни такива варианти като свързване на функционални групи на протеина, промени в третичната и кватернерната структура на апоензима, специфично свързване към определено място на апоензима, неспецифична адсорбция върху протеина;
Инхибиторът образува комплекс със субстрата;
Инхибиторът свързва коензима;
Инхибиторът свързва активатора;
Инхибиторът свързва кофактора.
Най-често инхибиторът взаимодейства с ензима, образувайки комплекс. Това може да се изрази със следното уравнение:
Константата на дисоциация на комплекса ензим-инхибитор (или константа на инхибиране) K i се определя от израза:
K iе право пропорционална на концентрацията на ензима и инхибитора и обратно пропорционална на концентрацията на комплекса ензим-инхибитор.
Има два основни вида инхибиране: необратимо и обратимо. Теоретично, в случай на необратимо инхибиране k -1 = 0, тоест EI комплексът е толкова силен, че изобщо не се дисоциира. Но за повечето необратими инхибитори, стойността к-1 _, макар и много малко, не е равно на нула.
Обратимото инхибиране от своя страна е конкурентно и неконкурентно.
Конкурентен инхибитор се конкурира със субстрата въз основа на структурно сходство чрез свързване към активното място на ензима, за да образува неактивен комплекс ензим-инхибитор. Отличителна чертаконкурентното инхибиране е, че то може да бъде елиминирано или отслабено чрез увеличаване на концентрацията на субстрата. Конкурентен инхибитор намалява афинитета на ензима към субстрата; следователно стойността на Km се увеличава в присъствието на конкурентен инхибитор.
Графично това изглежда като показаното на фиг. 8.8

Ориз. 8.8.Конкурентно инхибиране: 1
- без инхибитор; 2-
с конкурентен инхибитор
При неконкурентно инхибиране инхибиторът не се свързва с активното място на ензима (тоест не там, където е прикрепен субстратът), а с друга част от ензимната молекула. Очевидно в този случай инхибиторът не влияе върху стойността на константата на Михаелис K t,но ще намалее максимална скоростреакции - Vmax
Графично това може да се изобрази по следния начин (виж Фиг. 8.9):

Ориз. 8.9.Неконкурентно инхибиране: 1- без инхибитор; 2-ри неконкурентен инхибитор
Едни от най-често срещаните неконкурентни инхибитори са алостеричните инхибитори. Прикрепвайки се не към активния, а към друг, така наречения алостеричен център на ензимната молекула, инхибиторът предизвиква конформационни промени в структурата на активния център, в резултат на което образуването на ензимно-субстратния комплекс става невъзможно.
Изследването на взаимодействието на ензими с ензимни инхибитори и активатори дава ценна информация за субстратната специфичност на ензимите, естеството на функционалните групи на активния център и механизмите на каталитичната активност.
Тъй като крайните продукти на реакцията, различни междинни продукти на метаболизма, могат да действат като инхибитори, няма съмнение за огромната роля, която инхибиторите играят в регулирането на ензимната активност.
Това се потвърждава и от факта, че инхибиторите от протеинова природа са широко използвани (виж гл. 2). Освен това, според принципа на специфичното инхибиране, мн лекарства, антибиотици, токсични вещества, антиалиментарни хранителни фактори.
Специфични инхибитори, открити в хранителните суровини и хранителни продукти, присъстват като компоненти както в традиционни рецепти, така и в сложни съставни състави.
нови, модифицирани храни. Следователно не може да се пренебрегне влиянието им върху активността на отделните ензими и върху биохимичните процеси като цяло, протичащи при съхранение и обработка на хранителни суровини.
Всичко това още веднъж говори за множеството сложни проблеми, които се срещат при експерименталната работа с ензими и използването на ензимните препарати в практиката.
281::282::283::284::285::286::287::288::289::290::291::292::293::294::295::Съдържание
295::296::297::298::Съдържание
Край на работата -
Тази тема принадлежи на:
Теоретични основи на производството на храни. Проучване
Химия на храните Учебник за студенти, обучаващи се в областта на хранителните технологии A P Nechaev Svetlana Evgenievna ... Книгата разглежда химичния състав на хранителните системи, неговата полезност и ... Теоретична основапроизводство на храни Изследвания Химия на храните...
Ако имате нужда от допълнителен материал по тази тема или не сте намерили това, което търсите, препоръчваме да използвате търсенето в нашата база данни с произведения:
Какво ще правим с получения материал:
Ако този материал се оказа полезен за вас, можете да го запазите на страницата си в социалните мрежи:
| туит |
Всички теми в този раздел:
БЕЛТЪЦИ В ХРАНЕНЕТО НА ЧОВЕКА. ПРОБЛЕМЪТ С ДЕФИЦИТА НА ПРОТЕИН НА ЗЕМЯТА
Протеините заемат специално място в храненето на човека. Те изпълняват редица специфични функции, присъщи само на живата материя. Протеиновите вещества придават на тялото пластични свойства, включително
БЕЛТЪЧНО-КАЛОРИЕН НЕДОСТАТОЧНОСТ И ПОСЛЕДСТВИЯТА ОТ НЕГО. ХРАНИТЕЛНИ АЛЕРГИИ
Дефицитът на протеин е основен хранителен проблем. Лошо живеещите семейства на фона на недостатъчно висококалорична храна консумират малко протеини, което води до синдром на недохранване, което
АМИНОКИСЕЛИНИ И НЯКОИ ТЕХНИ ФУНКЦИИ В ОРГАНИЗМА
Общият брой на естествено срещащите се аминокиселини достига около 300. Сред тях има: а) аминокиселини, които изграждат протеините; б) аминокиселини, образувани от други аминокиселини, но само n
НЕСЕНЦИАЛНИ АМИНОКИСЕЛИНИ. ХРАНИТЕЛНА И БИОЛОГИЧНА СТОЙНОСТ НА ПРОТЕИНИТЕ
Всички живи организми се различават по способността си да синтезират аминокиселините, необходими за биосинтеза на протеини. В човешкото тяло се синтезират само част от аминокиселините, други трябва да бъдат доставени
СТРУКТУРА НА ПЕПТИДИ И ПРОТЕИНИ. ФИЗИОЛОГИЧНА РОЛЯ НА ПЕПТИДИТЕ
До средата на ХХ век. смяташе се, че пептидите не са независим клас органични съединения, но са продукти на непълна хидролиза на протеини, които се образуват по време на храносмилането
Протеини от хранителни суровини
Зърнени протеини Анализирайки аминокиселинния състав на общите протеини на различни зърнени култури по отношение на състава на референтния протеин за човешкото хранене (FAO, 1973), трябва да се отбележи, че всички те
Протеини от бобови растения
Основната част от котиледоните на бобовите растения (соя, грах, боб, фий) са запасни протеини, които са глобулини в съответствие с класификацията на Osborn. Освен това семената съдържат небето
Протеини от маслодайни семена
При маслодайните семена основната тъкан за съхранение на протеини и липиди е паренхимът на котиледона (слънчоглед, памук, рапица), ендоспермът (семена от рицин, кориандър) или едновременно паренхимът.
Протеини от картофи, зеленчуци и плодове
Сравнително ниското съдържание на азотни вещества в картофите (около 2%), зеленчуците (1,0-2,0%) и плодовете (0,4-1,0%) показва, че тези видове хранителни растителни суровини не играят съществена роля.
Патладжан Пипер
РНК ................................ 0,27-0,32 ..... 0,13- 0,31 ДНК ..... ............................ 0,21-0,36 ..... 0 ,14-0,22 Фосфор........ ...................... 5,5-7,2 .....
Месни и млечни протеини
Месото, млякото и продуктите, получени от тях, съдържат необходими за тялотопротеини, които са благоприятно балансирани и добре усвоими. Протеините на мускулната тъкан на животинското месо са пълноценни, според
НОВИ ФОРМИ НА ПРОТЕИНОВА ХРАНА. ПРОБЛЕМЪТ ЗА ОБОГАТЯВАНЕ НА ПРОТЕИНИ С ОГРАНИЧАВАНЕ НА АМИНОКИСЕЛИНИ
основно направление научно-техническия прогресв областта на производството на храни през последните три десетилетия е интензификацията на процесите на приготвяне на храна при даване
ФУНКЦИОНАЛНИ СВОЙСТВА НА БЕЛТЪКИТЕ
Растителните протеини се използват в производството на храни като съставки с хранителна, технологична и терапевтична стойност поради уникалните си свойства.
ПРОТЕИНОВИ ПРЕОБРАЗУВАНИЯ В ПОТОКА НА ПРОЦЕСА
Естествената триизмерна структура на протеините се поддържа от различни вътрешно- и междумолекулни сили и кръстосани връзки. Всяка промяна в условията на околната среда в технологичните потоци на производството на храни
КАЧЕСТВЕНО И КОЛИЧЕСТВЕНО ОПРЕДЕЛЯНЕ НА БЕЛТЪК
Наличието на белтъци в хранителните обекти се установява с помощта на качествени реакции, които условно се разделят на две групи: а) цветни реакции; б) реакции на утаяване. Сред първата група
Монозахариди
Монозахаридите обикновено съдържат от 3 до 9 въглеродни атома, като пентозите и хексозите са най-често срещаните. Според функционалната група се делят на алдози и кетози. Монозахаридите се намират в
полизахариди
Олигозахариди , Това са полизахариди от 1-ви ред, чиито молекули съдържат от 2 до 10 монозахаридни остатъка, свързани с гликозидни връзки. В съответствие с това се разграничават дисахари
ФИЗИОЛОГИЧНО ЗНАЧЕНИЕ НА ВЪГЛЕХИДРАТИТЕ
Въглехидратите играят изключително важна роля в храненето на човека. Те са основният източник на енергия за човешкото тялонеобходим за жизнената дейност на всички клетки, тъкани и органи
Смилаеми и несмилаеми въглехидрати
По отношение на хранителната стойност въглехидратите се делят на усвоими и неусвоими. Смилаеми въглехидрати - моно- и олигозахариди, нишесте, гликоген. Несмилаеми - целулоза, хемицелулози, в
Въглехидрати в храните
Въглехидратите съставляват 3/4 от сухото тегло на растенията и водораслите и се намират в зърнени храни, плодове, зеленчуци и други храни. Основните усвоими въглехидрати в човешкото хранене са
Хидролиза на въглехидрати
В много хранителни производства се извършва хидролиза на хранителни гликозиди, олигозахариди и полизахариди. Хидролизата зависи от много фактори: pH, температура, аномерна конфигурация, фермен комплекс
Реакции на дехидратация и термично разграждане на въглехидрати
При обработка на хранителни суровини хранителни продуктитези реакции са важни. Те се катализират от киселини и основи и много от тях следват модела на β-елиминиране. Пентози като основен пр
Реакции за образуване на кафяви продукти
Потъмняването на хранителните продукти може да възникне в резултат на окислителни или неокислителни реакции. Окислителното или ензимно покафеняване е реакция между фенолен субстрат и кислород.
Окисляване до алдонова, дикарбоксилна и уранова киселини
Действието на окислителите Способността на алдозите да се окисляват е важна и за хранителните продукти. При определени условия е възможно окисление до алдонови киселини и β-за
Ферментационни процеси
Ферментацията е процес (в който участват въглехидрати), използван в редица хранителни технологии: при приготвяне на тесто при производството на хляб, при производството на бира, квас, алкохол, вино и други продукти.
хидрофилност
Хидрофилността е една от основните физични свойстваполезни за храна въглехидрати. Хидрофилността се дължи на наличието на множество ОН групи. Те взаимодействат с водната молекула
Свързване на аромата
За много храни, които използват различни видове сушене, въглехидратите са важен компонент, който спомага за запазването на цвета и летливите вкусове.
Образуване на неензимни продукти за покафеняване и вкус на храна
Както вече беше отбелязано, неензимните реакции на покафеняване произвеждат оцветени меланоидинови пигменти и голямо разнообразие от летливи компоненти. Те са отговорни за тази или онази миризма.
сладост
Усещането за сладост в устата при консумация на нискомолекулни въглехидрати характеризира друга важна функция на тях в храните. В табл. 3.12 дава характеристика на относителната сладост на различни
Структурни и функционални свойства на полизахаридите
Всички полизахариди, присъстващи в хранителните продукти, изпълняват една или друга полезна роля, свързана с тяхната молекулярна архитектура, размер и наличие на междумолекулни взаимодействия, дължащи се на
нишесте
Нишестето е растителен полизахарид със сложна структура. Състои се от амилоза и амилопектин; тяхното съотношение е различно в различните нишестета (амилоза 13–30%; амилопектин 70–85%). амилоза
Гликоген
Гликогенът се намира в храните в много малки количества, поради ниското съдържание в месната тъкан и черния дроб. Това е хомоглюкан, подобен по структура на нишестен амилопектин; съдържа
Целулоза
Целулозата е компонент на клетъчните стени. Обикновено се свързва с различни хемицелулози и лигнин; и видът и размерът на тези асоциации формират характерната текстура на хранителните растения. Въпреки това, повече
Хемицелулози
Известно е, че стените на растителните клетки са сложна матрица, състояща се от целулоза, лигнин и хемицелулоза. Хемицелулозите са клас полизахариди, които са несмилаеми от човешкото тяло.
пектинови вещества
Пектинът се намира в растителни храни като плодове и зеленчуци. В растителната клетка пектинът действа като структуриращ агент в централния слой. клетъчна стена. Освен t
МЕТОДИ ЗА ОПРЕДЕЛЯНЕ НА ВЪГЛЕХИДРАТИ В ХРАНИТЕ
Моно- и олигозахариди.За определяне на тези въглехидрати се използва тяхната редуцираща способност. Първо, те се извличат от хранителни продукти с 80% етилов алкохол. Алкохолни екстри
СТРУКТУРА И СЪСТАВ НА ЛИПИДИТЕ. МАСТНОКИСЕЛИНЕН СЪСТАВ НА МАСЛА И МАЗНИНИ
Липидите (от гръцки lipos - мазнина) са сложна смес от органични съединения със сходни физични и химични свойства, която се среща в растения, животни и микроорганизми. Липидите са широко разпространени
Хидролиза на триацилглицероли
Под въздействието на алкали, киселини, ензима липаза, триацилглицеролите се хидролизират до образуване на ди-, след това моноацилглицероли и в крайна сметка мастни киселини и глицерол.
Интересност
Голямо практическо значение има група от реакции, при които има обмен на ацилни групи (ацилна миграция), което води до образуването на молекули на нови ацилглицероли. Триацилглицероли при температури
РЕАКЦИИ НА АЦИЛГЛИЦЕРОЛИ С УЧАСТИЕТО НА ВЪГЛЕВОДОРОДНИ РАДИКАЛИ
Добавяне на водород (хидрогениране на ацилглицероли) Хидрогенирането на масла и мазнини с молекулярен водород в промишлеността се извършва при температури 180–240°C в присъствието на n
Окисляване на ацилглицероли
Мазнините и маслата, особено тези, които съдържат радикали на ненаситени мастни киселини, се окисляват от атмосферния кислород. Хидропероксиди с различни структури са първите продукти на окисление. Качиха се
СВОЙСТВА И ПРЕОБРАЗУВАНИЯ НА ГЛИЦЕРОФОСФОЛИПИДИТЕ
Глицерофосфолипидите са безцветни вещества без мирис, силно разтворими в течни въглеводороди и техните халогенни производни, отделни груписе различават по разтворимост в алкохоли, ацетон. Те съществуват
МЕТОДИ ЗА ИЗОЛИРАНЕ НА ЛИПИДИ ОТ СУРОВИНИ И ХРАНИТЕЛНИ ПРОДУКТИ И ТЕХЕН АНАЛИЗ
Анализът на липидите и продуктите на техните трансформации е сложна задача, която изисква използването, наред с класическите химични методи, на съвременни физикохимични методи за изследване (хроматография).
ХРАНИТЕЛНА СТОЙНОСТ НА МАСЛАТА И МАЗНИНИТЕ
Растителните мазнини и масла са основен компонент на храната, източник на енергия и пластичен материал за човека, доставчик на редица необходими за него вещества (ненаситени мастни киселини).
ПРЕОБРАЗУВАНИЯ НА ЛИПИДИ В ПРОИЗВОДСТВОТО НА ХРАНИ
При получаване на хранителни продукти, както в промишлеността, така и у дома, в процеса на протичане на липидите от суровината (зърно, зърнени храни, месо и мляко, мазнини и масла, плодове и зеленчуци и др.)
РОЛЯТА НА МИНЕРАЛИТЕ В ЧОВЕШКОТО ТЯЛО
Много елементи във формата минерални соли, йони, комплексни съединения и органична материяса част от живата материя и са основни хранителни вещества, които трябва да се консумират ежедневно
Макронутриенти
Калций Това е основният структурен компоненткости и зъби; влиза в състава на ядрата на клетките, клетъчните и тъканните течности, необходим е за съсирването на кръвта. форма на калций
микроелементи
Желязо , Този елемент е необходим за биосинтеза на съединения, които осигуряват дишане, хемопоеза; участва в имунобиологични и редокс реакции; включени
ВЛИЯНИЕ НА ТЕХНОЛОГИЧНАТА ОБРАБОТКА ВЪРХУ МИНЕРАЛНИЯ СЪСТАВ НА ХРАНИТЕЛНИТЕ ПРОДУКТИ
При обработката на хранителни суровини, като правило, има намаляване на съдържанието на минерали (с изключение на добавянето на хранителна сол). В растителните храни те се губят с отпадъците. И така, съдържанието
МЕТОДИ ЗА ОПРЕДЕЛЯНЕ НА МИНЕРАЛНИ ВЕЩЕСТВА
За анализ на минерални вещества се използват предимно физикохимични методи - оптични и електрохимични. Почти всички тези методи изискват специална подготовка на пробите за анализ, което
Електрохимични методи за анализ
Йонометрия Методът се използва за определяне на йони K+, Na+, Ca2+, Mn2+, F–, I–, Cl– и др.
ВОДОРАЗТВОРИМИ ВИТАМИНИ
Витамин С (L-аскорбинова киселина). Първо изолиран от лимон. Химически това е γ-лактон на 2,3-дехидро-4-гулонова киселина, лесно се трансформира в окислен
МАСТНОРАЗТВОРИМИ ВИТАМИНИ
Витамин А. Среща се като четири отделни представителя: ретинол, ретинил ацетат, ретинал, ретиноева киселина. Ретинол в химично отношение - ненаситен моноат
ВИТАМИНОПОДОБНИ СЪЕДИНЕНИЯ
Витаминоподобните съединения, както вече беше споменато, са биологично активни съединения, които изпълняват важни и разнообразни функции в тялото. Те могат да бъдат разделени на няколко
ВИТАМИНИЗИРАНЕ НА ХРАНИТЕЛНИ ПРОДУКТИ
здравословно хранененаселението е едно от съществени условияздравето на нацията. Масовите проучвания, проведени от Института по хранене на Руската академия на медицинските науки, показват недостиг на витамини при по-голямата част от населението.
ОБЩА ХАРАКТЕРИСТИКА НА КИСЕЛИНИТЕ НА ХРАНИТЕЛНИТЕ ПРЕДМЕТИ
Основните източници на хранителни киселини са растителните суровини и продуктите от тяхната преработка. Органичните хранителни киселини се намират в повечето видове растителни хранителни продукти - горски плодове, плодове, зеленчуци
ХРАНИТЕЛНИТЕ КИСЕЛИНИ И ТЯХНОТО ВЛИЯНИЕ ВЪРХУ КАЧЕСТВОТО НА ХРАНИТЕ
Хранителните киселини в състава на хранителните суровини и продукти изпълняват различни функции, свързани с качеството на хранителните продукти. Като част от комплекс от ароматични вещества те участват
КИСЕЛИННИ РЕГУЛАТОРИ В ХРАНИТЕЛНИТЕ СИСТЕМИ
Наличието на хранителни киселини в даден продукт може да е резултат от умишленото въвеждане на киселина в хранителната система по време на технологичен процесза регулиране на pH. В случая храна
ХРАНИТЕЛНИ КИСЕЛИНИ В ХРАНЕНЕТО
Стойността на хранителните киселини в храненето на човека се определя от тяхната енергийна стойност (Таблица 7.5) и участието им в метаболизма. Обикновено не предизвикват допълнително киселинно натоварване на организма, ок
МЕТОДИ ЗА ОПРЕДЕЛЯНЕ НА КИСЕЛИНИ В ХРАНИТЕЛНИ ПРОДУКТИ
Определянето на pH на различни хранителни системи се основава на стандартни методи, описани в ръководствата по аналитична химия. Те включват калориметрични и електрометрични методи. О
ОБЩИ СВОЙСТВА НА ЕНЗИМИТЕ
Ензимите са биологични катализатори с протеинова природа. Те значително увеличават скоростта на химичните реакции, които при липса на ензими протичат много бавно. В същото време ензимите не се консумират
Ензимна кинетика
Ензимната катализа се различава значително от неензимната катализа, във връзка с която са разработени много специални модели в кинетиката на ензимните реакции. Те правят възможно изолирането на ензима
Оксидоредуктаза
Полифенолоксидаза (N.F. 1.14.18.1). Този ензим е известен под различни тривиални имена: о-дифенолоксидаза, тирозиназа, фенолаза, катехолаза и др. Ензимът може да катализира окислението
хидролитични ензими
Ролята на хидролазните ензими в хранителните технологии е много важна. Това е отразено в специализирана литература, монографии, технически инструкции и стандарти. Затова в този раздел ще спрем
ПРИЛОЖЕНИЕ НА ЕНЗИМИТЕ В ХРАНИТЕЛНИТЕ ТЕХНОЛОГИИ
Ензимните препарати, за разлика от ензимите, съдържат в допълнение към активния ензим много баластни вещества, включително други протеини. Освен това повечето ензимни препарати са
Мелница и хлебопекарна
Качеството на хляба се определя от характеристиките химичен съставбрашно и активността на неговия ензимен комплекс. Условията на ферментация и печене също оказват значително влияние. Вземете хляб
Производство на нишесте и продукти от нишесте
Съвременната индустрия за нишесте и меласа, използвайки предимно традиционни източници на суровини - картофи и царевица, произвежда широка гама от продукти, включващи десетки артикули.
Сладкарски изделия
Сладкарските изделия в зависимост от вида на суровината и вида на технологичния процес се разделят на две групи: брашнени и захарни. Продуктите от брашно включват бисквити, бисквити, крекери, вафли, подправки
Производство на плодови сокове, безалкохолни напитки и вина
Използването на ензимни препарати при производството на сокове от плодове и горски плодове, вина и безалкохолни напитки се извършва с цел увеличаване на добива на сок, избистряне и стабилизиране на сокове, без
Спиртни напитки и пивоварство
Производство на алкохолни напитки Производството на алкохолни напитки от суровини, съдържащи нишесте, се практикува в почти всички страни по света. Основни суровини са картофите и ръжта.
ИМОБИЛИЗИРАНИ ЕНЗИМИ
В различни хранителни технологии дълго време се използват само препарати от свободни ензими, чийто период на използване е един производствен цикъл. Въпреки това напредъкът в молекулярната биология, биохим
ЕНЗИМНИ МЕТОДИ ЗА АНАЛИЗ НА ХРАНИ
Ензимният анализ е един от основните аналитични инструменти в международната и националната практика. научно изследване, модерно производство и сертификация
ОБЩА ИНФОРМАЦИЯ ЗА ХРАНИТЕЛНИТЕ ДОБАВКИ
Хранителните добавки са естествени, идентични с природата или изкуствени (синтетични) вещества, които не се използват като хранителен продукт или като обикновен хранителен компонент. Те нарочно добавиха
Общи подходи при избора на технологични добавки
Ефективността от използването на добавките в храните, особено тези, които проявяват технологични функции, изисква създаването на технология за техния избор и приложение, като се вземат предвид характеристиките химическа структура, функционален
За безопасността на хранителните добавки
Хранителните добавки, чийто обхват на приложение непрекъснато се разширява, изпълняват различни функции в хранителните технологии и хранителните продукти. Използването на добавки е възможно само след
ВЕЩЕСТВА, ПОДОБРЯВАЩИ ВЪНШНИЯ ВИД НА ХРАНИТЕЛНИТЕ ПРОДУКТИ
Хранителни оцветители Основната група вещества, които определят външен видхранителните продукти са хранителни оцветители (функционален клас 7, таблица 9.1). Потребителят е свикнал
Материали за коригиране на цвета
В хранително-вкусовата промишленост се използват съединения, които променят цвета на продукта в резултат на взаимодействие с компонентите на суровините и готовите продукти. Сред тях са избелващите агенти – добавки, които предотвратяват
ВЕЩЕСТВА, КОИТО ПРОМЕНЯТ СТРУКТУРАТА И ФИЗИКО-ХИМИЧНИТЕ СВОЙСТВА НА ХРАНИТЕЛНИТЕ ПРОДУКТИ
Тази група хранителни добавки може да включва вещества, използвани за създаване на необходимите или промяна на съществуващите реологични свойства на хранителни продукти, т.е. добавки, които регулират или
Емулгатори
Тази група хранителни добавки (функционален клас 9) включва вещества, които при добавяне към хранителен продукт осигуряват възможност за образуване и поддържане на хомогенна дисперсия на два
ВЕЩЕСТВА, ВЛИЯЮЩИ НА АРОМАТ И АРОМАТ НА ХРАНИТЕЛНИ ПРОДУКТИ
При оценка на храната Специално вниманиепотребителят плаща техния вкус и аромат. Традиции, навици, чувство за хармония, което възниква в човешкото тяло при употреба
Подсладители
В хранително-вкусовата промишленост, готвенето и готвенето у дома, вещества със сладък вкус, подсладители (подсладители), са били широко използвани от древни времена. от
Аромати
Ароматът на хранителния продукт е неразделен фактор поради наличието в него на сложна смес от органични съединения, съдържащи се преди това в суровините (I), образувани под въздействието на редица фактори в
Хранителни добавки, които подобряват и променят вкуса и аромата
Хранителните добавки, които подобряват и променят вкуса и мириса на храната - функционален клас 12 (Таблица 9.1), включват съединения, които подобряват и променят вкуса на храната, и вещества
ХРАНИТЕЛНИ ДОБАВКИ, КОИТО ЗАБАВЯТ МИКРОБИОЛОГИЧНОТО И ОКИСЛИВНОТО ОТПАДАНЕ НА ХРАНИТЕЛНИТЕ СУРОВИНИ И ГОТОВИТЕ ПРОДУКТИ
Развалянето на хранителни суровини и готови продукти е резултат от сложни физикохимични и микробиологични процеси: хидролитични, окислителни, развитие на микробна флора. Те са тясно свързани
консерванти
Консерванти - вещества, които удължават срока на годност на продуктите, предпазвайки ги от разваляне, причинено от микроорганизми (бактерии, плесени, дрожди, които могат да включват патогенни и непатогенни)
антибиотици
Специална група хранителни добавки, които забавят развалянето на хранителни продукти (месо, риба, птици, зеленчуци и др.), са антибиотиците. Антибиотици, одобрени за употреба с медицински цели, не допълнително
Хранителни антиоксиданти
Хранителните антиоксиданти (антиоксиданти) включват вещества, които забавят окисляването на предимно ненаситени мастни киселини, които изграждат липидите (функционален клас 5). Този клас храна
БИОЛОГИЧНО АКТИВНИ ДОБАВКИ
Биологично активните добавки (БАД) или хранителните добавки са естествени (идентични на естествените) биологично активни вещества, предназначени да се консумират едновременно с храна или да се въвеждат в диетата.
Физични свойства на водата и леда
Водата има молекулно тегло приблизително 18,02 и може да съществува в състояние на течност, пара и лед, характеризиращи се със следните скорости на фазов преход:
Диаграма на състоянието на водата
Диаграмата на състоянието (или фазовата диаграма) е графично представяне на връзката между величините, характеризиращи състоянието на системата, и фазовите трансформации в системата.
Структурата на молекулата и свойствата на водата
Аномалните свойства на водата предполагат съществуването на силни сили между водните молекули. Това може да се обясни още при разглеждането на естеството на една водна молекула и след това на група от молекули. шест долини
Взаимодействие вода-разтворено вещество
Когато различни вещества се добавят към водата, свойствата както на самото вещество, така и на водата се променят. Хидрофилните вещества взаимодействат с водата чрез йонно-диполен или дипол-диполен механизъм, причинявайки
Структура и свойства на леда
Една водна молекула, кристализирайки, може да свърже четири други водни молекули в тетраедрична конфигурация. Следователно полученият лед има шестоъгълник кристална решетка. Структурата на леда беше
СВОБОДНА И СВЪРЗАНА ВЛАГА В ХРАНИТЕ
Водата в хранителните продукти играе, както вече беше отбелязано, важна роля, тъй като определя консистенцията и структурата на продукта, а взаимодействието й с присъстващите компоненти определя стабилността на храната.
ВОДНА АКТИВНОСТ
Отдавна е известно, че има връзка (макар и далеч от перфектна) между съдържанието на влага в храните и тяхното запазване (или разваляне). Следователно, основният метод за удължаване на срока на годност
Изотерми на сорбция
Кривите, показващи връзката между съдържанието на влага (маса вода, g H2O / g C B) в хранителен продукт с активността на водата в него при постоянна температура, се наричат сорбционни изотерми. Информирам
Активност на водата и стабилност на храната
С оглед на горното е ясно, че стабилността на храната и активността на водата са тясно свързани. На фиг. 10.8 показва връзката между aw и скоростта на различни реакции, които протичат.
РОЛЯТА НА ЛЕДА ЗА СТАБИЛНОСТТА НА ХРАНАТА
Замразяването е най-разпространеният начин за запазване (консервиране) на много храни. Желаният ефект се постига в по-голяма степен от излагане на ниска температура.
Определяне на общото съдържание на влага
Сушене до постоянно тегло Съдържанието на влага се изчислява от разликата в масата на пробата преди и след сушене в пещ при температура 100 - 105°C. Това е стандартният метод
Замърсяването на хранителни суровини и хранителни продукти с чужди вещества или ксенобиотици пряко зависи от степента на замърсяване на околната среда. В резултат на стопанска дейност
Мерки за токсичност на веществото
Количествената характеристика на токсичността на веществата е доста сложна и изисква многостранен подход. Трябва да се съди по резултатите от въздействието на дадено вещество върху живия организъм, за което ха
Токсични елементи
Токсичните елементи (по-специално някои тежки метали) представляват обширна и много опасна група вещества от токсикологично отношение. Обикновено се разглеждат 14 елемента: Hg, Pb, Cd, As, Sb,
Ядрено замърсяване
Източниците на радиоактивност, както и другите замърсители, са компоненти на хранителните вериги: атмосфера-вятър-дъжд-почва-растения-животни-човек. Анализиране на данни за взаимодействието на радионуклиди с
Диоксини и диоксиноподобни съединения
Диоксините са силно токсични съединения с мутагенни, канцерогенни и тератогенни свойства. Те представляват реална заплаха от замърсяване на храни, включително вода.
Полициклични ароматни въглеводороди
Полициклични ароматни въглеводороди (ПАВ) - има повече от 200 представителя, които са силни канцерогени. Най-активните канцерогени включват 3,4-бенз (а) пирен,
Замърсяване от вещества, използвани в растениевъдството
Остатъците от селскостопански пестициди представляват най-значимата група замърсители, тъй като присъстват в почти всички хранителни продукти. Към тази група замърсители спадат пестицидите.
Замърсяване от вещества, използвани в животновъдството
За да се увеличи продуктивността на селскостопанските животни, да се предотвратят заболявания и да се поддържа качеството на фуражите в животновъдството се използват широко различни лекарствени и химически препарати.
ПРИРОДНИ ТОКСИКАНТИ
Естествените токсини, които не отстъпват по канцерогенна активност на антропогенните ксенобиотици, поради широкото им разпространение и много висока степен на натоварване върху човешкото тяло, са
Микотоксини
Микотоксините (от гръцки mukes - гъба и toxicon - отрова) са вторични метаболити на микроскопични плесени, които имат изразени токсични свойства. Те не са от съществено значение за
Методи за определяне на микотоксини и контрол на замърсяването на храните
Методи за определяне на микотоксини Съвременните методи за откриване и определяне на съдържанието на микотоксини в храните и фуражите включват скринингови методи, количествени аналитични
АНТИАЛИМЕНТАРНИ ХРАНИТЕЛНИ ФАКТОРИ
В допълнение към чуждите съединения, които замърсяват храните, така наречените замърсители-замърсители и естествени токсиканти, е необходимо да се вземе предвид ефектът на вещества, които нямат общ
МЕТАБОЛИЗЪМ НА ЧУЖДИ СЪЕДИНЕНИЯ
Механизмът на детоксикация на ксенобиотиците се състои от две фази.Важно е изследването на метаболизма на чуждите съединения, трансформациите, които те претърпяват, когато попаднат в човешкото тяло, първо
Фалшификация: Аспектът на сигурността
От гледна точка на безопасността на храните, някои видове подправяне на храни също могат да представляват значителен риск. По правило това са видове фалшификация на асортимента, които
Генетично модифицирани храни
Особен интерес представляват генетично модифицираните (трансгенни) храни. В началото се появиха съобщения за генетично модифицирани растения и храни, получени от тях
ФИЗИОЛОГИЧНИ АСПЕКТИ НА ХИМИЯТА НА ХРАНИТЕЛНИТЕ ВЕЩЕСТВА
Продуктите, консумирани от хората в естествена или преработена форма (хранителни продукти), са сложни системи с единна вътрешна структура и общи физични и химични свойства.
ХРАНЕНИЕ И ХРАНОСМИЛАНЕ
Храносмилането е началният етап на асимилацията на хранителните вещества, който се състои в трансформирането на първоначалните хранителни структури със сложен химичен състав в компоненти, лишени от видова специфичност,
Основни храносмилателни процеси
В общия случай физичните и физико-химичните промени в храната се състоят в нейното смилане, смесване, набъбване, частично разтваряне, образуване на суспензии и емулсии; химически промени от
Схеми на процесите на смилане на макронутриенти
Основните крайни продукти на хидролитичното разграждане на макромолекулните вещества, съдържащи се в храната, са мономерите. Всеки от трите вида макронутриенти има своя собствена схема на процеса на храносмилане.
Метаболизъм на макронутриенти
Основните крайни продукти от хидролитичното разграждане на съдържащите се в храната макронутриенти са мономери (захари, аминокиселини, висши мастни киселини), които, абсорбирани от
ТЕОРИИ И КОНЦЕПЦИИ ЗА ХРАНЕНЕТО
Формирането на научни представи за храненето и ролята на хранителните вещества в жизнените процеси започва едва в средата на 19 век.
Първият принцип на рационалното хранене
Храната за човешкото тяло, на първо място, е източник на енергия. Това е по време на нейните трансформации - окисление и гниене сложни веществакъм по-простите - освобождава се енергия, необходимо е
Вторият принцип на рационалното хранене
В съответствие с втория принцип на рационалното хранене, задоволяването на нуждите на организма от основни хранителни вещества, включително източници на енергия (протеини, мазнини, въглехидрати
Третият принцип на рационалното хранене
Според третия принцип на рационалното хранене, основополагащ за нормално функциониранеорганизъм е не само каква храна и в какво количество приема човек, но и т
ПРЕПОРЪЧИТЕЛНИ ХРАНИТЕЛНИ И ЕНЕРГИЙНИ НОРМИ
Според принципите на рационалното хранене, за да поддържа здравето си в продължение на много години, човек трябва да поддържа енергиен баланс, да консумира разнообразна и балансирана диета и да поддържа диета.
ХРАНИТЕЛНА ДИЕТА НА СЪВРЕМЕННИЯ ЧОВЕК. ОСНОВНИ ГРУПИ ХРАНИ
Диета модерен човек, което в крайна сметка определя здравето му, се формира на базата на физиологичните нужди от енергия, макро- и микроелементи, като се вземат предвид трите принципа на рационалното хранене.
КОНЦЕПЦИЯТА ЗА ЗДРАВОСЛОВНА ХРАНА. ФУНКЦИОНАЛНИ СЪСТАВКИ И ПРОДУКТИ
Концепцията за здравословно (позитивно, функционално) хранене е формулирана в началото на 80-те години. в Япония, където са закупени голяма популярностт.нар функционални продукти(съкратено име
При t=36-38 0 ензимите имат най-висока активност. Тази температура се нарича температурен оптимум:
С увеличаване на t 0 до оптималното, активността на ензимите се увеличава.
Високото t причинява денатурация на ензима.
Ниското t намалява активността на ензимите.
Промяната на t 0 води до разрушаване на връзките, които фиксират протеиновата структура на ензимите (третични, кватернерни), т.е. причинява денатурация.
Наблюдава се обратима денатурация с намаляване на t 0 . Това ви позволява да съхранявате ензими, телесни течности, кръв.
Повишаването на температурата необратимо нарушава протеиновата структура на ензима. Това свойство се използва при стерилизация на материали и инструменти.
Треската е защитно свойство на тялото, т.к. има денатурация на ензимите на микроорганизмите и поради това е неуместно да се използват антипиретици.
Зависимостта на скоростта на реакцията от рН
На графиката тази зависимост изглежда като камбана. В горната част на кривата има рН оптимална точка, където ензимът има най-висока активност. pH влияе върху степента на йонизация на киселинните и основните групи. При различни стойности pH на активния център може да бъде в частично йонизирана или нейонизирана форма, което влияе върху третичната структура на активния център и образуването на ензимно-субстратния комплекс.
Ефект на pH.
Ензимите, както всички протеини, съдържат много положително и отрицателно инфектирани групи (-NH2, -COOH), които са част от аминокиселините arg, lys, asp и glu. Общата такса зависи от съотношението между тези групи. Зарядът на протеиновия ензим се променя в зависимост от концентрацията на водородни йони в клетката, които неутрализират (потискат дисоциацията) на карбоксилната група:
и образуват положително заредени групи:
По този начин увеличаването на положителния заряд или намаляването на отрицателния заряд на повърхността на ензима се дължи на увеличаване на концентрацията на водородни йони.
Състоянието на протеинова молекула, при което общият заряд на протеина е 0, се нарича изоелектрично състояние.
Стойността на pH, при която зарядът на протеиновата молекула е 0, се нарича изоелектрична точка (IEP).
Повечето ензими са най-активни и стабилни около изоелектричната точка.
Резките колебания в pH насърчават денатурацията на протеина, т.е. намаляване на ензимната активност.
Стойността на рН, при която ензимът проявява максимална активност, се нарича рН оптимум, който е характерен за даден ензим, реагиращ със специфичен субстрат.
Вътреклетъчните ензими обикновено имат оптимално pH, съответстващо на неутрална среда (pH = 7), близка до нормална стойност pH за телесни течности. Има ензими, чието оптимално рН е в силно кисела и силно алкална среда.
Класификация на ензимите.
Има шест класа ензими:
1. Хидролази - ензими, които разграждат субстрата с участието на водни молекули.
2. Лиази - ензими, които разграждат молекулите на субстрата без участието на вода, докато често се образуват продукти с ниско молекулно тегло - CO 2, NH 3, H 2 O.
3. Изомерази - ензими, които предизвикват изомерни трансформации в молекулата.
4. Ферази (трансферази) - ензими, които пренасят групи от една молекула в друга или от една позиция в друга в рамките на една молекула.
5. Оксидоредуктази - ензими, които катализират преноса на протони и електрони (т.е. редокс реакции).
6. Лигази (синтетази) - ензими, които катализират синтеза на големи молекули от по-малки.
Ензимна номенклатура.
Работното наименование на ензима се състои от името на субстрата, вида на катализираната реакция и окончанието -аза.
Систематичното наименование се състои от името на субстратите, името на типа на катализираната химическа трансформация и окончанието -аза.
Името на класа показва вида на химичната реакция, катализирана от ензими. Класовете са разделени на подкласове - изяснява действието на ензима, тъй като показва природата химическа групасубстрат, атакуван от ензима. Подкласът е разделен на подкласове. Подподкласовете уточняват действието на ензима, определяйки естеството на атакуваната субстратна връзка или естеството на акцептора.
I. Оксидоредуктазите катализират редокс реакциите. Оксидоредуктазите се наричат още дехидрогенази или редуктази. Оксидоредуктазите пренасят протони и електрони. Оксидоредуктазите се разделят на подкласове:
1. Аеробни дехидрогенази - пренасят протони и електрони към кислород.
Коензимите на оксидоредуктазите са:
NAD - никотинамид аденин динуклеотид - съдържа витамин B 5 - никотинамид.
NADP - никотинамид аденин динуклеотид фосфат, съдържа витамин B 5.
FAD - флавин аденин динуклеотид, съдържа витамин B 2 - рибофлавин.
FMN - флавин мононуклеотид, съдържа витамин B 2 - рибофлавин.
Оксидоредуктазите катализират реакциите на дехидрогениране, т.е. елиминиране на водорода.
Оксидоредуктазите окисляват следните функционални групи:
OH, -C \u003d O, -NH 2
Дехидрогеназните коензими свързват протони и електрони.
NAD-зависимите дехидрогенази окисляват следните функционални групи: алкохолна хидроксилна (OH), алдехидна група (COH), аминогрупа (NH 2).
NAD-зависимите дехидрогенази катализират следните видове реакции:
1. Дехидрогениране на хидроксилни групи
| лактат дехидрогеназа |
COOH НАД + NADH + H + CH 3
лактат пируват
Млечна киселина
2. Дехидрогениране на алдехидни групи (дехидрогениране на глицералдехид - 3 - фосфат)
| + НАД + + H 3 RO 4 | + NADH + H +
CH 2 OPO 3 H 2 CH 2 OPO 3 H 2
Глицералдехид-3-фосфат 1,3-бифосфоглицеринова киселина
3. Дехидрогениране на аминогрупи
UNSD UNSD
CH 2 + НАД CH 2
| | + NADH + H +
СН2 глутамат дехидрогеназа СН2
Глутаминова киселина
FAD - зависимите дехидрогенази окисляват (дехидрогенират) следните функционални групи: елиминирането на водорода от групите -CH 2 - CH 2 - с образуването на двойна връзка.
UNSD UNSD
| FADH FADH 2 |
СН2 сукцинат дехидрогеназа СН
UNSD UNSD
Сукцинат фумарат
2. Анаеробните дехидрогенази пренасят протони и електрони не към кислорода, а към някакъв друг субстрат. Тези ензими се наричат още оксигенази.
II. Трансферазите са ензими, които катализират прехвърлянето на различни групи от един субстрат към друг.
Подкласове трансфераза:
1. Аминотрансферазите извършват прехвърлянето на аминогрупа от аминокиселина към кетокиселина. Катализира реакцията на трансаминиране.
2. Метилтрансферазите катализират преноса на метилови групи (СН 3 -).
3. Фосфотрансферазите катализират преноса на остатък от фосфорна киселина. Подклас фосфотрансферази включва кинази, които използват АТФ като донор на фосфатен остатък.
III. Лиазите са ензими, които катализират празнина C-O, C-C, C-N и други връзки, както и обратими реакции на елиминиране на различни групи, без участието на вода.
1. Карбоксилаза - добавяне на карбоксилна група (CO 2).
2. Дехидратаза - отстраняване на водна молекула от субстрата.
3. Алдолази - разцепват С-С връзката.
4. Хидратази - водни ензими на двойна връзка.
IV. Изомеразите са ензими, които катализират трансформацията в рамките на една молекула.
Катализира реакциите на изомеризация. Подкласове: мутази, тавтомерази, рацемази, епимерази, изомерази.
V. Хидралазите са ензими, които катализират разкъсването на връзките в присъствието на вода.
VI. Лигазите (синтетазите) са ензими, които катализират обединяването на две молекули, използвайки енергията на АТФ фосфатната връзка.
Влияние на нискомолекулните вещества върху активността на ензимите.
Веществата с ниско молекулно тегло, които променят скоростта на ензимните реакции, се разделят на 2 групи:
1. Активатори - ускоряват протичането на ензимна реакция.
2. Инхибитори - забавят хода на ензимните реакции.
Активаторите са разделени на 2 групи:
1. Може да действа като активатор коензими или простетична група(предимно витамини).
Тази група се характеризира със същите модели, които са описани за взаимодействието на ензима и субстрата F+S и A+Ko се подчиняват на същите модели
K m определя колко да въведете Ko.
2. Активатори, които са връзка между F и S (ориентация на ензима и субстрата) и осигуряват взаимодействието на ензима и субстрата (F A S), взаимодействието на апоензима и кофактора Apof A Ko
Често това са Me-Co, Mn, Mg, Zn йони.
Значение на инхибирането на ензимната активност.
1. Инхибирането е в основата на действието лекарствени веществаи токсични агенти.
2. Инхибирането е един от подходите за изследване на ензимното действие (например структурата на активния център).
Инхибирането е 2 вида:
1. Необратимо
2. Обратими
Необратимо инхибиране възниква, когато свързването на инхибитора с ензима е необратимо.
Например: това е действието на алкилиращи агенти (подацетамид), които необратимо действат върху тио групата ензими. Необратимостта се дължи на факта, че равновесието се измества надясно, към образуването на ковалентно производно на ензима:
F-S-H + J-CH 2 CONH 2 F-S-CH 2 -CONH 2 + HJ
Действието на токсичните органофосфорни съединения, които се наричат нервни отрови, е необратимо, те инхибират ацетилхолинестеразата, която участва в предаването на нервните импулси.
необратимо инхибиране
Много инхибитори се свързват необратимо с Е или ES и тъй като това засяга Vmax, това инхибиране се счита за неконкурентно.
Инхибиторите от този тип често се свързват ковалентно с ензима или с ензим-субстратния комплекс, необратимо променяйки нативната конфигурация. Това обяснява токсичен ефект Hg 2+, Pb 2+ и арсенови съединения.
Действието на пеницилина се основава на необратимо инхибиране. Пеницилинът инхибира действието на един от ензимите, участващи в сглобяването на бактериалната клетъчна стена. Клетките, които нямат клетъчна стена, лесно се лизират.
Действието на аспирина се основава на ковалентната модификация на ензима. Аспиринът намалява скоростта на синтеза на простагландин, действайки като инхибитор на циклооксигеназния компонент на ендопероксид синтетазата. Смята се, че появата на болка, възпаление, температура е свързана с простагландините.
В случай на интоксикация, свързването на отровата или нейното изместване от ензимно-инхибиторния комплекс е възможно с помощта на реактиватори или антидоти. Те включват всички SH-съдържащи комплексони (цистеин, димеркаптопропанол), лимонена киселина.
Обратимото инхибиране е от 2 вида:
1. Състезателен
2. Несъстезателен
Обратимо конкурентно инхибиране - активността на ензима се възстановява след отстраняването на инхибитора чрез увеличаване на концентрацията на субстрата.
Отличителна черта на конкурентен инхибитор е, че конкурентният инхибитор е подобен по структура на субстрата. Конкурентен инхибитор се конкурира със субстрата за активното място на ензима.
Пример: сукцинат дехидрогеназата катализира превръщането на сукцинат във фумарат. Конкурентен инхибитор на сукцинат дехидрогеназата е малоновата киселина, която съдържа една СН2 група по-малко от сукцината.
COOH COOH COOH
CH 2 CH CH 2
CH 2 CH COOH
| | малонова киселина
UNSD UNSD
Сукцинатът и малоновата киселина са структурни аналози и се конкурират за активното място на ензима. (Това е потвърждение, че активното място не е твърда формация, подходяща за субстрата, като "ключалка".)
При конкурентно инхибиране степента на ензимно инхибиране не зависи от абсолютната концентрация на инхибитора, а от съотношението на инхибитора и субстрата, ако това съотношение е J:S=1:50, тогава активността на ензима се инхибира от 50%.
Действието на конкурентен инхибитор се премахва чрез увеличаване на концентрацията на субстрата, тъй като афинитетът на ензима и субстрата е по-висок от афинитета на ензима и инхибитора.
Km F и S и Km F и J са различни и това се знае от графиката на Michaelis-Menten и Lineever-Burk
Vmax - същото
K m нараства с инхибитора.
Действието на много химиотерапевтични средства се основава на конкурентно инхибиране. Например сулфаниламидни препарати, използвани за лечение на заболявания, причинени от микробни инфекции. Сулфаниламидните препарати са структурно подобни на р-аминобензоената киселина. PABA е прекурсор в микробиологичния синтез фолиева киселина, от който се получава коензимът, необходим за синтеза на нуклеиновите киселини на микроорганизмите. При въвеждането на сулфаниламидни препарати се наблюдава инхибиране на ензима и смърт на микроорганизми.
Използването на флуороурацил, който се използва при лечението на рак, също се основава на конкурентно инхибиране.
Неконкурентно, обратимо инхибиране.
Действието на неконкурентен инхибитор не може да бъде елиминирано чрез увеличаване на концентрацията на субстрата.
Неконкурентен инхибитор несе свързва с активния сайт, той може да се свърже със свободния ензим, или с FS комплекса, или и двете, но и двете форми на JF и JFS са неактивни.
K m - не се променя, защото няма обвързване на активен сайт.
Vmax - намалява.
Повечето общ типнеконкурентното инхибиране възниква под действието на реагенти, които обратимо свързват SH групите на цис, който е част от каталитичния център или близо до него. Това са йони Cu 2+, Hg 2+, Ag + и техните производни с образуването на меркаптиди:
Ензимите, които изискват Me йони за активиране, се инхибират по този начин от агенти, които свързват тези йони:
феро или фероцианид.
Регулиране на ензимната активност.
Използването на ензими във фармацията, медицината.
Видове регулиране на ензимната активност:
1. Алостерична модификация.
2. Активиране на зимогените.
3. Регулиране чрез химична модификация.
Край на работата -
Тази тема принадлежи на:
Структура, свойства и функции на протеините
Изясняването на структурата на протеините е един от основните проблеми на съвременната биохимия ... Протеиновите молекули са високомолекулни съединения ... Повечето протеини имат ниво на организация на структурата на протеиновата молекула ...
Ако имате нужда от допълнителен материал по тази тема или не сте намерили това, което търсите, препоръчваме да използвате търсенето в нашата база данни с произведения:
Какво ще правим с получения материал:
Ако този материал се оказа полезен за вас, можете да го запазите на страницата си в социалните мрежи:
