Terapia per la BPCO stabile. Linee guida cliniche: malattie polmonari croniche ostruttive Linee guida federali per la BPCO
La classificazione della BPCO (broncopneumopatia cronica ostruttiva) è ampia e comprende una descrizione degli stadi più comuni della malattia e delle varianti in cui si manifesta. E sebbene non tutti i pazienti sviluppino la BPCO secondo lo stesso scenario e non tutti possano essere identificati come un certo tipo, la classificazione rimane sempre rilevante: la maggior parte dei pazienti vi si adatta.
Fasi della BPCO
La prima classificazione (classificazione spirografica della BPCO), che ha determinato gli stadi della BPCO e i loro criteri, è stata proposta nel 1997 da un gruppo di scienziati riuniti in un comitato chiamato World COPD Initiative (in inglese, il nome suona "Global Initiative for chronic Malattia polmonare ostruttiva" e abbreviata in GOLD). Secondo lei, ci sono quattro fasi principali, ognuna delle quali è determinata principalmente dal FEV, cioè il volume del flusso espiratorio forzato nel primo secondo:
- La BPCO di grado 1 non è diversa sintomi speciali. Il lume dei bronchi è piuttosto ristretto, anche il flusso d'aria è limitato in modo non troppo evidente. Il paziente non ha difficoltà nella vita di tutti i giorni, avverte mancanza di respiro solo durante l'attività fisica attiva e tosse umida- solo occasionalmente, con un'alta probabilità di notte. In questa fase, poche persone vanno dal medico, di solito a causa di altre malattie.
- Il grado di BPCO 2 diventa più pronunciato. La mancanza di respiro inizia immediatamente quando si cerca di impegnarsi in attività fisica, la tosse compare al mattino, accompagnata da una notevole secrezione di espettorato, a volte purulenta. Il paziente si accorge di essere diventato meno resistente e inizia a soffrire di malattie respiratorie ricorrenti, dalla semplice SARS alla bronchite e alla polmonite. Se il motivo per andare dal medico non è il sospetto di BPCO, prima o poi il paziente arriva ancora da lui a causa di infezioni concomitanti.
- La BPCO di grado 3 è descritta come una fase difficile: se il paziente ha abbastanza forza, può richiedere la disabilità e attendere con fiducia che gli venga rilasciato un certificato. La mancanza di respiro appare anche con uno sforzo fisico minore, fino a salire una rampa di scale. Il paziente ha le vertigini, gli occhi scuri. La tosse appare più spesso, almeno due volte al mese, diventa di natura parossistica ed è accompagnata da dolori al petto. Allo stesso tempo, l'aspetto cambia: il torace si espande, le vene si gonfiano sul collo, la pelle cambia colore in cianotico o rosato. Il peso corporeo diminuisce bruscamente o diminuisce bruscamente.
- Lo stadio 4 della BPCO significa che puoi dimenticare qualsiasi capacità di lavorare: il flusso d'aria che entra nei polmoni del paziente non supera il trenta percento del volume richiesto. Qualsiasi sforzo fisico - fino al cambio di vestiti o alle procedure igieniche - provoca mancanza di respiro, respiro sibilante al petto, vertigini. Il respiro stesso è pesante, faticoso. Il paziente deve costantemente usare una bombola di ossigeno. Nei casi peggiori è necessario il ricovero in ospedale.
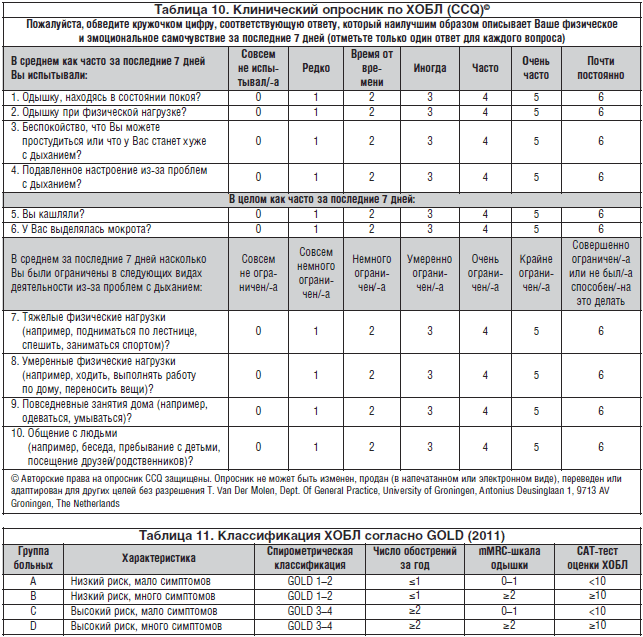
Tuttavia, nel 2011, GOLD ha concluso che tali criteri sono troppo vaghi ed è sbagliato fare una diagnosi esclusivamente sulla base della spirometria (che determina il volume di espirazione). Inoltre, non tutti i pazienti hanno sviluppato la malattia in sequenza, da uno stadio lieve a uno stadio grave - in molti casi, era impossibile determinare lo stadio della BPCO. È stato sviluppato un questionario CAT, che viene compilato dal paziente stesso e consente di determinare la condizione in modo più completo. In esso, il paziente deve determinare, su una scala da uno a cinque, quanto sono pronunciati i suoi sintomi:
- tosse - uno corrisponde all'affermazione "niente tosse", cinque "costantemente";
- espettorato - uno è "nessun espettorato", cinque è "l'espettorato esce costantemente";
- una sensazione di oppressione al petto - rispettivamente "no" e "molto forte";
- mancanza di respiro - da "nessuna mancanza di respiro" a "mancanza di respiro con il minimo sforzo";
- attività domestica - da "senza restrizioni" a "molto limitata";
- uscire di casa - da "fiduciosamente per necessità" a "nemmeno per necessità";
- sogno - da " Sogni d'oro» a «insonnia»;
- energia - da "pieno di energia" a "nessuna energia".
Il risultato è determinato dal punteggio. Se ce ne sono meno di dieci, la malattia non ha quasi alcun effetto sulla vita del paziente. Meno di venti, ma più di dieci - ha un effetto moderato. Meno di trenta - ha una forte influenza. Più di trenta - ha un enorme impatto sulla vita.
Vengono presi in considerazione anche indicatori oggettivi delle condizioni del paziente, che possono essere registrati utilizzando strumenti. I principali sono la tensione dell'ossigeno e la saturazione dell'emoglobina. In una persona sana, il primo valore non scende al di sotto di ottanta e il secondo non scende al di sotto di novanta. Nei pazienti, a seconda della gravità della condizione, i numeri variano:
- con relativamente lieve - fino a ottanta e novanta in presenza di sintomi;
- sul corso moderare- fino a sessanta e ottanta;
- nei casi più gravi - meno di quaranta e circa settantacinque.
 Dopo il 2011, secondo GOLD, la BPCO non ha più stadi. Ci sono solo gradi di gravità, che indicano quanta aria entra nei polmoni. E la conclusione generale sulle condizioni del paziente non sembra "si trova a un certo stadio della BPCO", ma come "si trova in un certo gruppo a rischio di esacerbazioni, effetti avversi e morte dovuta a BPCO". Ce ne sono quattro in totale.
Dopo il 2011, secondo GOLD, la BPCO non ha più stadi. Ci sono solo gradi di gravità, che indicano quanta aria entra nei polmoni. E la conclusione generale sulle condizioni del paziente non sembra "si trova a un certo stadio della BPCO", ma come "si trova in un certo gruppo a rischio di esacerbazioni, effetti avversi e morte dovuta a BPCO". Ce ne sono quattro in totale.
- Gruppo A - basso rischio, pochi sintomi. Un paziente appartiene al gruppo se non ha avuto più di una riacutizzazione in un anno, ha ottenuto meno di dieci punti su CAT e la mancanza di respiro si verifica solo durante lo sforzo.
- Gruppo B - basso rischio, molti sintomi. Il paziente appartiene al gruppo se non si è verificata più di una riacutizzazione, ma la mancanza di respiro si verifica frequentemente e sono stati assegnati più di dieci punti alla CAT.
- Gruppo C - alto rischio, pochi sintomi. Il paziente appartiene al gruppo se ha avuto più di una riacutizzazione all'anno, la dispnea si verifica durante l'esercizio e il punteggio CAT è inferiore a dieci punti.
- Gruppo D - alto rischio, molti sintomi. Più di una esacerbazione, la mancanza di respiro si verifica con il minimo sforzo e più di dieci punti su CAT.
La classificazione, sebbene sia stata fatta in modo tale da tenere il più possibile conto delle condizioni di un particolare paziente, non includeva ancora due importanti indicatori che influenzano la vita del paziente e sono indicati nella diagnosi. Questi sono i fenotipi e le comorbilità della BPCO.
Fenotipi della BPCO
 Nella broncopneumopatia cronica ostruttiva, ci sono due fenotipi principali che determinano l'aspetto del paziente e il progredire della malattia.
Nella broncopneumopatia cronica ostruttiva, ci sono due fenotipi principali che determinano l'aspetto del paziente e il progredire della malattia.
tipo di bronchite:
- Causa. La causa è la bronchite cronica, le cui ricadute si verificano per almeno due anni.
- Cambiamenti nei polmoni. La fluorografia mostra che le pareti dei bronchi sono ispessite. Sulla spirometria, si può vedere che il flusso d'aria è indebolito ed entra solo parzialmente nei polmoni.
- L'età classica della scoperta è di cinquant'anni o più.
- Caratteristiche dell'aspetto del paziente. Il paziente ha un colore della pelle cianotico pronunciato, il torace è a forma di botte, il peso corporeo di solito cresce a causa dell'aumento dell'appetito e può avvicinarsi al confine dell'obesità.
- Il sintomo principale è una tosse, parossistica, con abbondante espettorato purulento.
- Infezioni - spesso, perché i bronchi non sono in grado di filtrare l'agente patogeno.
- Deformazione del muscolo cardiaco del tipo "cuore polmonare" - spesso.
Il cuore polmonare è un sintomo concomitante in cui il ventricolo destro si allarga e la frequenza cardiaca accelera - in questo modo il corpo cerca di compensare la mancanza di ossigeno nel sangue:
- Raggi X. Si può vedere che il cuore è deformato e ingrandito e il modello dei polmoni è migliorato.
- Capacità diffusa dei polmoni, ovvero il tempo necessario alle molecole di gas per entrare nel sangue. Normalmente, se diminuisce, allora non molto.
- Previsione. Secondo le statistiche, il tipo di bronchite ha un tasso di mortalità più elevato.
La gente chiama il tipo di bronchite "edema blu" e questa è una descrizione abbastanza accurata - un paziente con questo tipo di BPCO è solitamente blu pallido, sovrappeso, tossisce costantemente, ma è vigile - la mancanza di respiro non lo colpisce tanto quanto i pazienti con un altro tipo.
 tipo enfisematoso:
tipo enfisematoso:
- Causa. La causa è l'enfisema cronico.
- Cambiamenti nei polmoni. Sulla fluorografia, si vede chiaramente che le partizioni tra gli alveoli vengono distrutte e si formano cavità piene d'aria - bolle. Con la spirometria viene registrata l'iperventilazione: l'ossigeno entra nei polmoni, ma non viene assorbito nel sangue.
- L'età classica della scoperta è di sessant'anni o più.
- Caratteristiche dell'aspetto del paziente. Il paziente ha un colore della pelle rosa, anche il torace è a forma di botte, le vene si gonfiano sul collo, il peso corporeo diminuisce a causa della diminuzione dell'appetito e può avvicinarsi al limite di valori pericolosi.
- Il sintomo principale è la mancanza di respiro, che può essere osservata anche a riposo.
- Le infezioni sono rare, perché i polmoni affrontano ancora il filtraggio.
- La deformazione del tipo "cuore polmonare" è rara, la mancanza di ossigeno non è così pronunciata.
- Raggi X. L'immagine mostra le bolle e la deformità del cuore.
- Capacità di diffusione - ovviamente notevolmente ridotta.
- Previsione. Secondo le statistiche, questo tipo ha un'aspettativa di vita più lunga.
Il tipo enfisematoso è popolarmente chiamato “puffer rosa” e anche questo è abbastanza esatto: un paziente con questo tipo di hodl è solitamente magro, con un colore della pelle innaturalmente rosa, soffoca costantemente e preferisce non uscire di casa ancora una volta.
Se un paziente ha segni di entrambi i tipi, parla di un fenotipo misto di BPCO - si verifica abbastanza spesso in un'ampia varietà di variazioni. anche in l'anno scorso gli scienziati hanno identificato diversi sottotipi:
- con frequenti esacerbazioni. È impostato se il paziente viene inviato in ospedale con esacerbazioni almeno quattro volte l'anno. Si verifica negli stadi C e D.
- Con asma bronchiale. Si verifica in un terzo dei casi: con tutti i sintomi della BPCO, il paziente prova sollievo se usa farmaci per combattere l'asma. Ha anche attacchi d'asma.
- Inizio precoce. È caratterizzato da rapidi progressi ed è spiegato da una predisposizione genetica.
- In gioventù. La BPCO è una malattia degli anziani, ma può colpire anche i giovani. In questo caso, di regola, è molte volte più pericoloso e ha un alto tasso di mortalità.
Malattie concomitanti
 Con la BPCO, il paziente ha una grande possibilità di soffrire non solo dell'ostruzione stessa, ma anche delle malattie che l'accompagnano. Tra loro:
Con la BPCO, il paziente ha una grande possibilità di soffrire non solo dell'ostruzione stessa, ma anche delle malattie che l'accompagnano. Tra loro:
- Malattie cardiovascolari, dalla malattia coronarica allo scompenso cardiaco. Si verificano in quasi la metà dei casi e sono spiegati in modo molto semplice: con una mancanza di ossigeno nel corpo, il sistema cardiovascolare subisce un grande stress: il cuore si muove più velocemente, il sangue scorre più velocemente nelle vene, il lume dei vasi si restringe. Dopo qualche tempo, il paziente inizia a notare dolori al petto, polso fluttuante, mal di testa e aumento della mancanza di respiro. Un terzo dei pazienti la cui BPCO è accompagnata da malattie cardiovascolari muore a causa loro.
- Osteoporosi. Si verifica in un terzo dei casi. Non fatale, ma molto spiacevole e provocato anche dalla mancanza di ossigeno. Il suo sintomo principale è la fragilità ossea. Di conseguenza, la colonna vertebrale del paziente è piegata, la postura si deteriora, la schiena e gli arti fanno male, si osservano crampi notturni alle gambe e debolezza generale. Diminuzione della resistenza, mobilità delle dita. Qualsiasi frattura guarisce per molto tempo e può essere fatale. Spesso ci sono problemi con tratto gastrointestinale- costipazione e diarrea, che sono causate dalla pressione della colonna vertebrale curva sugli organi interni.
- Depressione. Si verifica in quasi la metà dei pazienti. Spesso i suoi pericoli rimangono sottovalutati, mentre il paziente, nel frattempo, soffre di diminuzione del tono, mancanza di energia e motivazione, pensieri suicidi, aumento dell'ansia sentimenti di solitudine e problemi di apprendimento. Tutto è visto sotto una luce cupa, l'umore è costantemente depresso. Il motivo è sia la mancanza di ossigeno che l'impatto che la BPCO ha sulla vita del paziente. La depressione non è fatale, ma è difficile da trattare e riduce significativamente il piacere che il paziente potrebbe ottenere dalla vita.
- Infezioni. Si verificano nel settanta per cento dei pazienti e causano la morte in un terzo dei casi. Ciò è spiegato dal fatto che i polmoni affetti da BPCO sono molto vulnerabili a qualsiasi agente patogeno ed è difficile rimuovere l'infiammazione in essi. Inoltre, qualsiasi aumento della produzione di espettorato è una diminuzione del flusso d'aria e un rischio di insufficienza respiratoria.
- Sindrome delle apnee notturne. Con l'apnea, il paziente smette di respirare di notte per più di dieci secondi. Di conseguenza, soffre di costante carenza di ossigeno e può anche morire per insufficienza respiratoria.
- Cancro. Si verifica frequentemente e provoca la morte in un caso su cinque. È spiegato, come le infezioni, dalla vulnerabilità dei polmoni.
Negli uomini, la BPCO è spesso accompagnata da impotenza e negli anziani provoca cataratta.
Diagnosi e disabilità
 La formulazione della diagnosi di BPCO implica un'intera formula che i medici seguono:
La formulazione della diagnosi di BPCO implica un'intera formula che i medici seguono:
- il nome della malattia è malattia polmonare cronica;
- Fenotipo BPCO - misto, bronchite, enfisematoso;
- la gravità dell'ostruzione bronchiale - da lieve a estremamente grave;
- gravità dei sintomi della BPCO - determinata da CAT;
- frequenza delle esacerbazioni - più di due frequenti, meno rare;
- malattie di accompagnamento.
Di conseguenza, quando l'esame è completato secondo il piano, il paziente riceve una diagnosi che suona, ad esempio, in questo modo: "broncopneumopatia cronica ostruttiva del tipo di bronchite, II grado di ostruzione bronchiale con sintomi gravi, frequenti esacerbazioni, aggravata dall'osteoporosi”.
Sulla base dei risultati dell'esame, viene elaborato un piano di trattamento e il paziente può richiedere la disabilità - più grave è la BPCO, più è probabile che venga partorito il primo gruppo.
E sebbene la BPCO non venga curata, il paziente deve fare tutto ciò che è in suo potere per mantenere la sua salute a un certo livello - e quindi aumenteranno sia la qualità che la durata della sua vita. L'importante è rimanere ottimisti nel processo e non trascurare i consigli dei medici.
Gli obiettivi del trattamento della BPCO possono essere suddivisi in 4 gruppi principali:
Alleviare i sintomi e migliorare la qualità della vita;
Ridurre i rischi futuri, ecc.; prevenzione delle esacerbazioni;
Rallentare la progressione della malattia;
Diminuzione della mortalità.
La terapia della BPCO comprende approcci farmacologici e non farmacologici. I trattamenti farmacologici comprendono broncodilatatori, combinazioni di ICS e broncodilatatori a lunga durata d'azione (LABD), inibitori della fosfodiesterasi-4, teofillina e vaccinazione antinfluenzale e infezione pneumococcica.
I metodi non farmacologici includono smettere di fumare, riabilitazione polmonare, ossigenoterapia, supporto respiratorio e chirurgia.
Il trattamento delle riacutizzazioni della BPCO è considerato separatamente.
3.1 Trattamento conservativo.
Smettere di fumare.
La cessazione del fumo è raccomandata per tutti i pazienti con BPCO.Commenti. Smettere di fumare è l'intervento più efficace con il maggiore impatto sulla progressione della BPCO. Il solito consiglio di un medico porta alla cessazione del fumo nel 7,4% dei pazienti (2,5% in più rispetto ai controlli) e, a seguito di una consultazione di 3-10 minuti, la frequenza della cessazione del fumo raggiunge circa il 12%. Con più tempo e interventi più complessi, tra cui lo sviluppo delle competenze, la formazione per la risoluzione dei problemi e il supporto psicosociale, i tassi di cessazione del fumo possono raggiungere il 20-30%.
In assenza di controindicazioni, si raccomandano agenti farmacologici per il trattamento della dipendenza da tabacco per sostenere gli sforzi per smettere di fumare.
Commenti. La farmacoterapia supporta efficacemente gli sforzi per smettere di fumare. I farmaci di prima linea per il trattamento della dipendenza da tabacco includono vareniclina, bupropione a rilascio prolungato e farmaci sostitutivi della nicotina.
Una combinazione di consulenza medica, gruppi di supporto, sviluppo delle competenze e terapia sostitutiva della nicotina porta il 35% a smettere di fumare dopo 1 anno, mentre il 22% rimane non fumatore dopo 5 anni.
Principi di farmacoterapia per la BPCO stabile.
Le classi farmacologiche dei farmaci utilizzati nel trattamento della BPCO sono presentate nella Tabella. cinque.
Tabella 5 Classi farmacologiche di farmaci utilizzati nel trattamento della BPCO.
| Classe farmacologica | Preparativi |
| KDB | Salbutamolo Fenoterolo |
| DDBA | Vilanterol Indacaterol Salmeterol Olodaterol Formoterol |
| KDAH | Ipratropio bromuro |
| DAH | Bromuro di aclidinio Bromuro di glicopirronio Bromuro di tiotropio Bromuro di umeclidinio |
| IGC | Beclometasone Budesonide Mometasone Fluticasone Fluticasone Furoato Ciclosonide |
| Combinazioni fisse DDAH/DDBA | Glicopirronio bromuro/indacaterolo Tiotropio bromuro/olodaterolo Umeclidinio bromuro/vilanterolo Aclidinio bromuro/formoterolo |
| Combinazioni fisse di ICS/LABA | Beclometasone/formoterolo Budesonide/formoterolo Fluticasone/salmeterolo Fluticasone furoato/vilanterolo |
| Inibitori della fosfodiesterasi-4 | Roflumilast |
| Altro | Teofillina |
Nota. SABA - β2-agonisti a breve durata d'azione, KDAH - anticolinergici a breve durata d'azione, LABA - β2-agonisti a lunga durata d'azione, DDAC - anticolinergici a lunga durata d'azione.
Quando si prescrive la farmacoterapia, si raccomanda di mirare al controllo dei sintomi e alla riduzione dei rischi futuri - td; Riacutizzazioni e mortalità della BPCO (Appendice D5).
Commenti. La decisione di continuare o terminare il trattamento è raccomandata sulla base della riduzione dei rischi futuri (riacutizzazioni). Ciò è dovuto al fatto che non è noto come la capacità di correlare medicinale migliorare la funzione polmonare o ridurre i sintomi con la sua capacità di ridurre il rischio di esacerbazioni della BPCO. Ad oggi, non ci sono prove evidenti che una particolare farmacoterapia rallenti la progressione della malattia (misurata dal tasso medio di declino del FEV1 minimo) o riduca la mortalità, sebbene siano stati pubblicati dati preliminari che indicano tali effetti.
Broncodilatatori.
I broncodilatatori comprendono i β2-agonisti e gli anticolinergici, compresi i farmaci a breve durata d'azione (durata dell'effetto 3-6 ore) e a lunga durata d'azione (durata dell'effetto 12-24 ore).
Si raccomanda che a tutti i pazienti con BPCO vengano somministrati broncodilatatori a breve durata d'azione da utilizzare al bisogno.
Livello di persuasività delle raccomandazioni A (livello di evidenza - 1).
Commenti. L'uso di broncodilatatori a breve durata d'azione al bisogno è possibile anche nei pazienti trattati con LABD. Allo stesso tempo, l'uso regolare di alte dosi di broncodilatatori a breve durata d'azione (anche attraverso un nebulizzatore) nei pazienti che ricevono DDBD non è giustificato e dovrebbe essere fatto ricorso solo nei casi più difficili. In tali situazioni, è necessario valutare in modo completo la necessità dell'uso di DDBD e la capacità del paziente di eseguire correttamente le inalazioni.
β2-agonisti.
Per il trattamento della BPCO, si raccomanda di utilizzare i seguenti β2-agonisti a lunga durata d'azione (LABA): formoterolo, salmeterolo, indacaterolo, olodaterolo (Appendice D6).
Livello di forza della raccomandazione A (livello di evidenza - 1).
Commenti. Influenzando il FEV1 e la dispnea, indacaterolo e olodaterolo sono efficaci almeno quanto formoterolo, salmeterolo e tiotropio bromuro. In termini di effetto sul rischio di riacutizzazioni moderate/gravi, i LABA (indacaterolo, salmeterolo) sono inferiori al tiotropio bromuro.
Nel trattamento di pazienti con BPCO con malattie cardiovascolari concomitanti, si raccomanda di valutare il rischio di sviluppare complicanze cardiovascolari prima di prescrivere LABA.
Commenti. L'attivazione dei recettori β-adrenergici del cuore sotto l'azione dei β2-agonisti può presumibilmente causare ischemia, insufficienza cardiaca, aritmie e anche aumentare il rischio di morte improvvisa. Tuttavia, in studi clinici controllati in pazienti con BPCO, non sono stati ottenuti dati su un aumento della frequenza di aritmie, mortalità cardiovascolare o complessiva con l'uso di β2-agonisti.
Nel trattamento della BPCO, a differenza dell'asma, LABA può essere utilizzato in monoterapia (senza ICS).
Farmaci anticolinergici.
Per il trattamento della BPCO si raccomandano i seguenti anticolinergici a lunga durata d'azione (LDAC): tiotropio bromuro, aclidinio bromuro, glicopirronio bromuro, umeclidinio bromuro (Appendice D6).
Livello di persuasività delle raccomandazioni A (livello di evidenza - 1).
Commenti. Tiotropio bromuro ha la più grande base di prove tra DDAC. Tiotropio bromuro aumenta la funzionalità polmonare, allevia i sintomi, migliora la qualità della vita e riduce il rischio di riacutizzazioni della BPCO.
Il bromuro di aclidinio e il bromuro di glicopirronio migliorano la funzionalità polmonare, la qualità della vita e riducono la necessità di farmaci di salvataggio. In studi fino a 1 anno, il bromuro di aclidinio, il bromuro di glicopirronio e il bromuro di umeclidinio hanno ridotto il rischio di esacerbazioni della BPCO, ma finora non sono stati condotti studi a lungo termine della durata superiore a 1 anno, simili agli studi sul tiotropio bromuro.
Gli anticolinergici inalatori sono generalmente ben tollerati e gli eventi avversi (EA) sono relativamente rari con il loro uso.
Nei pazienti con BPCO e malattie cardiovascolari concomitanti, si raccomanda l'uso di DDAC.
Livello di persuasività delle raccomandazioni A (livello di evidenza - 1).
Commenti.È stato sospettato che gli anticolinergici a breve durata d'azione (SAC) causino eventi avversi cardiaci, ma non vi sono segnalazioni di un'aumentata incidenza di eventi avversi cardiaci in relazione ai DDAC. Nello studio UPLIFT della durata di 4 anni, i pazienti trattati con tiotropio bromuro hanno avuto un numero significativamente inferiore di eventi cardiovascolari e la mortalità complessiva è stata inferiore rispetto al gruppo placebo. Nello studio TIOSPIR (durata media del trattamento 2,3 anni), tiotropio bromuro in un inalatore liquido si è dimostrato altamente sicuro, senza differenze rispetto a tiotropio bromuro in un inalatore di polvere secca in termini di mortalità, eventi avversi cardiaci gravi ed esacerbazioni della BPCO.
Combinazioni di broncodilatatori.
Si raccomanda una combinazione di broncodilatatori con diversi meccanismi d'azione per ottenere una maggiore broncodilatazione e sollievo dai sintomi.
Livello di persuasività delle raccomandazioni A (livello di evidenza - 1).
Commenti. Ad esempio, la combinazione di CAAC con CABA o LABA migliora il FEV1 in misura maggiore rispetto a qualsiasi monocomponente. SABA o LABA possono essere somministrati in combinazione con DDAC se il DDAA da solo non fornisce un sufficiente sollievo dai sintomi.
Per il trattamento della BPCO si raccomanda l'uso di combinazioni fisse di DDAH / LABA: bromuro di glicopirronio / indacaterolo, bromuro di tiotropio / olodaterolo, bromuro di umeclidinio / vilanterolo, bromuro di aclidinio / formoterolo.
Livello di persuasività delle raccomandazioni A (livello di evidenza - 1).
Commenti. Queste combinazioni hanno mostrato un vantaggio rispetto al placebo e ai suoi monocomponenti in termini di effetto sul FEV1 minimo, dispnea e qualità della vita, non inferiore a loro in termini di sicurezza. Rispetto al tiotropio bromuro, tutte le combinazioni DDAC/LABA hanno mostrato effetti superiori sulla funzionalità polmonare e sulla qualità della vita. In termini di effetto sulla dispnea, non è stato dimostrato alcun beneficio per la combinazione di umeclidinio bromuro/vilanterolo, e solo tiotropio bromuro/olodaterolo è risultato significativamente superiore alla monoterapia con tiotropio bromuro in termini di effetto sulla PHI.
Allo stesso tempo, le combinazioni DDAC/LABA non hanno ancora dimostrato vantaggi rispetto alla monoterapia con tiotropio bromuro in termini di effetto sul rischio di riacutizzazioni moderate/gravi della BPCO.
Glucocorticosteroidi inalatori e loro combinazioni con β2-agonisti.
Si raccomanda di prescrivere corticosteroidi per via inalatoria solo in aggiunta alla terapia in corso con DDBD in pazienti con BPCO con una storia di BA e con eosinofilia nel sangue (il contenuto di eosinofili nel sangue senza esacerbazione è superiore a 300 cellule per 1 μl).
Livello di persuasività delle raccomandazioni B (livello di evidenza - 1).
Commenti. Nell'AD, gli effetti terapeutici e indesiderati degli ICS dipendono dalla dose utilizzata, ma nella BPCO non esiste tale dipendenza dalla dose e negli studi a lungo termine sono state utilizzate solo dosi medie e alte di ICS. La risposta dei pazienti con BPCO al trattamento con ICS non può essere prevista sulla base della risposta ai corticosteroidi orali, dei risultati di un test di broncodilatazione o della presenza di iperreattività bronchiale.
Si raccomanda inoltre ai pazienti con BPCO e riacutizzazioni frequenti (2 o più riacutizzazioni moderate entro 1 anno o almeno 1 riacutizzazione grave che richieda il ricovero in ospedale) di prescrivere ICS in aggiunta a LABD.
Livello di persuasività delle raccomandazioni B (livello di evidenza - 1).
Commenti. Il trattamento a lungo termine (6 mesi) con ICS e combinazioni di ICS/LABA riduce la frequenza delle riacutizzazioni della BPCO e migliora la qualità della vita dei pazienti.
Gli ICS possono essere utilizzati come terapia doppia (LABA/IGCS) o tripla (LAAA/LABA/IGCS). La terapia tripla è stata studiata in studi in cui l'aggiunta di una combinazione di ICS/LABA al trattamento con tiotropio bromuro ha determinato un miglioramento funzione polmonare, qualità della vita e un'ulteriore riduzione della frequenza delle riacutizzazioni, soprattutto gravi. Tuttavia, la terapia tripla richiede ulteriori studi in studi più lunghi.
Nei pazienti con BPCO ad alto rischio di riacutizzazioni e senza eosinofilia ematica, con lo stesso grado di evidenza, si raccomanda di prescrivere LAAC o IGCS/LABA.
Livello di persuasività delle raccomandazioni A (livello di evidenza - 1).
Commenti. Il principale effetto atteso della nomina di ICS nei pazienti con BPCO è una riduzione del rischio di esacerbazioni. A questo proposito, ICS/LABA non sono superiori alla monoterapia con DDAH (tiotropio bromuro). Studi recenti mostrano che il vantaggio delle combinazioni di ICS / LABA rispetto ai broncodilatatori in termini di effetto sul rischio di esacerbazioni è solo nei pazienti con eosinofilia ematica.
I pazienti con BPCO con funzionalità polmonare conservata e nessuna storia di esacerbazioni ricorrenti non sono raccomandati per l'uso di ICS.
Livello di persuasività delle raccomandazioni B (livello di evidenza - 1).
Commenti. La terapia con ICS e combinazioni di ICS/LABA non influenza il tasso di riduzione del FEV1 e la mortalità nella BPCO.
Dato il rischio di gravi effetti avversi, gli ICS nella BPCO non sono raccomandati come parte della terapia iniziale.
Livello di persuasività delle raccomandazioni B (livello di evidenza - 1).
Commenti. Gli effetti indesiderati degli ICS comprendono la candidosi orale e la raucedine. Vi è evidenza di un aumento del rischio di polmonite, osteoporosi e fratture con le combinazioni di ICS e ICS/LABA. Il rischio di polmonite nei pazienti con BPCO aumenta con l'uso non solo di fluticasone, ma anche di altri ICS. L'inizio del trattamento con ICS è stato accompagnato da un aumentato rischio di sviluppare diabete mellito nei pazienti con patologia respiratoria.
Roflumilast.
Roflumilast inibisce la BPCO correlata risposta infiammatoria inibendo l'enzima fosfodiesterasi-4 e aumentando il contenuto intracellulare di adenosina monofosfato ciclico.
Roflumilast è raccomandato per i pazienti con BPCO con FEV1< 50% от должного, с хроническим бронхитом и частыми обострениями, несмотря на применение ДДБД для уменьшения частоты среднетяжелых и тяжелых обострений .
Livello di persuasività delle raccomandazioni A (livello di evidenza - 1).
Roflumilast non è raccomandato per il trattamento dei sintomi della BPCO.
Livello di persuasività delle raccomandazioni A (livello di evidenza - 1).
Commenti. Roflumilast non è un broncodilatatore, sebbene durante il trattamento a lungo termine in pazienti trattati con salmeterolo o tiotropio bromuro, roflumilast aumenti ulteriormente il FEV1 di 50-80 ml.
L'effetto di roflumilast sulla qualità della vita e sui sintomi è debole. Il farmaco provoca effetti indesiderati significativi, tipici tra i quali sono disordini gastrointestinali e mal di testa, così come la perdita di peso.
Glucocorticosteroidi orali.
Si raccomanda di evitare il trattamento a lungo termine con corticosteroidi orali nei pazienti con BPCO, in quanto tale trattamento può peggiorare la loro prognosi a lungo termine.
Commenti. Sebbene una dose elevata di corticosteroidi orali (pari a ≥30 mg di prednisolone orale al giorno) migliori la funzione polmonare a breve termine, non sono disponibili dati sui benefici dell'uso a lungo termine di corticosteroidi orali a dosi basse o medie e alte con una aumento significativo del rischio di AE. Tuttavia, questo fatto non impedisce la nomina di corticosteroidi orali durante le esacerbazioni.
I corticosteroidi orali causano una serie di gravi effetti indesiderati; uno dei più importanti in relazione alla BPCO è la miopatia da steroidi, i cui sintomi sono debolezza muscolare, ridotta attività fisica e insufficienza respiratoria in pazienti con BPCO estremamente grave.
Teofillina.
Rimane la controversia sull'esatto meccanismo d'azione della teofillina, ma questo farmaco ha attività sia broncodilatatoria che antinfiammatoria. La teofillina migliora significativamente la funzione polmonare nella BPCO e possibilmente migliora la funzione dei muscoli respiratori, ma aumenta il rischio di eventi avversi. Esistono prove che basse dosi di teofillina (100 mg 2 r / die) riducono in modo statisticamente significativo la frequenza delle riacutizzazioni della BPCO.
La teofillina è raccomandata per il trattamento della BPCO come terapia aggiuntiva nei pazienti con sintomi gravi.
Commenti. L'effetto della teofillina sulla funzionalità polmonare e sui sintomi nella BPCO è meno pronunciato di quello del LABA formoterolo e salmeterolo.
La durata esatta dell'azione della teofillina, inclusa droghe moderne con rilascio lento, nella BPCO non è noto.
Quando si prescrive la teofillina, si raccomanda di monitorarne la concentrazione nel sangue e regolare la dose del farmaco in base ai risultati ottenuti.
Livello di persuasività delle raccomandazioni C (livello di evidenza - 3).
Commenti. La farmacocinetica della teofillina è caratterizzata da differenze interindividuali e da una tendenza alle interazioni farmacologiche. La teofillina ha un intervallo di concentrazione terapeutica ristretto e può portare a tossicità. Gli eventi avversi più comuni includono irritazione gastrica, nausea, vomito, diarrea, aumento della diuresi, segni di stimolazione del sistema nervoso centrale (mal di testa, nervosismo, ansia, agitazione) e aritmie cardiache.
Farmaci antibatterici.
La nomina di macrolidi (azitromicina) nel regime di terapia a lungo termine è raccomandata per i pazienti con BPCO con bronchiectasie e frequenti esacerbazioni purulente.
Livello di forza della raccomandazione C (livello di evidenza - 2).
Commenti. Una recente meta-analisi ha dimostrato che il trattamento a lungo termine con macrolidi (eritromicina, claritromicina e azitromicina) in 6 studi della durata da 3 a 12 mesi ha determinato una riduzione del 37% dell'incidenza delle riacutizzazioni della BPCO rispetto al placebo. Inoltre, i ricoveri sono diminuiti del 21%. L'uso diffuso dei macrolidi è limitato dal rischio di aumento della resistenza batterica ad essi e dagli effetti collaterali (perdita dell'udito, cardiotossicità).
Farmaci mucoattivi.
Questo gruppo comprende diverse sostanze con diversi meccanismi di azione. L'uso regolare di mucolitici nella BPCO è stato studiato in diversi studi con risultati contrastanti.
La nomina di N-acetilcisteina e carbocisteina è raccomandata per i pazienti con BPCO con fenotipo di bronchite e frequenti esacerbazioni, specialmente se l'ICS non viene trattato.
Livello di forza della raccomandazione C (livello di evidenza - 3).
Commenti. La N-aceticisteina e la carbocisteina possono esibire proprietà antiossidanti e possono ridurre le riacutizzazioni, ma non migliorano la funzionalità polmonare o la qualità della vita nei pazienti con BPCO.
Scelta dell'inalatore.
Si raccomanda di istruire i pazienti con BPCO sull'uso corretto degli inalatori all'inizio del trattamento e quindi monitorarne l'uso nelle visite successive.Commenti. Una percentuale significativa di pazienti commette errori durante l'uso di inalatori. Quando si utilizza un inalatore di polvere predosata (DPI), non è richiesta alcuna coordinazione tra la pressione del pulsante e l'inalazione, ma è necessario uno sforzo inspiratorio sufficiente per creare un flusso inspiratorio sufficiente. Quando si utilizza un inalatore aerosol predosato (MAI), non è richiesto un flusso inspiratorio elevato, ma il paziente deve essere in grado di coordinare l'attivazione dell'inalatore con l'inizio dell'inspirazione.
Si raccomanda di utilizzare distanziatori quando si prescrivono PDI per eliminare il problema della coordinazione e ridurre la deposizione del farmaco nel tratto respiratorio superiore.
Livello di persuasività delle raccomandazioni A (livello di evidenza - 3).
Nei pazienti con BPCO grave, si raccomanda di dare la preferenza a un PDI (anche con un distanziatore) oa un inalatore liquido.
Livello di persuasività delle raccomandazioni A (livello di evidenza - 3).
Commenti. Questa raccomandazione si basa sul fatto che il flusso inspiratorio non è sempre sufficiente nei pazienti con BPCO grave che utilizzano DPI.
I principi di base per la scelta dell'inalatore giusto sono descritti nell'Appendice G7.
Gestione della BPCO stabile.
Si consiglia a tutti i pazienti con BPCO di implementare misure non farmacologiche, prescrivere un broncodilatatore a breve durata d'azione da utilizzare secondo necessità, vaccinarsi contro l'influenza e l'infezione pneumococcica e trattare le comorbidità.Commenti. Gli interventi non farmacologici comprendono la cessazione del fumo, la tecnica di inalazione e la formazione all'autogestione, le vaccinazioni contro l'influenza e lo pneumococco, l'incoraggiamento all'attività fisica, la valutazione della necessità di ossigenoterapia a lungo termine (VCT) e la ventilazione non invasiva (NIV).
Si consiglia a tutti i pazienti con BPCO di prescrivere DDBD - una combinazione di DDAC / LABA o uno di questi farmaci in monoterapia (Appendice B).
Livello di persuasività delle raccomandazioni A (livello di evidenza - 1).
Se il paziente presenta sintomi gravi (mMRC ≥ 2 o CAT ≥ 10), si raccomanda di prescrivere una combinazione di LAAD / LABA immediatamente dopo aver stabilito la diagnosi di BPCO.
Livello di persuasività delle raccomandazioni A (livello di evidenza - 1).
Commenti. La maggior parte dei pazienti con BPCO presenta sintomi gravi come mancanza di respiro e ridotta tolleranza all'esercizio. La nomina di una combinazione di DDAH / LABA consente, grazie alla massima broncodilatazione, di alleviare la mancanza di respiro, aumentare la tolleranza all'esercizio e migliorare la qualità della vita dei pazienti.
L'inizio della monoterapia con un singolo broncodilatatore a lunga durata d'azione (LABA o LABA) è raccomandato nei pazienti asintomatici (mMRC< 2 или САТ.
Livello di persuasività delle raccomandazioni A (livello di evidenza - 1).
Commenti. Il vantaggio di DDAH è un effetto più pronunciato sul rischio di esacerbazioni.
Con la persistenza dei sintomi (mancanza di respiro e ridotta tolleranza all'esercizio) sullo sfondo della monoterapia con solo LABD, si raccomanda di aumentare la terapia con broncodilatatori - trasferimento a una combinazione di DDAH / LABA (Appendice B) .
La nomina di una combinazione di DDAH / LABA invece della monoterapia è raccomandata anche per esacerbazioni ripetute (2 o più esacerbazioni moderate entro 1 anno o almeno 1 grave esacerbazione che richiede il ricovero in ospedale) in pazienti senza indicazioni di asma e senza eosinofilia del sangue (Appendice B) .
Livello di persuasività delle raccomandazioni A (livello di evidenza - 2).
Commenti. La combinazione di DDAC/LABA glicopirronio bromuro/indacaterolo nello studio FLAME ha ridotto il rischio di esacerbazioni moderate/gravi della BPCO in modo più efficace rispetto alla combinazione di ICS/LABA (fluticasone/salmeterolo) nei pazienti con BPCO con FEV1 25-60% del previsto e senza eosinofilia alta nel sangue.
Se durante la terapia con solo LABA si verificano ripetute riacutizzazioni in un paziente con BPCO e BA o con eosinofilia ematica, si raccomanda al paziente di prescrivere LABA / ICS (Appendice B).
Livello di persuasività delle raccomandazioni A (livello di evidenza - 2).
Commenti. Il criterio per l'eosinofilia del sangue è il contenuto di eosinofili nel sangue (senza esacerbazione) 300 cellule per 1 µl.
Se durante la terapia con una combinazione di DDAC / LABA si verificano ripetute riacutizzazioni in pazienti con BPCO con asma o eosinofilia, si raccomanda l'aggiunta di ICS al paziente (Appendice B).
Livello di persuasività delle raccomandazioni A (livello di evidenza - 2).
Commenti. Il paziente può anche arrivare alla tripla terapia con efficacia insufficiente della terapia IGCS/LABA, quando al trattamento viene aggiunto il LAAA.
La terapia tripla con LAAA/LABA/IGCS può attualmente essere somministrata in due modi: 1) utilizzando una combinazione fissa di LAAA/LABA e un inalatore separato di ICS; 2) utilizzando una combinazione fissa di LABA/IGCS e un inalatore DDAH separato. La scelta tra questi metodi dipende dalla terapia iniziale, dalla conformità con diversi inalatori e dalla disponibilità di farmaci.
In caso di riacutizzazioni ripetute in terapia con una combinazione di LAAA/LABA in un paziente senza asma ed eosinofilia o di recidiva di riacutizzazioni in terapia tripla (LAHA/LABA/IGCS), si raccomanda di chiarire il fenotipo della BPCO e prescrivere un fenotipo specifico terapia (roflumilast, N-acetilcisteina, azitromicina, ecc.; – appendice B).
Livello di persuasività delle raccomandazioni B (livello di evidenza - 3).
Si sconsiglia di ridurre il volume della terapia broncodilatatoria (in assenza di eventi avversi) anche in caso di massimo sollievo dai sintomi.
Forza della raccomandazione A (livello di evidenza -2).
Commenti. Ciò è dovuto al fatto che la BPCO è una malattia progressiva, quindi non è possibile una completa normalizzazione della funzione polmonare.
Nei pazienti con BPCO senza riacutizzazioni ricorrenti e con funzione polmonare conservata (FEV1 50% del predetto), si raccomanda di cancellare completamente l'ICS, a condizione che sia prescritta la DDBD.
Livello di forza della raccomandazione B (livello di evidenza -2).
Commenti. Se, a parere del medico, il paziente non ha bisogno di continuare il trattamento con ICS, o si sono verificati eventi avversi da tale terapia, allora ICS può essere annullato senza aumentare il rischio di esacerbazioni.
Nei pazienti con FEV1< 50% от должного, получающих тройную терапию, рекомендуется постепенная отмена ИГКС со ступенчатым уменьшением его дозы в течение 3 месяцев .
Forza della raccomandazione A (livello di evidenza -3).
Commenti. Valore FEV1< 50% ранее считалось фактором риска частых обострений ХОБЛ и рассматривалось как показание к назначению комбинации ИГКС/ДДБА. В настоящее время такой подход не рекомендуется, поскольку он приводит к нежелательным эффектам и неоправданным затратам , хотя в реальной практике ИГКС и комбинации ИГКС/ДДБА назначаются неоправданно часто.
3.2 Trattamento chirurgico.
La chirurgia per la riduzione del volume polmonare è raccomandata per i pazienti con BPCO con enfisema del lobo superiore e scarsa tolleranza all'esercizio.Livello di persuasività delle raccomandazioni C (livello di evidenza - 3).
Commenti. L'intervento chirurgico di riduzione del volume polmonare viene eseguito rimuovendo parte del polmone per ridurre l'iperinflazione e ottenere un pompaggio più efficiente dei muscoli respiratori. Allo stato attuale, per ridurre il volume polmonare, è anche possibile utilizzare metodi meno invasivi: occlusione dei bronchi segmentari mediante valvole, colla speciale, ecc.;
Il trapianto di polmone è raccomandato per un numero di pazienti con BPCO molto grave in presenza delle seguenti indicazioni: indice BODE ≥ 7 punti (BODE - B - indice di massa corporea (indice di massa corporea), O - ostruzione (ostruzione) D - dispnea ( mancanza di respiro), E - tolleranza all'esercizio (tolleranza all'attività fisica)), FEV1< 15% от должных, ≥ 3 обострений в предшествующий год, 1 обострение с развитием острой гиперкапнической дыхательной недостаточности (ОДН), среднетяжелая-тяжелая легочная гипертензия (среднее давление в легочной артерии ≥35 мм) .
Livello di persuasività delle raccomandazioni C (livello di evidenza - 3).
Commenti. Il trapianto di polmone può migliorare la qualità della vita e le prestazioni funzionali in pazienti con BPCO accuratamente selezionati.
3.3 Altri trattamenti.
Ossigenoterapia a lungo termine.
Una delle complicanze più gravi della BPCO che si sviluppa nelle sue fasi tardive (terminali) è l'insufficienza respiratoria cronica (IRC). Il sintomo principale dell'insufficienza renale cronica è lo sviluppo di ipossiemia, ecc.; diminuzione del contenuto di ossigeno nel sangue arterioso (PaO2).La VCT è attualmente una delle poche terapie in grado di ridurre la mortalità nei pazienti con BPCO. L'ipossiemia non solo accorcia la vita dei pazienti con BPCO, ma ha anche altre conseguenze avverse significative: deterioramento della qualità della vita, sviluppo di policitemia, aumento del rischio di aritmie cardiache durante il sonno e sviluppo e progressione dell'ipertensione polmonare. La VCT può ridurre o eliminare tutti questi effetti negativi dell'ipossiemia.
La VCT è raccomandata per i pazienti con BPCO con insufficienza renale cronica (vedere l'appendice D8 per le indicazioni).
Forza della raccomandazione A (livello di evidenza -1).
Commenti. Va sottolineato che la presenza di segni clinici cuore polmonare suggerisce la nomina anticipata di VCT.
La correzione dell'ipossiemia con l'ossigeno è il metodo fisiopatologicamente più comprovato per il trattamento della CRD. A differenza di una fila condizioni di emergenza(polmonite, edema polmonare, trauma), l'uso dell'ossigeno nei pazienti con ipossiemia cronica deve essere costante, prolungato e solitamente svolto a casa, motivo per cui questa forma di terapia è chiamata VCT.
Si raccomanda di valutare i parametri dello scambio gassoso, su cui si basano le indicazioni per VCT, solo durante lo stato stabile dei pazienti, ecc.; 3-4 settimane dopo l'esacerbazione della BPCO.
Livello di persuasività delle raccomandazioni C (livello di evidenza - 3).
Commenti.È questo il tempo necessario per ripristinare lo scambio di gas e il trasporto di ossigeno dopo un periodo di ODN. Prima di prescrivere VCT a pazienti con BPCO, si raccomanda di assicurarsi che le possibilità della terapia farmacologica siano state esaurite e che possibile terapia non porta ad un aumento della PaO2 al di sopra dei valori limite.
Quando si prescrive l'ossigenoterapia, si raccomanda di sforzarsi di raggiungere valori di PaO2 di 60 mm e SaO2 del 90%.
Livello di persuasività delle raccomandazioni C (livello di evidenza - 3).
La VCT non è raccomandata per i pazienti con BPCO che continuano a fumare; non ricevere un'adeguata terapia farmacologica volta a controllare il decorso della BPCO (broncodilatatori, ICS); insufficientemente motivati per questo tipo di terapia.
Livello di persuasività delle raccomandazioni C (livello di evidenza - 3).
Si raccomanda alla maggior parte dei pazienti con BPCO di condurre VCT per almeno 15 ore al giorno con intervalli massimi tra le sessioni non superiori a 2 ore consecutive, con un flusso di ossigeno di 1-2 l/min.
Livello di persuasività delle raccomandazioni B (livello di evidenza - 2).
Ventilazione domestica prolungata.
L'ipercapnia (td; un aumento della tensione parziale dell'anidride carbonica nel sangue arterioso - PaCO2 ≥ 45 mm) è un marker di una diminuzione della riserva ventilatoria con stadi terminali malattie polmonari e funge anche da fattore prognostico negativo per i pazienti con BPCO. L'ipercapnia notturna modifica la sensibilità del centro respiratorio alla CO2, portando a livelli più elevati di PaCO2 durante il giorno, che ha Conseguenze negative per la funzione del cuore, del cervello e dei muscoli respiratori. La disfunzione dei muscoli respiratori, unita ad un elevato carico resistivo, elastico e di soglia sull'apparato respiratorio, aggrava ulteriormente l'ipercapnia nei pazienti con BPCO, sviluppando così un "circolo vizioso" che può essere interrotto solo dal supporto respiratorio (ventilazione polmonare).Nei pazienti con BPCO con insufficienza renale cronica stabile che non hanno bisogno terapia intensiva, è possibile condurre un supporto respiratorio a lungo termine su base continuativa a casa - la cosiddetta ventilazione domiciliare a lungo termine dei polmoni (LHVL).
L'uso di DDWL nei pazienti con BPCO è accompagnato da una serie di effetti fisiopatologici positivi, il principale dei quali è il miglioramento dei parametri di scambio gassoso: un aumento della PaO2 e una diminuzione della PaCO2, un miglioramento della funzione dei muscoli respiratori, un aumento della tolleranza all'esercizio, un miglioramento della qualità del sonno e una diminuzione del LHI. Recenti studi hanno dimostrato che con parametri di ventilazione polmonare non invasiva (NIV) adeguatamente selezionati, è possibile un significativo miglioramento della sopravvivenza dei pazienti con BPCO complicata da CRD ipercapnica.
La DDWL è raccomandata per i pazienti con BPCO che soddisfano i seguenti criteri:
- La presenza di sintomi di insufficienza renale cronica: debolezza, mancanza di respiro, mal di testa mattutino;
- Presenza di uno dei seguenti: PaCO2 55 mm, PaCO2 50-54 mm ed episodi di desaturazioni notturne (SaO2< 88% в течение более 5 мин во время O2-терапии 2 л/мин), PaCO2 50-54 мм и частые госпитализации вследствие развития повторных обострений (2 и более госпитализаций за 12 мес).
Livello di persuasività delle raccomandazioni A (livello di evidenza - 1).
Società respiratoria russa
broncopneumopatia cronica ostruttiva
Chuchalin Alexander Grigorevich |
Direttore dell'istituto di bilancio dello Stato federale "Istituto di ricerca di pneumologia" FMBA |
Russia, presidente del consiglio di amministrazione del russo |
|
società respiratoria, capo |
|
pneumologo specialista libero professionista |
|
Ministero della Salute della Federazione Russa, Accademico dell'Accademia Russa delle Scienze Mediche, Professore, |
|
Aisanov Zaurbek Ramazanovich |
Direttore del Dipartimento di Fisiologia Clinica |
e ricerca clinica FSBI "NII |
|
Avdeev Sergey Nikolaevich |
Vicedirettore per lavoro scientifico, |
Capo del dipartimento clinico dell'Istituto di bilancio dello Stato federale "NII |
|
pneumologia" FMBA della Russia, professore, MD |
|
Belevsky Andrey |
Professore del Dipartimento di Pneumologia, SBEI HPE |
Stanislavovich |
Università medica di ricerca nazionale russa intitolata a N.I. Pirogova, testa |
laboratorio di risanamento dell'Istituto di Bilancio dello Stato Federale "NII |
|
pneumologia" FMBA della Russia , professore, d.m.s. |
|
Leshchenko Igor Viktorovich |
Professore del Dipartimento di Tisiologia e |
pneumologia GBOU VPO USMU, capo |
|
pneumologo libero professionista, Ministero della Salute |
|
Regione e amministrazione di Sverdlovsk |
|
assistenza sanitaria di Ekaterinburg, scientifica |
|
capo della clinica "Medica |
|
Associazione "Nuovo Ospedale", professore, |
|
Dottore in scienze mediche, dottore onorato della Russia, |
|
Meshcheryakova Natalya Nikolaevna |
Professore Associato del Dipartimento di Pneumologia, Russian National Research Medical University |
prende il nome da N.I. Pirogova, ricercatore leader |
|
laboratorio di riabilitazione dell'Istituto di bilancio dello Stato federale "NII |
|
pneumologia" FMBA della Russia, Ph.D. |
|
Ovcharenko Svetlana Ivanovna |
Docente del Dipartimento di Terapia della Facoltà n. |
1 Facoltà di Medicina, GBOU VPO First |
|
MGMU loro. LORO. Sechenov, professore, MD, |
|
Dottore Onorato della Federazione Russa |
|
Shmelev Evgeny Ivanovich |
Capo del Dipartimento del differenziale |
diagnosi di tubercolosi CNIIT RAMS, dottore |
|
miele. Sci., professore, d.m.s., stagnato |
|
lavoratore della scienza della Federazione Russa. |
Metodologia |
||
Definizione di BPCO ed epidemiologia |
||
Quadro clinico della BPCO |
||
Principi diagnostici |
||
Test funzionali in diagnostica e monitoraggio |
||
corso di BPCO |
||
Diagnosi differenziale della BPCO |
||
Classificazione moderna della BPCO. Integrato |
||
valutazione della gravità della corrente. |
||
Terapia per la BPCO stabile |
||
Esacerbazione della BPCO |
||
Terapia per la riacutizzazione della BPCO |
||
BPCO e comorbidità |
||
Riabilitazione ed educazione del paziente |
||
1. Metodologia
Metodi utilizzati per raccogliere/selezionare le prove:
ricerca nelle banche dati elettroniche.
Descrizione dei metodi utilizzati per raccogliere/selezionare le prove:
Metodi utilizzati per valutare la qualità e la forza delle prove:
Consenso degli esperti;
Descrizione |
||||||
evidenza |
||||||
Meta-analisi Alta qualità, revisioni sistematiche |
||||||
studi randomizzati controllati (RCT) o |
||||||
RCT con rischio di bias molto basso |
||||||
Meta-analisi condotte qualitativamente, sistematiche o |
||||||
RCT con basso rischio di bias |
||||||
Meta-analisi, RCT sistematici o ad alto rischio |
||||||
errori sistematici |
||||||
alta qualità |
revisioni sistematiche |
ricerca |
||||
controllo dei casi |
coorte |
ricerca. |
||||
Revisioni di alta qualità di studi caso-controllo o |
||||||
studi di coorte con un rischio di effetti molto basso |
||||||
errori di miscelazione o sistematici e la probabilità media |
||||||
causa |
||||||
Studi caso-controllo ben condotti o |
||||||
studi di coorte con un rischio medio di effetti confondenti |
||||||
o errori sistematici e la probabilità media di causalità |
||||||
interconnessioni |
||||||
Studi caso-controllo o di coorte con |
||||||
alto rischio di effetti confondenti o sistemici |
||||||
errori e la probabilità media di una relazione causale |
||||||
Studi non analitici (ad esempio, descrizioni dei casi, |
||||||
serie di casi) |
||||||
Opinione di un esperto |
||||||
Metodi utilizzati per analizzare le prove:
Revisioni sistematiche con tabelle di evidenza.
Descrizione dei metodi utilizzati per analizzare le prove:
Quando si selezionano le pubblicazioni come potenziali fonti di evidenza, la metodologia utilizzata in ogni studio viene rivista per garantirne la validità. Il risultato dello studio influenza il livello di evidenza assegnato alla pubblicazione, che a sua volta influenza la forza delle raccomandazioni che ne derivano.
Lo studio metodologico si basa su diverse domande chiave che si concentrano su quelle caratteristiche del disegno dello studio che hanno un impatto significativo sulla validità dei risultati e delle conclusioni. Queste domande chiave possono variare a seconda dei tipi di studi e dei questionari utilizzati per standardizzare il processo di valutazione della pubblicazione. Le raccomandazioni hanno utilizzato il questionario MERGE sviluppato dal New South Wales Department of Health. Questo questionario è destinato alla valutazione dettagliata e all'adattamento in conformità con i requisiti della Russian Respiratory Society (RRS) al fine di mantenere un equilibrio ottimale tra rigore metodologico e applicazione pratica.
Il processo di valutazione, ovviamente, può essere influenzato dal fattore soggettivo. Per ridurre al minimo i potenziali errori, ogni studio è stato valutato in modo indipendente, ad es. almeno due membri indipendenti del gruppo di lavoro. Eventuali differenze nelle valutazioni sono state già discusse da tutto il gruppo in in pieno vigore. Se non è stato possibile raggiungere un consenso, è stato coinvolto un esperto indipendente.
Tabelle delle prove:
Le tabelle delle prove sono state compilate dai membri del gruppo di lavoro.
Metodi utilizzati per formulare raccomandazioni:
Descrizione |
|
Almeno una meta-analisi, revisione sistematica o RCT |
|
dimostrare la sostenibilità dei risultati |
|
Gruppo di prova inclusi i risultati dello studio valutati |
|
sostenibilità complessiva dei risultati |
|
evidenze estrapolate da studi classificati 1++ |
|
Gruppo di prova inclusi i risultati dello studio valutati |
|
sostenibilità complessiva dei risultati; |
|
evidenze estrapolate da studi classificati 2++ |
|
prove di livello 3 o 4; |
|
evidenze estrapolate da studi classificati 2+ |
Punti di buona pratica (GPP):
Analisi economica:
L'analisi dei costi non è stata eseguita e le pubblicazioni sulla farmacoeconomia non sono state analizzate.
Revisione inter pares esterna;
Revisione inter pares interna.
Queste bozze di linee guida sono state riviste da esperti indipendenti a cui è stato chiesto di commentare principalmente la misura in cui l'interpretazione delle prove alla base delle raccomandazioni è comprensibile.
Sono stati ricevuti commenti da medici di base e terapisti distrettuali in merito alla comprensibilità della presentazione delle raccomandazioni e alla loro valutazione dell'importanza delle raccomandazioni come strumento di lavoro nella pratica quotidiana.
La bozza è stata anche inviata a un revisore non medico per commenti dal punto di vista del paziente.
I commenti ricevuti dagli esperti sono stati accuratamente sistematizzati e discussi dal presidente e dai membri del gruppo di lavoro. Ogni punto è stato discusso e le conseguenti modifiche alle raccomandazioni sono state registrate. Se non sono state apportate modifiche, sono state registrate le ragioni del rifiuto di apportare modifiche.
Consultazione e valutazione di esperti:
La bozza è stata pubblicata per la discussione pubblica sul sito web dell'RPO in modo che i partecipanti non congressuali potessero partecipare alla discussione e al miglioramento delle raccomandazioni.
Gruppo di lavoro:
Per la revisione finale e il controllo di qualità, le raccomandazioni sono state riesaminate dai membri del gruppo di lavoro, che sono giunti alla conclusione che tutti i commenti e le osservazioni degli esperti sono stati presi in considerazione, il rischio di errori sistematici nello sviluppo di le raccomandazioni sono state ridotte al minimo.
2. Definizione di BPCO ed epidemiologia
Definizione
La BPCO è una malattia prevenibile e curabile caratterizzata da una persistente limitazione del flusso aereo che di solito è progressiva ed è associata a una marcata risposta infiammatoria cronica dei polmoni a particelle o gas patogeni. In alcuni pazienti, le riacutizzazioni e le comorbilità possono influenzare la gravità complessiva della BPCO (GOLD 2014).
Tradizionalmente, la BPCO combina la bronchite cronica e l'enfisema polmonare.La bronchite cronica è generalmente definita clinicamente come la presenza di tosse con
produzione di espettorato per almeno 3 mesi nei successivi 2 anni.
L'enfisema è definito morfologicamente come la presenza di dilatazione permanente delle vie aeree distali ai bronchioli terminali, associata a distruzione delle pareti alveolari, non associata a fibrosi.
Nei pazienti con BPCO, entrambe le condizioni sono più spesso presenti e in alcuni casi è abbastanza difficile distinguerle clinicamente nelle prime fasi della malattia.
Il concetto di BPCO non include l'asma bronchiale e altre malattie associate a ostruzione bronchiale scarsamente reversibile (fibrosi cistica, bronchiectasie, bronchiolite obliterante).
Epidemiologia
Prevalenza
BPCO è attualmente problema globale. In alcune parti del mondo la prevalenza della BPCO è molto alta (oltre il 20% in Cile), in altre è inferiore (circa il 6% in Messico). Le ragioni di questa variabilità sono le differenze nel modo di vivere delle persone, il loro comportamento e il contatto con vari agenti dannosi.
Uno degli studi globali (il progetto BOLD) ha fornito un'opportunità unica per stimare la prevalenza della BPCO utilizzando questionari standardizzati e test di funzionalità polmonare nelle popolazioni adulte di età superiore ai 40 anni, sia nei paesi sviluppati che in quelli in via di sviluppo. La prevalenza della BPCO stadio II e superiore (GOLD 2008), secondo lo studio BOLD, tra le persone di età superiore ai 40 anni era del 10,1±4,8%; compreso per gli uomini - 11,8±7,9% e per le donne - 8,5±5,8%. Secondo uno studio epidemiologico sulla prevalenza della BPCO nella regione di Samara (residenti di età pari o superiore a 30 anni), la prevalenza della BPCO nel campione totale era del 14,5% (uomini -18,7%, donne - 11,2%). Secondo i risultati di un altro studio russo condotto nella regione di Irkutsk, la prevalenza della BPCO nelle persone di età superiore ai 18 anni tra la popolazione urbana era del 3,1%, tra quella rurale del 6,6%. La prevalenza della BPCO aumentava con l'età: nella fascia di età da 50 a 69 anni, il 10,1% degli uomini in città e il 22,6% nelle zone rurali soffrivano della malattia. A quasi un uomo su due di età superiore ai 70 anni che vive nelle zone rurali è stata diagnosticata la BPCO.
Mortalità
Secondo l'OMS, la BPCO è attualmente la quarta causa di morte nel mondo. Circa 2,75 milioni di persone muoiono ogni anno di BPCO, rappresentando il 4,8% di tutte le cause di morte. In Europa, la mortalità per BPCO varia considerevolmente, da 0,20 per 100.000 abitanti in Grecia, Svezia, Islanda e Norvegia, a 80 per 100.000 abitanti
in Ucraina e Romania.
IN periodo dal 1990 al 2000 letalità damalattia cardiovascolare
in in generale e da ictus sono diminuiti rispettivamente del 19,9% e del 6,9%, mentre la mortalità per BPCO è aumentata del 25,5%. Un aumento particolarmente pronunciato della mortalità per BPCO si osserva tra le donne.
Predittori di mortalità nei pazienti con BPCO sono fattori come la gravità ostruzione bronchiale, stato nutrizionale (indice di massa corporea), resistenza fisica secondo il test del cammino di 6 minuti e gravità della dispnea, frequenza e gravità delle riacutizzazioni, ipertensione polmonare.
Le principali cause di morte nei pazienti con BPCO sono l'insufficienza respiratoria (RF), cancro ai polmoni, malattie cardiovascolari e tumori di altra localizzazione.
Importanza socioeconomica della BPCO
IN Nei paesi sviluppati, i costi economici totali associati alla BPCO nella struttura delle malattie polmonari occupano 2° dopo cancro al polmone e 1°
in termini di costi diretti, superando di 1,9 volte i costi diretti per l'asma bronchiale. I costi economici per paziente associato alla BPCO sono tre volte superiori a quelli per un paziente con asma bronchiale. I pochi rapporti sui costi medici diretti nella BPCO indicano che oltre l'80% delle risorse materiali è destinato all'assistenza ospedaliera dei pazienti e meno del 20% all'assistenza ambulatoriale. È stato stabilito che il 73% dei costi è per il 10% dei pazienti con un decorso grave della malattia. Il maggior danno economico è causato dal trattamento delle riacutizzazioni della BPCO. In Russia, l'onere economico della BPCO, tenendo conto dei costi indiretti, inclusi l'assenteismo (assenteismo) e il presenzialismo (lavoro meno efficace a causa della cattiva salute), è di 24,1 miliardi di rubli.
3. Quadro clinico della BPCO
In condizioni di esposizione a fattori di rischio (fumo, sia attivo che passivo, inquinanti esogeni, combustibili bioorganici, ecc.), la BPCO di solito si sviluppa lentamente e progredisce gradualmente. La particolarità del quadro clinico è quella a lungo la malattia procede senza manifestazioni cliniche pronunciate (3, 4; D).
I primi segni che i pazienti cercano assistenza medica sono la tosse, spesso con produzione di espettorato e/o mancanza di respiro. Questi sintomi sono più pronunciati al mattino. Durante le stagioni fredde si verificano "frequenti raffreddori". Questo è il quadro clinico dell'esordio della malattia, che è considerata dal medico una manifestazione della bronchite del fumatore, e la diagnosi di BPCO in questa fase non viene praticamente fatta.
Anche la tosse cronica, di solito il primo sintomo della BPCO, è spesso sottovalutata dai pazienti, in quanto considerata una conseguenza attesa del fumo e/o dell'esposizione a fattori ambientali avversi. Di solito, i pazienti producono una piccola quantità di espettorato viscoso. Un aumento della tosse e della produzione di espettorato si verifica più spesso nei mesi invernali, durante le esacerbazioni infettive.
La mancanza di respiro è il sintomo più importante della BPCO (4; D). Spesso serve come motivo per cercare assistenza medica e il motivo principale che limita l'attività lavorativa del paziente. L'impatto della dispnea sulla salute viene valutato utilizzando il questionario del British Medical Council (MRC). All'inizio, la mancanza di respiro si nota con un livello relativamente alto di attività fisica, come correre su un terreno pianeggiante o camminare sulle scale. Con il progredire della malattia, la dispnea peggiora e può limitare anche l'attività quotidiana, per poi manifestarsi a riposo, costringendo il paziente a rimanere a casa (Tabella 3). Inoltre, la valutazione della dispnea sulla scala MRC è uno strumento sensibile per predire la sopravvivenza dei pazienti con BPCO.
Tabella 3. Valutazione della dispnea secondo la scala della dispnea del Medical Research Council Scale (MRC).
Descrizione |
|||
Sento mancanza di respiro solo con un forte fisico |
|||
caricare |
|||
Resto senza fiato quando cammino velocemente su un terreno pianeggiante o |
|||
salendo una dolce collina |
|||
A causa della mancanza di respiro, cammino più lentamente su un terreno pianeggiante, |
|||
di persone della stessa età, o mi ferma |
|||
respiro mentre cammino su un terreno pianeggiante nel mio solito |
|||
temp per me |
Nel descrivere la clinica della BPCO, è necessario tenere conto delle caratteristiche caratteristiche di questa particolare malattia: il suo esordio subclinico, assenza sintomi specifici la costante progressione della malattia.
La gravità dei sintomi varia a seconda della fase del decorso della malattia (decorso stabile o esacerbazione). Stabile dovrebbe essere considerata la condizione in cui la gravità dei sintomi non cambia significativamente nell'arco di settimane o addirittura mesi e, in questo caso, la progressione della malattia può essere rilevata solo con un monitoraggio dinamico a lungo termine (6-12 mesi) della paziente.
Le esacerbazioni della malattia hanno un impatto significativo sul quadro clinico - peggioramento ricorrente della condizione (che dura almeno 2-3 giorni), accompagnato da un aumento dell'intensità dei sintomi e disturbi funzionali. Durante un'esacerbazione, c'è un aumento della gravità dell'iperinflazione e del cosiddetto. trappole d'aria in combinazione con un flusso espiratorio ridotto, che porta ad un aumento della dispnea, che di solito è accompagnato dalla comparsa o dall'intensificazione di respiro sibilante remoto, una sensazione di pressione al petto e una diminuzione della tolleranza all'esercizio. Inoltre, vi è un aumento dell'intensità della tosse, della quantità di espettorato, della natura della sua separazione, del cambiamento di colore e viscosità (aumenta o diminuisce bruscamente). Allo stesso tempo, gli indicatori di performance si deteriorano respirazione esterna e gas nel sangue: gli indicatori di velocità diminuiscono (FEV1, ecc.), possono verificarsi ipossiemia e persino ipercapnia.
Il decorso della BPCO è un'alternanza di una fase stabile e un'esacerbazione della malattia, ma in persone diverse procede diversamente. Tuttavia, la progressione della BPCO è comune, specialmente se il paziente continua ad essere esposto a particelle o gas patogeni inalati.
Il quadro clinico della malattia dipende anche seriamente dal fenotipo della malattia e, viceversa, il fenotipo determina le caratteristiche delle manifestazioni cliniche della BPCO. Per molti anni, c'è stata una divisione dei pazienti in fenotipi enfisematosi e bronchitici.
Il tipo di bronchite è caratterizzato da una predominanza di segni di bronchite (tosse, espettorato). L'enfisema in questo caso è meno pronunciato. Nel tipo enfisematoso, al contrario, l'enfisema è la principale manifestazione patologica, la mancanza di respiro prevale sulla tosse. Tuttavia, nella pratica clinica, è molto raro distinguere il fenotipo enfisematoso o bronchite della BPCO nel cosiddetto. forma "pura" (sarebbe più corretto parlare di un fenotipo della malattia prevalentemente bronchitico o prevalentemente enfisematoso). Le caratteristiche dei fenotipi sono presentate in maggior dettaglio nella Tabella 4.
Tabella 4. Caratteristiche cliniche e di laboratorio dei due principali fenotipi di BPCO.
Peculiarità |
esterno |
Nutrizione ridotta |
||||
carnagione rosa |
Cianosi diffusa |
|||||
Arti - freddi |
arti caldi |
|||||
Sintomo predominante |
||||||
Scarso - più spesso mucoso |
Abbondante - più spesso mucoso |
|||||
infezione bronchiale |
||||||
Cuore polmonare |
||||||
fase terminale |
||||||
Radiografia |
Iper inflazione, |
Guadagno |
polmonare |
|||
petto |
bolloso |
i cambiamenti, |
aumento |
|||
cuore "verticale". |
dimensione del cuore |
|||||
Ematocrito, % |
||||||
PaO2 |
||||||
PaCO2 |
||||||
Diffusione |
piccolo |
|||||
capacità |
declino |
|||||
Se è impossibile individuare la predominanza dell'uno o dell'altro fenotipo, si dovrebbe parlare di fenotipo misto. In ambito clinico, i pazienti con un tipo misto di malattia sono più comuni.
Oltre a quanto sopra, attualmente si distinguono altri fenotipi della malattia. Prima di tutto, questo si riferisce al cosiddetto fenotipo di sovrapposizione (combinazione di BPCO e BA). Nonostante sia necessario differenziare attentamente i pazienti con BPCO e asma bronchiale e una differenza significativa nell'infiammazione cronica in queste malattie, in alcuni pazienti BPCO e asma possono essere presenti contemporaneamente. Questo fenotipo può svilupparsi in pazienti fumatori affetti da asma bronchiale. Insieme a questo, a seguito di studi su larga scala, è stato dimostrato che circa il 20-30% dei pazienti con BPCO può avere un'ostruzione bronchiale reversibile e, in composizione cellulare gli eosinofili compaiono durante l'infiammazione. Alcuni di questi pazienti possono anche essere attribuiti al fenotipo COPD + BA. Questi pazienti rispondono bene alla terapia con corticosteroidi.
Un altro fenotipo discusso di recente è quello dei pazienti con riacutizzazioni frequenti (2 o più riacutizzazioni all'anno o 1 o più riacutizzazioni con conseguente ricovero). L'importanza di questo fenotipo è determinata dal fatto che il paziente esce dall'esacerbazione con parametri funzionali polmonari ridotti e la frequenza delle esacerbazioni influisce direttamente sull'aspettativa di vita dei pazienti e richiede un approccio individuale al trattamento. L'identificazione di numerosi altri fenotipi richiede ulteriori chiarimenti. Diversi studi recenti hanno attirato l'attenzione sulla differenza di manifestazioni cliniche BPCO tra uomini e donne. Come si è scoperto, le donne sono caratterizzate da un'iperreattività più pronunciata delle vie aeree, notano una mancanza di respiro più pronunciata agli stessi livelli di ostruzione bronchiale degli uomini, ecc. Con gli stessi indicatori funzionali nelle donne, l'ossigenazione avviene meglio che negli uomini. Tuttavia, le donne hanno maggiori probabilità di sviluppare esacerbazioni, mostrano un effetto minore. allenamento fisico nei programmi riabilitativi, valutare la qualità della vita inferiore secondo questionari standard.
È ben noto che i pazienti con BPCO presentano numerose manifestazioni extrapolmonari della malattia dovute all'effetto sistemico della
5
1 FGBOU VO RNIMU loro. N.I. Pirogov del Ministero della Salute della Russia, Mosca
2 Istituto di ricerca di pneumologia, Agenzia medica e biologica federale della Russia, Mosca
3 Istituto di istruzione superiore di bilancio dello Stato federale USMU del Ministero della salute della Russia, Ekaterinburg
4 FGAOU VO Prima Università medica statale di Mosca. I. M. Sechenov del Ministero della Salute della Russia (Università Sechenov), Mosca
5 FGBNU "TsNIIT", Mosca
Per citazione: Chuchalin A.G., Aisanov Z.R., Avdeev S.N., Leshchenko I.V., Ovcharenko S.I., Shmelev E.I. Linee guida cliniche federali per la diagnosi e il trattamento della broncopneumopatia cronica ostruttiva // BC. 2014. N. 5. 331
1. Metodologia
1. Metodologia
Metodi utilizzati per raccogliere/selezionare le prove:
. ricerca nelle banche dati elettroniche.
Descrizione dei metodi utilizzati per raccogliere/selezionare le prove:
. La base di evidenza per le raccomandazioni sono le pubblicazioni incluse nella Cochrane Library, nei database EMBASE e MEDLINE. La profondità di ricerca è stata di 5 anni.
Metodi utilizzati per valutare la qualità e la forza delle prove:
. consenso di esperti;
. valutazione di significatività secondo lo schema di rating (Tabella 1).
Metodi utilizzati per analizzare le prove:
. revisioni di meta-analisi pubblicate;
. revisioni sistematiche con tabelle di evidenza.
Descrizione dei metodi utilizzati per analizzare le prove.
Quando si selezionano le pubblicazioni come potenziali fonti di evidenza, la metodologia utilizzata in ogni studio viene rivista per garantirne la validità. Il risultato dello studio influenza il livello di evidenza assegnato alla pubblicazione, che a sua volta influenza la forza delle raccomandazioni che ne derivano.
Lo studio metodologico si basa su diverse domande chiave che si concentrano su quelle caratteristiche del disegno dello studio che hanno un impatto significativo sulla validità dei risultati e delle conclusioni. Queste domande chiave possono variare a seconda dei tipi di studi e dei questionari utilizzati per standardizzare il processo di valutazione della pubblicazione. Le raccomandazioni hanno utilizzato il questionario MERGE sviluppato dal New South Wales Department of Health. Questo questionario è destinato alla valutazione dettagliata e all'adattamento in conformità con i requisiti della Russian Respiratory Society al fine di mantenere un equilibrio ottimale tra rigore metodologico e possibilità di applicazione pratica.
Il processo di valutazione, ovviamente, può essere influenzato dal fattore soggettivo. Per ridurre al minimo i potenziali errori, ogni studio è stato valutato in modo indipendente, ovvero da almeno due membri indipendenti del gruppo di lavoro. Eventuali differenze nelle valutazioni erano già state discusse dall'intero gruppo. Se non è stato possibile raggiungere un consenso, è stato coinvolto un esperto indipendente.
Tabelle delle prove:
. le tabelle delle evidenze sono state compilate dai membri del gruppo di lavoro.
Metodi utilizzati per formulare raccomandazioni:
. consenso degli esperti.
Raccomandazioni chiave:
La forza delle raccomandazioni (A-D), i livelli di evidenza (1++, 1+, 1-, 2++, 2+, 2-, 3, 4) e gli indicatori di buona pratica (punti di buona pratica) sono forniti quando si presentano le testo delle raccomandazioni (Tabella 1).1 e 2).
2. Definizione di broncopneumopatia cronica ostruttiva (BPCO) ed epidemiologia
Definizione:
La BPCO è una malattia caratterizzata da una disfunzione ventilatoria ostruttiva parzialmente reversibile, generalmente progressiva, associata a un'aumentata risposta infiammatoria cronica dei polmoni all'azione di particelle o gas patogeni. In alcuni pazienti, le riacutizzazioni e le comorbilità possono influenzare la gravità complessiva della BPCO.
Tradizionalmente, la BPCO combina bronchite cronica ed enfisema.
La bronchite cronica è generalmente definita clinicamente come la presenza di tosse con produzione di espettorato per almeno 3 mesi. nei prossimi 2 anni. L'enfisema è definito morfologicamente come la presenza di dilatazione permanente delle vie aeree distali ai bronchioli terminali, associata a distruzione delle pareti alveolari, non associata a fibrosi. Nei pazienti con BPCO, entrambe le condizioni sono più spesso presenti ed è difficile distinguerle clinicamente.
Il concetto di BPCO non include l'asma bronchiale (BA) e altre malattie associate a ostruzione bronchiale scarsamente reversibile (fibrosi cistica, bronchiectasie, bronchiolite obliterante).
Epidemiologia
Prevalenza
La BPCO è attualmente un problema globale. In alcune parti del mondo la prevalenza della BPCO è molto alta (oltre il 20% in Cile), in altre è inferiore (circa il 6% in Messico). Le ragioni di questa variabilità sono le differenze nel modo di vivere delle persone, il loro comportamento e il contatto con vari agenti dannosi.
Uno degli studi globali (il progetto BOLD) ha fornito un'opportunità unica per stimare la prevalenza della BPCO utilizzando questionari standardizzati e test di funzionalità polmonare nelle popolazioni adulte di età superiore ai 40 anni sia nei paesi sviluppati che in quelli in via di sviluppo. La prevalenza della BPCO di stadio II e superiore (GOLD 2008), secondo lo studio BOLD, tra le persone di età superiore ai 40 anni era del 10,1±4,8%, compresi gli uomini - 11,8±7,9% e le donne - 8,5±5,8%. Secondo uno studio epidemiologico sulla prevalenza della BPCO nella regione di Samara (residenti di età pari o superiore a 30 anni), la prevalenza della BPCO nel campione totale era del 14,5% (tra gli uomini - 18,7%, tra le donne - 11,2%). Secondo i risultati di un altro studio russo condotto nella regione di Irkutsk, la prevalenza della BPCO nelle persone di età superiore ai 18 anni tra la popolazione urbana era del 3,1%, tra la popolazione rurale - 6,6%. La prevalenza della BPCO aumentava con l'età: nella fascia di età da 50 a 69 anni, il 10,1% degli uomini in città e il 22,6% nelle zone rurali soffrivano della malattia. A quasi un uomo su due di età superiore ai 70 anni che vive nelle zone rurali è stata diagnosticata la BPCO.
Mortalità
Secondo l'OMS, la BPCO è attualmente la quarta causa di morte nel mondo. Circa 2,75 milioni di persone muoiono ogni anno di BPCO, rappresentando il 4,8% di tutte le cause di morte. In Europa la mortalità per BPCO varia notevolmente: dallo 0,2 per 100mila abitanti in Grecia, Svezia, Islanda e Norvegia all'80 per 100mila in Ucraina e Romania.
Tra il 1990 e il 2000 la mortalità per malattie cardiovascolari (CVD) in generale e per ictus è diminuita rispettivamente del 19,9% e del 6,9%, mentre la mortalità per BPCO è aumentata del 25,5%. Un aumento particolarmente pronunciato della mortalità per BPCO si osserva tra le donne.
Fattori predittivi di mortalità nei pazienti con BPCO sono fattori quali la gravità dell'ostruzione bronchiale, lo stato nutrizionale (indice di massa corporea (BMI)), la resistenza fisica secondo il test del cammino in 6 minuti e la gravità della dispnea, la frequenza e la gravità delle riacutizzazioni , ipertensione polmonare.
Le principali cause di morte nei pazienti con BPCO sono insufficienza respiratoria (RF), cancro del polmone, CVD e tumori di altra localizzazione.
Importanza socioeconomica della BPCO
Nei paesi sviluppati, i costi economici totali associati alla BPCO, nella struttura delle malattie polmonari, occupano il 2° posto dopo il cancro del polmone e il 1° posto in termini di costi diretti, superando di 1,9 volte i costi diretti della BA. I costi economici per paziente associato alla BPCO sono 3 volte superiori a quelli per paziente con asma. I pochi rapporti sui costi medici diretti nella BPCO indicano che oltre l'80% delle risorse materiali è destinato all'assistenza ospedaliera dei pazienti e meno del 20% all'assistenza ambulatoriale. È stato stabilito che il 73% dei costi è per il 10% dei pazienti con un decorso grave della malattia. Il maggior danno economico è causato dal trattamento delle riacutizzazioni della BPCO. In Russia, l'onere economico della BPCO, tenendo conto dei costi indiretti, inclusi l'assenteismo (assenteismo) e il presenzialismo (lavoro meno efficace a causa della cattiva salute), è di 24,1 miliardi di rubli.
3. Quadro clinico della BPCO
In condizioni di esposizione a fattori di rischio (fumo, sia attivo che passivo, inquinanti esogeni, combustibili bioorganici, ecc.), la BPCO di solito si sviluppa lentamente e progredisce gradualmente. La particolarità del quadro clinico è che per lungo tempo la malattia procede senza manifestazioni cliniche pronunciate (3, 4; D).
I primi segni che i pazienti cercano assistenza medica sono la tosse, spesso con produzione di espettorato, e/o mancanza di respiro. Questi sintomi sono più pronunciati al mattino. Durante le stagioni fredde si verificano "frequenti raffreddori". Questo è il quadro clinico dell'insorgenza della malattia.
La tosse cronica - di solito il primo sintomo della BPCO - è spesso sottovalutata da pazienti e medici, in quanto considerata una conseguenza attesa del fumo e/o dell'esposizione a fattori ambientali avversi. Di solito, i pazienti producono una piccola quantità di espettorato viscoso. Un aumento della tosse e della produzione di espettorato si verifica più spesso nei mesi invernali, durante le esacerbazioni infettive.
La mancanza di respiro è il sintomo più importante della BPCO (4; D). Spesso serve come motivo per cercare assistenza medica e il motivo principale che limita l'attività lavorativa del paziente. L'impatto sulla salute della dispnea viene valutato utilizzando il questionario del British Medical Research Council (mMRC). Inizialmente, la mancanza di respiro si nota con un livello relativamente alto di attività fisica, ad esempio correndo su un terreno pianeggiante o camminando sulle scale. Con il progredire della malattia, la dispnea peggiora e può limitare anche l'attività quotidiana, per poi manifestarsi a riposo, costringendo il paziente a rimanere a casa (Tabella 3). Inoltre, la valutazione della dispnea sulla scala mMRC è uno strumento sensibile per prevedere la sopravvivenza dei pazienti con BPCO.
Quando si descrive la clinica della BPCO, è necessario tenere conto delle caratteristiche caratteristiche di questa particolare malattia: il suo esordio subclinico, l'assenza di sintomi specifici e la costante progressione della malattia.
La gravità dei sintomi varia a seconda della fase del decorso della malattia (decorso stabile o esacerbazione). Stabile dovrebbe essere considerato lo stato in cui la gravità dei sintomi non cambia in modo significativo per settimane o addirittura mesi, e in questo caso la progressione della malattia può essere rilevata solo con un monitoraggio dinamico a lungo termine (6-12 mesi) del paziente.
Le esacerbazioni della malattia hanno un effetto speciale sul quadro clinico: deterioramento ricorrente della condizione (che dura almeno 2-3 giorni), accompagnato da un aumento dell'intensità dei sintomi e dei disturbi funzionali. Durante una riacutizzazione, vi è un aumento della gravità dell'iperinflazione e delle cosiddette "trappole d'aria" in combinazione con un flusso espiratorio ridotto, che porta ad un aumento della dispnea, che di solito è accompagnato dalla comparsa o dall'intensificazione del respiro sibilante a distanza, un sensazione di pressione al petto e una diminuzione della tolleranza all'esercizio. Inoltre, vi è un aumento dell'intensità della tosse, della quantità di espettorato, della natura della sua separazione, del cambiamento di colore e viscosità (aumenta o diminuisce bruscamente). Allo stesso tempo, gli indicatori della funzione respiratoria esterna (RF) e dei gas del sangue peggiorano: gli indicatori di velocità diminuiscono (volume espiratorio forzato in 1 s (FEV1), ecc.), Possono verificarsi ipossiemia e persino ipercapnia. Le riacutizzazioni possono iniziare gradualmente, gradualmente o possono essere caratterizzate da un rapido deterioramento delle condizioni del paziente con lo sviluppo di insufficienza respiratoria acuta, meno spesso insufficienza ventricolare destra.
Il decorso della BPCO è un'alternanza di una fase stabile e un'esacerbazione della malattia, ma in persone diverse procede diversamente. Tuttavia, la progressione della BPCO è comune, specialmente se il paziente continua ad essere esposto a particelle o gas patogeni inalati. Il quadro clinico della malattia dipende anche seriamente dal fenotipo della malattia e, viceversa, il fenotipo determina le caratteristiche delle manifestazioni cliniche della BPCO. Per molti anni, c'è stata una divisione dei pazienti in fenotipi enfisematosi e bronchitici.
Il tipo di bronchite è caratterizzato da una predominanza di segni di bronchite (tosse, espettorato). L'enfisema in questo caso è meno pronunciato. Nel tipo enfisematoso, al contrario, l'enfisema è la principale manifestazione patologica, la mancanza di respiro prevale sulla tosse. Tuttavia, nella pratica clinica, è molto raro distinguere il fenotipo enfisematoso o bronchitico della BPCO nella forma cosiddetta "pura" (sarebbe più corretto parlare di un fenotipo prevalentemente bronchitico o prevalentemente enfisematoso della malattia). Le caratteristiche dei fenotipi sono presentate in maggior dettaglio nella Tabella 4.
Se è impossibile individuare la predominanza dell'uno o dell'altro fenotipo, si dovrebbe parlare di fenotipo misto. In ambito clinico, i pazienti con un tipo misto di malattia sono più comuni.
Oltre a quanto sopra, attualmente si distinguono altri fenotipi della malattia. Prima di tutto, questo si riferisce al cosiddetto fenotipo di sovrapposizione (combinazione di BPCO e BA). È necessario differenziare accuratamente i pazienti con BPCO e asma. Ma nonostante le differenze significative nell'infiammazione cronica in queste malattie, in alcuni pazienti la BPCO e l'asma possono essere presenti contemporaneamente. Questo fenotipo può svilupparsi nei fumatori con asma. Insieme a questo, a seguito di studi su larga scala, è stato dimostrato che circa il 20-30% dei pazienti con BPCO può avere un'ostruzione bronchiale reversibile e gli eosinofili compaiono nella composizione cellulare durante l'infiammazione. Alcuni di questi pazienti possono anche essere attribuiti al fenotipo COPD + BA. Questi pazienti rispondono bene alla terapia con corticosteroidi.
Un altro fenotipo discusso di recente è quello dei pazienti con riacutizzazioni frequenti (2 o più riacutizzazioni all'anno o 1 o più riacutizzazioni con conseguente ospedalizzazione). L'importanza di questo fenotipo è determinata dal fatto che il paziente esce da una riacutizzazione con parametri funzionali polmonari ridotti e la frequenza delle riacutizzazioni influisce direttamente sull'aspettativa di vita dei pazienti, è necessario un approccio individuale al trattamento. L'identificazione di numerosi altri fenotipi richiede ulteriori chiarimenti. Diversi studi recenti hanno attirato l'attenzione sulle differenze nelle manifestazioni cliniche della BPCO tra uomini e donne. Come si è scoperto, le donne sono caratterizzate da un'iperreattività più pronunciata delle vie respiratorie, notano una mancanza di respiro più pronunciata agli stessi livelli di ostruzione bronchiale degli uomini, ecc. Con gli stessi indicatori funzionali, l'ossigenazione nelle donne è migliore che in uomini. Tuttavia, le donne hanno maggiori probabilità di sviluppare riacutizzazioni, dimostrano un minore effetto dell'allenamento fisico nei programmi di riabilitazione e valutano la loro qualità della vita (QoL) inferiore secondo i questionari standard.
È ben noto che i pazienti con BPCO hanno numerose manifestazioni extrapolmonari della malattia a causa dell'effetto sistemico dell'infiammazione cronica insita nella BPCO. Prima di tutto, ciò riguarda la disfunzione dei muscoli scheletrici periferici, che contribuisce in modo significativo alla diminuzione della tolleranza all'esercizio. L'infiammazione cronica persistente svolge un ruolo importante nel danno dell'endotelio vascolare e nello sviluppo dell'aterosclerosi nei pazienti con BPCO, che a sua volta contribuisce alla crescita di CVD (ipertensione arteriosa (AH), malattia coronarica (CHD), infarto miocardico acuto ( IMA), insufficienza cardiaca (HF)) nei pazienti con BPCO e aumenta il rischio di mortalità. I cambiamenti nello stato nutrizionale sono chiaramente manifestati. A sua volta, uno stato nutrizionale ridotto può fungere da fattore di rischio indipendente per la morte dei pazienti. L'infiammazione sistemica contribuisce anche allo sviluppo dell'osteoporosi. I pazienti con BPCO hanno segni più pronunciati di osteoporosi rispetto agli stessi gruppi di età di persone senza BPCO. Recentemente, è stata prestata attenzione al fatto che oltre alla policitemia, l'anemia si verifica nel 10-20% dei pazienti con BPCO. La sua causa non è completamente compresa, ma c'è motivo di credere che sia il risultato di un effetto sistemico dell'infiammazione cronica nella BPCO.
Un impatto significativo sul quadro clinico della malattia è esercitato dai disturbi neuropsichiatrici, manifestati da perdita di memoria, depressione, comparsa di "paure" e disturbi del sonno.
I pazienti con BPCO sono caratterizzati dal frequente sviluppo di comorbilità che si verificano nei pazienti anziani, indipendentemente da presenza di BPCO, ma se è presente, è più probabile (CHD, ipertensione, aterosclerosi dei vasi degli arti inferiori, ecc.). Altro comorbidità(diabete mellito (DM), malattia da reflusso gastroesofageo, adenoma prostatico, artrite) possono coesistere con la BPCO perché fanno parte del processo di invecchiamento e hanno anche un impatto significativo sul quadro clinico del paziente con BPCO.
Nel processo di naturale sviluppo della BPCO il quadro clinico può cambiare tenendo conto delle complicanze emergenti della malattia: polmonite, pneumotorace, DN acuta (ARN), embolia polmonare (EP), bronchiectasie, emorragia polmonare, sviluppo del cuore polmonare e suo scompenso con grave insufficienza circolatoria.
Riassumendo la descrizione del quadro clinico, va sottolineato che la gravità delle manifestazioni cliniche della malattia dipende da molti dei suddetti fattori. Tutto questo, insieme all'intensità dell'esposizione ai fattori di rischio, il tasso di progressione della malattia crea l'aspetto del paziente in diversi periodi della sua vita.
4. Principi di diagnosi
Per la corretta diagnosi di BPCO, è necessario prima di tutto basarsi sulle disposizioni chiave (di base) derivanti dalla definizione della malattia. La diagnosi di BPCO dovrebbe essere presa in considerazione in tutti i pazienti con tosse, produzione di espettorato o dispnea e sono identificati i fattori di rischio per la BPCO. IN vita reale nelle prime fasi della malattia, il fumatore non si considera malato, perché valuta la tosse come condizione normale, Se attività lavorativa non è stato ancora rotto. Anche l'aspetto della mancanza di respiro che si verifica durante lo sforzo fisico è considerato da lui come risultato della vecchiaia o del detraining.
Il fattore anamnestico chiave che aiuta a stabilire la diagnosi di BPCO è l'accertamento del fatto dell'esposizione per inalazione agli organi respiratori di agenti patogeni, principalmente fumo di tabacco. Nella valutazione dello stato di fumatore viene sempre indicato l'indice dei fumatori (pack-anni). Quando si raccoglie un'anamnesi, occorre prestare grande attenzione anche all'identificazione degli episodi di fumo passivo. Questo vale per tutte le fasce d'età, compresa l'esposizione al fumo di tabacco fetale in utero a seguito del fumo da parte della donna incinta stessa o di coloro che la circondano. Le esposizioni professionali per inalazione, insieme al fumo, sono considerate fattori che contribuiscono all'insorgenza della BPCO. Riguarda varie forme l'inquinamento atmosferico sul posto di lavoro, inclusi gas e aerosol, e l'esposizione al fumo dei combustibili fossili.
Pertanto, la diagnosi di BPCO dovrebbe includere le seguenti aree:
- identificazione dei fattori di rischio;
- oggettivazione dei sintomi di ostacolo;
- monitoraggio della funzione respiratoria dei polmoni.
Ne consegue che la diagnosi di BPCO si basa sull'analisi di una serie di stadi:
- creazione di un ritratto verbale del paziente sulla base di informazioni raccolte da una conversazione con lui (accurata raccolta di anamnesi);
- esame obiettivo (fisico);
- risultati di studi di laboratorio e strumentali. La diagnosi di BPCO deve sempre essere confermata dalla spirometria. Valori postbroncodilatazione FEV1/capacità vitale forzata (FVC)<70% - обязательный признак ХОБЛ, который существует на всех стадиях заболевания.
A causa del fatto che la BPCO non ha manifestazioni specifiche e il criterio diagnostico è un indicatore spirometrico, la malattia può rimanere non diagnosticata per lungo tempo. Il problema della sottodiagnosi è anche legato al fatto che molte persone con BPCO non si sentono male a causa della mancanza di respiro corto a un certo stadio dello sviluppo della malattia e non cadono nel campo visivo del medico. Ne consegue che nella stragrande maggioranza dei casi la BPCO viene diagnosticata negli stadi invalidanti della malattia.
Una conversazione dettagliata con ciascun paziente fumatore contribuirà alla diagnosi precoce della malattia, poiché con l'interrogatorio attivo e l'assenza di reclami, è possibile identificare i segni caratteristici dello sviluppo dell'infiammazione cronica nell'albero bronchiale, principalmente la tosse.
Durante il colloquio con il paziente è possibile utilizzare il questionario per la diagnosi di BPCO* (Tabella 5).
Nel processo di formazione di cambiamenti irreversibili nell'albero bronchiale e nel parenchima polmonare, appare mancanza di respiro (in una conversazione con il paziente, è necessario valutarne la gravità, la connessione con l'attività fisica, ecc.).
Nelle prime fasi della malattia (se per qualche motivo il paziente in questo momento arriva ancora all'attenzione del medico), l'esame non rivela alcuna anomalia caratteristica della BPCO, ma l'assenza di sintomi clinici non ne esclude la presenza. Con un aumento dell'enfisema e una componente irreversibile dell'ostruzione bronchiale, l'espirazione può avvenire attraverso labbra ben chiuse o piegate, che indica un pronunciato collasso espiratorio dei piccoli bronchi e rallenta la portata dell'aria espirata, che allevia la condizione dei pazienti. Altri segni di iperinflazione possono essere un torace a forma di botte, una direzione orizzontale delle costole, una diminuzione dell'ottusità cardiaca.
L'inclusione dei muscoli Scalenae e Sternocleidomastoideus nell'atto di respirare è un indicatore di ulteriore aggravamento della violazione della meccanica della respirazione e di un aumento del carico sull'apparato respiratorio. Un altro segno potrebbe essere il movimento paradossale della parete anteriore della cavità addominale - la sua retrazione durante l'inspirazione, che indica affaticamento del diaframma. L'appiattimento del diaframma porta alla retrazione delle costole inferiori durante l'inspirazione (segno di Hoover) e all'allargamento dell'angolo cifosternale. Con l'affaticamento dei muscoli respiratori, si verifica spesso l'ipercapnia, che richiede una valutazione appropriata.
Durante un esame fisico dei pazienti, è possibile oggettivare la presenza di ostruzione bronchiale ascoltando rantoli sibilanti e secchi, e durante la percussione, un suono di percussione in scatola conferma la presenza di iperinflazione.
Tra i metodi diagnostici di laboratorio, gli studi obbligatori includono un esame del sangue clinico e un esame citologico dell'espettorato. Con enfisema grave e un paziente giovane, deve essere determinata l'α1-antitripsina. Con un'esacerbazione della malattia, la leucocitosi neutrofila con uno spostamento della pugnalata e un aumento della VES sono le più comuni. La presenza di leucocitosi funge da ulteriore argomento a favore di un fattore infettivo come causa di esacerbazione della BPCO. Possono essere rilevate sia l'anemia (il risultato di una sindrome infiammatoria generale) che la policitemia. Sindrome policitemica (aumento del numero di globuli rossi, alto livello di emoglobina -
>16 g/dl nelle donne e >18 g/dl negli uomini, un aumento dell'ematocrito >47% nelle donne e >52% negli uomini) possono indicare l'esistenza di ipossiemia grave e prolungata.
L'esame citologico dell'espettorato fornisce informazioni sulla natura processo infiammatorio e il grado della sua espressione. La determinazione delle cellule atipiche aumenta la vigilanza oncologica e richiede l'uso di ulteriori metodi di esame.
culturale ricerca microbiologica Si consiglia di eseguire l'espettorato con progressione incontrollata del processo infettivo e utilizzarlo per la selezione della terapia antibiotica razionale. Allo stesso scopo, esame batteriologico contenuto bronchiale ottenuto mediante broncoscopia.
Una radiografia del torace deve essere eseguita in tutti i pazienti con sospetta diagnosi di BPCO. Questo metodo non è uno strumento sensibile per fare una diagnosi, ma consente di escludere altre malattie accompagnate da sintomi clinici simili (tumore, tubercolosi, insufficienza cardiaca congestizia, ecc.) E nel periodo di esacerbazione - per rilevare polmonite, versamento pleurico , pneumotorace spontaneo, ecc. Inoltre, possono essere rilevati i seguenti segni radiologici di ostruzione bronchiale: appiattimento della cupola e limitazione della mobilità del diaframma in movimenti respiratori, variazione delle dimensioni antero-posteriori della cavità toracica, espansione dello spazio retrosternale, disposizione verticale del cuore.
L'esame broncoscopico serve come metodo aggiuntivo per diagnosticare la BPCO per escludere altre malattie e condizioni che si verificano con sintomi simili.
L'elettrocardiografia e l'ecocardiografia vengono eseguite per escludere l'origine cardiaca dei sintomi respiratori e per identificare i segni di ipertrofia del cuore destro.
Tutti i pazienti con sospetto di BPCO dovrebbero essere sottoposti a spirometria.
5. Test diagnostici funzionali
monitoraggio del decorso della BPCO
La spirometria è il metodo principale per diagnosticare e documentare i cambiamenti nella funzione polmonare nella BPCO. Sulla base degli indicatori spirometrici, è stata costruita una classificazione della BPCO in base alla gravità dei disturbi della ventilazione ostruttiva. Ti permette di escludere altre malattie con sintomi simili.
La spirometria è lo studio iniziale preferito per valutare la presenza e la gravità dell'ostruzione delle vie aeree.
Metodologia
. Esistono varie raccomandazioni per l'uso della spirometria come metodo per la diagnosi e la determinazione della gravità della broncopneumopatia ostruttiva.
. Lo studio della funzione polmonare con il metodo della spirometria forzata può considerarsi completato se si ottengono 3 manovre respiratorie tecnicamente accettabili. Allo stesso tempo, i risultati dovrebbero essere riproducibili: gli indicatori FVC massimo e successivo, nonché gli indicatori FEV1 massimo e successivo, non dovrebbero differire di più di 150 ml. Nei casi in cui il valore FVC non supera i 1000 ml, la differenza massima consentita sia in FVC che in FEV1 non deve superare i 100 ml.
. Se non si ottengono risultati riproducibili dopo 3 tentativi, le manovre respiratorie devono essere proseguite fino a 8 tentativi. Un maggior numero di manovre respiratorie può portare all'affaticamento del paziente e, in rari casi, a una diminuzione del FEV1 o della FVC.
. Se i valori scendono di oltre il 20% rispetto al valore iniziale a seguito di ripetute manovre forzate, ulteriori test dovrebbero essere interrotti nell'interesse della sicurezza del paziente e la dinamica degli indicatori dovrebbe essere riflessa nel rapporto. Il rapporto deve presentare risultati grafici e valori numerici di almeno 3 migliori tentativi.
. I risultati di tentativi tecnicamente accettabili ma non riproducibili possono essere utilizzati per scrivere una conclusione che indichi che non sono riproducibili.
Manifestazioni spirometriche della BPCO
Durante la spirometria, la BPCO si manifesta con la limitazione del flusso aereo espiratorio dovuta all'aumentata resistenza delle vie aeree (Fig. 1).
Il tipo ostruttivo dei disturbi della ventilazione è caratterizzato da una diminuzione del rapporto FEV1 / FVC<0,7.
C'è una depressione della parte espiratoria della curva flusso-volume e il suo ginocchio discendente assume una forma concava. La perdita di linearità nella metà inferiore della curva flusso-volume è una caratteristica dei disturbi della ventilazione ostruttiva, anche quando il rapporto FEV1/FVC è >0,7. La gravità dei cambiamenti dipende dalla gravità dei disturbi ostruttivi.
Con la progressione dell'ostruzione bronchiale, c'è un'ulteriore diminuzione del flusso espiratorio, un aumento delle "trappole d'aria" e l'iperinflazione dei polmoni, che porta a una diminuzione della FVC. Per escludere disturbi misti ostruttivi-restrittivi, è necessario misurare la capacità polmonare totale (TLC) mediante pletismografia corporea.
Per valutare la gravità dell'enfisema, è necessario esaminare REL e DSL di diffusione.
Test di reversibilità (test di broncodilatazione)
Se durante lo studio spirometrico iniziale vengono registrati segni di ostruzione bronchiale, è consigliabile eseguire un test di reversibilità (test del broncodilatatore) per determinare il grado di reversibilità dell'ostruzione sotto l'influenza di farmaci broncodilatatori.
Per studiare la reversibilità dell'ostruzione, vengono eseguiti test con broncodilatatori inalatori, viene valutato il loro effetto sul FEV1. Altri indicatori della curva flusso-volume, che sono principalmente derivati e calcolati dalla FVC, non sono raccomandati.
Metodologia
. Quando si esegue il test, si raccomanda di utilizzare broncodilatatori a breve durata d'azione nella dose singola massima:
- per β2-agonisti - salbutamolo 400 mcg;
- per farmaci anticolinergici - ipratropio bromuro 160 mcg.
. In alcuni casi è possibile utilizzare una combinazione di anticolinergici e β2-agonisti breve azione alle dosi indicate. Gli inalatori aerosol predosati devono essere utilizzati con un distanziatore.
. Lo studio spirometrico ripetuto dovrebbe essere effettuato dopo 15 minuti. dopo l'inalazione
β2-agonisti o dopo 30-45 minuti. dopo l'inalazione di farmaci anticolinergici o la loro combinazione con
β2-agonisti.
Criteri per una risposta positiva
Un test di broncodilatazione è considerato positivo se, dopo l'inalazione di un broncodilatatore, il coefficiente di broncodilatazione (CBD) raggiunge o supera il 12% e l'aumento assoluto è pari o superiore a 200 ml:
CBD \u003d (FEV1 dopo (ml) - FEV1 ref (ml) / FEV1 ref. (ml)) x 100%
Aumento assoluto (ml) = FEV1 dopo (ml) - FEV1 rif. (ml)
dove FEV1 rif. - il valore dell'indicatore spirometrico prima dell'inalazione del broncodilatatore, FEV1 dopo - il valore dell'indicatore dopo l'inalazione del broncodilatatore.
Per concludere un test broncodilatatore positivo, entrambi i criteri devono essere soddisfatti.
Quando si valuta un test di broncodilatazione, è importante tenere conto delle reazioni avverse da del sistema cardiovascolare: tachicardia, aritmia, aumento della pressione sanguigna, così come la comparsa di sintomi come agitazione o tremore.
La variabilità tecnica dei risultati della spirometria può essere ridotta al minimo con la regolare calibrazione dell'apparecchiatura, un'attenta istruzione del paziente e la formazione del personale.
Valori adeguati
I valori corretti dipendono da parametri antropometrici, principalmente altezza, sesso, età, razza. Tuttavia, occorre tenere conto anche della variazione individuale. Quindi, nelle persone con indicatori di base superiori al livello medio, con lo sviluppo della patologia polmonare, questi indicatori diminuiranno rispetto a quelli iniziali, ma possono comunque rimanere all'interno della norma della popolazione.
Monitoraggio (studi seriali)
Il monitoraggio degli indicatori spirometrici (FEV1 e FVC) riflette in modo affidabile la dinamica dei cambiamenti nella funzione polmonare durante il follow-up a lungo termine, tuttavia, è necessario tenere conto della possibilità di variabilità tecnica e biologica dei risultati.
In individui sani, le variazioni di FVC e FEV1 sono considerate clinicamente significative se la differenza supera il 5% durante studi ripetuti entro 1 giorno e il 12% entro diverse settimane.
Un aumento del tasso di declino della funzione polmonare (più di 40 ml/anno) non è un segno obbligatorio di BPCO. Inoltre, non può essere confermato individualmente, poiché il livello accettabile di variabilità del FEV1 all'interno di uno studio supera significativamente questo valore ed è di 150 ml.
Monitoraggio del picco di flusso espiratorio (PEF).
Il PSV viene utilizzato per escludere una maggiore variabilità giornaliera degli indicatori, più caratteristica dell'asma e della risposta alla terapia farmacologica.
Registrato miglior indicatore dopo 3 tentativi di eseguire una manovra forzata con una pausa non superiore a 2 s dopo l'inspirazione. La manovra viene eseguita seduti o in piedi. Vengono effettuate più misurazioni se la differenza tra i 2 valori PSV massimi supera i 40 l/min.
Il PEF viene utilizzato per stimare la variabilità del flusso d'aria attraverso misurazioni multiple effettuate nell'arco di almeno 2 settimane. È possibile registrare una maggiore variabilità con misurazioni doppie entro 1 giorno. Misurazioni più frequenti migliorano la stima. Un aumento dell'accuratezza della misurazione in questo caso si ottiene in particolare nei pazienti con ridotta compliance.
La variabilità del PSV è meglio calcolata come differenza tra i valori massimo e minimo in percentuale del PSV medio o massimo giornaliero.
Il limite superiore dei valori normali per la variabilità dall'indicatore massimo è di circa il 20% quando si eseguono 4 o più misurazioni entro 1 giorno. Tuttavia, potrebbe essere inferiore quando si utilizzano misurazioni doppie.
La variabilità del PSV può essere aumentata nelle malattie con cui l'AD è più spesso differenziato. Pertanto, nella pratica clinica, esiste un livello di specificità inferiore per una maggiore variabilità nel PSV rispetto agli studi sulla popolazione.
I valori di PEF dovrebbero essere interpretati tenendo conto della situazione clinica. Lo studio PSV è applicabile solo per monitorare i pazienti con una diagnosi già stabilita di BPCO.
6. Diagnosi differenziale della BPCO
Il compito principale della diagnosi differenziale della BPCO è l'esclusione di malattie con sintomi simili. Nonostante le differenze abbastanza definite tra BA e BPCO nei meccanismi di sviluppo, manifestazioni cliniche e principi di prevenzione e trattamento, queste 2 malattie hanno alcune caratteristiche comuni. Inoltre, è possibile anche una combinazione di queste malattie in una persona.
La diagnosi differenziale di BA e BPCO si basa sull'integrazione dei dati clinici di base, i risultati dei test funzionali e di laboratorio. Le caratteristiche dell'infiammazione nella BPCO e nella BA sono mostrate nella Figura 2.
I principali punti di ingresso per la diagnosi differenziale di queste malattie sono riportati nella Tabella 6.
In alcune fasi dello sviluppo della BPCO, specialmente al primo incontro con il paziente, diventa necessario differenziarlo da una serie di malattie con sintomi simili. Le loro principali caratteristiche distintive sono mostrate nella Tabella 7.
La diagnosi differenziale nelle diverse fasi dello sviluppo della BPCO ha le sue caratteristiche. Nella BPCO lieve, la cosa principale è identificare le differenze rispetto ad altre malattie associate a fattori di aggressione ambientale che si verificano in modo subclinico o con pochi sintomi. Prima di tutto, questo vale per varie opzioni bronchite cronica. La difficoltà si alza effettuando diagnosi differenziale nei pazienti con BPCO grave. È determinato non solo dalla gravità delle condizioni del paziente, dalla gravità dei cambiamenti irreversibili, ma anche da un ampio insieme di malattie concomitanti (IHD, ipertensione, malattie metaboliche, ecc.).
7. Classificazione moderna della BPCO.
Valutazione completa della gravità del decorso della malattia
La classificazione della BPCO (Tabella 8) negli ultimi anni si basava su indicatori dello stato funzionale dei polmoni, basati sui valori post-broncodilatatori del FEV1, e in essa si distinguevano 4 stadi della malattia.
Il Comitato di Esperti del programma GOLD 2011 ha abbandonato l'uso del termine “stadi”, poiché questo indicatore si basa solo sul valore del FEV1 e non era adeguato per caratterizzare la gravità della malattia. Studi recenti hanno dimostrato che la stadiazione non è disponibile in tutti i casi della malattia. Non ci sono prove della reale esistenza degli stadi della BPCO (il passaggio da uno stadio all'altro con la terapia moderna). Allo stesso tempo, i valori del FEV1 rimangono rilevanti, poiché riflettono il grado (da lieve - stadio I, rispettivamente, a estremamente grave - stadio IV) della gravità della limitazione del flusso aereo. Sono utilizzati in una valutazione completa della gravità dei pazienti con BPCO.
Nella revisione del documento GOLD nel 2011, è stato proposto nuova classificazione, basato su una valutazione integrale della gravità dei pazienti con BPCO. Prende in considerazione non solo la gravità dell'ostruzione bronchiale (il grado di compromissione della pervietà bronchiale) in base ai risultati di uno studio spirometrico, ma anche i dati clinici sul paziente: il numero di esacerbazioni della BPCO all'anno e la gravità dei sintomi clinici secondo i risultati di mMRC (Tabella 3) e COPD Assessment Test (CAT) (Tabella 9).
È noto che il "gold standard" per valutare l'impatto dei sintomi sulla QoL sono i risultati del St. George's Hospital Respiratory Questionnaire (SGRQ), la sua scala dei "sintomi". Nella pratica clinica, il test di valutazione CAT ha trovato un uso più ampio e, più recentemente, il Clinical COPD Questionnaire (CCQ).
In GOLD 2013, la valutazione dei sintomi è stata più ampliata grazie all'uso della scala CCQ, che consente di oggettivare i sintomi sia per 1 giorno che per l'ultima settimana e dare loro non solo una caratteristica qualitativa, ma anche clinica ( Tabella 10).
Il punteggio finale è calcolato dalla somma dei punteggi ottenuti rispondendo a tutte le domande e diviso per 10. Con il suo valore<1 симптомы оцениваются как невыраженные, а при ≥1 - выраженные, т. е. оказывающие влияние на жизнь пациента. Вместе с тем еще окончательно не установлены значения CCQ, соответствующие выраженному влиянию симптомов на КЖ, эквивалентные значениям SGRQ. Пограничными значениями отличия выраженных от невыраженных симптомов предлагаются значения 1,0-1,5 (GOLD 2014).
La classificazione della BPCO basata sulle raccomandazioni del programma GOLD è presentata nella Tabella 11.
Quando si valuta il grado di rischio, si raccomanda di selezionare il grado più alto in base alla limitazione del flusso aereo GOLD o alla storia delle riacutizzazioni.
Nella nuova edizione del GOLD 2013 è stata aggiunta una disposizione secondo la quale se un paziente ha avuto anche una sola riacutizzazione nell'anno precedente che ha portato al ricovero (cioè una grave riacutizzazione), il paziente deve essere classificato come ad alto rischio.
Pertanto, una valutazione integrale dell'impatto della BPCO su un particolare paziente combina la valutazione dei sintomi con la classificazione spirometrica con una valutazione del rischio di esacerbazioni.
Tenendo presente quanto sopra, una diagnosi di BPCO potrebbe assomigliare a questa:
“Broncopneumopatia cronica ostruttiva…” seguita da una valutazione di:
- gravità (I-IV) dell'ostruzione bronchiale;
- gravità dei sintomi clinici: grave (CAT ≥10, mMRC ≥2, CCQ ≥1), inespresso (CAT<10, mMRC <2, CCQ <1);
- frequenza delle riacutizzazioni: rare (0-1), frequenti (≥2);
- fenotipo BPCO (se possibile);
- malattie concomitanti.
Il ruolo delle malattie concomitanti è estremamente importante nella valutazione della gravità della BPCO, tuttavia, anche nell'ultima raccomandazione GOLD del 2013, non ha trovato un posto degno nella suddetta classificazione.
8. Trattamento della BPCO stabile
L'obiettivo principale del trattamento è prevenire la progressione della malattia. Gli obiettivi del trattamento sono descritti nella Tabella 12.
Le principali direzioni di trattamento:
I. Effetti non farmacologici:
- ridurre l'influenza dei fattori di rischio;
- programmi educativi.
I metodi di esposizione non farmacologici sono presentati nella tabella 13.
Nei pazienti con malattia grave (GOLD 2-4), la riabilitazione polmonare dovrebbe essere utilizzata come misura necessaria.
II. Trattamento medico
La scelta del volume della terapia farmacologica si basa sulla gravità dei sintomi clinici, sul valore del FEV1 post-broncodilatatorio e sulla frequenza delle riacutizzazioni della malattia (Tabelle 14, 15).
Schemi di terapia farmacologica per pazienti con BPCO, compilati tenendo conto di una valutazione completa della gravità della BPCO (la frequenza delle esacerbazioni della malattia, la gravità dei sintomi clinici, lo stadio della BPCO, determinato dal grado di compromissione della pervietà bronchiale) , sono riportati nella Tabella 16.
Altri trattamenti includono ossigenoterapia, supporto respiratorio e trattamento chirurgico.
Ossigenoterapia
È stato riscontrato che la somministrazione a lungo termine di ossigeno (O2) (>15 h/die) aumenta la sopravvivenza nei pazienti con DN cronica e grave ipossiemia a riposo (B, 2++).
Supporto respiratorio
La ventilazione non invasiva (NIV) è ampiamente utilizzata nei pazienti con BPCO estremamente grave di decorso stabile.
La combinazione di NIV con ossigenoterapia a lungo termine può essere efficace in pazienti selezionati, soprattutto in presenza di ipercapnia conclamata durante il giorno.
Chirurgia
Chirurgia per la riduzione del volume polmonare (LUL)
La RULA viene eseguita rimuovendo parte del polmone per ridurre l'iperinflazione e ottenere un pompaggio più efficiente dei muscoli respiratori. Il suo utilizzo viene effettuato in pazienti con enfisema del lobo superiore e bassa tolleranza all'esercizio.
Trapianto di polmone
Il trapianto di polmone può migliorare la QoL e le prestazioni funzionali in pazienti accuratamente selezionati con BPCO molto grave. I criteri di selezione sono FEV1<25% от должной величины, РаО2 <55 мм рт. ст., РаСО2 >50 mmHg Arte. quando si respira aria ambiente e ipertensione polmonare (Pra> 40 mm Hg).
9. Esacerbazione della BPCO
Definizione e significato delle riacutizzazioni della BPCO
Lo sviluppo di riacutizzazioni è una caratteristica del decorso della BPCO. Come definito da GOLD (2013): "Una riacutizzazione della BPCO è un evento acuto caratterizzato da un peggioramento dei sintomi respiratori che va oltre le loro normali fluttuazioni giornaliere e porta a un cambiamento nel regime della terapia utilizzata".
L'esacerbazione della BPCO è uno dei motivi più comuni per cui i pazienti cercano assistenza medica di emergenza. Il frequente sviluppo di esacerbazioni nei pazienti con BPCO porta a un deterioramento a lungo termine (fino a diverse settimane) della funzione respiratoria e dello scambio di gas, una progressione più rapida della malattia, una significativa diminuzione della qualità della vita dei pazienti ed è associato a costi economici significativi per il trattamento. Inoltre, le riacutizzazioni della BPCO portano allo scompenso delle malattie croniche concomitanti. Le gravi esacerbazioni della BPCO sono la principale causa di morte nei pazienti. Nei primi 5 giorni dall'inizio delle riacutizzazioni, il rischio di sviluppare IMA aumenta di oltre 2 volte.
Classificazione delle riacutizzazioni della BPCO
Una delle più note classificazioni della gravità delle riacutizzazioni della BPCO, proposta dalla task force sulle riacutizzazioni della BPCO, è presentata nella Tabella 17.
Steer et al. sviluppato una nuova scala per valutare la prognosi dei pazienti con riacutizzazione della BPCO ricoverati in ospedale. Sono stati identificati i 5 più potenti predittori di esito letale: 1) la gravità della dispnea sulla scala eMRCD; 2) eosinopenia del sangue periferico (<0,05 клеток x109/л); 3) признаки консолидации паренхимы легких по данным рентгенографии грудной клетки; 4) ацидоз крови (pH <7,3) и 5) мерцательная аритмия. Перечисленные признаки были объединены в шкалу DECAF (по аббревиатуре первых букв в английской транскрипции) (табл. 17).
Questa scala ha dimostrato un'eccellente capacità discriminatoria di prevedere la morte durante una riacutizzazione della BPCO.
Cause di esacerbazioni
Le cause più comuni di riacutizzazione della BPCO sono le infezioni respiratorie batteriche e virali e gli inquinanti atmosferici, ma non è possibile determinare le cause di circa il 20-30% dei casi di riacutizzazione.
Tra i batteri nell'esacerbazione della BPCO, Haemophilus influenzae, Streptococcus pneumoniae e Moraxella catarrhalis non tipizzabili giocano il ruolo più importante. Studi condotti su pazienti con gravi riacutizzazioni di BPCO hanno dimostrato che gli enterobatteri gram-negativi e Pseudomonas aeruginosa possono essere più comuni in tali pazienti (Tabella 18).
I rinovirus sono una delle cause più comuni di infezioni virali respiratorie acute e possono essere una causa significativa di riacutizzazioni della BPCO. Si nota che le esacerbazioni della BPCO si sviluppano più spesso nei mesi autunno-inverno. L'aumento del numero di esacerbazioni della BPCO può essere associato ad un aumento della prevalenza delle infezioni virali respiratorie nei mesi invernali e ad un aumento della sensibilità dell'epitelio del tratto respiratorio superiore ad esse nella stagione fredda.
Le condizioni che possono assomigliare e/o esacerbare le riacutizzazioni includono polmonite, EP, insufficienza cardiaca congestizia, aritmie, pneumotorace e versamento pleurico. Queste condizioni dovrebbero essere differenziate dalle riacutizzazioni e, se presenti, dovrebbe essere effettuato un trattamento appropriato.
10. Trattamento della riacutizzazione della BPCO
Le tattiche di gestione dei pazienti con BPCO con vari gradi di gravità della riacutizzazione sono presentate nella Tabella 19.
Broncodilatatori inalatori
La nomina di broncodilatatori per via inalatoria è uno dei collegamenti principali nel trattamento delle riacutizzazioni della BPCO (A, 1++). Tradizionalmente, ai pazienti con riacutizzazioni di BPCO vengono prescritti β2-agonisti ad azione rapida (salbutamolo, fenoterolo) o anticolinergici ad azione rapida (ipratropio bromuro). L'efficacia dei β2-agonisti e dell'ipratropio bromuro nelle riacutizzazioni della BPCO è approssimativamente la stessa (B, 2++), il vantaggio dei β2-agonisti è un inizio d'azione più rapido e dei farmaci anticolinergici: elevata sicurezza e buona tollerabilità. Oggi, molti esperti considerano la terapia di combinazione β2-agonista/ipratropio bromuro come la strategia ottimale per la gestione delle riacutizzazioni della BPCO (B, 2++), soprattutto nel trattamento dei pazienti con BPCO con riacutizzazioni gravi.
GKS
Secondo studi clinici sulle riacutizzazioni della BPCO che richiedono il ricovero, i corticosteroidi sistemici riducono il tempo di insorgenza della remissione, migliorano la funzione polmonare (FEV1) e riducono l'ipossiemia (PaO2) e possono anche ridurre il rischio di recidiva precoce e fallimento del trattamento, ridurre la durata di degenza (A, 1+). Un ciclo di prednisolone orale 30-40 mg/die per 5-14 giorni è generalmente raccomandato (B, 2++). Secondo dati recenti, i pazienti con riacutizzazione della BPCO ed eosinofilia ematica >2% hanno la migliore risposta ai corticosteroidi sistemici (C, 2+).
Un'alternativa più sicura ai corticosteroidi sistemici nelle riacutizzazioni della BPCO sono i corticosteroidi per via inalatoria, in particolare i corticosteroidi nebulizzati (B, 2++).
Terapia antibatterica (ABT)
Poiché i batteri sono la causa di tutt'altro che tutte le riacutizzazioni della BPCO (50%), è importante determinare le indicazioni per la prescrizione di ABT nello sviluppo delle riacutizzazioni. Le attuali linee guida raccomandano antibiotici per i pazienti con le riacutizzazioni più gravi di BPCO, come quelli con riacutizzazioni di tipo I di Anthonisen (cioè, se c'è dispnea aumentata, aumento del volume dell'espettorato e grado di purulenza) o di tipo II (presenza di 2 dei 3 segni elencati ) (SI, 2++). Nei pazienti con simili scenari di riacutizzazione della BPCO, gli antibiotici sono più efficaci, poiché la causa di tali riacutizzazioni è un'infezione batterica. Gli antibiotici sono raccomandati anche per i pazienti con gravi esacerbazioni di BPCO che richiedono invasività o NIV (D, 3). L'uso di biomarcatori come la proteina C-reattiva (CRP) aiuta a migliorare la diagnosi e la gestione dei pazienti con riacutizzazioni di BPCO (C, 2+). Un aumento dei livelli di CRP ≥15 mg/l durante l'esacerbazione della BPCO è un segno sensibile di un'infezione batterica.
La scelta degli antibiotici più appropriati per il trattamento di una riacutizzazione della BPCO dipende da molti fattori, come la gravità della BPCO, i fattori di rischio per l'esito avverso della terapia (p. terapia (D, 3)).
Nelle esacerbazioni lievi e moderate della BPCO senza fattori di rischio, si raccomanda la nomina di macrolidi moderni (azitromicina, claritromicina), cefalosporine (cefixima, ecc.) (Tabella 18). Sia l'amoxicillina/clavulanato che i fluorochinoloni respiratori (levofloxacina o moxifloxacina) sono raccomandati come agenti di prima linea per i pazienti con gravi riacutizzazioni di BPCO e fattori di rischio (B, 2++). Ad alto rischio di infezione da P. aeruginosa, ciprofloxacina e altri farmaci con attività antipseudomonas (B, 2++).
Ossigenoterapia
L'ipossiemia rappresenta una vera minaccia per la vita del paziente, quindi l'ossigenoterapia è una priorità nel trattamento dell'IRA sullo sfondo della BPCO (B, 2++). L'obiettivo dell'ossigenoterapia è raggiungere una PaO2 compresa tra 55 e 65 mm Hg. Arte. e SaO2 88-92%. In ARF nei pazienti con BPCO, le cannule nasali o una maschera Venturi sono più comunemente utilizzate per erogare O2. Quando l'O2 viene somministrato tramite cannula, un flusso di O2 di 1–2 L/min è sufficiente per la maggior parte dei pazienti (D, 3). La maschera Venturi è considerata il metodo preferito di erogazione di O2, poiché consente di fornire valori abbastanza accurati della frazione di O2 nella miscela inalata (FiO2), indipendentemente dalla ventilazione minuto e dal flusso inspiratorio del paziente. In media, l'ossigenoterapia con FiO2 24% aumenta la PaO2 di 10 mm Hg. Art., e con FiO2 28% - di 20 mm Hg. Arte. Dopo aver iniziato o modificato il regime di ossigenoterapia entro i successivi 30-60 minuti. si raccomanda un'emogasanalisi arteriosa per monitorare PaCO2 e pH (D, 3).
NVL
NVL - condurre benefici di ventilazione senza impostare vie aeree artificiali. Lo sviluppo di questa nuova linea di supporto respiratorio consente di scaricare in modo sicuro ed efficace i muscoli respiratori, ripristinare lo scambio gassoso e ridurre la dispnea nei pazienti con ARF. Durante la NIV, il rapporto tra il paziente e il respiratore viene effettuato utilizzando maschere nasali o facciali (meno spesso caschi e boccagli), il paziente è cosciente, di norma non è richiesto l'uso di sedativi e miorilassanti. Un altro importante vantaggio della NIV è la possibilità della sua rapida cessazione, nonché della ripresa immediata, se necessario. Di seguito sono riportate le indicazioni e le controindicazioni per la NIV.
I criteri di inclusione per la NIV per ARF sullo sfondo della BPCO sono:
1. Sintomi e segni di ARF:
- pronunciata mancanza di respiro a riposo;
- frequenza respiratoria>24, partecipazione alla respirazione dei muscoli respiratori ausiliari, paradosso addominale.
2. Segni di alterazione dello scambio di gas:
- PaCO2 >45mmHg Art., pH<7,35;
- PaO2/FiO2<200 мм рт. ст.
I criteri di esclusione per NIV per ARF sono:
1. Smetti di respirare.
2. Emodinamica instabile (ipotensione, aritmie incontrollate o ischemia miocardica).
3. Incapacità di proteggere le vie respiratorie (tosse e deglutizione alterate).
4. Eccessiva secrezione bronchiale.
5. Segni di alterazione della coscienza (agitazione o depressione), incapacità del paziente di collaborare con il personale medico.
I pazienti con ARF che richiedono intubazione tracheale di emergenza e supporto respiratorio invasivo sono considerati candidati non idonei per questo metodo di supporto respiratorio (C, 2+). La NIV è l'unica terapia comprovata in grado di ridurre la mortalità nei pazienti con BPCO e ARF (A, 1++).
Supporto respiratorio invasivo
La ventilazione meccanica è indicata per i pazienti con BPCO con ARF, nei quali la terapia medica o altra terapia conservativa (NIV) non porta a un ulteriore miglioramento della condizione (B, 2++). Le indicazioni per la ventilazione dovrebbero tenere conto non solo della mancanza di effetto dei metodi conservativi di terapia, della gravità degli indicatori funzionali, ma anche della velocità del loro sviluppo e della potenziale reversibilità del processo che ha causato l'ARF.
Le indicazioni assolute per la ventilazione meccanica nell'ARF sullo sfondo dell'esacerbazione della BPCO sono:
1) arresto respiratorio;
2) disturbi pronunciati della coscienza (stupore, coma);
3) emodinamica instabile (SBP<70 мм рт. ст., частота сердечных сокращений <50/мин. или >160/min);
4) affaticamento dei muscoli respiratori.
Le indicazioni relative per la ventilazione meccanica in ARF sullo sfondo dell'esacerbazione della BPCO sono:
1) frequenza respiratoria >35/min.;
2) pH del sangue arterioso<7,25;
3) PaO2<45 мм рт. ст., несмотря на проведение кислородотерапии.
Di norma, quando si prescrive il supporto respiratorio, viene eseguita una valutazione clinica e funzionale completa dello stato del paziente. Lo svezzamento dalla ventilazione meccanica dovrebbe iniziare il più presto possibile nei pazienti con BPCO (B, 2++), perché ogni giorno in più di supporto respiratorio invasivo aumenta significativamente il rischio di complicanze della ventilazione meccanica, in particolare come la polmonite associata al ventilatore (A, 1+).
Metodi di mobilizzazione e rimozione
secrezioni bronchiali
La sovrapproduzione di secrezioni e la scarsa evacuazione delle vie aeree possono essere un serio problema per molti pazienti con una grave riacutizzazione della BPCO.
Secondo recenti studi, la terapia con farmaci mucoattivi (acetilcisteina, carbocisteina, erdosteina) accelera la risoluzione delle riacutizzazioni della BPCO e contribuisce ulteriormente alla riduzione della gravità dell'infiammazione sistemica (C, 2+).
Con l'esacerbazione della BPCO, è possibile ottenere un miglioramento significativo della condizione utilizzando metodi speciali per migliorare la funzione di drenaggio delle vie respiratorie. Ad esempio, la ventilazione a percussione ad alta frequenza è un metodo di terapia respiratoria in cui piccoli volumi d'aria ("percussioni") vengono erogati al paziente ad un'alta frequenza regolabile.
(60-400 cicli/min.) e livello di pressione controllato attraverso uno speciale circuito di respirazione aperto (fazitron). La "percussione" può essere data attraverso una maschera, un boccaglio, un tubo endotracheale e una tracheostomia. Un altro metodo sono le oscillazioni ad alta frequenza (oscillazioni) della parete toracica, che vengono trasmesse attraverso il torace alle vie respiratorie e al flusso di gas che le attraversa. Le vibrazioni ad alta frequenza vengono create utilizzando un giubbotto gonfiabile che si adatta perfettamente al torace ed è collegato a un compressore d'aria.
11. BPCO e comorbidità
La BPCO, insieme all'ipertensione, alla malattia coronarica e al diabete, costituiscono il gruppo principale di malattie croniche: rappresentano oltre il 30% di tutte le altre patologie umane. La BPCO è spesso associata a queste malattie, che possono peggiorare significativamente la prognosi nei pazienti.
Le comorbilità più comuni nella BPCO sono presentate nella Tabella 20.
Nei pazienti con BPCO, il rischio di morte aumenta con l'aumentare del numero di malattie concomitanti e non dipende dal valore del FEV1 (Fig. 3).
Tutte le cause di morte nei pazienti con BPCO sono riportate nella Tabella 21.
Secondo ampi studi di popolazione, il rischio di morte per CVD nei pazienti con BPCO è aumentato di 2-3 volte rispetto ai pazienti della stessa fascia di età e senza BPCO ed è circa il 50% del numero totale di decessi.
La patologia cardiovascolare è la principale patologia che accompagna la BPCO. Questo è probabilmente il gruppo delle malattie più comuni e più gravi che coesistono con la BPCO. Tra questi, dovrebbero essere distinti la malattia coronarica, l'insufficienza cardiaca cronica, la fibrillazione atriale, l'ipertensione, che, a quanto pare, è il compagno più comune della BPCO.
Spesso il trattamento di tali pazienti diventa controverso: i farmaci (inibitori dell'enzima di conversione dell'angiotensina, β-bloccanti) usati per la malattia coronarica e/o l'ipertensione possono peggiorare il decorso della BPCO (rischio di sviluppare tosse, mancanza di respiro, comparsa o aumento dell'ostruzione bronchiale) e farmaci prescritti per circa BPCO (broncodilatatori, corticosteroidi), possono influenzare negativamente il decorso delle malattie cardiovascolari (il rischio di sviluppare aritmia cardiaca, aumento della pressione sanguigna). Tuttavia, il trattamento della CVD nei pazienti con BPCO dovrebbe essere effettuato secondo le raccomandazioni standard, poiché non vi è alcuna evidenza che debbano essere trattati diversamente in presenza di BPCO. Se è necessario prescrivere beta-bloccanti a pazienti affetti da BPCO con concomitante patologia cardiovascolare, la preferenza dovrebbe essere data ai beta-bloccanti selettivi.
L'osteoporosi e la depressione sono comorbidità importanti che sono spesso sottodiagnosticate. Tuttavia, sono associati a un declino dello stato di salute e a una prognosi infausta. La nomina di cicli ripetuti di corticosteroidi sistemici per le riacutizzazioni dovrebbe essere evitata, poiché il loro uso aumenta significativamente il rischio di osteoporosi e fratture.
Negli ultimi anni, i casi di una combinazione di sindrome metabolica e diabete nei pazienti con BPCO sono diventati più frequenti. Il DM ha un impatto significativo sul decorso della BPCO e peggiora la prognosi della malattia. Nei pazienti con BPCO in combinazione con diabete di tipo 2, la DN è più pronunciata, le esacerbazioni sono più comuni, si nota un decorso più grave della malattia coronarica, insufficienza cardiaca cronica e ipertensione, l'ipertensione polmonare aumenta con minore gravità dell'iperinflazione.
Nei pazienti con BPCO lieve, la causa più comune di morte è il cancro ai polmoni. Nei pazienti con BPCO grave, la ridotta funzionalità polmonare limita significativamente la possibilità di un intervento chirurgico per il cancro del polmone.
12. Riabilitazione ed educazione del paziente
Uno dei metodi di trattamento aggiuntivi raccomandati per i pazienti con BPCO, a partire dallo stadio II della malattia, è la riabilitazione polmonare. Si è dimostrato efficace nel migliorare la tolleranza all'esercizio (A, 1++), l'attività quotidiana, ridurre la percezione della dispnea (A, 1++), l'ansia e la depressione (A, 1+) e ridurre il numero e durata dei ricoveri (A, 1++), tempo di recupero dopo la dimissione dall'ospedale e, in generale, un aumento della QoL (A, 1++) e della sopravvivenza (B, 2++).
La riabilitazione polmonare è un programma completo di interventi basati sulla terapia centrata sul paziente, che comprende, oltre all'allenamento fisico, programmi educativi e psicosociali progettati per migliorare lo stato fisico ed emotivo dei pazienti e garantire l'adesione a lungo termine del paziente a comportamenti mirati al mantenimento della salute.
Secondo le raccomandazioni ERS/ATS del 2013, il percorso riabilitativo dovrebbe essere continuato per
6-12 settimane (almeno 12 lezioni, 2 rubli/settimana, della durata di 30 minuti o più) e comprendono le seguenti componenti:
1) allenamento fisico;
2) correzione dello stato nutrizionale;
3) educazione del paziente;
4) supporto psicosociale.
Questo programma può essere svolto sia in regime ambulatoriale che in ambito ospedaliero.
La componente principale della riabilitazione polmonare è l'allenamento fisico, che può aumentare l'efficacia dei broncodilatatori a lunga durata d'azione (B, 2++). Un approccio integrato alla loro implementazione è particolarmente importante, combinando esercizi di forza e resistenza: camminare, allenare i muscoli degli arti superiori e inferiori con l'aiuto di espansori, manubri, stepper, esercizi su un cicloergometro. Durante questi allenamenti, anche vari gruppi di articolazioni sono coinvolti nel lavoro, si sviluppano le capacità motorie della mano.
Tutti gli esercizi dovrebbero essere combinati con esercizi di respirazione volti a sviluppare il corretto schema respiratorio, che porta ulteriori benefici (C, 2+). Inoltre, la ginnastica respiratoria dovrebbe includere l'uso di simulatori speciali (Threshold PEP, IMT), che coinvolgono in modo differenziato i muscoli respiratori inspiratori ed espiratori nel lavoro.
La correzione dello stato nutrizionale dovrebbe mirare a mantenere la forza muscolare con una quantità sufficiente di proteine e vitamine nella dieta.
Oltre alla riabilitazione fisica, molta attenzione dovrebbe essere prestata alle attività volte a modificare il comportamento dei pazienti insegnando loro le capacità di auto-riconoscimento dei cambiamenti nel corso della malattia e metodi per la loro correzione.
* Malattie croniche delle vie aeree, una guida per i medici di base, 2005.